化学:3.3《沉淀溶解平衡》课件(2)(鲁科版选修4)
文档属性
| 名称 | 化学:3.3《沉淀溶解平衡》课件(2)(鲁科版选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 585.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-24 14:07:50 | ||
图片预览





文档简介
(共19张PPT)
第3节 沉淀溶解平衡
沈丘县直高学高二化学
第3章 物质在水溶液中的行为
一、了解难溶电
解质在水中的溶
解情况。
确理解和掌握溶度积KSP的概念。
二、理解难溶电解质在水中的沉淀 溶解平衡特点。正
三、掌握简单的利用KSP的表达式,计算溶液中相关离子的浓度。
在NaCl的饱和水溶液中,再加NaCl固体溶质,固体有没有溶解过程
探究:
饱和NaCl溶液
形状不规则的NaCl固体
形状规则的NaCl固体
一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变
思考:
得到什么启示?
一昼夜后……
探究:
饱和
溶液中
v(结晶)=v(溶解)
NaCl(S) Na+ + Cl-
迁移应用:可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
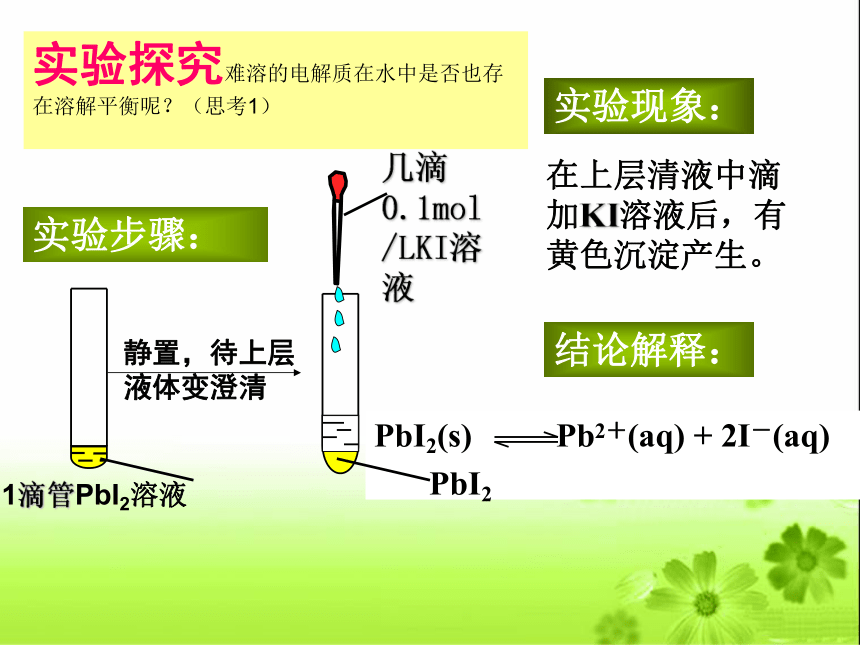
实验探究难溶的电解质在水中是否也存在溶解平衡呢?(思考1)
实验步骤:
在上层清液中滴加KI溶液后,有黄色沉淀产生。
实验现象:
结论解释:
1滴管PbI2溶液
静置,待上层
液体变澄清
几滴
0.1mol/LKI溶液
PbI2(s) Pb2+(aq) + 2I-(aq)
PbI2
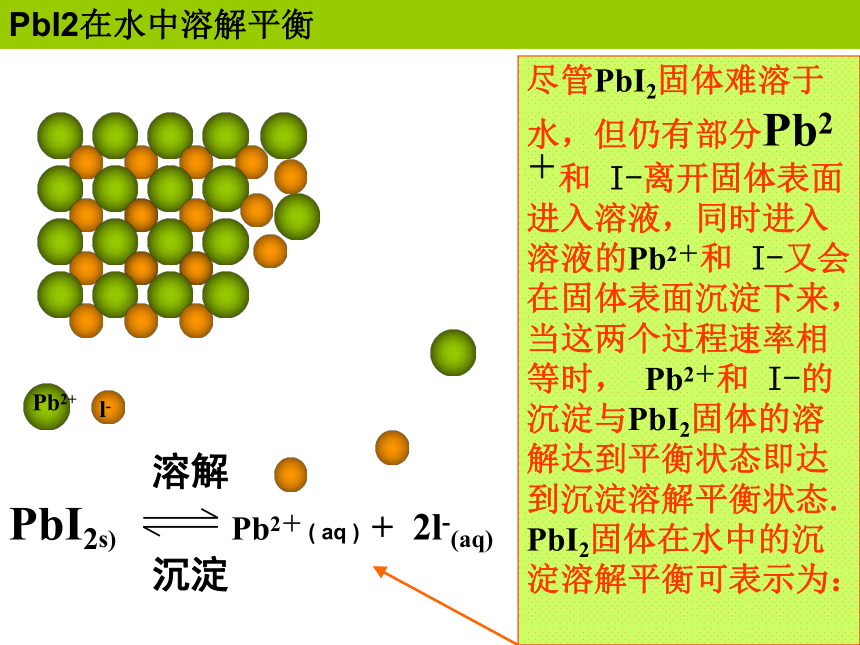
PbI2在水中溶解平衡
Pb2+
l-
尽管PbI2固体难溶于水,但仍有部分Pb2+和 I-离开固体表面进入溶液,同时进入溶液的Pb2+和 I-又会在固体表面沉淀下来,当这两个过程速率相等时, Pb2+和 I-的沉淀与PbI2固体的溶解达到平衡状态即达到沉淀溶解平衡状态. PbI2固体在水中的沉淀溶解平衡可表示为:
溶解
PbI2s) Pb2+ ( aq ) + 2l-(aq)
沉淀
一、沉淀溶解平衡(难溶电解质)
3)特征:
逆、动、等、定、变
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
2)表达式:
1)概念:
PbI2 (s) Pb2+ (aq) +2I- (aq)
沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。
动态平衡
外界条件一定,溶液中各粒子的浓度保持不变
外界条件改变,溶解平衡发生移动。
V溶解=V析出≠0
动:
等:
定:
变:
问题探究2、
难溶电解质的沉淀溶解平衡与难电离物质的电离平衡有什么区别和联系?
习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。
难溶 微溶 可溶 易溶
0.01 1 10 (Sg/100g水)
4)影响溶解平衡的因素:
①内因:电解质本身的性质
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
②外因:
a)浓度:
b)温度:
AgCl(s) Ag+(aq) + Cl-(aq)
通常我们讲的外因包括浓度、温度、压强等。对于溶解平衡来说,在溶液中进行,可忽略压强的影响。
平衡右移
平衡左移
多数平衡向溶解方向移动
升温
①加水
②增大相同离子浓度
思考:对于平衡 AgCl Ag++Cl-
若改变条件,对其有何影响
改变条件 平衡移动方向 C(Ag+ ) C(Cl-)
升 温
加AgCl(s)
加NaCl(s)
加AgNO3(s)
→ ↑ ↑
不移动 不变 不变
← ↓ ↑
← ↑ ↓
【巩固练习5】
将足量AgCl分别溶于下列试剂中形成AgCl饱和溶液 ,沉淀溶解平衡表示式为:AgCl的Ksp= 1.8×
① 水中 ② 10mL 0.1mol/L NaCl溶液
5mL 0.1mol/L 的MgCl2溶液中。
相同温度下,Ag+浓度大小顺序? _____
几种难溶电解质在25℃时的溶解平衡和溶度积:
AgCl(s) Ag+ + Cl- Ksp= [Ag+][Cl-] = 1.8×10-10mol2 L-2
AgBr(s) Ag+ + Br- Ksp= [Ag+][Br-] = 5.0×10-13mol2 L-2
AgI(s) Ag+ + I- Ksp= [Ag+][I-] = 8.3×10-17mol2 L-2
Mg(OH)2(s) Mg2++2OH- Ksp= [Mg2+][OH-] 2 = 5.6×10-12mol3 L-3
相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶解度:AgCl > AgBr > AgI
② Ksp反映了难溶电解质在水中的溶解度
【巩固练习3】
已知在某温时, 的溶度积Ksp=3.2× 求室温下饱和 溶液中 和 的物质的量浓度。
【巩固练习4】
已知的 溶度积为4.0× 在下列情况时的溶解度(以 表示, 不考虑副反应)。(1)在纯水中;
(2)在1.0× mol/LNaF溶液中;
(3)在1.0× mol/LCaCl2溶液中。
练一练
1、下列叙述正确的是( )
A.由于AgCl水溶液导电性很弱,所以它是弱电解质
B.难溶电解质离子浓度的乘积就是该物质的溶度积常数
C.溶度积常数大者,溶解度也大
D.用水稀释含有AgCl固体的溶液时, AgCl的溶度积常数不变。
D
小结
1.理解难溶电解质的溶解平衡。
2.溶度积和溶度积规则。
3.利用平衡移动原理分析沉淀的生成。
第3节 沉淀溶解平衡
沈丘县直高学高二化学
第3章 物质在水溶液中的行为
一、了解难溶电
解质在水中的溶
解情况。
确理解和掌握溶度积KSP的概念。
二、理解难溶电解质在水中的沉淀 溶解平衡特点。正
三、掌握简单的利用KSP的表达式,计算溶液中相关离子的浓度。
在NaCl的饱和水溶液中,再加NaCl固体溶质,固体有没有溶解过程
探究:
饱和NaCl溶液
形状不规则的NaCl固体
形状规则的NaCl固体
一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变
思考:
得到什么启示?
一昼夜后……
探究:
饱和
溶液中
v(结晶)=v(溶解)
NaCl(S) Na+ + Cl-
迁移应用:可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
实验探究难溶的电解质在水中是否也存在溶解平衡呢?(思考1)
实验步骤:
在上层清液中滴加KI溶液后,有黄色沉淀产生。
实验现象:
结论解释:
1滴管PbI2溶液
静置,待上层
液体变澄清
几滴
0.1mol/LKI溶液
PbI2(s) Pb2+(aq) + 2I-(aq)
PbI2
PbI2在水中溶解平衡
Pb2+
l-
尽管PbI2固体难溶于水,但仍有部分Pb2+和 I-离开固体表面进入溶液,同时进入溶液的Pb2+和 I-又会在固体表面沉淀下来,当这两个过程速率相等时, Pb2+和 I-的沉淀与PbI2固体的溶解达到平衡状态即达到沉淀溶解平衡状态. PbI2固体在水中的沉淀溶解平衡可表示为:
溶解
PbI2s) Pb2+ ( aq ) + 2l-(aq)
沉淀
一、沉淀溶解平衡(难溶电解质)
3)特征:
逆、动、等、定、变
一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。
2)表达式:
1)概念:
PbI2 (s) Pb2+ (aq) +2I- (aq)
沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。
动态平衡
外界条件一定,溶液中各粒子的浓度保持不变
外界条件改变,溶解平衡发生移动。
V溶解=V析出≠0
动:
等:
定:
变:
问题探究2、
难溶电解质的沉淀溶解平衡与难电离物质的电离平衡有什么区别和联系?
习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。
难溶 微溶 可溶 易溶
0.01 1 10 (Sg/100g水)
4)影响溶解平衡的因素:
①内因:电解质本身的性质
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
②外因:
a)浓度:
b)温度:
AgCl(s) Ag+(aq) + Cl-(aq)
通常我们讲的外因包括浓度、温度、压强等。对于溶解平衡来说,在溶液中进行,可忽略压强的影响。
平衡右移
平衡左移
多数平衡向溶解方向移动
升温
①加水
②增大相同离子浓度
思考:对于平衡 AgCl Ag++Cl-
若改变条件,对其有何影响
改变条件 平衡移动方向 C(Ag+ ) C(Cl-)
升 温
加AgCl(s)
加NaCl(s)
加AgNO3(s)
→ ↑ ↑
不移动 不变 不变
← ↓ ↑
← ↑ ↓
【巩固练习5】
将足量AgCl分别溶于下列试剂中形成AgCl饱和溶液 ,沉淀溶解平衡表示式为:AgCl的Ksp= 1.8×
① 水中 ② 10mL 0.1mol/L NaCl溶液
5mL 0.1mol/L 的MgCl2溶液中。
相同温度下,Ag+浓度大小顺序? _____
几种难溶电解质在25℃时的溶解平衡和溶度积:
AgCl(s) Ag+ + Cl- Ksp= [Ag+][Cl-] = 1.8×10-10mol2 L-2
AgBr(s) Ag+ + Br- Ksp= [Ag+][Br-] = 5.0×10-13mol2 L-2
AgI(s) Ag+ + I- Ksp= [Ag+][I-] = 8.3×10-17mol2 L-2
Mg(OH)2(s) Mg2++2OH- Ksp= [Mg2+][OH-] 2 = 5.6×10-12mol3 L-3
相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶解度:AgCl > AgBr > AgI
② Ksp反映了难溶电解质在水中的溶解度
【巩固练习3】
已知在某温时, 的溶度积Ksp=3.2× 求室温下饱和 溶液中 和 的物质的量浓度。
【巩固练习4】
已知的 溶度积为4.0× 在下列情况时的溶解度(以 表示, 不考虑副反应)。(1)在纯水中;
(2)在1.0× mol/LNaF溶液中;
(3)在1.0× mol/LCaCl2溶液中。
练一练
1、下列叙述正确的是( )
A.由于AgCl水溶液导电性很弱,所以它是弱电解质
B.难溶电解质离子浓度的乘积就是该物质的溶度积常数
C.溶度积常数大者,溶解度也大
D.用水稀释含有AgCl固体的溶液时, AgCl的溶度积常数不变。
D
小结
1.理解难溶电解质的溶解平衡。
2.溶度积和溶度积规则。
3.利用平衡移动原理分析沉淀的生成。
