高一新生化学第一学期开学考试测试题(含答案)
文档属性
| 名称 | 高一新生化学第一学期开学考试测试题(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 542.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-09 00:00:00 | ||
图片预览


文档简介
高一新生化学第一学期开学考试测试题(含答案)
满分100分
考试时间100分钟
可能用到的相对分子质量:
H-1
C-12
N-14
0-16
Na-23
Cl-35.5
第Ⅰ卷
选择题(60分)
一、选择题(选出下列各题中唯一正确的答案。每小题3分,共60分。)
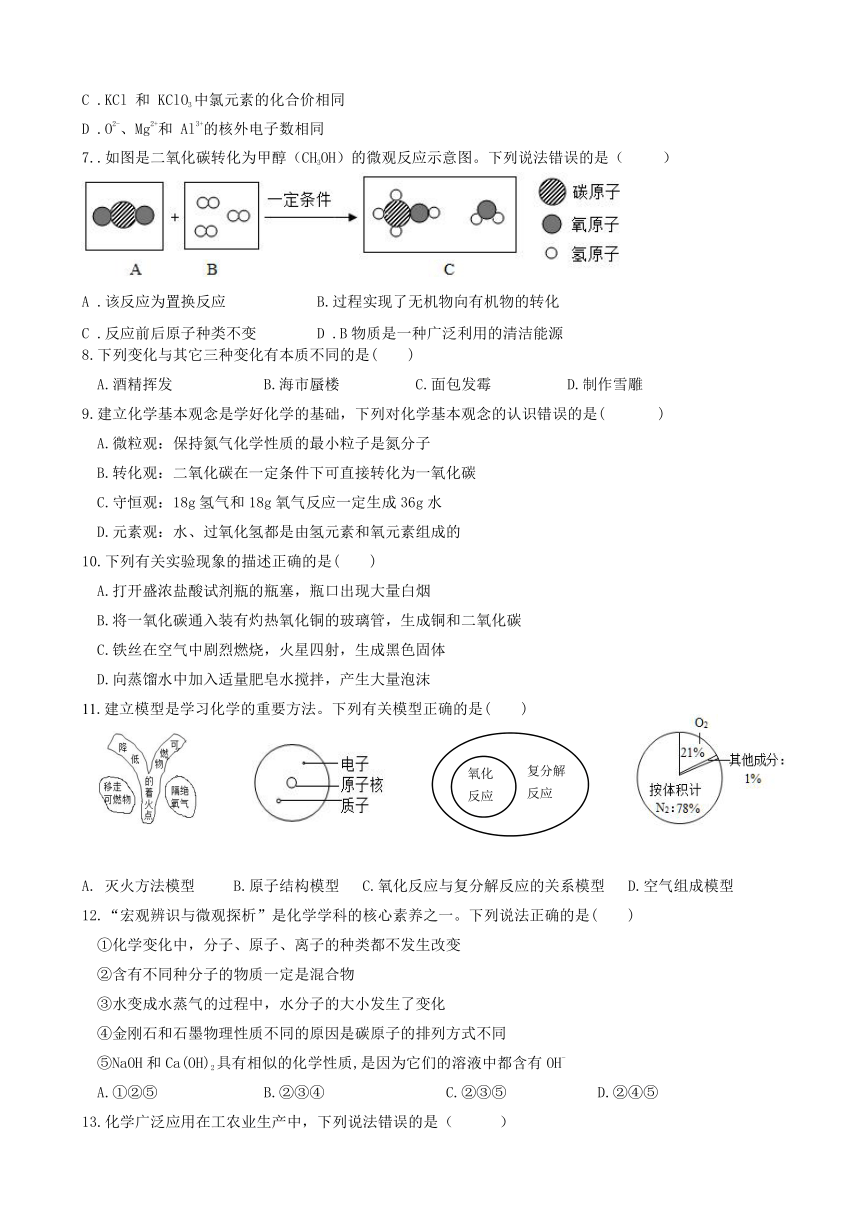
1.疫情就是命令,防控就是责任。面对突如其来的新型冠状病毒肺炎疫情,我省各地积极行动起来,下列做法涉及化学变化的是(
??)
A
.佩戴口罩出行
B
.勤洗手
C.
测体温
D
.消毒液清毒
2.下列实验操作正确的是(
??)
A
.过滤?
B
.滴加滴体?
C
.收集二氧化碳并验满?
D
.闻气体的气味?
3..钪(Kc)是一种“工业的维生素”。下图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是(
???)
A
.钪的相对原子质量是21
B
.钪属于非金属元素
C
.钪原子核外有四个电子层
D
.原子结构示意图中X=10
4.根据你的生活经验和所学知识,下列做法不合理的是(
??)
A
.含有黄曲霉素的霉变大米,可以清洗后煮熟食用
B
.被蚊虫叮咬后,在叮咬处涂抹肥皂水减轻痛痒
C
.发生火灾时,用湿毛巾捂住口鼻,并尽量贴近地面逃生
D
.用灼烧闻气味的方法区分棉纱线和羊毛线
5..下列物质放在空气中,质量增加且变质的是(
??)
A
浓盐酸
B.食盐
C.烧碱
D.浓硫酸
6.正确理解和使用化学用语是重要的化学学科素养。下列说法正确的是(
??)
A.H2O、H2O2、H2SO4中均含有氢分子
B.
表示的粒子都是阳离子
C
.KCl
和
KClO3中氯元素的化合价相同
D
.O2-、Mg2+和
Al3+的核外电子数相同
7..如图是二氧化碳转化为甲醇(CH3OH)的微观反应示意图。下列说法错误的是(
??)
A
.该反应为置换反应
B.过程实现了无机物向有机物的转化
C
.反应前后原子种类不变
D
.B物质是一种广泛利用的清洁能源
8.下列变化与其它三种变化有本质不同的是(
)
A.酒精挥发
B.海市蜃楼
C.面包发霉
D.制作雪雕
9.建立化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(
)
A.微粒观:保持氮气化学性质的最小粒子是氮分子
B.转化观:二氧化碳在一定条件下可直接转化为一氧化碳
C.守恒观:18g氢气和18g氧气反应一定生成36g水
D.元素观:水、过氧化氢都是由氢元素和氧元素组成的
10.下列有关实验现象的描述正确的是(
)
A.打开盛浓盐酸试剂瓶的瓶塞,瓶口出现大量白烟
B.将一氧化碳通入装有灼热氧化铜的玻璃管,生成铜和二氧化碳
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.向蒸馏水中加入适量肥皂水搅拌,产生大量泡沫
11.建立模型是学习化学的重要方法。下列有关模型正确的是(
)
A.
灭火方法模型
B.原子结构模型
C.氧化反应与复分解反应的关系模型
D.空气组成模型
12.“宏观辨识与微观探析”是化学学科的核心素养之一。下列说法正确的是(
)
①化学变化中,分子、原子、离子的种类都不发生改变
②含有不同种分子的物质一定是混合物
③水变成水蒸气的过程中,水分子的大小发生了变化
④金刚石和石墨物理性质不同的原因是碳原子的排列方式不同
⑤NaOH和Ca(OH)2具有相似的化学性质,是因为它们的溶液中都含有OH-
A.①②⑤
B.②③④
C.②③⑤
D.②④⑤
13.化学广泛应用在工农业生产中,下列说法错误的是(
)
A.焊接铁制品时可用稀盐酸除去其表面的铁锈
B.生石灰易吸水潮解,可以作为食品的干燥剂
C.磷酸二氢铵和硝酸钾都属于复合肥料
D.大力推广使用脱硫煤,可减少酸雨的形成
14.关于下列符号或图示的有关说法正确的是(
)
A.①表示两个氧原子
B.②和④均表示阳离子
C.③和⑤所表示的粒子化学性质相似
D.由⑥可知碘的相对原子质量为126.9g
15.归纳法是很好的学习方法。小红同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁(如右图所示)。下列表格中的各组物质不符合这种关系的是(
)
选项
甲
乙
丙
丁
A
黑色固体
木炭
二氧化锰
高锰酸钾
B
合成材料
塑料
合成纤维
合成橡胶
C
溶液
糖水
生理盐水
泥浆
D
化石燃料
石油
煤
酒精
16.分析推理是化学学习中常用的思维方法.下列分析推理正确的是:
A.浓硫酸具有吸水性,所以浓盐酸也具有吸水性
B.O2和O3的分子构成不同,所以它们的化学性质不同
C.离子是带电荷的微粒,所以带电荷的微粒一定是离子
D.酸雨的pH小于7,所以pH小于7的雨水一定是酸雨
17.如图所示,实验小组的同学按表中的选项添加试剂,实验时将滴管中的液体滴入试管B中,试管A中的溶液甲没有明显现象的是(
)
选项
滴管中的液体
试管B中的固体乙
试管A中的溶液甲
A
水
烧碱
饱和澄清石灰水
B
浓氨水
熟石灰
紫色石蕊溶液
C
浓盐酸
铜片
硝酸银溶液
D
稀盐酸
石灰石
酚酞溶液
18.下列有关说法,正确的是(
)
A.配制氯化钠溶液过程中,量取水时俯视量筒读数,会导致配制溶液的溶质质量分数偏小
B.称量固体药品过程中,砝码端忘垫质量相同的纸片,则称得的固体质量偏小
C.浓硫酸在空气中敞口放置一段时间后,溶液的溶质质量分数变大
D.去除粗盐中难溶性杂质的实验过程中,蒸发滤液时,待蒸发皿中滤液蒸干后停止加热
19.推理是化学学习中常用的方法,下列推理正确的是(
)
A.CO2
、SO2均可与碱溶液发生反应,所以非金属氧化物一定能与碱溶液反应
B.同种元素的质子数相同,所以含有相同质子数的粒子一定属于同种元素
C.有机化合物都含有碳元素,所以含有碳元素的化合物一定是有机化合物
D.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定显酸性
20.下列实验操作能达到实验目的的是(
)
选项
实验目的
实验操作
A
除去部分变质的氢氧化钠溶液中的杂质
加入适量的氯化钙溶液,过滤
B
鉴别氯化铵、氯化钾、尿素三种化肥
加入熟石灰研磨后闻气味
C
FeCl3、HCl、NaOH、NaCl四种溶液
仅用组内物质鉴别
D
除去二氧化碳气体中的氯化氢
将混合气体通入氢氧化钠溶液
第Ⅱ卷
非选择题(共40分)
二、填空题(12分)
21.(3分)饺子是中国的传统美食。制作饺子的原料有:面粉、牛肉、蔬菜、植物油、调味剂等。请根据所学知识回答下列问题。
(1)制作饺子的原料中富含蛋白质的是
。笊篱由竹蔑、柳条、金属丝等编成,烹饪时可以用它来捞取饺子,其分离原理与
(填“过滤”或“蒸发”)操作类似。
(2)
制作饺子时可加入加碘盐,人体中缺碘可能患有的疾病是
。
22.(4分)在抗击“新冠肺炎病毒”期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用,其中84消毒液[有效成分为次氯酸钠(NaClO)和二氧化氯(ClO2)
]是常用的消毒剂。
(1)次氯酸钠所属的物质类别为
(填“酸”、“碱”、“盐”或“氧化物”),
其中氯元素的化合价为
。
(2)已知次氯酸钠溶液和空气中的二氧化碳反应,生成X和次氯酸(HClO)。该反应的化学方程式为
NaClO+CO2
+H2O=X+HClO,则X的化学式为
。
(3)二氧化氯是一种环保型杀菌消毒剂,则二氧化氯中各元素的质量比为
(填整数比)。
23.(5分)某同学查阅了
NaCl和
KNO3在不同温度时的溶解度,并绘制出相应的溶解度曲线。回答下列问题。
(1)图中表示NaCl溶解度曲线的是
(填“a”或“b”)。
(2)现有一瓶接近饱和的KNO3溶液,若要使其变为饱和溶液且溶质质量分数增大,可采取的一种方法是
。
(3)20
℃时,将20克的氯化钠加入50克水中,所得溶液是
(填“饱和”或“不饱和”)溶液,溶质质量分数为
(结果精确到0.1%)。
(4))60
℃时,饱和的KNO3溶液中混有少量的氯化钠,应采用
的方法提纯硝酸钾。
三、实验探究题(共16分)
24.
(8分)小亮学完合金后,知道了不锈钢的主要成分是铁,白铜中含有铜和镍(Ni)。他决定探究Fe、Cu、Ni的金属活动性顺序。
(1)【查阅资料】镍能与稀硫酸反应,生成能溶于水的NiSO4,并放出氢气。写出镍与稀硫酸反应的化学方程式:
。(2分)
(2)【猜想与假设】根据教材中常见金属的活动性顺序和查阅的资料,对以上三种金属的活动性作出猜想:
猜想
①Fe>Ni>Cu;
猜想②
(3)【实验探究】把用砂纸打磨过的镍片浸入FeSO4
溶液中,过一会儿取出后,却发现镍片表面无明显变化。证明
(填“猜想①”或“猜想②”)成立。
(4)【拓展延伸】用铜片、NiSO4溶液和
,通过实验探究也能判断
Fe、Cu、Ni的金属活动性顺序。
(5)探究完上述金属之后,他知道了铁容易生锈是因为它跟
和
共同作用的结果,防止铁生锈的方法是
(填写一种)
25.(8分)充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。钠的化学性质活泼,常温下可以与氧气、水反应。在实验室里,金属钠保存
在煤油中。用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水(滴有酚酞溶液)的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发现嘶嘶的响声,偶有火星出现,
溶液变成红色。
依据提供的信息,回答下列问题:
(1)“钠保存在煤油中”说明钠具有的化学性质是 。
(2)“钠块浮在水面上”说明钠具有的物理性质是 。
(3)“溶液变成红色”
说明钠与水反应的生成物中含有显 性的物质。
(4)根据所学知识解释钠“熔化成银白色小球”的原因是 。
四、应用题(12分)
26.(5分)根据下列实验装置,请回答:
第5题图
(1)检查装置A气密性的方法是夹紧止水夹, ,则气密性良好。
(2)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法制备甲烷。选择的发生装置为________
(填字母代号)。用装置E收集甲烷,利用了甲烷 的物理性质。
(3)用装置C而不用装置D收集甲烷,原因是 。
(4)设计实验证明CH4中含有氢元素:检验其纯度后, 。
27.(7分)实验小组用pH传感器探究盐酸与氢氧化钠溶液的反应,测定结果如图所示。
(1)向烧瓶中缓慢注入盐酸,能说明盐酸与氢氧化钠恰好完全反应的现象是
(2)60s时,取反应后的溶液100g,向其中加入
10.6g碳酸钠粉末恰好完全反应,计算60s时溶液
中HCl的质量分数。(写出计算过程)
参考答案
一.选择题(每题3分,,共60分)
1
2
3
4
5
6
7
8
9
10
D
C
C
A
C
D
A
C
C
D
11
12
13
14
15
16
17
18
19
20
D
D
B
C
B
B
D
B
D
C
二、填空题(共3小题,共12分)
21.(3分)(1)牛肉(2)过滤
(3)甲状腺肿大
22.(4分)(1)盐;正一价
(2)NaHCO3
(3)Cl:O=71:64
23.(5分)(1)
b
(2)增加溶质
(3)饱和;26.5%
(4)降温结晶
三、实验探究(共2小题,共16分)
24.(8分)
(1)Ni+
H2SO4
=
Ni
SO4
+H2↑(2分)
(2)Ni〉Fe〉Cu
(3)猜想①
(4)铁片
(5)氧气和水蒸气;保持铁制品表面洁净和干燥等(合理即可)
25.
(8分)
(1)常温下与氧气、水发生反应
(2)钠的密度比水的密度小
(3)碱
(4)钠的熔点低,钠与水反应放热
四、应用题(共2小题,共12分)
26.(5分)(1)向长颈漏斗中加水,使其下端浸在水中,继续加水形成一段水柱,产生高度差,在一定时间内,水柱不回落
(2)B 不溶于水
(3)甲烷的密度比空气小
(4)点燃甲烷气体,在火焰上方罩一个干而冷的烧杯
27.(共7分)(1)溶液由红色恰好变为无色
(2)解:设HCl的质量为X
Na2CO3+
2HCl=2
NaCl+H2O+CO2↑
106
73
10.6g
X
106/106g=73/7.3g
X=7.3g
HCl的质量分数为:7.3g/100g×100%=7.3%
答:HCl的质量分数为7.3
%。
甲
氧化
反应
复分解
反应
乙
丙
丁
满分100分
考试时间100分钟
可能用到的相对分子质量:
H-1
C-12
N-14
0-16
Na-23
Cl-35.5
第Ⅰ卷
选择题(60分)
一、选择题(选出下列各题中唯一正确的答案。每小题3分,共60分。)
1.疫情就是命令,防控就是责任。面对突如其来的新型冠状病毒肺炎疫情,我省各地积极行动起来,下列做法涉及化学变化的是(
??)
A
.佩戴口罩出行
B
.勤洗手
C.
测体温
D
.消毒液清毒
2.下列实验操作正确的是(
??)
A
.过滤?
B
.滴加滴体?
C
.收集二氧化碳并验满?
D
.闻气体的气味?
3..钪(Kc)是一种“工业的维生素”。下图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是(
???)
A
.钪的相对原子质量是21
B
.钪属于非金属元素
C
.钪原子核外有四个电子层
D
.原子结构示意图中X=10
4.根据你的生活经验和所学知识,下列做法不合理的是(
??)
A
.含有黄曲霉素的霉变大米,可以清洗后煮熟食用
B
.被蚊虫叮咬后,在叮咬处涂抹肥皂水减轻痛痒
C
.发生火灾时,用湿毛巾捂住口鼻,并尽量贴近地面逃生
D
.用灼烧闻气味的方法区分棉纱线和羊毛线
5..下列物质放在空气中,质量增加且变质的是(
??)
A
浓盐酸
B.食盐
C.烧碱
D.浓硫酸
6.正确理解和使用化学用语是重要的化学学科素养。下列说法正确的是(
??)
A.H2O、H2O2、H2SO4中均含有氢分子
B.
表示的粒子都是阳离子
C
.KCl
和
KClO3中氯元素的化合价相同
D
.O2-、Mg2+和
Al3+的核外电子数相同
7..如图是二氧化碳转化为甲醇(CH3OH)的微观反应示意图。下列说法错误的是(
??)
A
.该反应为置换反应
B.过程实现了无机物向有机物的转化
C
.反应前后原子种类不变
D
.B物质是一种广泛利用的清洁能源
8.下列变化与其它三种变化有本质不同的是(
)
A.酒精挥发
B.海市蜃楼
C.面包发霉
D.制作雪雕
9.建立化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(
)
A.微粒观:保持氮气化学性质的最小粒子是氮分子
B.转化观:二氧化碳在一定条件下可直接转化为一氧化碳
C.守恒观:18g氢气和18g氧气反应一定生成36g水
D.元素观:水、过氧化氢都是由氢元素和氧元素组成的
10.下列有关实验现象的描述正确的是(
)
A.打开盛浓盐酸试剂瓶的瓶塞,瓶口出现大量白烟
B.将一氧化碳通入装有灼热氧化铜的玻璃管,生成铜和二氧化碳
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.向蒸馏水中加入适量肥皂水搅拌,产生大量泡沫
11.建立模型是学习化学的重要方法。下列有关模型正确的是(
)
A.
灭火方法模型
B.原子结构模型
C.氧化反应与复分解反应的关系模型
D.空气组成模型
12.“宏观辨识与微观探析”是化学学科的核心素养之一。下列说法正确的是(
)
①化学变化中,分子、原子、离子的种类都不发生改变
②含有不同种分子的物质一定是混合物
③水变成水蒸气的过程中,水分子的大小发生了变化
④金刚石和石墨物理性质不同的原因是碳原子的排列方式不同
⑤NaOH和Ca(OH)2具有相似的化学性质,是因为它们的溶液中都含有OH-
A.①②⑤
B.②③④
C.②③⑤
D.②④⑤
13.化学广泛应用在工农业生产中,下列说法错误的是(
)
A.焊接铁制品时可用稀盐酸除去其表面的铁锈
B.生石灰易吸水潮解,可以作为食品的干燥剂
C.磷酸二氢铵和硝酸钾都属于复合肥料
D.大力推广使用脱硫煤,可减少酸雨的形成
14.关于下列符号或图示的有关说法正确的是(
)
A.①表示两个氧原子
B.②和④均表示阳离子
C.③和⑤所表示的粒子化学性质相似
D.由⑥可知碘的相对原子质量为126.9g
15.归纳法是很好的学习方法。小红同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁(如右图所示)。下列表格中的各组物质不符合这种关系的是(
)
选项
甲
乙
丙
丁
A
黑色固体
木炭
二氧化锰
高锰酸钾
B
合成材料
塑料
合成纤维
合成橡胶
C
溶液
糖水
生理盐水
泥浆
D
化石燃料
石油
煤
酒精
16.分析推理是化学学习中常用的思维方法.下列分析推理正确的是:
A.浓硫酸具有吸水性,所以浓盐酸也具有吸水性
B.O2和O3的分子构成不同,所以它们的化学性质不同
C.离子是带电荷的微粒,所以带电荷的微粒一定是离子
D.酸雨的pH小于7,所以pH小于7的雨水一定是酸雨
17.如图所示,实验小组的同学按表中的选项添加试剂,实验时将滴管中的液体滴入试管B中,试管A中的溶液甲没有明显现象的是(
)
选项
滴管中的液体
试管B中的固体乙
试管A中的溶液甲
A
水
烧碱
饱和澄清石灰水
B
浓氨水
熟石灰
紫色石蕊溶液
C
浓盐酸
铜片
硝酸银溶液
D
稀盐酸
石灰石
酚酞溶液
18.下列有关说法,正确的是(
)
A.配制氯化钠溶液过程中,量取水时俯视量筒读数,会导致配制溶液的溶质质量分数偏小
B.称量固体药品过程中,砝码端忘垫质量相同的纸片,则称得的固体质量偏小
C.浓硫酸在空气中敞口放置一段时间后,溶液的溶质质量分数变大
D.去除粗盐中难溶性杂质的实验过程中,蒸发滤液时,待蒸发皿中滤液蒸干后停止加热
19.推理是化学学习中常用的方法,下列推理正确的是(
)
A.CO2
、SO2均可与碱溶液发生反应,所以非金属氧化物一定能与碱溶液反应
B.同种元素的质子数相同,所以含有相同质子数的粒子一定属于同种元素
C.有机化合物都含有碳元素,所以含有碳元素的化合物一定是有机化合物
D.酸溶液能使紫色石蕊溶液变红,所以能使紫色石蕊变红的溶液一定显酸性
20.下列实验操作能达到实验目的的是(
)
选项
实验目的
实验操作
A
除去部分变质的氢氧化钠溶液中的杂质
加入适量的氯化钙溶液,过滤
B
鉴别氯化铵、氯化钾、尿素三种化肥
加入熟石灰研磨后闻气味
C
FeCl3、HCl、NaOH、NaCl四种溶液
仅用组内物质鉴别
D
除去二氧化碳气体中的氯化氢
将混合气体通入氢氧化钠溶液
第Ⅱ卷
非选择题(共40分)
二、填空题(12分)
21.(3分)饺子是中国的传统美食。制作饺子的原料有:面粉、牛肉、蔬菜、植物油、调味剂等。请根据所学知识回答下列问题。
(1)制作饺子的原料中富含蛋白质的是
。笊篱由竹蔑、柳条、金属丝等编成,烹饪时可以用它来捞取饺子,其分离原理与
(填“过滤”或“蒸发”)操作类似。
(2)
制作饺子时可加入加碘盐,人体中缺碘可能患有的疾病是
。
22.(4分)在抗击“新冠肺炎病毒”期间,消毒剂在公共场所进行卫生防疫时发挥着重要作用,其中84消毒液[有效成分为次氯酸钠(NaClO)和二氧化氯(ClO2)
]是常用的消毒剂。
(1)次氯酸钠所属的物质类别为
(填“酸”、“碱”、“盐”或“氧化物”),
其中氯元素的化合价为
。
(2)已知次氯酸钠溶液和空气中的二氧化碳反应,生成X和次氯酸(HClO)。该反应的化学方程式为
NaClO+CO2
+H2O=X+HClO,则X的化学式为
。
(3)二氧化氯是一种环保型杀菌消毒剂,则二氧化氯中各元素的质量比为
(填整数比)。
23.(5分)某同学查阅了
NaCl和
KNO3在不同温度时的溶解度,并绘制出相应的溶解度曲线。回答下列问题。
(1)图中表示NaCl溶解度曲线的是
(填“a”或“b”)。
(2)现有一瓶接近饱和的KNO3溶液,若要使其变为饱和溶液且溶质质量分数增大,可采取的一种方法是
。
(3)20
℃时,将20克的氯化钠加入50克水中,所得溶液是
(填“饱和”或“不饱和”)溶液,溶质质量分数为
(结果精确到0.1%)。
(4))60
℃时,饱和的KNO3溶液中混有少量的氯化钠,应采用
的方法提纯硝酸钾。
三、实验探究题(共16分)
24.
(8分)小亮学完合金后,知道了不锈钢的主要成分是铁,白铜中含有铜和镍(Ni)。他决定探究Fe、Cu、Ni的金属活动性顺序。
(1)【查阅资料】镍能与稀硫酸反应,生成能溶于水的NiSO4,并放出氢气。写出镍与稀硫酸反应的化学方程式:
。(2分)
(2)【猜想与假设】根据教材中常见金属的活动性顺序和查阅的资料,对以上三种金属的活动性作出猜想:
猜想
①Fe>Ni>Cu;
猜想②
(3)【实验探究】把用砂纸打磨过的镍片浸入FeSO4
溶液中,过一会儿取出后,却发现镍片表面无明显变化。证明
(填“猜想①”或“猜想②”)成立。
(4)【拓展延伸】用铜片、NiSO4溶液和
,通过实验探究也能判断
Fe、Cu、Ni的金属活动性顺序。
(5)探究完上述金属之后,他知道了铁容易生锈是因为它跟
和
共同作用的结果,防止铁生锈的方法是
(填写一种)
25.(8分)充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明。钠的化学性质活泼,常温下可以与氧气、水反应。在实验室里,金属钠保存
在煤油中。用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水(滴有酚酞溶液)的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发现嘶嘶的响声,偶有火星出现,
溶液变成红色。
依据提供的信息,回答下列问题:
(1)“钠保存在煤油中”说明钠具有的化学性质是 。
(2)“钠块浮在水面上”说明钠具有的物理性质是 。
(3)“溶液变成红色”
说明钠与水反应的生成物中含有显 性的物质。
(4)根据所学知识解释钠“熔化成银白色小球”的原因是 。
四、应用题(12分)
26.(5分)根据下列实验装置,请回答:
第5题图
(1)检查装置A气密性的方法是夹紧止水夹, ,则气密性良好。
(2)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法制备甲烷。选择的发生装置为________
(填字母代号)。用装置E收集甲烷,利用了甲烷 的物理性质。
(3)用装置C而不用装置D收集甲烷,原因是 。
(4)设计实验证明CH4中含有氢元素:检验其纯度后, 。
27.(7分)实验小组用pH传感器探究盐酸与氢氧化钠溶液的反应,测定结果如图所示。
(1)向烧瓶中缓慢注入盐酸,能说明盐酸与氢氧化钠恰好完全反应的现象是
(2)60s时,取反应后的溶液100g,向其中加入
10.6g碳酸钠粉末恰好完全反应,计算60s时溶液
中HCl的质量分数。(写出计算过程)
参考答案
一.选择题(每题3分,,共60分)
1
2
3
4
5
6
7
8
9
10
D
C
C
A
C
D
A
C
C
D
11
12
13
14
15
16
17
18
19
20
D
D
B
C
B
B
D
B
D
C
二、填空题(共3小题,共12分)
21.(3分)(1)牛肉(2)过滤
(3)甲状腺肿大
22.(4分)(1)盐;正一价
(2)NaHCO3
(3)Cl:O=71:64
23.(5分)(1)
b
(2)增加溶质
(3)饱和;26.5%
(4)降温结晶
三、实验探究(共2小题,共16分)
24.(8分)
(1)Ni+
H2SO4
=
Ni
SO4
+H2↑(2分)
(2)Ni〉Fe〉Cu
(3)猜想①
(4)铁片
(5)氧气和水蒸气;保持铁制品表面洁净和干燥等(合理即可)
25.
(8分)
(1)常温下与氧气、水发生反应
(2)钠的密度比水的密度小
(3)碱
(4)钠的熔点低,钠与水反应放热
四、应用题(共2小题,共12分)
26.(5分)(1)向长颈漏斗中加水,使其下端浸在水中,继续加水形成一段水柱,产生高度差,在一定时间内,水柱不回落
(2)B 不溶于水
(3)甲烷的密度比空气小
(4)点燃甲烷气体,在火焰上方罩一个干而冷的烧杯
27.(共7分)(1)溶液由红色恰好变为无色
(2)解:设HCl的质量为X
Na2CO3+
2HCl=2
NaCl+H2O+CO2↑
106
73
10.6g
X
106/106g=73/7.3g
X=7.3g
HCl的质量分数为:7.3g/100g×100%=7.3%
答:HCl的质量分数为7.3
%。
甲
氧化
反应
复分解
反应
乙
丙
丁
同课章节目录
