山东省临沂市兰陵四高2022届高三上学期开学收心考试化学试题(Word版含答案)
文档属性
| 名称 | 山东省临沂市兰陵四高2022届高三上学期开学收心考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 588.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-09 20:30:46 | ||
图片预览

文档简介
兰陵四高2019级高三上学期开学收心考试试题
化
学
2021.09
可能用到的相对原子质量:
1
12
16
23
35.5
56
一、选择题(本题共10小题,每小题2分,共20分。在每小题只有一项符合题目要求)
1.
化学知识在新冠肺炎的疫情防控中发挥着重要作用,下列说法正确的是(
)
A.
用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸()等均属于有机物
B.
医用消毒酒精是的乙醇溶液
C.
修建“火神山”医院所用的(高密度聚乙烯)膜是一种无毒、无味的高分子材料
D.
医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
2.
下列说法不正确的是(
)
A.
用稀盐酸清洗铜器表面
B.
明矾可以对自来水消毒杀菌
C.
具有氧化性,其稀溶液可用于消毒
D.
钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
3.
以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是(
)
A.
反应③表明具有酸性氧化物的性质
B.
反应④说明的热稳定性强于
C.
反应⑤、⑥可用于潜水艇中氧气的供给
D.
上述转化中发生的反应有分解反应、化合反应、置换反应
4.
为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是(
)
A.
溶液(),选用适量的溶液
B.
溶液()通入过量的气体
C.
粉末(),加入过量的溶液
D.
,将混合气体通入饱和溶液
5.
下列离子方程式正确的是(
)
A.
氮化镁投入过量盐酸中:
B.
溶于氨水:
C.
向胶体中加入溶液:
D.
向新制悬浊液中加入溶液并加热:
6.
已知有机物、之间存在转化关系:(已配平),则符合该反应条件的有机物有(不含立体异构)(
)
A.
2种
B.
4种
C.
6种
D.
8种
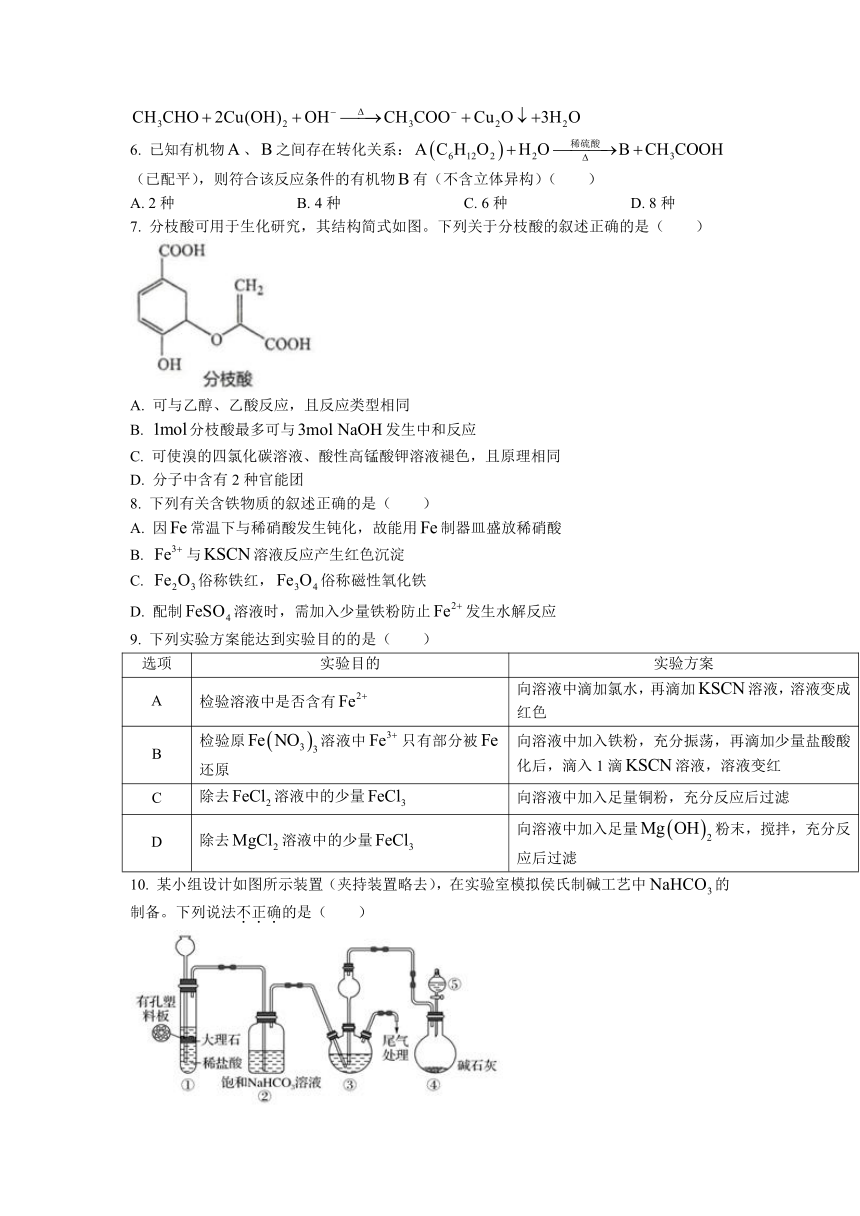
7.
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是(
)
A.
可与乙醇、乙酸反应,且反应类型相同
B.
分枝酸最多可与发生中和反应
C.
可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
D.
分子中含有2种官能团
8.
下列有关含铁物质的叙述正确的是(
)
A.
因常温下与稀硝酸发生钝化,故能用制器皿盛放稀硝酸
B.
与溶液反应产生红色沉淀
C.
俗称铁红,俗称磁性氧化铁
D.
配制溶液时,需加入少量铁粉防止发生水解反应
9.
下列实验方案能达到实验目的的是(
)
选项
实验目的
实验方案
A
检验溶液中是否含有
向溶液中滴加氯水,再滴加溶液,溶液变成红色
B
检验原溶液中只有部分被还原
向溶液中加入铁粉,充分振荡,再滴加少量盐酸酸化后,滴入1滴溶液,溶液变红
C
除去溶液中的少量
向溶液中加入足量铜粉,充分反应后过滤
D
除去溶液中的少量
向溶液中加入足量粉末,搅拌,充分反应后过滤
10.
某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中的制备。下列说法不正确的是(
)
A.
③中反应的离子方程式为
B.
应先向③中先通入足量,再通入足量
C.
③、⑤中可分别盛放饱和食盐水和浓氨水
D.
装置①也可用于制
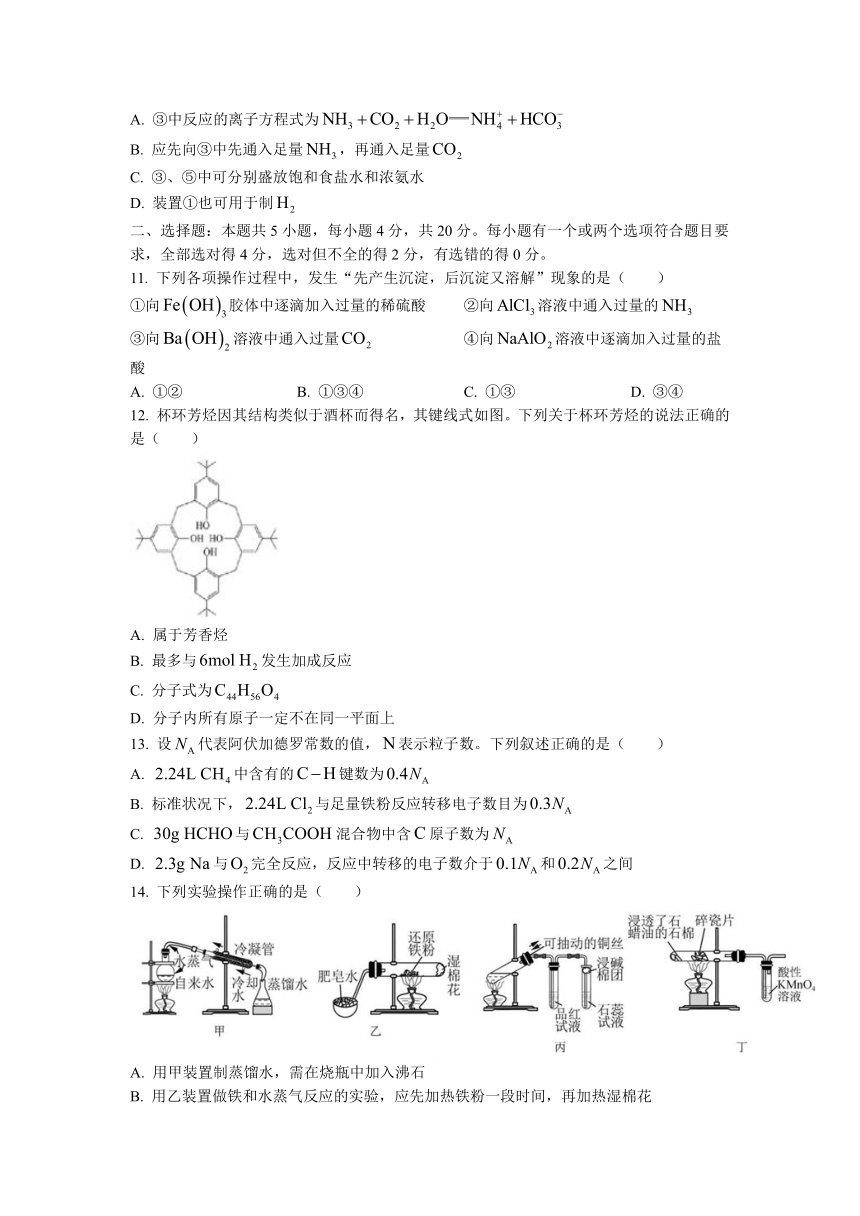
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是(
)
①向胶体中逐滴加入过量的稀硫酸
②向溶液中通入过量的
③向溶液中通入过量
④向溶液中逐滴加入过量的盐酸
A.
①②
B.
①③④
C.
①③
D.
③④
12.
杯环芳烃因其结构类似于酒杯而得名,其键线式如图。下列关于杯环芳烃的说法正确的是(
)
A.
属于芳香烃
B.
最多与发生加成反应
C.
分子式为
D.
分子内所有原子一定不在同一平面上
13.
设代表阿伏加德罗常数的值,表示粒子数。下列叙述正确的是(
)
A.
中含有的键数为
B.
标准状况下,与足量铁粉反应转移电子数目为
C.
与混合物中含原子数为
D.
与完全反应,反应中转移的电子数介于和之间
14.
下列实验操作正确的是(
)
A.
用甲装置制蒸馏水,需在烧瓶中加入沸石
B.
用乙装置做铁和水蒸气反应的实验,应先加热铁粉一段时间,再加热湿棉花
C.
丙装置中,铜与浓硫酸反应后停止加热,待试管冷却后向试管中加水,观察溶液的颜色
D.
用丁装置探究石蜡油分解的部分产物,实验结束时,先停止加热,再撤导管
15.
分解的过程如图所示,依次发生反应Ⅰ和Ⅱ,其中反应Ⅰ较慢,反应Ⅱ很快,下列有关反应的说法错误的是(
)
A.
是该反应的催化剂
B.
分解的速率由反应Ⅱ决定
C.
反应Ⅰ较慢的原因可能是反应Ⅰ的活化能较高
D.
升高温度,可提高反应Ⅰ、Ⅱ的速率
二、非选择题(共4小题,60分)
16.(16分)请用化学用语回答下列各题:
(1)实验室用无水乙醇处理废小钠屑的化学方程式______________________________。
(2)可用作生氧剂的淡黄色固体,其电子式为_____________________,与水反应的离子方程式为______________________________。
(3)在氮气中___________(填“能”或者“不能”)冷却镁粉,其原因是(用化学方程式表示)______________________________。
(4)向铝制易拉罐中,滴加溶液直至过量,主要反应的离子方程式有____________________。
(5)用化合反应制备氯化亚铁的化学方程式:______________________________。
(6)用氯化铁溶液腐蚀废旧线路板上铜箔的离子方程式______________________________。
17.(14分)具有强氧化性,具有还原性,某同学根据氧化还原反应的知识推测与能发生反应。为了验证此推测结果,该同学设计并进行如下实验:
步骤1:按如上图所示的装置组装仪器(图中夹持仪器已省略)并_____________________,然后装入药品。
步骤2:打开、,在氢气流经装有的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)步骤1中组装好仪器后的操作是_______________________________。
(2)装置中所盛放的试剂是___________,其作用是_______________________________。
(3)步骤3中的必要操作为打开、,___________(请按正确的顺序填入下列步骤的字母)。
A.
加热至逐渐熔化,反应一段时间
B.
用小试管收集气体并检验其纯度
C.
关闭
D.
停止加热,充分冷却
(4)由上述实验可推出与反应的化学方程式为_______________________________。
(5)若只用水和酚酞试液__________(填“能”或者“不能”)检验中是否反应完全,若出现_____________________,则可能没有反应完全(若不能,此空不填)。
18.(14分)硫酸铁铵[]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)步骤①是用热的纯碱溶液能去除废铁屑表面油污的原因(用离子方程式表示)____________________。
(2)步骤②需要加热的目的是_____________________,温度保持,采用的合适加热方式是____________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为___________(填标号)。
(3)步骤③中选用足量的,发生反应的离子方程式是_____________________,分批加入,同时为了____________________,溶液要保持小于0.5。
(4)步骤⑤的具体实验操作有______________________,经干燥得到硫酸铁铵晶体样品。
19.(16分)课本上分别介绍了聚丙烯酸钠()接枝共聚物高吸水性树脂和聚碳酸酯()。它们均可由乙烯等原料合成制备:
回答下列问题:
(1)的结构简式为___________,反应③的反应类型为____________,该反应生成的官能团的名称为___________。
(2)由乙烯得到(反应①)的两种经典方法,分别是
a.
氯代乙醇法:
b.
催化氧化法:
其中原子利用率较高的方法为___________(填“a”或“b”);中,核磁共振氢谱峰的组数与乙烯相等物质的有___________(填字母)。
(3)反应⑦的化学方程式为_______________________________。
(4)是比少两个碳原子的同系物,符合下列条件的的同分异构体共有___________种(不考虑立体异构)。
i.
含有“”结构;
ii.
所有取代基接在同一苯环上;
iii.
该同分异构体恰好能与完全反应。
(5)参照题目流程,设计以乙烯为原料制备的合成路线(无机试剂任选)。
兰陵四高2019级高三上学期开学收心考试化学试题答案
2021.09
一、1-5:CBBCD
6-10:BACDA
11.
B
12.
CD
13.
C
14.
A
15.
BC
二、非选择题
16.(16分)
(1)
(2)
(3)不能(1分)
(4)
(5)
(6)
17.(14分,每空2分)
(1)检查气密性
(2)碱石灰
除去中的和
(3)BADC
(4)
(5)能
溶液先变红后褪色
18.(14分,每空2分)
(1)
(2)加快反应速率
水浴加热
C
(3)
防止水解
(4)加热浓缩,冷却结晶,过滤
19.(16分,除特殊标记外,每空2分)
(1)
消去反应(1分)
碳碳双键(1分)
(2)b
AFG
(3)
(4)20
(5)(4分)
化
学
2021.09
可能用到的相对原子质量:
1
12
16
23
35.5
56
一、选择题(本题共10小题,每小题2分,共20分。在每小题只有一项符合题目要求)
1.
化学知识在新冠肺炎的疫情防控中发挥着重要作用,下列说法正确的是(
)
A.
用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸()等均属于有机物
B.
医用消毒酒精是的乙醇溶液
C.
修建“火神山”医院所用的(高密度聚乙烯)膜是一种无毒、无味的高分子材料
D.
医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
2.
下列说法不正确的是(
)
A.
用稀盐酸清洗铜器表面
B.
明矾可以对自来水消毒杀菌
C.
具有氧化性,其稀溶液可用于消毒
D.
钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
3.
以不同类别物质间的转化为线索,认识钠及其化合物。下列分析不正确的是(
)
A.
反应③表明具有酸性氧化物的性质
B.
反应④说明的热稳定性强于
C.
反应⑤、⑥可用于潜水艇中氧气的供给
D.
上述转化中发生的反应有分解反应、化合反应、置换反应
4.
为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是(
)
A.
溶液(),选用适量的溶液
B.
溶液()通入过量的气体
C.
粉末(),加入过量的溶液
D.
,将混合气体通入饱和溶液
5.
下列离子方程式正确的是(
)
A.
氮化镁投入过量盐酸中:
B.
溶于氨水:
C.
向胶体中加入溶液:
D.
向新制悬浊液中加入溶液并加热:
6.
已知有机物、之间存在转化关系:(已配平),则符合该反应条件的有机物有(不含立体异构)(
)
A.
2种
B.
4种
C.
6种
D.
8种
7.
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是(
)
A.
可与乙醇、乙酸反应,且反应类型相同
B.
分枝酸最多可与发生中和反应
C.
可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
D.
分子中含有2种官能团
8.
下列有关含铁物质的叙述正确的是(
)
A.
因常温下与稀硝酸发生钝化,故能用制器皿盛放稀硝酸
B.
与溶液反应产生红色沉淀
C.
俗称铁红,俗称磁性氧化铁
D.
配制溶液时,需加入少量铁粉防止发生水解反应
9.
下列实验方案能达到实验目的的是(
)
选项
实验目的
实验方案
A
检验溶液中是否含有
向溶液中滴加氯水,再滴加溶液,溶液变成红色
B
检验原溶液中只有部分被还原
向溶液中加入铁粉,充分振荡,再滴加少量盐酸酸化后,滴入1滴溶液,溶液变红
C
除去溶液中的少量
向溶液中加入足量铜粉,充分反应后过滤
D
除去溶液中的少量
向溶液中加入足量粉末,搅拌,充分反应后过滤
10.
某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中的制备。下列说法不正确的是(
)
A.
③中反应的离子方程式为
B.
应先向③中先通入足量,再通入足量
C.
③、⑤中可分别盛放饱和食盐水和浓氨水
D.
装置①也可用于制
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是(
)
①向胶体中逐滴加入过量的稀硫酸
②向溶液中通入过量的
③向溶液中通入过量
④向溶液中逐滴加入过量的盐酸
A.
①②
B.
①③④
C.
①③
D.
③④
12.
杯环芳烃因其结构类似于酒杯而得名,其键线式如图。下列关于杯环芳烃的说法正确的是(
)
A.
属于芳香烃
B.
最多与发生加成反应
C.
分子式为
D.
分子内所有原子一定不在同一平面上
13.
设代表阿伏加德罗常数的值,表示粒子数。下列叙述正确的是(
)
A.
中含有的键数为
B.
标准状况下,与足量铁粉反应转移电子数目为
C.
与混合物中含原子数为
D.
与完全反应,反应中转移的电子数介于和之间
14.
下列实验操作正确的是(
)
A.
用甲装置制蒸馏水,需在烧瓶中加入沸石
B.
用乙装置做铁和水蒸气反应的实验,应先加热铁粉一段时间,再加热湿棉花
C.
丙装置中,铜与浓硫酸反应后停止加热,待试管冷却后向试管中加水,观察溶液的颜色
D.
用丁装置探究石蜡油分解的部分产物,实验结束时,先停止加热,再撤导管
15.
分解的过程如图所示,依次发生反应Ⅰ和Ⅱ,其中反应Ⅰ较慢,反应Ⅱ很快,下列有关反应的说法错误的是(
)
A.
是该反应的催化剂
B.
分解的速率由反应Ⅱ决定
C.
反应Ⅰ较慢的原因可能是反应Ⅰ的活化能较高
D.
升高温度,可提高反应Ⅰ、Ⅱ的速率
二、非选择题(共4小题,60分)
16.(16分)请用化学用语回答下列各题:
(1)实验室用无水乙醇处理废小钠屑的化学方程式______________________________。
(2)可用作生氧剂的淡黄色固体,其电子式为_____________________,与水反应的离子方程式为______________________________。
(3)在氮气中___________(填“能”或者“不能”)冷却镁粉,其原因是(用化学方程式表示)______________________________。
(4)向铝制易拉罐中,滴加溶液直至过量,主要反应的离子方程式有____________________。
(5)用化合反应制备氯化亚铁的化学方程式:______________________________。
(6)用氯化铁溶液腐蚀废旧线路板上铜箔的离子方程式______________________________。
17.(14分)具有强氧化性,具有还原性,某同学根据氧化还原反应的知识推测与能发生反应。为了验证此推测结果,该同学设计并进行如下实验:
步骤1:按如上图所示的装置组装仪器(图中夹持仪器已省略)并_____________________,然后装入药品。
步骤2:打开、,在氢气流经装有的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)步骤1中组装好仪器后的操作是_______________________________。
(2)装置中所盛放的试剂是___________,其作用是_______________________________。
(3)步骤3中的必要操作为打开、,___________(请按正确的顺序填入下列步骤的字母)。
A.
加热至逐渐熔化,反应一段时间
B.
用小试管收集气体并检验其纯度
C.
关闭
D.
停止加热,充分冷却
(4)由上述实验可推出与反应的化学方程式为_______________________________。
(5)若只用水和酚酞试液__________(填“能”或者“不能”)检验中是否反应完全,若出现_____________________,则可能没有反应完全(若不能,此空不填)。
18.(14分)硫酸铁铵[]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)步骤①是用热的纯碱溶液能去除废铁屑表面油污的原因(用离子方程式表示)____________________。
(2)步骤②需要加热的目的是_____________________,温度保持,采用的合适加热方式是____________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为___________(填标号)。
(3)步骤③中选用足量的,发生反应的离子方程式是_____________________,分批加入,同时为了____________________,溶液要保持小于0.5。
(4)步骤⑤的具体实验操作有______________________,经干燥得到硫酸铁铵晶体样品。
19.(16分)课本上分别介绍了聚丙烯酸钠()接枝共聚物高吸水性树脂和聚碳酸酯()。它们均可由乙烯等原料合成制备:
回答下列问题:
(1)的结构简式为___________,反应③的反应类型为____________,该反应生成的官能团的名称为___________。
(2)由乙烯得到(反应①)的两种经典方法,分别是
a.
氯代乙醇法:
b.
催化氧化法:
其中原子利用率较高的方法为___________(填“a”或“b”);中,核磁共振氢谱峰的组数与乙烯相等物质的有___________(填字母)。
(3)反应⑦的化学方程式为_______________________________。
(4)是比少两个碳原子的同系物,符合下列条件的的同分异构体共有___________种(不考虑立体异构)。
i.
含有“”结构;
ii.
所有取代基接在同一苯环上;
iii.
该同分异构体恰好能与完全反应。
(5)参照题目流程,设计以乙烯为原料制备的合成路线(无机试剂任选)。
兰陵四高2019级高三上学期开学收心考试化学试题答案
2021.09
一、1-5:CBBCD
6-10:BACDA
11.
B
12.
CD
13.
C
14.
A
15.
BC
二、非选择题
16.(16分)
(1)
(2)
(3)不能(1分)
(4)
(5)
(6)
17.(14分,每空2分)
(1)检查气密性
(2)碱石灰
除去中的和
(3)BADC
(4)
(5)能
溶液先变红后褪色
18.(14分,每空2分)
(1)
(2)加快反应速率
水浴加热
C
(3)
防止水解
(4)加热浓缩,冷却结晶,过滤
19.(16分,除特殊标记外,每空2分)
(1)
消去反应(1分)
碳碳双键(1分)
(2)b
AFG
(3)
(4)20
(5)(4分)
同课章节目录
