高中化学人教版(2019)必修第一册1.3氧化还原反应(共25张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3氧化还原反应(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-09 21:25:59 | ||
图片预览





文档简介
(共25张PPT)
常见元素的化合价
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
一至五价都有氮
铜汞二价最常见
学习目标:
1.了解氧化还原反应的概念。
2.知道氧化还原反应与四种基本反应类型的关系。
3.学会用化合价升降和电子转移的观点理解氧化还原反应。
4.了解氧化还原反应的本质是电子的转移。
〖交流·研讨〗
写出下列反应的化学方程
式,标出各元素的化合价
H2还原CuO:
Fe与CuSO4溶液反应:
H2+CuO
===
Cu+H2
O
△
Fe+CuSO4
==
Cu+FeSO4
0
+2
-2
0
+1
-2
0
+2
+6
-2
0
+2
+6
-2
1.3第一课时
氧化还原反应
(2)标出这两个反应中各物质所含元素化合价,比较反应前后价态有没有变化。
2CuO
+
C
=
2Cu
+
CO2
高温
Fe2O3
+
3
CO
=
2Fe
+
3
CO2
高温
0
0
+4
+2
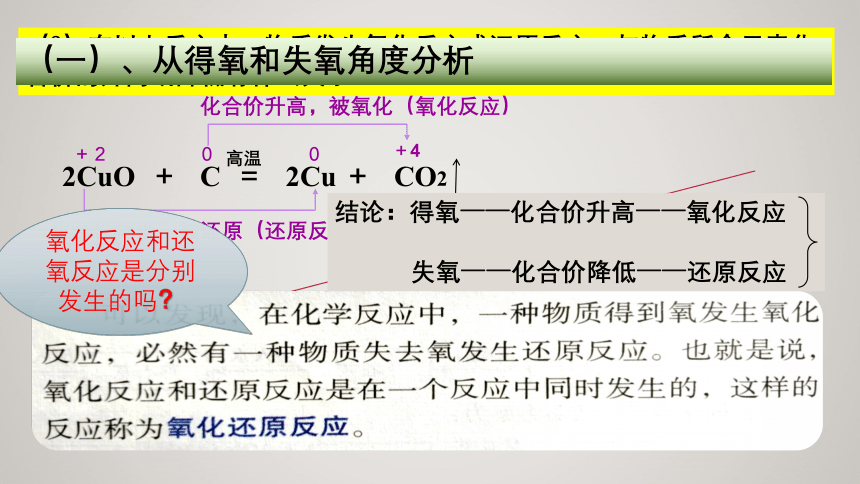
化合价降低,被还原(还原反应)
+4
+2
+3
0
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
(3)在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
氧化反应和还氧反应是分别发生的吗?
化合价升高,被氧化(氧化反应)
结论:得氧——化合价升高——氧化反应
失氧——化合价降低——还原反应
(一)、从得氧和失氧角度分析
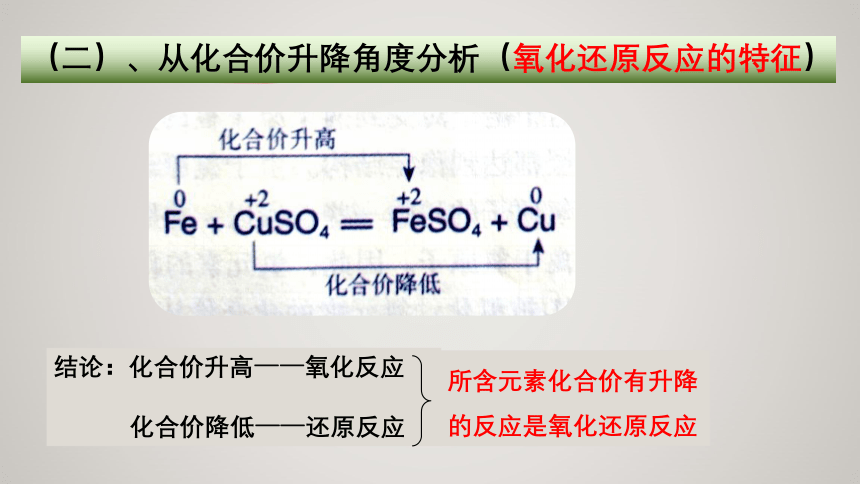
所含元素化合价有升降的反应是氧化还原反应
结论:化合价升高——氧化反应
化合价降低——还原反应
只有得氧(或失氧)的反应才是氧化还原反应吗?
(二)、从化合价升降角度分析(氧化还原反应的特征)
[问题]下列反应是否属于氧化还原反应?
可见,从化合价升降角度不但可以分析有
得氧失氧的化学反应,也可以分析没有得氧失
氧的化学反应,扩大了概念的适用范围。
因为有化合价升降,所以是氧化还原反应。
2Na+Cl2
=
2NaCl
2H2+Cl2
=
2HCl
点燃
点燃
反应前后有元素化合价发生变化,是氧化还原反应的重要特征。
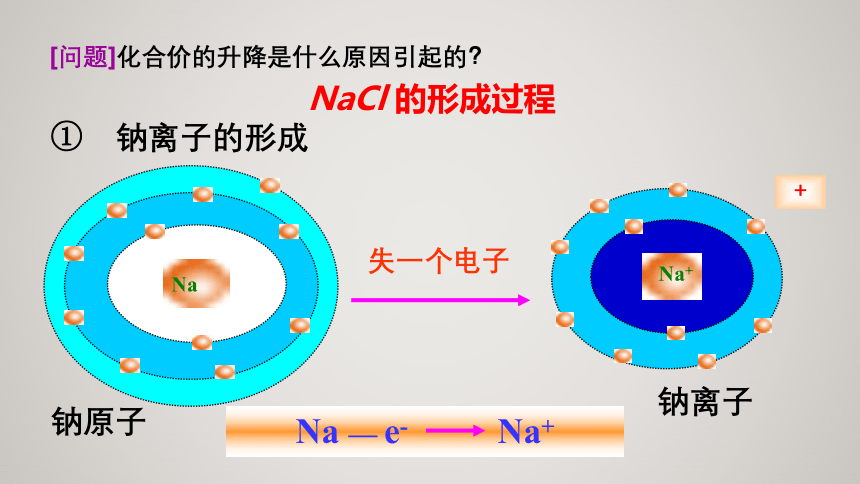
失一个电子
钠原子
钠离子
Na
—
e-
Na+
+
Na
Na+
①
钠离子的形成
[问题]化合价的升降是什么原因引起的?
NaCl
的形成过程
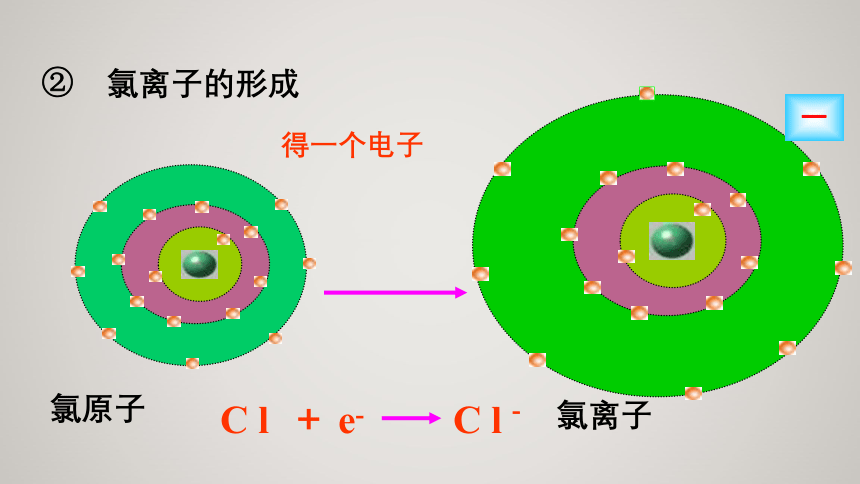
②
氯离子的形成
得一个电子
C
l
+
e-
C
l
-
氯原子
氯离子
-
[问题]化合价的升降是什么原因引起的?
2Na+Cl2
==
2Na
Cl
0
0
+1
-1
失去2Xe-,化合价升高,被氧化
得到2Xe-,化合价降低,被还原
NaCl
的形成过程
化合价升降的原因:电子的得失
(三)、从电子得失角度分析(氧化还原反应的本质)
H2
+
Cl2
=
2
H
Cl
0
0
+1-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
HCl
的形成过程
H2与Cl2的反应跟Na和Cl2的反应不同。
化合价升降的原因:共用电子的偏移
氢原子最外电子层1个电子
氯原子最外电子层7个电子
共用电子对
氧化还原反应的概念
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。
[小结]
氧化还原反应
从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化还原反应的判断依据)
从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
氧化还原反应的实质:
元素化合价变化
电子的转移
Na元素
化合价升高
失电子
氧化反应
Cl元素
化合价降低
得电子
还原反应
外观表现
判断依据
本质
电子的转移
燃料燃烧
铁生锈
Click
to
add
Text
广泛存在的氧化还原反应
铁生锈
高炉炼铁
光合作用
1、Cu+Cl2
===
CuCl2
△
2、CaO
+
H2O
===
Ca(OH)
2
5、Fe+CuSO4
==
Cu+FeSO4
〖练习〗判断下列反应属于那种基本反应类型?
哪些是氧化还原反应?[]
3、CaCO3===CaO+CO2
↑
高温
4、2KClO3===2KCl+3O2
↑
△
6、NaOH+HCl==NaCl+H2O
√
化合
分解
置换
复分解
×
×
√
√
×
氧化还原反应与四种基本反应类型的关系
[小结]
置换反应全部是氧化还原反应;
复分解反应全部是非氧化还原反应;
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
非氧化还原反应
图
1-14
化合反应
分解反应
复分解反应
置换反应
化
学
反
应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关系
化学反应
氧化还原反应与四种
基本反应类型的关系
〖小结〗
非氧化还原反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
氧化还原反应与四种基本反应类型的关系
1.下列有关氧化还原反应的叙述正确的是(
)
A.元素化合价升高的反应是还原反应
B.物质在反应中失去电子,此物质中的某一元素化合价降低
C
.有电子转移的反应是氧化还原反应
D.有化合价升降的反应不一定是氧化还原反应
[课堂练习]
C
2.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
2KNO3+
S
+3C
K2S
+
N2↑+
3CO2↑。该反应中被氧化的元素是(
)
A.C B.N
C.N和S
D.N和C
点燃
A
[课堂练习]
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”的电子总数
注意:失电子数=得电子数
Mg
+
Cl2
=
MgCl2
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
失去2e-
得到2
X
e-
“双线桥”法
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
3.下列电子转移的表示方法中正确的是
(
)
被氧化
被还原
D
[课堂练习]
4.饮用水中的NO3-会对人类健康产生危害,为了降低饮用水中NO3-
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为
10Al
+
6NaNO3+
4NaOH
==
10NaAlO2+
3N2↑+
2H2O。请回答下列问题:(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。(2)用双线桥法表示反应中电子转移的方向和数目。
解析:在上述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
Al(或铝)
失去
N(或氮)
还原
over
常见元素的化合价
一价钾钠氯氢银
二价氧钙钡镁锌
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
一至五价都有氮
铜汞二价最常见
学习目标:
1.了解氧化还原反应的概念。
2.知道氧化还原反应与四种基本反应类型的关系。
3.学会用化合价升降和电子转移的观点理解氧化还原反应。
4.了解氧化还原反应的本质是电子的转移。
〖交流·研讨〗
写出下列反应的化学方程
式,标出各元素的化合价
H2还原CuO:
Fe与CuSO4溶液反应:
H2+CuO
===
Cu+H2
O
△
Fe+CuSO4
==
Cu+FeSO4
0
+2
-2
0
+1
-2
0
+2
+6
-2
0
+2
+6
-2
1.3第一课时
氧化还原反应
(2)标出这两个反应中各物质所含元素化合价,比较反应前后价态有没有变化。
2CuO
+
C
=
2Cu
+
CO2
高温
Fe2O3
+
3
CO
=
2Fe
+
3
CO2
高温
0
0
+4
+2
化合价降低,被还原(还原反应)
+4
+2
+3
0
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
(3)在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
氧化反应和还氧反应是分别发生的吗?
化合价升高,被氧化(氧化反应)
结论:得氧——化合价升高——氧化反应
失氧——化合价降低——还原反应
(一)、从得氧和失氧角度分析
所含元素化合价有升降的反应是氧化还原反应
结论:化合价升高——氧化反应
化合价降低——还原反应
只有得氧(或失氧)的反应才是氧化还原反应吗?
(二)、从化合价升降角度分析(氧化还原反应的特征)
[问题]下列反应是否属于氧化还原反应?
可见,从化合价升降角度不但可以分析有
得氧失氧的化学反应,也可以分析没有得氧失
氧的化学反应,扩大了概念的适用范围。
因为有化合价升降,所以是氧化还原反应。
2Na+Cl2
=
2NaCl
2H2+Cl2
=
2HCl
点燃
点燃
反应前后有元素化合价发生变化,是氧化还原反应的重要特征。
失一个电子
钠原子
钠离子
Na
—
e-
Na+
+
Na
Na+
①
钠离子的形成
[问题]化合价的升降是什么原因引起的?
NaCl
的形成过程
②
氯离子的形成
得一个电子
C
l
+
e-
C
l
-
氯原子
氯离子
-
[问题]化合价的升降是什么原因引起的?
2Na+Cl2
==
2Na
Cl
0
0
+1
-1
失去2Xe-,化合价升高,被氧化
得到2Xe-,化合价降低,被还原
NaCl
的形成过程
化合价升降的原因:电子的得失
(三)、从电子得失角度分析(氧化还原反应的本质)
H2
+
Cl2
=
2
H
Cl
0
0
+1-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
HCl
的形成过程
H2与Cl2的反应跟Na和Cl2的反应不同。
化合价升降的原因:共用电子的偏移
氢原子最外电子层1个电子
氯原子最外电子层7个电子
共用电子对
氧化还原反应的概念
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。
[小结]
氧化还原反应
从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化还原反应的判断依据)
从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
氧化还原反应的实质:
元素化合价变化
电子的转移
Na元素
化合价升高
失电子
氧化反应
Cl元素
化合价降低
得电子
还原反应
外观表现
判断依据
本质
电子的转移
燃料燃烧
铁生锈
Click
to
add
Text
广泛存在的氧化还原反应
铁生锈
高炉炼铁
光合作用
1、Cu+Cl2
===
CuCl2
△
2、CaO
+
H2O
===
Ca(OH)
2
5、Fe+CuSO4
==
Cu+FeSO4
〖练习〗判断下列反应属于那种基本反应类型?
哪些是氧化还原反应?[]
3、CaCO3===CaO+CO2
↑
高温
4、2KClO3===2KCl+3O2
↑
△
6、NaOH+HCl==NaCl+H2O
√
化合
分解
置换
复分解
×
×
√
√
×
氧化还原反应与四种基本反应类型的关系
[小结]
置换反应全部是氧化还原反应;
复分解反应全部是非氧化还原反应;
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
非氧化还原反应
图
1-14
化合反应
分解反应
复分解反应
置换反应
化
学
反
应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本反应类型的关系
化学反应
氧化还原反应与四种
基本反应类型的关系
〖小结〗
非氧化还原反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
氧化还原反应与四种基本反应类型的关系
1.下列有关氧化还原反应的叙述正确的是(
)
A.元素化合价升高的反应是还原反应
B.物质在反应中失去电子,此物质中的某一元素化合价降低
C
.有电子转移的反应是氧化还原反应
D.有化合价升降的反应不一定是氧化还原反应
[课堂练习]
C
2.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
2KNO3+
S
+3C
K2S
+
N2↑+
3CO2↑。该反应中被氧化的元素是(
)
A.C B.N
C.N和S
D.N和C
点燃
A
[课堂练习]
1.标出变价元素的化合价
2.用双箭号表示,箭头从反应物指向生成物的同一种元素。
3.标出“失去”、“得到”的电子总数
注意:失电子数=得电子数
Mg
+
Cl2
=
MgCl2
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
失去2e-
得到2
X
e-
“双线桥”法
Mg
+
Cl2
=
MgCl2
0
0
+2
-1
3.下列电子转移的表示方法中正确的是
(
)
被氧化
被还原
D
[课堂练习]
4.饮用水中的NO3-会对人类健康产生危害,为了降低饮用水中NO3-
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为
10Al
+
6NaNO3+
4NaOH
==
10NaAlO2+
3N2↑+
2H2O。请回答下列问题:(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。(2)用双线桥法表示反应中电子转移的方向和数目。
解析:在上述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
Al(或铝)
失去
N(或氮)
还原
over
