浙江省2012年科学中考分册汇编:八下
图片预览

文档简介
浙江省科学2012年中考八(下)汇编
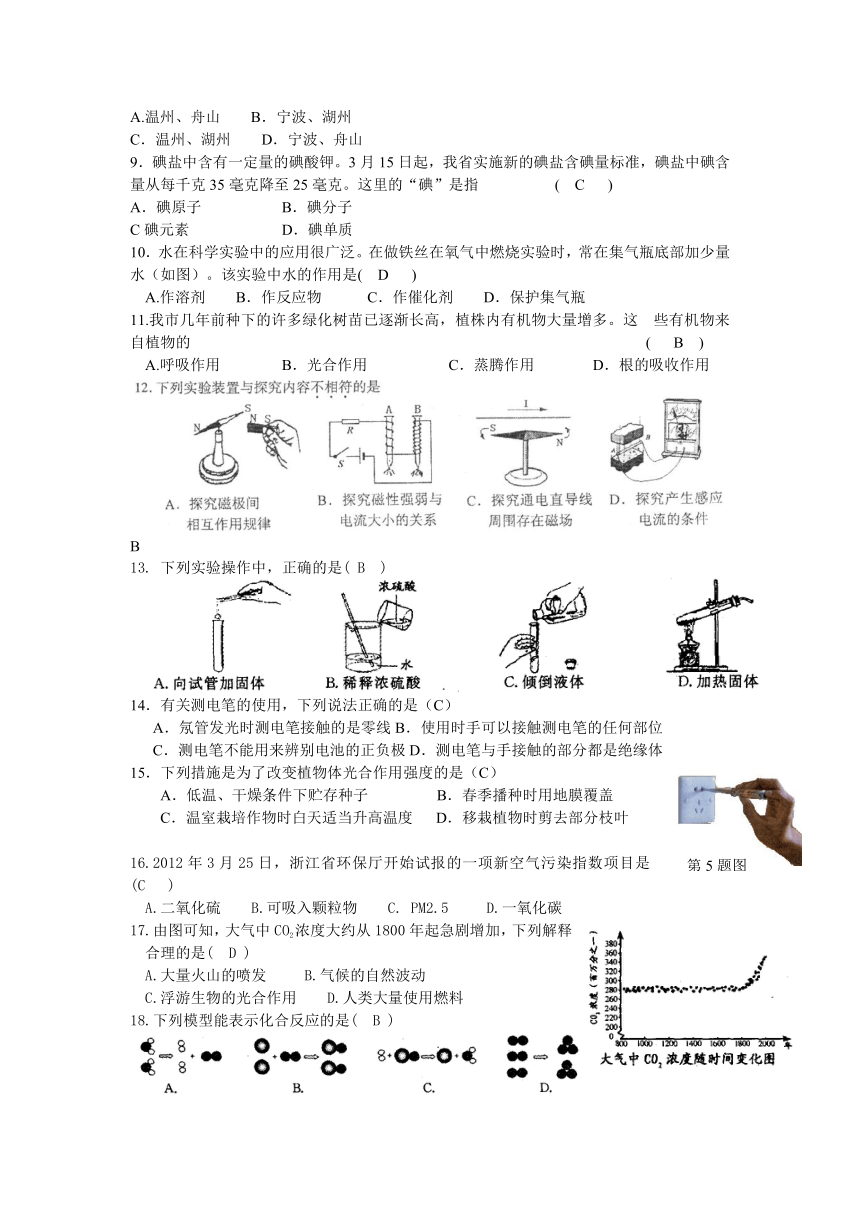
1.杭州市的自来水由于增设了加臭氧(O3)和加活性炭两道处理程序,水质处于全国大城市优秀水平。根据以上报道,人们得出的下列结论中,符合科学道理的是
A杭州市的自来水属于纯净物
B.杭州市自来水的物理、化学性质就是水的物理、化学性质
C.加臭氧和加活性炭都是利用它们的化学性质来净化水质
D.以上水处理过程中,水分子的化学性质不变
2.在肥沃的土壤中,种子萌发初期(如右图所示)所需要的有机物
A来自空气
B.来自土壤
C.来自种子
D.部分来自种子,部分来自土壤
3.下列有关氧气的叙述正确的是
A.氧气能和大多数金属、有机物反应,所以氧气是一种很不稳定的气体
B.铁在氧气中燃烧生成氧化铁
C.给氯酸钾加热,若不加二氧化锰就不产生氧气
D.课本上测定空气中氧气含量的实验中,若将红磷换成木炭实验会失败
4.对湖泊出现的“水华”现象,下列叙述不正确的是
A.生活污水不经处理排入湖泊,容易引发藻类过度繁殖
B.湖水温度升高是引起藻类大量繁殖的主要因素
C.藻类植物过度繁殖,会破坏湖泊原有生态系统
D.藻类植物过度繁殖可导致鱼虾死亡
5.根据实验目的和实验原理选择恰当的实验材料,是保证实验获得可靠结果的关键因素之一。下列实验材料的选用不恰当的是
A.用仙人掌来研究植物叶的蒸腾作用
B.用燕麦胚芽来研究植物的向光性
C.用菜豆种子来观察双子叶植物种子的结构
D.用银边天竺葵来研究植物光合作用是否需要叶绿体
6.小张用足量的盐酸、石灰石反应,并尝试直接利用右图所示装置制取和收集一瓶CO2。你认为小张
A.不可能收集到一瓶CO2,因为CO2可溶于水
B.选择B、C两种装置,导管b接导管d可收集到一瓶CO2
C.选择B、C两种装置,导管c接导管d可收集到一瓶CO2
D.选择A、B两种装置,导管a接导管c可收集到一瓶CO2
7.如右图所示是小李探究电磁铁磁性强弱与什么因素有关的实验装置。下列措施中能使电磁铁磁性增强的是
A.滑片P向右移动,其他条件不变
B.滑片P向左移动,其他条件不变
C.开关S由1扳到2,其他条件不变
D.电源的正负极对调,其他条件不变
24小时PM2.5平均浓度(微克/米3) 33 49 30 40
8.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康影响较大。我国的《环境空气质量标准>规定,PM2.5的一级标准为24小时平均浓度不超过35微克/米3,二级标准为不超过75微克/米3。3月25日,温州等城市的检测结果如下表,则表中城市当日PM2.5达到一级标准的是( A )
A.温州、舟山 B.宁波、湖州
C.温州、湖州 D.宁波、舟山
9.碘盐中含有一定量的碘酸钾。3月15日起,我省实施新的碘盐含碘量标准,碘盐中碘含量从每千克35毫克降至25毫克。这里的“碘”是指 ( C )
A.碘原子 B.碘分子
C碘元素 D.碘单质
10.水在科学实验中的应用很广泛。在做铁丝在氧气中燃烧实验时,常在集气瓶底部加少量水(如图)。该实验中水的作用是( D )
A.作溶剂 B.作反应物 C.作催化剂 D.保护集气瓶
11.我市几年前种下的许多绿化树苗已逐渐长高,植株内有机物大量增多。这 些有机物来自植物的 ( B )
A.呼吸作用 B.光合作用 C.蒸腾作用 D.根的吸收作用
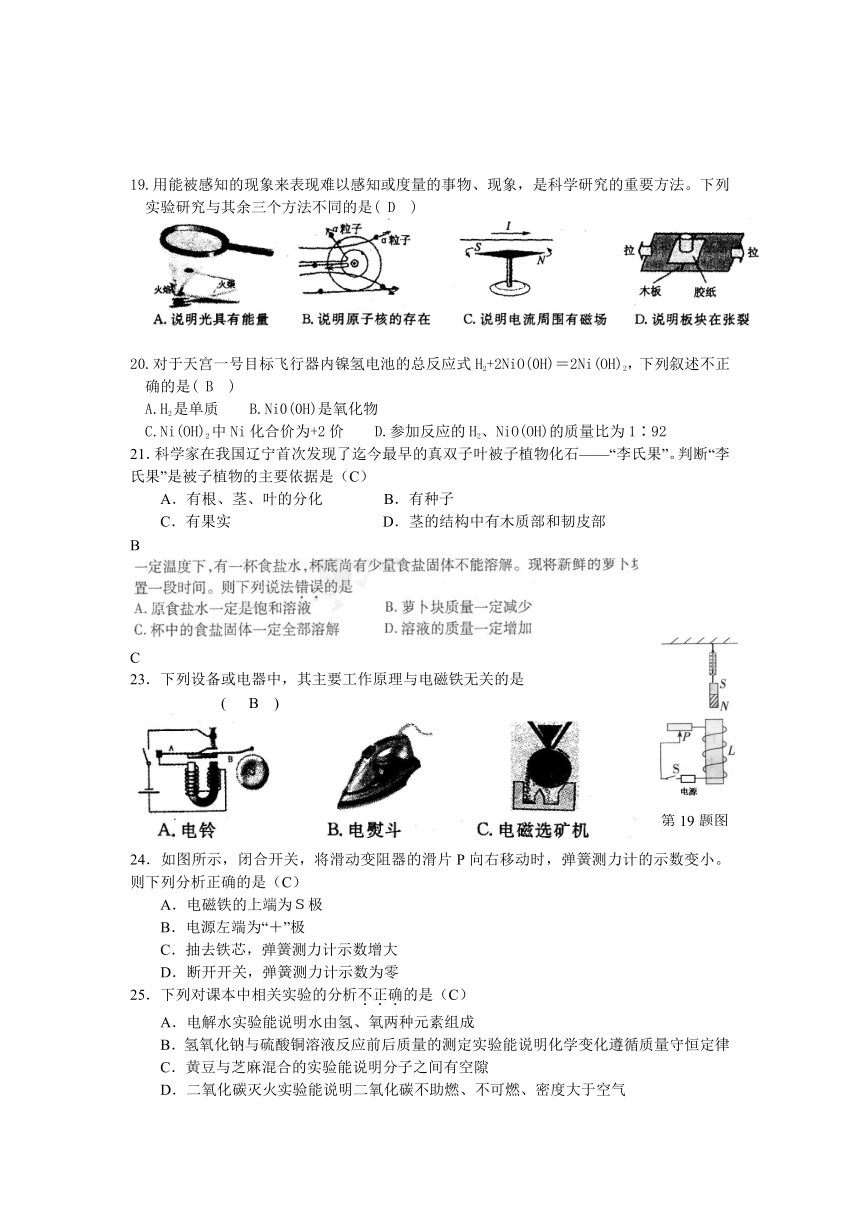
B
13. 下列实验操作中,正确的是( B )
14.有关测电笔的使用,下列说法正确的是(C)
A.氖管发光时测电笔接触的是零线B.使用时手可以接触测电笔的任何部位
C.测电笔不能用来辨别电池的正负极D.测电笔与手接触的部分都是绝缘体
15.下列措施是为了改变植物体光合作用强度的是(C)
A.低温、干燥条件下贮存种子 B.春季播种时用地膜覆盖
C.温室栽培作物时白天适当升高温度 D.移栽植物时剪去部分枝叶
16.2012年3月25日,浙江省环保厅开始试报的一项新空气污染指数项目是(C )
A.二氧化硫 B.可吸入颗粒物 C. PM2.5 D.一氧化碳
17.由图可知,大气中CO2浓度大约从1800年起急剧增加,下列解释合理的是( D )
A.大量火山的喷发 B.气候的自然波动
C.浮游生物的光合作用 D.人类大量使用燃料
18.下列模型能表示化合反应的是( B )
19.用能被感知的现象来表现难以感知或度量的事物、现象,是科学研究的重要方法。下列实验研究与其余三个方法不同的是( D )
20.对于天宫一号目标飞行器内镍氢电池的总反应式H2+2NiO(0H)=2Ni(OH)2,下列叙述不正确的是( B )
A.H2是单质 B.Ni0(0H)是氧化物
C.Ni(OH)2中Ni化合价为+2价 D.参加反应的H2、NiO(OH)的质量比为1∶92
21.科学家在我国辽宁首次发现了迄今最早的真双子叶被子植物化石——“李氏果”。判断“李氏果”是被子植物的主要依据是(C)
A.有根、茎、叶的分化 B.有种子
C.有果实 D.茎的结构中有木质部和韧皮部
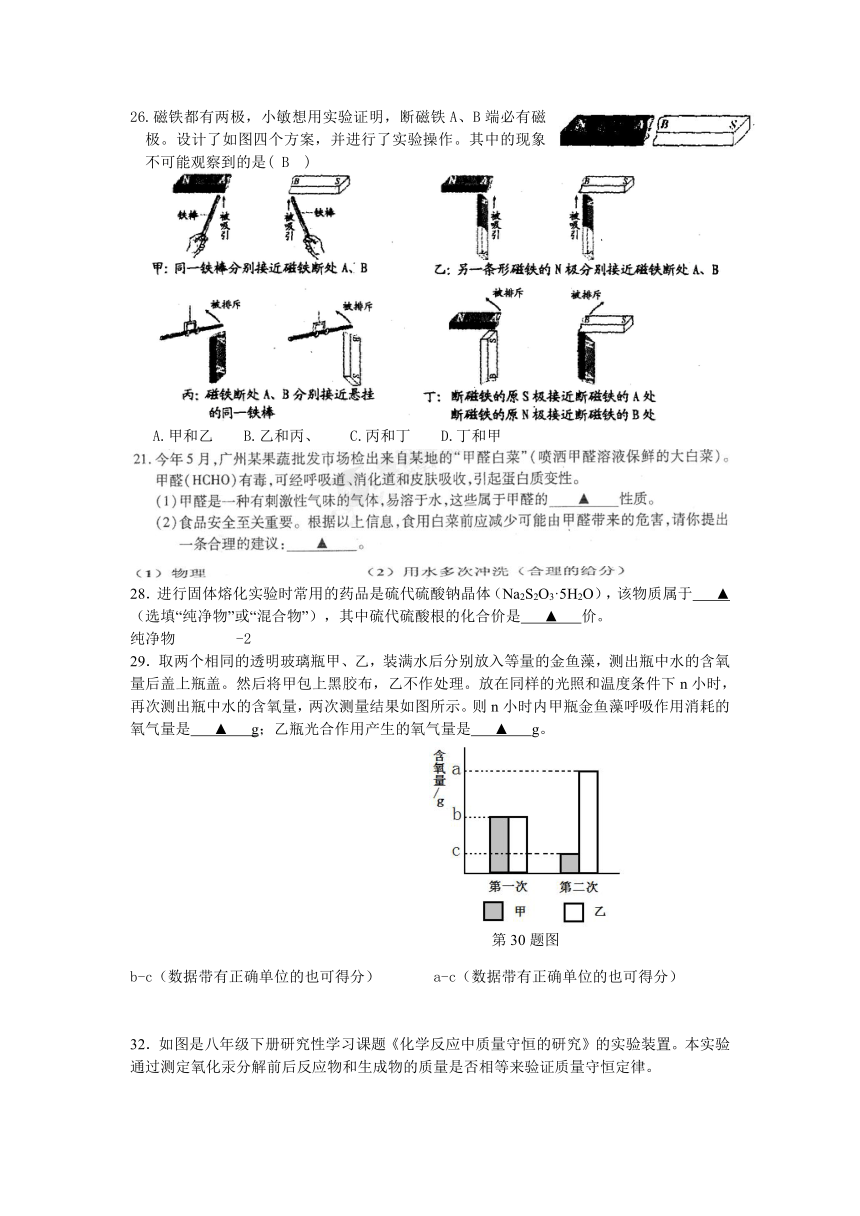
B
C
23.下列设备或电器中,其主要工作原理与电磁铁无关的是 ( B )
24.如图所示,闭合开关,将滑动变阻器的滑片P向右移动时,弹簧测力计的示数变小。则下列分析正确的是(C)
A.电磁铁的上端为S极
B.电源左端为“+”极
C.抽去铁芯,弹簧测力计示数增大
D.断开开关,弹簧测力计示数为零
25.下列对课本中相关实验的分析不正确的是(C)
A.电解水实验能说明水由氢、氧两种元素组成
B.氢氧化钠与硫酸铜溶液反应前后质量的测定实验能说明化学变化遵循质量守恒定律
C.黄豆与芝麻混合的实验能说明分子之间有空隙
D.二氧化碳灭火实验能说明二氧化碳不助燃、不可燃、密度大于空气
26.磁铁都有两极,小敏想用实验证明,断磁铁A、B端必有磁极。设计了如图四个方案,并进行了实验操作。其中的现象不可能观察到的是( B )
A.甲和乙 B.乙和丙、 C.丙和丁 D.丁和甲
28.进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于 ▲ (选填“纯净物”或“混合物”),其中硫代硫酸根的化合价是 ▲ 价。
纯净物 -2
29.取两个相同的透明玻璃瓶甲、乙,装满水后分别放入等量的金鱼藻,测出瓶中水的含氧量后盖上瓶盖。然后将甲包上黑胶布,乙不作处理。放在同样的光照和温度条件下n小时,再次测出瓶中水的含氧量,两次测量结果如图所示。则n小时内甲瓶金鱼藻呼吸作用消耗的氧气量是 ▲ g;乙瓶光合作用产生的氧气量是 ▲ g。
b-c(数据带有正确单位的也可得分) a-c(数据带有正确单位的也可得分)
32.如图是八年级下册研究性学习课题《化学反应中质量守恒的研究》的实验装置。本实验通过测定氧化汞分解前后反应物和生成物的质量是否相等来验证质量守恒定律。
已知:氧化汞分解的反应方程式:2HgO === 2Hg+O2↑
请回答下列问题:
(1)在组装实验装置时,欲调整试管的倾斜度,应调节
图中 A、B、C哪个旋钮? ▲
(2)下列有关本实验的描述正确的有哪些 ▲
A.在量筒中加入一些煤油,可以减少氧气在水中的溶解
B.塑料管口放出连续均匀的气泡后才能收集气体
C.氧化汞未分解完全就停止加热对实验结果没有影响
(1)B (2)AC(漏选得1分,错选、多选、不选均不得分)
33.中国是礼仪之邦,接待客人时常常会泡上一杯热茶。某同学用热水泡茶时发现茶叶很快就会沉入水底,他想如果用冷水来泡茶情况又是怎样的呢?为此他做了用不同温度的水泡茶的实验,并测出了茶叶从加水到下沉所需的时间,结果如下表所示。
温度(℃) 20 40 60 80 100
时间(分) 220 130 25 10 4
【现象分析】茶叶吸水膨胀,它的重力增大,浮力 ▲ ,由于重力大于浮力,所以下沉。
【原因解释】由上表可知,温度越高,茶叶从加水到下沉的时间越短,请从微观角度解释其可能的原因: ▲ 。
【实际应用】夏季到了,又是电蚊香大显身手的时候。使用时,接上电源,使蚊香片温度升
高,香味很快散发到空气中。请你再举出一个上述原理在生活中应用的例子: ▲ 。
增大 温度越高,分子运动越快 把衣服晒在阳光下容易干(合理即可得分)
34.现实生活中,氨气多用作致冷剂及农用化肥,其实它还是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气。最近,科学家用一种含钼的化合物作催化剂,在常温下就能完成氨的合成,从而大大降低了生产成本,使得液氨有望取代液氢成为新一代绿色能源。
(1)N2+3H2=====2NH3 该反应属于基本反应类型中的 ▲ 反应。
(2)请你根据下表信息分析用NH3取代H2的优点:
性质名称 颜色、气味 熔点(℃) 沸点(℃) 25℃水中溶解度(g/L) 标况下密度 (g/L)
NH3 无色、刺激性 -77.7 -33 456 0.6942
H2 无色、无味 -259.2 -253 0.0015 0.0899
①由于NH3比H2沸点高,所以更易 ▲ ,便于储存和运输。
② NH3泄漏时易发现是因为 ▲ ,同时它易溶于水,便于处理。
(1)化合 (2)①液化 ②氨气有刺激性气味
35.(4分)有水(H2O)、双氧水(H2O2)、重水(D2O,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有
2 种,从化学性质的角度看, 双氧水 与水的化学性质有较大的差异。
36(6分)我们可以利用如图一所示装置来比较植物光合作用强度和呼吸作用强度。已知其他条件适宜,据图回答下列问题:
( 1)当甲处气体的CO2浓度低于乙处时,植物光合作用强度 大于 呼吸作用。(选填“大于”、“小于”或“等于”)。
(2)黑暗时,甲处测到的CO2主要来自 植物的呼吸作用 、 空气中原有的二氧化碳 等。
(3)装置内,光由暗逐步调亮,测得甲处CO2量下降;光照强度与甲处CO2量的关系如图二,说明在ab段范围内随着光照强度的增强植物光合作用的强度 增强 。
(4)1771年英国科学家普里斯特利通过如图三实验证实植物能更新污浊的空气,可有人于黑暗环境中重复他的实验却得出相反的结论:植物和动物“都会使空气变污浊”。据他们的实验和学过的知识,你得出的结论是 植物只有在光照条件下才能进行光合作用,植物光合作用的同时也进行呼吸作用
37. 2012年4月22日,环保低价的甲醇汽油在我市开始销售。甲醇汽油是在普通汽油中加入一定比例的甲醇和石油添加剂而制成的。
(1)根据物质的组成进行分类,甲醇(CH4O)属于纯净物中的 ▲ 。
(2)工业制取甲醇的方法之一:利用二氧化碳与氢气在一定条件下反应制取甲醇,同时生成 另一种常见物质。请完成该反应的化学方程式:CO2+3H2CH4O+ ▲ 。
(1)化合物(或有机物) (2) H2O
38.铬是人体必需的微量元素之一,最近由于毒胶囊事件,引发人们对铬的关注。
(1)金属铬呈银白色,难溶于水,在空气中不易被氧化、耐腐蚀,在金属防锈上应用广泛。根据上述信息,写出金属铬的一种物理性质: ▲ 。
(2)含铬物质的毒性与铬元素(Cr)的化合价有关。已知CrCl3中氯元素的化合价为-1,则CrCl3中铬元素的化合价为 ▲ 。
(3)如图表示人体生理机能与必需元素含量的关系。若长期摄入铬超标的食品和饮用水,会导致人体生理机能从最佳区向 ▲ 区移动,从而影响健康。
(1)银白色(或难溶于水) (2)+3 (3)毒性(或致死)
39.近年来,许多地区的冬季出现了极端严寒天气,给当地人们生活带来一定危害。
(1)极寒天气容易引发冻雨,其过程是液态的降水与温度低于O℃的物体(如电线、树枝)接触形成冰层,这一物态变化称为 ▲ 。
(2)极寒天气造成路面结冰,使汽车车轮与路面间的 ▲ 变小,导致刹车变得困难而易引发交通事故。
(3)极寒天气加剧了部分地区煤、石油等能源的消耗,会在一定程度上导致空气中的 ▲ 增加,从而易引发酸雨。
(1)凝固 (2)摩擦力(或摩擦) (3)二氧化硫(或氮氧化物)
40.科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验。
(一)选择装置并检查气密性。
(二)称取0.1克的二氧化锰粉末加入容器中。
(三)量取50毫升溶质质量分数约1%的过氧化氢溶液加入容器中,记录一定时间内收集到的气体体积。
(四)改变二氧化锰的质量,重复上述实验,记录数据如下。
时间/秒 生成氧气的体积/毫升
0.1克MnO2 0.2克MnO2 0.3克MnO2 0.4克MnO2
40 49 61 75 86
80 77 87 90 92
120 89 92 92 92
160 92 92 92 92
(1)本实验探究的问题是 ▲ 。
(2)实验中除了量筒外,还需要用到的测量仪器有 ▲ 。
(3)为完成本实验,应选择下图气体发生和收集装置中的组合是 ▲ 。(选填序号)
.(1)二氧化锰的质量对过氧化氢分解快慢的影响(其它合理答案也给分)
(2)天平、停表(或秒表)
(3)②⑤
41.根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
空气 NH3 CH4 HCl O2
密度/g·L-1 1.293 0.77l 0.717 1.629 1.43
溶解性 —— 极易溶 难溶 极易溶 难溶
(1)既能用排水法,又能用向上排空气法收集的气体是________。
(2)用如图所示盛满水的集气瓶收集CH4,气体应从_____端进入。
(1)O2 (2)b
42.无土栽培是利用营养液栽培作物的一门技术,营养液中含有作物生长所需的无机盐。
(1)式①和式②分别表示绿色植物进行的不同生理活动。一般要求无土栽培温室棚内,晚上的温度低些。
目的是_______(选填“减弱”或“增强”)式②表示的生理活动。式①中的a是_______。
式①:二氧化碳+水有机物+氧气 式②:有机物+氧气二氧化碳+水+能量
(2)无土栽培的植物是通过__________(填器官名称)吸收无机盐的。
(3)选择两株生长状况相似,叶片数量不同的同种植株,分别放入烧杯中.烧杯装有油层密封的质量和浓度相同的同种营养液,将烧杯置于已调节平衡的天平上,如图甲所示,移动游码,使指针指在分度盘中央。同时将两烧杯置于同处阳光下照射一段时间。再放回原天平托盘上,天平的指针将会向____(选填“左”或“右”)偏转。
(4)若图乙温室中只有绿色植物,在不通入CO2的情况下。每天只在6∶00~18∶00接受日光照射。请在图丙的坐标上,用笔画出6∶00~24∶00该温室内C02浓度的大致变化曲线(0∶00~6∶00的曲线已经绘出)。
(1)减弱 叶绿体 (2)根 (3)右
(4)图像要求:①6∶00到18∶00为下降曲线,18∶00至24∶00为上升曲线
②18∶00和24∶00时均低于起始点
43.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? ▲ 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断
的理由: ▲ 。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
(1)容器内不再产生气泡(或电子天平的示数不再变化) (2分)
(2)2. 40克;查表可知,大理石碎屑完全反应生成的二氧化碳质量是2.40克,而块状大理石与其质量、成分都相同,所以完全反应生成的二氧化碳质量也是2. 40克(3分)
(3)解:18分钟时块状大理石生成CO2的质量为2.2克。 (1分)
设:此时块状大理石中发生反应的CaCO3质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2克
l00/x=44/2.2克(2分)
解得x=5克(1分)
答:块状大理石中有5克碳酸钙与稀盐酸发生了反应。
第5题图
第19题图
第30题图
第32题图
△
催化剂
1.杭州市的自来水由于增设了加臭氧(O3)和加活性炭两道处理程序,水质处于全国大城市优秀水平。根据以上报道,人们得出的下列结论中,符合科学道理的是
A杭州市的自来水属于纯净物
B.杭州市自来水的物理、化学性质就是水的物理、化学性质
C.加臭氧和加活性炭都是利用它们的化学性质来净化水质
D.以上水处理过程中,水分子的化学性质不变
2.在肥沃的土壤中,种子萌发初期(如右图所示)所需要的有机物
A来自空气
B.来自土壤
C.来自种子
D.部分来自种子,部分来自土壤
3.下列有关氧气的叙述正确的是
A.氧气能和大多数金属、有机物反应,所以氧气是一种很不稳定的气体
B.铁在氧气中燃烧生成氧化铁
C.给氯酸钾加热,若不加二氧化锰就不产生氧气
D.课本上测定空气中氧气含量的实验中,若将红磷换成木炭实验会失败
4.对湖泊出现的“水华”现象,下列叙述不正确的是
A.生活污水不经处理排入湖泊,容易引发藻类过度繁殖
B.湖水温度升高是引起藻类大量繁殖的主要因素
C.藻类植物过度繁殖,会破坏湖泊原有生态系统
D.藻类植物过度繁殖可导致鱼虾死亡
5.根据实验目的和实验原理选择恰当的实验材料,是保证实验获得可靠结果的关键因素之一。下列实验材料的选用不恰当的是
A.用仙人掌来研究植物叶的蒸腾作用
B.用燕麦胚芽来研究植物的向光性
C.用菜豆种子来观察双子叶植物种子的结构
D.用银边天竺葵来研究植物光合作用是否需要叶绿体
6.小张用足量的盐酸、石灰石反应,并尝试直接利用右图所示装置制取和收集一瓶CO2。你认为小张
A.不可能收集到一瓶CO2,因为CO2可溶于水
B.选择B、C两种装置,导管b接导管d可收集到一瓶CO2
C.选择B、C两种装置,导管c接导管d可收集到一瓶CO2
D.选择A、B两种装置,导管a接导管c可收集到一瓶CO2
7.如右图所示是小李探究电磁铁磁性强弱与什么因素有关的实验装置。下列措施中能使电磁铁磁性增强的是
A.滑片P向右移动,其他条件不变
B.滑片P向左移动,其他条件不变
C.开关S由1扳到2,其他条件不变
D.电源的正负极对调,其他条件不变
24小时PM2.5平均浓度(微克/米3) 33 49 30 40
8.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康影响较大。我国的《环境空气质量标准>规定,PM2.5的一级标准为24小时平均浓度不超过35微克/米3,二级标准为不超过75微克/米3。3月25日,温州等城市的检测结果如下表,则表中城市当日PM2.5达到一级标准的是( A )
A.温州、舟山 B.宁波、湖州
C.温州、湖州 D.宁波、舟山
9.碘盐中含有一定量的碘酸钾。3月15日起,我省实施新的碘盐含碘量标准,碘盐中碘含量从每千克35毫克降至25毫克。这里的“碘”是指 ( C )
A.碘原子 B.碘分子
C碘元素 D.碘单质
10.水在科学实验中的应用很广泛。在做铁丝在氧气中燃烧实验时,常在集气瓶底部加少量水(如图)。该实验中水的作用是( D )
A.作溶剂 B.作反应物 C.作催化剂 D.保护集气瓶
11.我市几年前种下的许多绿化树苗已逐渐长高,植株内有机物大量增多。这 些有机物来自植物的 ( B )
A.呼吸作用 B.光合作用 C.蒸腾作用 D.根的吸收作用
B
13. 下列实验操作中,正确的是( B )
14.有关测电笔的使用,下列说法正确的是(C)
A.氖管发光时测电笔接触的是零线B.使用时手可以接触测电笔的任何部位
C.测电笔不能用来辨别电池的正负极D.测电笔与手接触的部分都是绝缘体
15.下列措施是为了改变植物体光合作用强度的是(C)
A.低温、干燥条件下贮存种子 B.春季播种时用地膜覆盖
C.温室栽培作物时白天适当升高温度 D.移栽植物时剪去部分枝叶
16.2012年3月25日,浙江省环保厅开始试报的一项新空气污染指数项目是(C )
A.二氧化硫 B.可吸入颗粒物 C. PM2.5 D.一氧化碳
17.由图可知,大气中CO2浓度大约从1800年起急剧增加,下列解释合理的是( D )
A.大量火山的喷发 B.气候的自然波动
C.浮游生物的光合作用 D.人类大量使用燃料
18.下列模型能表示化合反应的是( B )
19.用能被感知的现象来表现难以感知或度量的事物、现象,是科学研究的重要方法。下列实验研究与其余三个方法不同的是( D )
20.对于天宫一号目标飞行器内镍氢电池的总反应式H2+2NiO(0H)=2Ni(OH)2,下列叙述不正确的是( B )
A.H2是单质 B.Ni0(0H)是氧化物
C.Ni(OH)2中Ni化合价为+2价 D.参加反应的H2、NiO(OH)的质量比为1∶92
21.科学家在我国辽宁首次发现了迄今最早的真双子叶被子植物化石——“李氏果”。判断“李氏果”是被子植物的主要依据是(C)
A.有根、茎、叶的分化 B.有种子
C.有果实 D.茎的结构中有木质部和韧皮部
B
C
23.下列设备或电器中,其主要工作原理与电磁铁无关的是 ( B )
24.如图所示,闭合开关,将滑动变阻器的滑片P向右移动时,弹簧测力计的示数变小。则下列分析正确的是(C)
A.电磁铁的上端为S极
B.电源左端为“+”极
C.抽去铁芯,弹簧测力计示数增大
D.断开开关,弹簧测力计示数为零
25.下列对课本中相关实验的分析不正确的是(C)
A.电解水实验能说明水由氢、氧两种元素组成
B.氢氧化钠与硫酸铜溶液反应前后质量的测定实验能说明化学变化遵循质量守恒定律
C.黄豆与芝麻混合的实验能说明分子之间有空隙
D.二氧化碳灭火实验能说明二氧化碳不助燃、不可燃、密度大于空气
26.磁铁都有两极,小敏想用实验证明,断磁铁A、B端必有磁极。设计了如图四个方案,并进行了实验操作。其中的现象不可能观察到的是( B )
A.甲和乙 B.乙和丙、 C.丙和丁 D.丁和甲
28.进行固体熔化实验时常用的药品是硫代硫酸钠晶体(Na2S2O3·5H2O),该物质属于 ▲ (选填“纯净物”或“混合物”),其中硫代硫酸根的化合价是 ▲ 价。
纯净物 -2
29.取两个相同的透明玻璃瓶甲、乙,装满水后分别放入等量的金鱼藻,测出瓶中水的含氧量后盖上瓶盖。然后将甲包上黑胶布,乙不作处理。放在同样的光照和温度条件下n小时,再次测出瓶中水的含氧量,两次测量结果如图所示。则n小时内甲瓶金鱼藻呼吸作用消耗的氧气量是 ▲ g;乙瓶光合作用产生的氧气量是 ▲ g。
b-c(数据带有正确单位的也可得分) a-c(数据带有正确单位的也可得分)
32.如图是八年级下册研究性学习课题《化学反应中质量守恒的研究》的实验装置。本实验通过测定氧化汞分解前后反应物和生成物的质量是否相等来验证质量守恒定律。
已知:氧化汞分解的反应方程式:2HgO === 2Hg+O2↑
请回答下列问题:
(1)在组装实验装置时,欲调整试管的倾斜度,应调节
图中 A、B、C哪个旋钮? ▲
(2)下列有关本实验的描述正确的有哪些 ▲
A.在量筒中加入一些煤油,可以减少氧气在水中的溶解
B.塑料管口放出连续均匀的气泡后才能收集气体
C.氧化汞未分解完全就停止加热对实验结果没有影响
(1)B (2)AC(漏选得1分,错选、多选、不选均不得分)
33.中国是礼仪之邦,接待客人时常常会泡上一杯热茶。某同学用热水泡茶时发现茶叶很快就会沉入水底,他想如果用冷水来泡茶情况又是怎样的呢?为此他做了用不同温度的水泡茶的实验,并测出了茶叶从加水到下沉所需的时间,结果如下表所示。
温度(℃) 20 40 60 80 100
时间(分) 220 130 25 10 4
【现象分析】茶叶吸水膨胀,它的重力增大,浮力 ▲ ,由于重力大于浮力,所以下沉。
【原因解释】由上表可知,温度越高,茶叶从加水到下沉的时间越短,请从微观角度解释其可能的原因: ▲ 。
【实际应用】夏季到了,又是电蚊香大显身手的时候。使用时,接上电源,使蚊香片温度升
高,香味很快散发到空气中。请你再举出一个上述原理在生活中应用的例子: ▲ 。
增大 温度越高,分子运动越快 把衣服晒在阳光下容易干(合理即可得分)
34.现实生活中,氨气多用作致冷剂及农用化肥,其实它还是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气。最近,科学家用一种含钼的化合物作催化剂,在常温下就能完成氨的合成,从而大大降低了生产成本,使得液氨有望取代液氢成为新一代绿色能源。
(1)N2+3H2=====2NH3 该反应属于基本反应类型中的 ▲ 反应。
(2)请你根据下表信息分析用NH3取代H2的优点:
性质名称 颜色、气味 熔点(℃) 沸点(℃) 25℃水中溶解度(g/L) 标况下密度 (g/L)
NH3 无色、刺激性 -77.7 -33 456 0.6942
H2 无色、无味 -259.2 -253 0.0015 0.0899
①由于NH3比H2沸点高,所以更易 ▲ ,便于储存和运输。
② NH3泄漏时易发现是因为 ▲ ,同时它易溶于水,便于处理。
(1)化合 (2)①液化 ②氨气有刺激性气味
35.(4分)有水(H2O)、双氧水(H2O2)、重水(D2O,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有
2 种,从化学性质的角度看, 双氧水 与水的化学性质有较大的差异。
36(6分)我们可以利用如图一所示装置来比较植物光合作用强度和呼吸作用强度。已知其他条件适宜,据图回答下列问题:
( 1)当甲处气体的CO2浓度低于乙处时,植物光合作用强度 大于 呼吸作用。(选填“大于”、“小于”或“等于”)。
(2)黑暗时,甲处测到的CO2主要来自 植物的呼吸作用 、 空气中原有的二氧化碳 等。
(3)装置内,光由暗逐步调亮,测得甲处CO2量下降;光照强度与甲处CO2量的关系如图二,说明在ab段范围内随着光照强度的增强植物光合作用的强度 增强 。
(4)1771年英国科学家普里斯特利通过如图三实验证实植物能更新污浊的空气,可有人于黑暗环境中重复他的实验却得出相反的结论:植物和动物“都会使空气变污浊”。据他们的实验和学过的知识,你得出的结论是 植物只有在光照条件下才能进行光合作用,植物光合作用的同时也进行呼吸作用
37. 2012年4月22日,环保低价的甲醇汽油在我市开始销售。甲醇汽油是在普通汽油中加入一定比例的甲醇和石油添加剂而制成的。
(1)根据物质的组成进行分类,甲醇(CH4O)属于纯净物中的 ▲ 。
(2)工业制取甲醇的方法之一:利用二氧化碳与氢气在一定条件下反应制取甲醇,同时生成 另一种常见物质。请完成该反应的化学方程式:CO2+3H2CH4O+ ▲ 。
(1)化合物(或有机物) (2) H2O
38.铬是人体必需的微量元素之一,最近由于毒胶囊事件,引发人们对铬的关注。
(1)金属铬呈银白色,难溶于水,在空气中不易被氧化、耐腐蚀,在金属防锈上应用广泛。根据上述信息,写出金属铬的一种物理性质: ▲ 。
(2)含铬物质的毒性与铬元素(Cr)的化合价有关。已知CrCl3中氯元素的化合价为-1,则CrCl3中铬元素的化合价为 ▲ 。
(3)如图表示人体生理机能与必需元素含量的关系。若长期摄入铬超标的食品和饮用水,会导致人体生理机能从最佳区向 ▲ 区移动,从而影响健康。
(1)银白色(或难溶于水) (2)+3 (3)毒性(或致死)
39.近年来,许多地区的冬季出现了极端严寒天气,给当地人们生活带来一定危害。
(1)极寒天气容易引发冻雨,其过程是液态的降水与温度低于O℃的物体(如电线、树枝)接触形成冰层,这一物态变化称为 ▲ 。
(2)极寒天气造成路面结冰,使汽车车轮与路面间的 ▲ 变小,导致刹车变得困难而易引发交通事故。
(3)极寒天气加剧了部分地区煤、石油等能源的消耗,会在一定程度上导致空气中的 ▲ 增加,从而易引发酸雨。
(1)凝固 (2)摩擦力(或摩擦) (3)二氧化硫(或氮氧化物)
40.科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验。
(一)选择装置并检查气密性。
(二)称取0.1克的二氧化锰粉末加入容器中。
(三)量取50毫升溶质质量分数约1%的过氧化氢溶液加入容器中,记录一定时间内收集到的气体体积。
(四)改变二氧化锰的质量,重复上述实验,记录数据如下。
时间/秒 生成氧气的体积/毫升
0.1克MnO2 0.2克MnO2 0.3克MnO2 0.4克MnO2
40 49 61 75 86
80 77 87 90 92
120 89 92 92 92
160 92 92 92 92
(1)本实验探究的问题是 ▲ 。
(2)实验中除了量筒外,还需要用到的测量仪器有 ▲ 。
(3)为完成本实验,应选择下图气体发生和收集装置中的组合是 ▲ 。(选填序号)
.(1)二氧化锰的质量对过氧化氢分解快慢的影响(其它合理答案也给分)
(2)天平、停表(或秒表)
(3)②⑤
41.根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
空气 NH3 CH4 HCl O2
密度/g·L-1 1.293 0.77l 0.717 1.629 1.43
溶解性 —— 极易溶 难溶 极易溶 难溶
(1)既能用排水法,又能用向上排空气法收集的气体是________。
(2)用如图所示盛满水的集气瓶收集CH4,气体应从_____端进入。
(1)O2 (2)b
42.无土栽培是利用营养液栽培作物的一门技术,营养液中含有作物生长所需的无机盐。
(1)式①和式②分别表示绿色植物进行的不同生理活动。一般要求无土栽培温室棚内,晚上的温度低些。
目的是_______(选填“减弱”或“增强”)式②表示的生理活动。式①中的a是_______。
式①:二氧化碳+水有机物+氧气 式②:有机物+氧气二氧化碳+水+能量
(2)无土栽培的植物是通过__________(填器官名称)吸收无机盐的。
(3)选择两株生长状况相似,叶片数量不同的同种植株,分别放入烧杯中.烧杯装有油层密封的质量和浓度相同的同种营养液,将烧杯置于已调节平衡的天平上,如图甲所示,移动游码,使指针指在分度盘中央。同时将两烧杯置于同处阳光下照射一段时间。再放回原天平托盘上,天平的指针将会向____(选填“左”或“右”)偏转。
(4)若图乙温室中只有绿色植物,在不通入CO2的情况下。每天只在6∶00~18∶00接受日光照射。请在图丙的坐标上,用笔画出6∶00~24∶00该温室内C02浓度的大致变化曲线(0∶00~6∶00的曲线已经绘出)。
(1)减弱 叶绿体 (2)根 (3)右
(4)图像要求:①6∶00到18∶00为下降曲线,18∶00至24∶00为上升曲线
②18∶00和24∶00时均低于起始点
43.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下表。(碳酸钙与稀盐酸反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
时间/分 0 2 4 6 8 10 12 14 16 18
大理石碎屑生成的CO2质量/克 0 1.45 1.75 1.98 2.18 2.30 2.36 2.40 2.40 2.40
块状大理石生成的CO2质量/克 0 0.45 0.80 1.10 1.36 1.60 1.81 1.98 2.11 2.20
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束? ▲ 。
(2)结合表格分析,块状大理石与稀盐酸反应最多能生成多少克二氧化碳?简要说明判断
的理由: ▲ 。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
(1)容器内不再产生气泡(或电子天平的示数不再变化) (2分)
(2)2. 40克;查表可知,大理石碎屑完全反应生成的二氧化碳质量是2.40克,而块状大理石与其质量、成分都相同,所以完全反应生成的二氧化碳质量也是2. 40克(3分)
(3)解:18分钟时块状大理石生成CO2的质量为2.2克。 (1分)
设:此时块状大理石中发生反应的CaCO3质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2克
l00/x=44/2.2克(2分)
解得x=5克(1分)
答:块状大理石中有5克碳酸钙与稀盐酸发生了反应。
第5题图
第19题图
第30题图
第32题图
△
催化剂
同课章节目录
