第二单元课题1空气第1课时课件(24张PPT)-2021-2022学年九年级化学人教版上册
文档属性
| 名称 | 第二单元课题1空气第1课时课件(24张PPT)-2021-2022学年九年级化学人教版上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-08 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第1课时
空气的组成
第二单元
我们周围的空气
课题1
空气
1.了解空气的主要成分。
2.探究空气中氧气的含量。
3.初步认识纯净物和混合物的概念。
4.初步学习科学实验的方法、观察、记忆并初步学会分析实验
现象。
学习目标
空气与我们朝夕相伴,离开了空气我们无法生存,你了解空气的组成吗?人类在探究空气的道路上经历了怎样的历程呢?
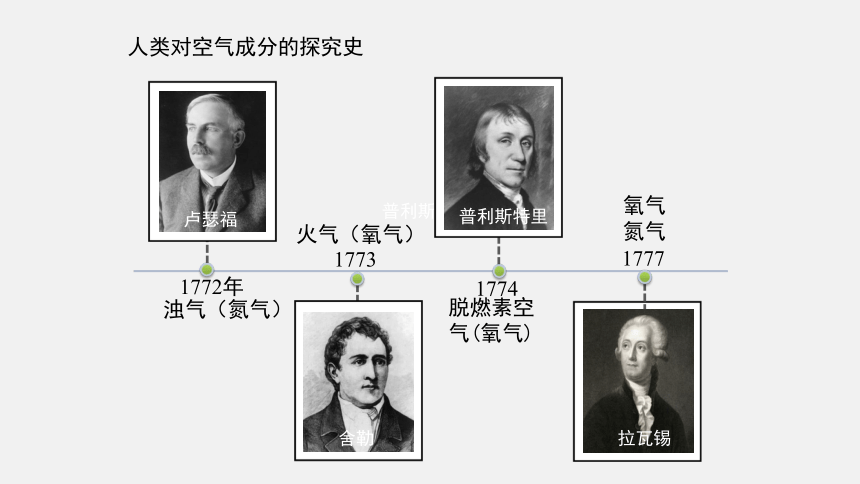
人类对空气成分的探究史
1772年
卢瑟福
浊气(氮气)
普利斯特里
脱燃素空气(氧气)
1773
舍勒
1774
普利斯特里
火气(氧气)
氧气
氮气
舍勒
1777
拉瓦锡
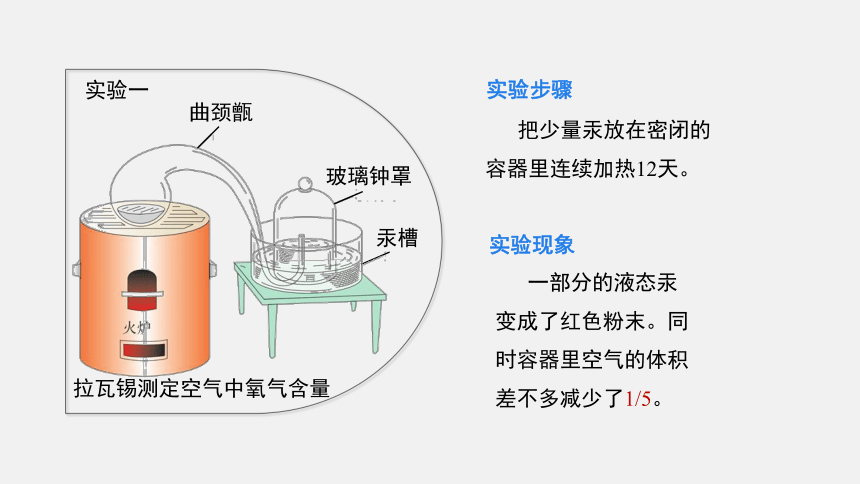
实验步骤
把少量汞放在密闭的容器里连续加热12天。
实验现象
一部分的液态汞变成了红色粉末。同时容器里空气的体积差不多减少了1/5。
实验一
曲颈甑
玻璃钟罩
汞槽
拉瓦锡测定空气中氧气含量
把汞表面上所生成的红色粉末收集后,放在一个小的容器里再加强热。
红色粉末又生成了银白色物质和能使带火星木条复燃的气体。
实验步骤
实验现象
实验二
实验结论
空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
拉瓦锡通过实验认识到空气由两种气体组成,一种是能助燃的、有助于呼吸的,并把它命名为“oxygen”(氧),另一种不助燃、无助于生命的气体,命名为“zote”(氮),意思是不能维持生命的窒息气体。
拉瓦锡测定空气中氧气含量的实验有什么优缺点?
思考讨论
优点:用严谨的科学态度进行反复的实验。
缺点:实验时间较长,操作装置比较复杂,且实验过程对环境有污染。
集气瓶
橡胶塞
燃烧匙
导气管
弹簧夹
导气管
烧杯
酒精灯
火柴
说一说下列仪器的名称
思考讨论
选用哪种药品测定空气中氧气含量?
红磷
木炭
镁
铁丝
红磷
木炭
镁条
铁丝
在空气中只与氧气反应生成五氧化二磷固体。
在空气中只与氧气,完全反应后生成气体。
能与空气中的氧气、氮气等气体发生反应。
不能在空气中燃烧
演示实验
测定空气里氧气的含量
合作探究
1.
瓶内装少量水,剩余体积分为5等份。
2.夹紧乳胶管,点燃红磷。
3.立即伸入瓶内,并塞紧塞子。
4.燃烧至冷却,打开弹簧夹。
小组分工操作,首先连接装置并检查装置气密性,然后实验,并观察、记录实验现象。
1.红磷燃烧,放热,产生大量的白烟。
2.集气瓶内水面上升,约占原有空气总体积的1/5。
现象
实验记录
磷+氧气
五氧化二磷
点燃
空气中氧气的体积约占空气的1/5。
结论
思考讨论
1.集气瓶内水面上升少于1/5的原因?
集气瓶内水面上升小于1/5
装置气密性不好
红磷量不足
瓶内温度没有降低到室温后就打开了弹簧夹。
思考讨论
2.集气瓶内水面上升大于1/5的原因?
集气瓶内水面上升大于1/5
插入燃烧匙太慢,塞紧瓶塞之前,瓶内空气受热逸出。
没夹紧弹簧夹,红磷燃烧时瓶内空气部分受热从导管逸出。
空气的成分(体积分数):
氮气:78%
氧气:21%
稀有气体:0.94%
二氧化碳:0.03%
其他气体和杂质:0.03%
氮气78%
氧气21%
其他成分1%
由两种或两种以上的物质混合而成的物质叫做混合物,混合物不能用化学符号表示。
只由一种物质组成的物质叫做纯净物,纯净物可以用化学符号表示。
例如:空气、可乐、自来水等物质都是混合物。
例如:氧气、二氧化碳、氮气等都是纯净物。
温馨提示:要根据物质的成分进行区分。
虽然普利斯特里也发现了氧,但是他坚信当时的“燃素说”,错误的认为这种气体不含燃素。燃素说是当时化学界一个先进的理论,统治化学领域近一个世纪,因为它似乎能解决一些问题。但是也有很多问题它无法解释,只有拉瓦锡抓住了这个关键点,通过实验推翻了“燃素说”。
燃素说
1.夏天从冰箱里拿出一瓶饮料,放在空气中,饮料外壁会潮湿,说明空气中含有(
)
A.氮气
B.氧气
C.水蒸气
D.二氧化碳
C
2.我们生活在物质的世界里,物质的种类繁多,下列属于纯净物的是( )
A.洁净的空气
B.干净的果汁
C.飘香的奶茶
D.冰水共存物
D
3.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是(
)
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
C
解析
空气中的氧气被燃烧完后,剩下的就是氮气,占空气体积的4/5,而进入集气瓶中水的体积约1/5,该实验可说明N?2?难溶于水。
空气的组成
空气的成分(体积分数)
物质的简单分类
空气中氧气含量的测定
原理
现象
结论
氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%
纯净物
混合物
只由一种物质组成
由多种物质组成
再见
第1课时
空气的组成
第二单元
我们周围的空气
课题1
空气
1.了解空气的主要成分。
2.探究空气中氧气的含量。
3.初步认识纯净物和混合物的概念。
4.初步学习科学实验的方法、观察、记忆并初步学会分析实验
现象。
学习目标
空气与我们朝夕相伴,离开了空气我们无法生存,你了解空气的组成吗?人类在探究空气的道路上经历了怎样的历程呢?
人类对空气成分的探究史
1772年
卢瑟福
浊气(氮气)
普利斯特里
脱燃素空气(氧气)
1773
舍勒
1774
普利斯特里
火气(氧气)
氧气
氮气
舍勒
1777
拉瓦锡
实验步骤
把少量汞放在密闭的容器里连续加热12天。
实验现象
一部分的液态汞变成了红色粉末。同时容器里空气的体积差不多减少了1/5。
实验一
曲颈甑
玻璃钟罩
汞槽
拉瓦锡测定空气中氧气含量
把汞表面上所生成的红色粉末收集后,放在一个小的容器里再加强热。
红色粉末又生成了银白色物质和能使带火星木条复燃的气体。
实验步骤
实验现象
实验二
实验结论
空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
拉瓦锡通过实验认识到空气由两种气体组成,一种是能助燃的、有助于呼吸的,并把它命名为“oxygen”(氧),另一种不助燃、无助于生命的气体,命名为“zote”(氮),意思是不能维持生命的窒息气体。
拉瓦锡测定空气中氧气含量的实验有什么优缺点?
思考讨论
优点:用严谨的科学态度进行反复的实验。
缺点:实验时间较长,操作装置比较复杂,且实验过程对环境有污染。
集气瓶
橡胶塞
燃烧匙
导气管
弹簧夹
导气管
烧杯
酒精灯
火柴
说一说下列仪器的名称
思考讨论
选用哪种药品测定空气中氧气含量?
红磷
木炭
镁
铁丝
红磷
木炭
镁条
铁丝
在空气中只与氧气反应生成五氧化二磷固体。
在空气中只与氧气,完全反应后生成气体。
能与空气中的氧气、氮气等气体发生反应。
不能在空气中燃烧
演示实验
测定空气里氧气的含量
合作探究
1.
瓶内装少量水,剩余体积分为5等份。
2.夹紧乳胶管,点燃红磷。
3.立即伸入瓶内,并塞紧塞子。
4.燃烧至冷却,打开弹簧夹。
小组分工操作,首先连接装置并检查装置气密性,然后实验,并观察、记录实验现象。
1.红磷燃烧,放热,产生大量的白烟。
2.集气瓶内水面上升,约占原有空气总体积的1/5。
现象
实验记录
磷+氧气
五氧化二磷
点燃
空气中氧气的体积约占空气的1/5。
结论
思考讨论
1.集气瓶内水面上升少于1/5的原因?
集气瓶内水面上升小于1/5
装置气密性不好
红磷量不足
瓶内温度没有降低到室温后就打开了弹簧夹。
思考讨论
2.集气瓶内水面上升大于1/5的原因?
集气瓶内水面上升大于1/5
插入燃烧匙太慢,塞紧瓶塞之前,瓶内空气受热逸出。
没夹紧弹簧夹,红磷燃烧时瓶内空气部分受热从导管逸出。
空气的成分(体积分数):
氮气:78%
氧气:21%
稀有气体:0.94%
二氧化碳:0.03%
其他气体和杂质:0.03%
氮气78%
氧气21%
其他成分1%
由两种或两种以上的物质混合而成的物质叫做混合物,混合物不能用化学符号表示。
只由一种物质组成的物质叫做纯净物,纯净物可以用化学符号表示。
例如:空气、可乐、自来水等物质都是混合物。
例如:氧气、二氧化碳、氮气等都是纯净物。
温馨提示:要根据物质的成分进行区分。
虽然普利斯特里也发现了氧,但是他坚信当时的“燃素说”,错误的认为这种气体不含燃素。燃素说是当时化学界一个先进的理论,统治化学领域近一个世纪,因为它似乎能解决一些问题。但是也有很多问题它无法解释,只有拉瓦锡抓住了这个关键点,通过实验推翻了“燃素说”。
燃素说
1.夏天从冰箱里拿出一瓶饮料,放在空气中,饮料外壁会潮湿,说明空气中含有(
)
A.氮气
B.氧气
C.水蒸气
D.二氧化碳
C
2.我们生活在物质的世界里,物质的种类繁多,下列属于纯净物的是( )
A.洁净的空气
B.干净的果汁
C.飘香的奶茶
D.冰水共存物
D
3.如图装置常用来测定空气中氧气的含量。下列对该实验的认识中正确的是(
)
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成细铁丝
C.该实验可说明N2难溶于水
D.红磷的量不足会导致进入集气瓶中水的体积大于1/5
C
解析
空气中的氧气被燃烧完后,剩下的就是氮气,占空气体积的4/5,而进入集气瓶中水的体积约1/5,该实验可说明N?2?难溶于水。
空气的组成
空气的成分(体积分数)
物质的简单分类
空气中氧气含量的测定
原理
现象
结论
氮气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%
纯净物
混合物
只由一种物质组成
由多种物质组成
再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
