黑龙江大庆市肇源县部分学校2021-2022学年九年级上学期开学考试化学试题(word版 含答案)
文档属性
| 名称 | 黑龙江大庆市肇源县部分学校2021-2022学年九年级上学期开学考试化学试题(word版 含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 338.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-09 15:45:07 | ||
图片预览



文档简介
2021-2022学年初四年级上学期期初模拟考试
(化学)试卷
可能用到的相对原子质量:
H-1
C-12
O-16
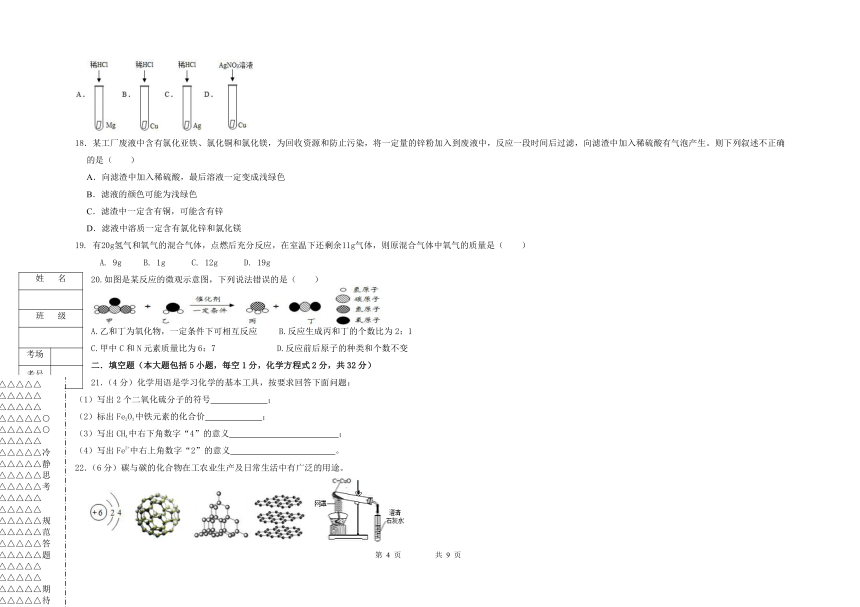
N-14
Fe-56
Cu-64
Zn-65
Ag-108
一.选择题(1-20题只有一个正确选项,每题2分,共40分)
1.精彩文艺演出中,发生化学变化的是( )
A.音乐喷泉
B.舞台升降
C.灯光表演
D.焰火表演
2.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50mL水和50mL乙醇混合后总体积小于100mL
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
3.下列物质属于纯净物的是( )
A.澄清石灰水
B.医用酒精
C.液氧
D.乙醇汽油
4.在反应2A+5B═2C+4D中,C、D的相对分子质量之比为9:22,若4.6g
A与B完全反应后,生成8.8g
D。则参加反应的B与生成C的质量比为( )
A.10:3
B.4:9
C.8:1
D.5:2
5.钛合金在航空工业有重要用途,工业制钛的一个反应为:TiF4+2H2SO4═4HF+2X+TiO2,则X的化学式为( )
A.SO3
B.SO2
C.H2SO3
D.H2O
6.碘是人体必需的微量元素之一,碘元素的相关信息如图所示。下列有关碘的说法正确的是( )
A.相对原子质量为126.9g
B.属于金属元素
C.原子的核电荷数为53
D.在化学反应中容易失电子
7.下列有关叙述、对应的方程式及所属基本反应类型都正确的是( )
A.拉瓦锡研究空气成分
HgOHg+O2↑
分解反应
B.海水吸收二氧化碳
CO2+H2O═H2CO3
化合反应
C.稀盐酸用于除铁锈
Fe2O3+2HCl═FeCl2+2H2O
复分解反应
D.一氧化碳还原氧化铜
CO+CuOCu+CO2↑
置换反应
8.下列有关碳和碳的氧化物的说法,错误的是( )
A.碳在空气中充分燃烧时生成CO2,不充分燃烧时生成CO
B.CO和CO2组成元素相同,所以它们的化学性质也相同
C.CO用于冶炼金属、做气体燃料;CO2可用于做气体肥料、灭火
D.《清明上河图》至今图案清晰可见,是因为在常温下碳单质的化学性质稳定
9.根据如图所示的实验现象分析,下列说法错误的是( )
A.①②对比说明物质燃烧需要与空气接触
B.烧杯中的热水只起提高温度的作用
C.①③对比说明红磷着火点高于白磷
D.①中使温度达到白磷着火点是利用了铜的导热性
10.下列图示实验操作,正确的是( )
A.检查气密性
B.检验O2是否集满
C.收集H2
D.探究甲烷的组成
11.下列有关“金属之最”描述中,属于金属物理性质的是( )
A.钙是人体中含量最多的金属元素
B.铁是世界年产量最高的金属
C.银是最好的导电导热金属
D.铝是地壳中含量最多的金属
12.有X、Y、Z三种金属片,分别放入稀硫酸中,X、Z表面有气泡产生,Y没有明显现象;X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是(
)
A.X>Y>Z
B.Z>X>Y
C.X>Z>Y
D.Y>X>Z
13.逻辑推理是一种重要的化学思维方法。下列推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.化学变化伴随着能量的变化,则有能量变化的一定是化学变化
C.蜡烛燃烧生成二氧化碳和水,则蜡烛组成中一定含有碳元素和氢元素
D.催化剂的质量在反应前后不变,则在反应前后质量不变的物质一定是该反应的催化剂
14.下列图象不能正确反映其对应关系的是( )
A
B
C
D
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.
AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
15.按如图所示流程进行实验(每步均充分反应)。下列判断正确的是( )
A.现象X应为无明显现象
B.由实验可判断出铁、铜、银的金属活动性强弱
C.烧杯中固体一定含有Ag,可能含有铜,一定没有铁
D.滤液的质量大于加入的AgNO3、Cu(NO3)2溶液的质量之和
16.两支试管中各注入5ml滴有石蕊试液的蒸馏水,通入CO2气体,然后将一只试管加热,另一支试管中撒入少量活性炭,其颜色变化分别为:①红﹣紫﹣无;②紫﹣红﹣紫;③紫﹣红﹣无;④无﹣红﹣无,其中正确的是( )
A.①②
B.②④
C.②③
D.①③
17.为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。其中不必进行的实验是( )
18.某工厂废液中含有氯化亚铁、氯化铜和氯化镁,为回收资源和防止污染,将一定量的锌粉加入到废液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生。则下列叙述不正确的是( )
A.向滤渣中加入稀硫酸,最后溶液一定变成浅绿色
B.滤液的颜色可能为浅绿色
C.滤渣中一定含有铜,可能含有锌
D.滤液中溶质一定含有氯化锌和氯化镁
19.
有20g氢气和氧气的混合气体,点燃后充分反应,在室温下还剩余11g气体,则原混合气体中氧气的质量是(
)
A.
9g
B.
1g
C.
12g
D.
19g
20.如图是某反应的微观示意图,下列说法错误的是( )
姓
名
班
级
考场
考号
A.乙和丁为氧化物,一定条件下可相互反应
B.反应生成丙和丁的个数比为2:1
C.甲中C和N元素质量比为6:7
D.反应前后原子的种类和个数不变
二.填空题(本大题包括5小题,每空1分,化学方程式2分,共32分)
21.(4分)化学用语是学习化学的基本工具,按要求回答下面问题:
(1)写出2个二氧化硫分子的符号
;
(2)标出Fe2O3中铁元素的化合价
;
(3)写出CH4中右下角数字“4”的意义
;
(4)写出Fe2+中右上角数字“2”的意义
。
22.(6分)碳与碳的化合物在工农业生产及日常生活中有广泛的用途。
图1
图
2
图3
图4
图5
(1)图1是碳原子结构示意图,碳原子的最外层电子数为
;
(2)图2、3、4对应三种碳单质,图3单质的名称是
;
(3)如图5是木炭还原氧化铜的实验,其反应的化学方程式是
(2分)。
(4)在习主席“一带一路”伟大的战略构想中,代表中国制造的高铁走在了世界的前列。高铁动车与电路连接的石墨电刷没有用到石墨的性质的是
。(填序号)
A.稳定性
B.滑腻感
C.还原性
D.导电性
(5)应对气候变化一直都是“G20”峰会关注的重点议题,全球参与控制CO2的排放量是防止温室效应进一步增强的根本对策。下列限制CO2排放量的做法不合理的是
(填字母)。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气
23.(11分)2016年“冰箭”冲天,中国挺进大火箭时代。
(1)氢气的利用:火箭采用液氢、液氧作为推进剂,其内部温度极低,因此称为“冰箭”,氢气是
(填序号)。
a.常规能源
b.绿色能源
c.不可再生能源
(2)氢气的制取:利用太阳能分解水制H2与电解水制H2相比,其优点是
;
(3)氢燃料电池是将化学能直接转化为
,且能量转化效率高达约80%;与化石燃料相比,氢能源的优点是:①原料来源广,②
,③燃烧热值高。
(4)实验室制取氢气选择
和
(填药品名称),发生装置选择
(填“固固加热型”或“固液常温型”),收集方法选择
法或
法,反应的方程式为
。
24.(6分)A、B、C是初中化学中重点学习的物质,其中一种是单质,另两种是由相同元素组成的氧化物,它们存在如图所示的转化关系(部分反应物,生成物和反应条件已省略)。
(1)若A是单质,B是易与血红蛋白结合的有毒气体,则C为
(填化学式),由C转化为B的化学方程式为
(2分);
(2)若C是单质,B是相对分子质量最小的氧化物,则B为
(填化学式),由A生成C的化学方程式为
(2分)。
25.(5分)成功着陆月球背面的“嫦娥四号”探测器使用了多种材料。
(1)探测器使用的铝合金硬度比纯铝的硬度
(填“大”或”小”)。
(2)探测器广泛使用了Al、Fe、Cu。利用它们完成如下实验:
①将未打磨的铝片放入FeSO4溶液中,没有明显现象
②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化
③将打磨过的铁片放入CuSO4溶液中,铁片表面变红
实验①中无现象是因为铝片表面有一层致密的
(填化学式)薄膜。
实验②中发生反应的化学方程式为
(2分)。
实验③中铁片足量,充分反应后溶液变为
色。
三.实验题(本大题包括2小题,每空1分,化学方程式2分,共20分)
26.(11分)通过化学学习,相信你已掌握了实验室制取气体的有关知识。请结合下图回答问题:
(1)请写出图中a、b仪器的名称:a
;b
。
(2)实验室可用氯酸钾和二氧化锰混合加热制取氧气,发生反应的化学方程式为
。(2分)
(3)实验室用B装置来制取二氧化碳,发生反应的化学方程式为
。(2分)若用D装置收集二氧化碳,验满的方法是
。若用E装置可用来测量生成的二氧化碳气体的体积,在水面上放一层植物油的目的是
,植物油上方原有的空气对实验的结果
(填“有”或“没有”)明显影响。
(4)作为制取二氧化碳的发生装置,F与B相比具有的优点是
。
(5)用G装置制取二氧化碳时,小试管的作用有
。(任填一点)
27.(9分)人类的生产和生活都离不开金属。
(1)金属的利用和保护:
①下列如图1金属制品的用途,利用其导电性的是
(填字母序号)。
②铁制品易生锈,铁生锈的实质是铁与
发生复杂的化学反应。
③现有等质量的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图2所示(已知甲、乙、丙在生成物中的化合价均为+2)。则甲、乙、丙三种金属的活动性由强到弱的顺序是
,相对原子质量的由大到小的关系为
。
班级:
姓名:
(2)金属的冶炼:图3是某化学小组模拟炼铁的装置,请按要求回答问题:
①写出装置A玻璃管中发生反应的化学方程式:
(2分);
②装置B中的现象为
;
③实验前先通一氧化碳的目的是
;
④装置C的作用是
。
四.计算题(本大题包括1小题,共8分)
28.(8分)化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如图所示(假设铁片除有Fe2O3外,不含其他杂质)。
(1)生成氢气的质量为
g;
(2)计算该铁片中铁单质的质量分数(写出计算过程)。
化学试卷参考答案
1.选择题(共20个小题,共40分)
1
2
3
4
5
6
7
8
9
10
D
D
C
A
A
C
B
B
B
A
11
12
13
14
15
16
17
18
19
20
C
B
C
B
C
C
C
A
D
C
2.填空题(每空1分,化学方程式2分,共32分)
21.(4分)(1)2SO2(2)Fe2O3
(3)一个甲烷分子中含有4个氢原子
(4)一个亚铁离子带2个单位的正电荷
22.(6分)(1)4
(2)金刚石
(3)C
+2CuO=高温=
2Cu+
CO2↑
(4)C
(5)c
23.(11分)(1)b
(2)节约电能,防止污染环境
(3)电能
产物为水,无污染
(4)锌粒
稀硫酸
固液常温型
排水
向下排空气
Zn+H2SO4==ZnSO4+H2↑
24.(6分)(1)CO2
C
+CO2=高温=
2CO
(2)H2O
2H2O2
=MnO2=
2H2O+
O2↑
25.(5分)(1)大(2)①Al2O3
②2Al+
3FeSO4
==Al2(SO4)3
+3Fe
③浅绿
三.实验题(每空1分,化学方程式2分,共20分)
26.(11分)(1)试管
集气瓶
(2)2KClO3=====
2KCl+3O2↑
(3)CaCO3
+2HCl=
CaCl2+
H2O+
CO2↑
将燃着的木条放在集气瓶口,若木条熄灭,则已集满
防止二氧化碳与水反应(或防止二氧化碳与水接触等合理即可)
没有
(4)可以控制反应的发生与停止
(5)节约药品(或便于形成液封或可以控制反应速率)
27.(9分)(1)①B
②O2和H2O
③乙﹥甲﹥丙
丙﹥乙﹥甲
(2)①Fe2O3+
3CO
=高温=
2Fe+
3CO2
②澄清石灰水变浑浊
③排尽装置中的空气,防止加热时发生爆炸
④点燃尾气,防止污染空气
四.计算题(共8分)
28.(8分)(1)0.4(1分)
(2)
解:设该铁片中Fe的质量为x
……………(1分)(注:“设”、“答”共1分)
Fe+2HCl═FeCl2+H2↑
……………………(2分)
56
2
x
0.4g
……………………(1分)
56/2=x/0.4g
………………………………(1分)
x=11.2g
………………………………(1分)
11.2g/12.8g×100%=87.5%……………………(1分)
答:该铁片中铁单质的质量分数为87.5%。
姓
名
班
级
考场
考号
△△△△△
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△冷
△△△△△静
△△△△△思
△△△△△考
△△△△△
△△△△△
△△△△△规
△△△△△范
△△△△△答
△△△△△题
△△△△△
△△△△△
△△△△△期
△△△△△待
△△△△△着
△△△△△你
△△△△△的
△△△△△进
△△△△△步
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
装
订
线
内
不
要
答
题
△△△△△
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△冷
△△△△△静
△△△△△思
△△△△△考
△△△△△
△△△△△
△△△△△规
△△△△△范
△△△△△答
△△△△△题
△△△△△
△△△△△
△△△△△期
△△△△△待
△△△△△着
△△△△△你
△△△△△的
△△△△△进
△△△△△步
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
装
订
线
内
不
要
答
题
+3
MnO2
△
第
1
页
共
3
页
(化学)试卷
可能用到的相对原子质量:
H-1
C-12
O-16
N-14
Fe-56
Cu-64
Zn-65
Ag-108
一.选择题(1-20题只有一个正确选项,每题2分,共40分)
1.精彩文艺演出中,发生化学变化的是( )
A.音乐喷泉
B.舞台升降
C.灯光表演
D.焰火表演
2.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50mL水和50mL乙醇混合后总体积小于100mL
C.在100g过氧化氢溶液中,含有30g过氧化氢和70g水
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
3.下列物质属于纯净物的是( )
A.澄清石灰水
B.医用酒精
C.液氧
D.乙醇汽油
4.在反应2A+5B═2C+4D中,C、D的相对分子质量之比为9:22,若4.6g
A与B完全反应后,生成8.8g
D。则参加反应的B与生成C的质量比为( )
A.10:3
B.4:9
C.8:1
D.5:2
5.钛合金在航空工业有重要用途,工业制钛的一个反应为:TiF4+2H2SO4═4HF+2X+TiO2,则X的化学式为( )
A.SO3
B.SO2
C.H2SO3
D.H2O
6.碘是人体必需的微量元素之一,碘元素的相关信息如图所示。下列有关碘的说法正确的是( )
A.相对原子质量为126.9g
B.属于金属元素
C.原子的核电荷数为53
D.在化学反应中容易失电子
7.下列有关叙述、对应的方程式及所属基本反应类型都正确的是( )
A.拉瓦锡研究空气成分
HgOHg+O2↑
分解反应
B.海水吸收二氧化碳
CO2+H2O═H2CO3
化合反应
C.稀盐酸用于除铁锈
Fe2O3+2HCl═FeCl2+2H2O
复分解反应
D.一氧化碳还原氧化铜
CO+CuOCu+CO2↑
置换反应
8.下列有关碳和碳的氧化物的说法,错误的是( )
A.碳在空气中充分燃烧时生成CO2,不充分燃烧时生成CO
B.CO和CO2组成元素相同,所以它们的化学性质也相同
C.CO用于冶炼金属、做气体燃料;CO2可用于做气体肥料、灭火
D.《清明上河图》至今图案清晰可见,是因为在常温下碳单质的化学性质稳定
9.根据如图所示的实验现象分析,下列说法错误的是( )
A.①②对比说明物质燃烧需要与空气接触
B.烧杯中的热水只起提高温度的作用
C.①③对比说明红磷着火点高于白磷
D.①中使温度达到白磷着火点是利用了铜的导热性
10.下列图示实验操作,正确的是( )
A.检查气密性
B.检验O2是否集满
C.收集H2
D.探究甲烷的组成
11.下列有关“金属之最”描述中,属于金属物理性质的是( )
A.钙是人体中含量最多的金属元素
B.铁是世界年产量最高的金属
C.银是最好的导电导热金属
D.铝是地壳中含量最多的金属
12.有X、Y、Z三种金属片,分别放入稀硫酸中,X、Z表面有气泡产生,Y没有明显现象;X放入ZCln溶液,没有明显现象。判断这三种金属的活动性由强到弱的顺序是(
)
A.X>Y>Z
B.Z>X>Y
C.X>Z>Y
D.Y>X>Z
13.逻辑推理是一种重要的化学思维方法。下列推理合理的是( )
A.在同一化合物中,金属元素显正价,则非金属元素一定显负价
B.化学变化伴随着能量的变化,则有能量变化的一定是化学变化
C.蜡烛燃烧生成二氧化碳和水,则蜡烛组成中一定含有碳元素和氢元素
D.催化剂的质量在反应前后不变,则在反应前后质量不变的物质一定是该反应的催化剂
14.下列图象不能正确反映其对应关系的是( )
A
B
C
D
A.表示用等质量、等质量分数的过氧化氢溶液制取氧气
B.在密闭容器中用红磷测定空气中氧气的含量
C.
AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
D.分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸
15.按如图所示流程进行实验(每步均充分反应)。下列判断正确的是( )
A.现象X应为无明显现象
B.由实验可判断出铁、铜、银的金属活动性强弱
C.烧杯中固体一定含有Ag,可能含有铜,一定没有铁
D.滤液的质量大于加入的AgNO3、Cu(NO3)2溶液的质量之和
16.两支试管中各注入5ml滴有石蕊试液的蒸馏水,通入CO2气体,然后将一只试管加热,另一支试管中撒入少量活性炭,其颜色变化分别为:①红﹣紫﹣无;②紫﹣红﹣紫;③紫﹣红﹣无;④无﹣红﹣无,其中正确的是( )
A.①②
B.②④
C.②③
D.①③
17.为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。其中不必进行的实验是( )
18.某工厂废液中含有氯化亚铁、氯化铜和氯化镁,为回收资源和防止污染,将一定量的锌粉加入到废液中,反应一段时间后过滤,向滤渣中加入稀硫酸有气泡产生。则下列叙述不正确的是( )
A.向滤渣中加入稀硫酸,最后溶液一定变成浅绿色
B.滤液的颜色可能为浅绿色
C.滤渣中一定含有铜,可能含有锌
D.滤液中溶质一定含有氯化锌和氯化镁
19.
有20g氢气和氧气的混合气体,点燃后充分反应,在室温下还剩余11g气体,则原混合气体中氧气的质量是(
)
A.
9g
B.
1g
C.
12g
D.
19g
20.如图是某反应的微观示意图,下列说法错误的是( )
姓
名
班
级
考场
考号
A.乙和丁为氧化物,一定条件下可相互反应
B.反应生成丙和丁的个数比为2:1
C.甲中C和N元素质量比为6:7
D.反应前后原子的种类和个数不变
二.填空题(本大题包括5小题,每空1分,化学方程式2分,共32分)
21.(4分)化学用语是学习化学的基本工具,按要求回答下面问题:
(1)写出2个二氧化硫分子的符号
;
(2)标出Fe2O3中铁元素的化合价
;
(3)写出CH4中右下角数字“4”的意义
;
(4)写出Fe2+中右上角数字“2”的意义
。
22.(6分)碳与碳的化合物在工农业生产及日常生活中有广泛的用途。
图1
图
2
图3
图4
图5
(1)图1是碳原子结构示意图,碳原子的最外层电子数为
;
(2)图2、3、4对应三种碳单质,图3单质的名称是
;
(3)如图5是木炭还原氧化铜的实验,其反应的化学方程式是
(2分)。
(4)在习主席“一带一路”伟大的战略构想中,代表中国制造的高铁走在了世界的前列。高铁动车与电路连接的石墨电刷没有用到石墨的性质的是
。(填序号)
A.稳定性
B.滑腻感
C.还原性
D.导电性
(5)应对气候变化一直都是“G20”峰会关注的重点议题,全球参与控制CO2的排放量是防止温室效应进一步增强的根本对策。下列限制CO2排放量的做法不合理的是
(填字母)。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气
23.(11分)2016年“冰箭”冲天,中国挺进大火箭时代。
(1)氢气的利用:火箭采用液氢、液氧作为推进剂,其内部温度极低,因此称为“冰箭”,氢气是
(填序号)。
a.常规能源
b.绿色能源
c.不可再生能源
(2)氢气的制取:利用太阳能分解水制H2与电解水制H2相比,其优点是
;
(3)氢燃料电池是将化学能直接转化为
,且能量转化效率高达约80%;与化石燃料相比,氢能源的优点是:①原料来源广,②
,③燃烧热值高。
(4)实验室制取氢气选择
和
(填药品名称),发生装置选择
(填“固固加热型”或“固液常温型”),收集方法选择
法或
法,反应的方程式为
。
24.(6分)A、B、C是初中化学中重点学习的物质,其中一种是单质,另两种是由相同元素组成的氧化物,它们存在如图所示的转化关系(部分反应物,生成物和反应条件已省略)。
(1)若A是单质,B是易与血红蛋白结合的有毒气体,则C为
(填化学式),由C转化为B的化学方程式为
(2分);
(2)若C是单质,B是相对分子质量最小的氧化物,则B为
(填化学式),由A生成C的化学方程式为
(2分)。
25.(5分)成功着陆月球背面的“嫦娥四号”探测器使用了多种材料。
(1)探测器使用的铝合金硬度比纯铝的硬度
(填“大”或”小”)。
(2)探测器广泛使用了Al、Fe、Cu。利用它们完成如下实验:
①将未打磨的铝片放入FeSO4溶液中,没有明显现象
②将打磨过的铝片放入FeSO4溶液中,铝片表面有明显变化
③将打磨过的铁片放入CuSO4溶液中,铁片表面变红
实验①中无现象是因为铝片表面有一层致密的
(填化学式)薄膜。
实验②中发生反应的化学方程式为
(2分)。
实验③中铁片足量,充分反应后溶液变为
色。
三.实验题(本大题包括2小题,每空1分,化学方程式2分,共20分)
26.(11分)通过化学学习,相信你已掌握了实验室制取气体的有关知识。请结合下图回答问题:
(1)请写出图中a、b仪器的名称:a
;b
。
(2)实验室可用氯酸钾和二氧化锰混合加热制取氧气,发生反应的化学方程式为
。(2分)
(3)实验室用B装置来制取二氧化碳,发生反应的化学方程式为
。(2分)若用D装置收集二氧化碳,验满的方法是
。若用E装置可用来测量生成的二氧化碳气体的体积,在水面上放一层植物油的目的是
,植物油上方原有的空气对实验的结果
(填“有”或“没有”)明显影响。
(4)作为制取二氧化碳的发生装置,F与B相比具有的优点是
。
(5)用G装置制取二氧化碳时,小试管的作用有
。(任填一点)
27.(9分)人类的生产和生活都离不开金属。
(1)金属的利用和保护:
①下列如图1金属制品的用途,利用其导电性的是
(填字母序号)。
②铁制品易生锈,铁生锈的实质是铁与
发生复杂的化学反应。
③现有等质量的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图2所示(已知甲、乙、丙在生成物中的化合价均为+2)。则甲、乙、丙三种金属的活动性由强到弱的顺序是
,相对原子质量的由大到小的关系为
。
班级:
姓名:
(2)金属的冶炼:图3是某化学小组模拟炼铁的装置,请按要求回答问题:
①写出装置A玻璃管中发生反应的化学方程式:
(2分);
②装置B中的现象为
;
③实验前先通一氧化碳的目的是
;
④装置C的作用是
。
四.计算题(本大题包括1小题,共8分)
28.(8分)化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如图所示(假设铁片除有Fe2O3外,不含其他杂质)。
(1)生成氢气的质量为
g;
(2)计算该铁片中铁单质的质量分数(写出计算过程)。
化学试卷参考答案
1.选择题(共20个小题,共40分)
1
2
3
4
5
6
7
8
9
10
D
D
C
A
A
C
B
B
B
A
11
12
13
14
15
16
17
18
19
20
C
B
C
B
C
C
C
A
D
C
2.填空题(每空1分,化学方程式2分,共32分)
21.(4分)(1)2SO2(2)Fe2O3
(3)一个甲烷分子中含有4个氢原子
(4)一个亚铁离子带2个单位的正电荷
22.(6分)(1)4
(2)金刚石
(3)C
+2CuO=高温=
2Cu+
CO2↑
(4)C
(5)c
23.(11分)(1)b
(2)节约电能,防止污染环境
(3)电能
产物为水,无污染
(4)锌粒
稀硫酸
固液常温型
排水
向下排空气
Zn+H2SO4==ZnSO4+H2↑
24.(6分)(1)CO2
C
+CO2=高温=
2CO
(2)H2O
2H2O2
=MnO2=
2H2O+
O2↑
25.(5分)(1)大(2)①Al2O3
②2Al+
3FeSO4
==Al2(SO4)3
+3Fe
③浅绿
三.实验题(每空1分,化学方程式2分,共20分)
26.(11分)(1)试管
集气瓶
(2)2KClO3=====
2KCl+3O2↑
(3)CaCO3
+2HCl=
CaCl2+
H2O+
CO2↑
将燃着的木条放在集气瓶口,若木条熄灭,则已集满
防止二氧化碳与水反应(或防止二氧化碳与水接触等合理即可)
没有
(4)可以控制反应的发生与停止
(5)节约药品(或便于形成液封或可以控制反应速率)
27.(9分)(1)①B
②O2和H2O
③乙﹥甲﹥丙
丙﹥乙﹥甲
(2)①Fe2O3+
3CO
=高温=
2Fe+
3CO2
②澄清石灰水变浑浊
③排尽装置中的空气,防止加热时发生爆炸
④点燃尾气,防止污染空气
四.计算题(共8分)
28.(8分)(1)0.4(1分)
(2)
解:设该铁片中Fe的质量为x
……………(1分)(注:“设”、“答”共1分)
Fe+2HCl═FeCl2+H2↑
……………………(2分)
56
2
x
0.4g
……………………(1分)
56/2=x/0.4g
………………………………(1分)
x=11.2g
………………………………(1分)
11.2g/12.8g×100%=87.5%……………………(1分)
答:该铁片中铁单质的质量分数为87.5%。
姓
名
班
级
考场
考号
△△△△△
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△冷
△△△△△静
△△△△△思
△△△△△考
△△△△△
△△△△△
△△△△△规
△△△△△范
△△△△△答
△△△△△题
△△△△△
△△△△△
△△△△△期
△△△△△待
△△△△△着
△△△△△你
△△△△△的
△△△△△进
△△△△△步
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
装
订
线
内
不
要
答
题
△△△△△
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△冷
△△△△△静
△△△△△思
△△△△△考
△△△△△
△△△△△
△△△△△规
△△△△△范
△△△△△答
△△△△△题
△△△△△
△△△△△
△△△△△期
△△△△△待
△△△△△着
△△△△△你
△△△△△的
△△△△△进
△△△△△步
△△△△△
△△△△△
△△△△△○
△△△△△○
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
△△△△△
装
订
线
内
不
要
答
题
+3
MnO2
△
第
1
页
共
3
页
同课章节目录
