2021-2022学年 鲁教版(五四制)九年级化学 第四单元 金属 达标检测卷(word版 含答案)
文档属性
| 名称 | 2021-2022学年 鲁教版(五四制)九年级化学 第四单元 金属 达标检测卷(word版 含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 419.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-09 22:27:51 | ||
图片预览



文档简介
第四单元达标检测卷
100分,90分钟)
题 号
一
二
三
四
总 分
得 分
可能用到的相对原子质量:H—1 O—16 Mg—24 Al—27 Cl—35.5 Fe—56 Cu—64 Zn—65 Ag—108
一、选择题(每题包括15小题,1~10小题每题2分,11~15小题每题3分,共35分)
1.下列金属中,熔点最高的是( )
A.铜
B.汞
C.钨
D.铝
2.下列化学方程式书写正确的是( )
A.2Fe+6HCl===2FeCl3+3H2↑
B.Cu+FeSO4===CuSO4+Fe
C.2Mg+O22MgO
D.Fe2O3+COFe+CO2
3.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条
B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面
D.用过的菜刀及时用盐水清洗
4.在柠檬中插入两种不同种类的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )
INCLUDEPICTURE"QC110.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\QC110.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\QC110.EPS"
\
MERGEFORMATINET
5.将甲、乙两种金属片(均不是铜)分别放入CuSO4溶液中,甲表面析出金属Cu,乙表面没有明显现象,据此判断,三种金属的活动性顺序是( )
A.甲>铜>乙
B.铜>甲>乙
C.乙>铜>甲
D.甲>乙>铜
6.下列与金属材料有关的说法中,正确的是( )
A.常温下所有的金属都是固体
B.钢是纯净物,生铁是混合物
C.银能与稀盐酸发生置换反应
D.为防止钢铁制品生锈,可在其表面刷漆
7.金属是一类重要的材料。下列有关金属的说法正确的是( )
A.不锈钢是绝对不会生锈的铁合金
B.武德合金的熔点比其成分金属高
C.日常生活中,钢铁表面刷油漆可以防止生锈
D.“曾青得铁则化为铜”的原理是用铜置换出铁
8.下列有关模拟工业炼铁的叙述不正确的是( )
INCLUDEPICTURE"XC88.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC88.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC88.eps"
\
MERGEFORMATINET
(第8题)
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
9.黄金是Au的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金与假黄金的方案是( )
A.在空气中灼烧
B.放在盐酸中
C.观察颜色
D.放在AgNO3溶液中
10.“中国高铁,世界第一”。高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO2Ni+CO2↑,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
11.已知R为金属单质,能发生如下反应:R+CuSO4===Cu+RSO4。下列说法错误的是( )
A.该反应为置换反应
B.R的金属活动性比Cu强
C.该金属R可以是Al
D.若R为Fe,反应后溶液的质量会减小
12.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
13.某固体由镁、锌、铁三种金属中的一种或几种组成,现取a
g固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g不含结晶水的固体,则a的取值范围是( )
A.4.8≤a≤13.0
B.11.2<a≤13.0
C.3.6≤a≤11.2
D.4.8≤a<11.2
14.在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是( )
A.向滤渣中加入稀盐酸可能有气泡产生
B.滤渣中一定有Ag,可能有Cu和Zn
C.滤液中一定无AgNO3
D.滤液中可能有四种金属离子
15.下列图像不能正确反映对应变化关系的是( )
INCLUDEPICTURE"CP36.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP36.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP36.EPS"
\
MERGEFORMATINET
(第15题)
A.图①是向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
B.图②是向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量
C.图③是浓硫酸长时间敞口露置于空气中
D.图④是向相同质量、相同质量分数的稀盐酸中分别逐渐加入镁粉和铁粉
二、填空题(本题包括5小题,共36分)
16.(6分)铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为________(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和__________(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:_____________________________________________。
(3)用砂纸除去铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验该气体为氢气。
①写出生成红色物质的化学方程式:___________________________________;
②硫酸铜溶液中的阳离子有____________(填离子符号)。
17.(8分)人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的历程。请回答:
(1)我国最早使用的合金是________。
(2)我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜。铁与硫酸铜溶液反应的化学方程式为
__________________________________________________________________。
(3)下列金属矿物中,可以用来炼铁的是________(填字母)。
A.赤铜矿(Cu2O) B.赤铁矿(Fe2O3) C.软锰矿(MnO2)
(4)19世纪初,铝的发现得益于电解技术的应用。下图为用铝土矿炼制铝的生产流程。
(第17题)
现有含Al2O3
51%的铝土矿200
t,经上述反应后可制得铝________t(假设上述各步反应中,铝元素一共损失10%。
18.(8分)金属材料广泛应用于生产、生活中。
INCLUDEPICTURE"XC89.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC89.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC89.eps"
\
MERGEFORMATINET
(第18题)
(1)用铜作导线,利用了铜的延展性和________性。
(2)镁是一种活泼的金属,请写出镁与稀盐酸反应的化学方程式:
__________________________________________________________________。
(3)将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是____________,相对原子质量最大的是________。
(4)向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是________(填字母)。
A.若滤渣只含一种金属,则滤液中的溶质一定有三种
B.若滤液中含有两种金属离子,则滤渣中的固体一定有两种
C.若最终得到的滤渣质量仍为m
g,则滤液中溶质最多有两种
D.若向滤渣中加入稀盐酸,有气泡产生,则滤液中的溶质最多有两种
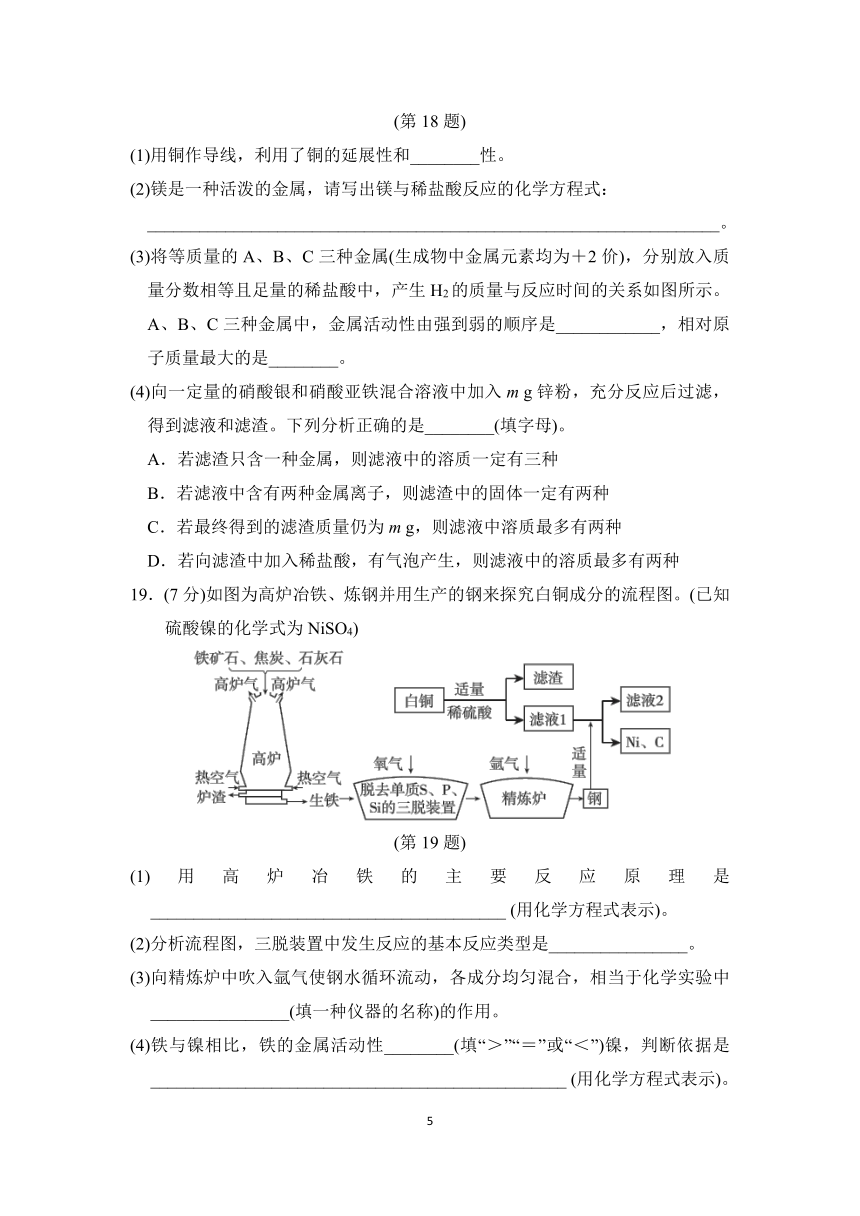
19.(7分)如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
INCLUDEPICTURE"WG6.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\WG6.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\WG6.EPS"
\
MERGEFORMATINET
(第19题)
(1)用高炉冶铁的主要反应原理是_________________________________________
(用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是________________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中________________(填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性________(填“>”“=”或“<”)镍,判断依据是________________________________________________
(用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是____________,其硬度比纯铜________(填“大”或“小”)。
20.(7分)从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
INCLUDEPICTURE"XC90.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC90.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC90.eps"
\
MERGEFORMATINET
(第20题)
(1)图中“操作”的名称是________。
(2)写出所得贵重金属中任意一种成分的化学式________。
(3)写出①中发生反应的化学方程式:_____________________________________
(任写一个);该反应的基本类型为_____________________________________。
(4)写出②中发生反应的化学方程式:____________________________________。
三、实验探究题(本题包括2小题,共20分)
21.(4分)小亮学完合金后,知道了不锈钢的主要成分是铁,白铜中含有铜和镍(Ni)。他决定探究Fe、Cu、Ni的金属活动性顺序。
(1)【查阅资料】镍能与稀硫酸反应生成能溶于水的NiSO4,并放出氢气。写出镍与稀硫酸反应的化学方程式:________________________________________。
(2)【猜想与假设】根据教材中常见金属的活动性顺序和查阅的资料,对以上三种金属的活动性作出猜想:
猜想①:Fe>Ni>Cu;猜想②:__________________。
(3)【实验探究】把用砂纸打磨过的镍片浸入FeSO4溶液中,过一会儿取出,发现镍片表面无明显变化。证明__________(填“猜想①”或“猜想②”)成立。
(4)【拓展延伸】用铜片、NiSO4溶液和________,通过实验探究也能判断Fe、Cu、Ni的金属活动性顺序。
22.(16分)金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。
【认识铁的腐蚀】
(1)下列环境中的铁制品最容易生锈的是________(填字母)。
A.未擦干的铁锅
B.涂油漆的栏杆
C.盛水的不锈钢水杯
(2)铁锈的主要成分是Fe2O3·xH2O,其中铁元素的化合价是________。
【探究铁的腐蚀】
INCLUDEPICTURE"CP5.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP5.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP5.EPS"
\
MERGEFORMATINET
(第22题)
(3)该小组用图甲装置进行实验,起始时量筒内水面处于50
mL刻度处,之后水面缓慢上升。几天后水面最终处于约________(填“40”或“10”)mL刻度处,原因是_____________________________________________________________。
【拓展探究】
(4)小强同学进行如下实验:取铁钉,用砂纸打磨,称其质量,按图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表所示。
温度/℃
10
20
30
40
50
60
70
铁钉质量增加/g
0.02
0.04
0.08
0.16
0.18
0.18
0.18
小强同学的实验是探究______________对铁钉腐蚀快慢的影响,结论是___________________________________________________________________________________________________________________________________。
(5)有同学认为小强的实验未能真实反映50
℃以后铁钉腐蚀的快慢,理由是50
℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:_________________________________________________________________;
改进实验方案证明你的分析:__________________________________________
__________________________________________________________________。
四、计算题(本题包括1小题,共9分)
23.(9分)铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组用图1所示装置测定黄铜中锌的含量。将足量的稀硫酸全部加入锥形瓶中,充分反应后天平示数的变化如图2所示。请计算:
INCLUDEPICTURE"E30.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\E30.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\E30.EPS"
\
MERGEFORMATINET
(第23题)
(1)生成氢气________
g。
(2)黄铜样品中锌的质量分数。(写出计算过程)
参考答案
一、1.
C
2.
C 点拨:铁与盐酸反应时生成FeCl2,而不是FeCl3,A错误;Cu的活动性比Fe弱,Cu不能与FeSO4发生反应,B错误;D中化学方程式未配平。
3.
B 4.
C 5.
A 6.
D
7.
C 点拨:不锈钢并不是绝对不会生锈的铁合金,而是比较难生锈的铁合金,A不正确;武德合金的熔点比其成分金属低,B不正确;日常生活中,钢铁表面刷油漆,可以防止铁与氧气和水接触,防止铁生锈,C正确;“曾青得铁则化为铜”的原理是用铁置换出铜,D不正确。
8.
A 点拨:一氧化碳具有还原性,在高温的条件下,一氧化碳能将氧化铁还原为铁的单质,氧化铁是红色的,铁粉是黑色的,所以观察到红色固体慢慢变成黑色,A错误。
9.
C
10.
D 点拨:由化学方程式可知,反应中NiO失去了氧元素,发生了还原反应,A正确;该反应的反应物是C和NiO,气体产物中可能有CO,B正确;钢是含碳量在0.
03%~2%的铁合金,所以该不锈钢中还含有铁和碳,C正确;由合金的性质可知,该不锈钢合金的硬度大于纯铁,D错误。
11.
C 点拨:Al在化合物中显+3价。
12.
C
13.
A 点拨:反应后所得固体中氯元素的质量为(a+14.
2)g-a
g=14.
2
g,假设原固体全部是镁,则镁的质量为=4.
8
g;假设原固体全部是铁,则铁的质量为=11.
2
g;假设原固体全部是锌,则锌的质量为=13.
0
g。所以a的取值范围是4.
8≤a≤13.
0。故选A。
14.
D 点拨:充分反应后过滤,得到滤渣和蓝色滤液,说明滤液中含有硝酸铜。滤液中含有硝酸铜,则锌不可能有剩余,则向滤渣中加入稀盐酸,不可能有气泡产生,A错误;滤渣中一定有Ag,无法确定硝酸铜是否参加了反应,不能确定是否有Cu,但不可能含有锌,B错误;滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有AgNO3,C错误;滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有AgNO3,则滤液中可能有银离子、铜离子、锌离子、铝离子四种金属离子,D正确。
15.
A 点拨:向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量,锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银反应完后,锌才能与硝酸铜溶液反应生成硝酸锌溶液和铜。每65份质量的锌可置换出216份质量的银,溶液的质量会先减少,A错误。
二、16.
(1)b (2)密度小(或质轻等);3Li2O+2Al6Li+Al2O3
(3)①2Al+3CuSO4===Al2(SO4)3+3Cu
②H+、Cu2+
点拨:(1)铝是地壳中含量最多的金属元素,人类冶炼和使用金属铝的时间较晚,是因为冶炼铝的技术要求高,故选b。(2)铝锂合金具有强度高、耐腐蚀和密度小等性质。高温下,铝与Li2O反应的化学方程式为3Li2O+2Al6Li+Al2O3。(3)①铝和硫酸铜溶液反应,生成硫酸铝和铜,其化学方程式为2Al+3CuSO4===Al2(SO4)3+3Cu。②硫酸铜溶液中加入铝时,产生氢气,说明溶液中含有氢离子,因此硫酸铜溶液中的阳离子有氢离子和铜离子。
17.
(1)青铜 (2)Fe+CuSO4===Cu+FeSO4
(3)B (4)48.
6
点拨:(1)我国在商代就会制造青铜器,所以我国最早使用的合金是青铜。(2)铁和硫酸铜反应生成硫酸亚铁和铜,据此书写化学方程式。(3)化学反应前后元素种类不变,氧化亚铜、二氧化锰中不含铁元素,所以选项所给金属矿物中,可以用来炼铁的是赤铁矿。
(4)设经上述反应后可制得铝的质量为x。
Al2O3 ~
2Al
102
54
51%×200
t
=
x=48.
6
t。
18.
(1)导电 (2)Mg+
2HCl===MgCl2
+
H2↑
(3)A>C>B;C (4)C、D
点拨:(4)向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,锌会先和硝酸银反应生成硝酸锌和银,再和硝酸亚铁反应,生成铁和硝酸锌,若滤渣中只含一种金属,则一定是银,硝酸银可能部分反应,此时滤液中溶质为硝酸银、硝酸亚铁和硝酸锌,硝酸银也可能完全反应,此时滤液中溶质为硝酸亚铁和硝酸锌,A错;若滤液中含有两种金属离子,则溶质为硝酸锌和硝酸亚铁,硝酸亚铁和锌可能没反应,也可能部分反应,滤渣中固体可能为银,也可能为银和铁,B错;向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,若最终得到的滤渣质量仍为m
g,说明锌和硝酸银以及硝酸亚铁都发生了反应,硝酸亚铁可能有剩余也可能完全反应,则滤液中溶质最多有两种,C正确;若向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定有铁,硝酸亚铁可能完全反应,也可能部分反应,则滤液中溶质最多有两种,D正确。
19.
(1)3CO+Fe2O32Fe+3CO2(或4CO+Fe3O43Fe+4CO2)
(2)化合反应 (3)玻璃棒
(4)>;Fe+NiSO4===Ni+FeSO4
(5)铜、镍;大
20.
(1)过滤 (2)Au(或Pt)
(3)Fe+H2SO4===FeSO4+H2↑[或2Al+3H2SO4===Al2(SO4)3+3H2↑];置换反应 (4)2Cu+2H2SO4+O22CuSO4+2H2O
三、21.
(1)Ni+H2SO4===NiSO4+H2↑
(2)Ni>Fe>Cu
(3)猜想①
(4)铁片
22.
(1)A (2)+3 (3)40;铁锈蚀消耗氧气,且氧气约占空气总体积的
(4)温度;其他条件相同时,在一定温度范围内,温度越高,铁钉腐蚀的速率越快
(5)50
℃以后,试管中的氧气耗尽,铁钉的腐蚀停止;用容积较大的容器代替装置乙中的试管,分别在50
℃、60
℃、70
℃下重复上述实验
四、23.
(1)0.
2
(2)解:设黄铜样品中锌的质量分数为x。
Zn+H2SO4===ZnSO4+H2↑
65
2
20.
0
g·x
0.
2
g
= x=32.
5%
答:黄铜样品中锌的质量分数为32.
5%。
100分,90分钟)
题 号
一
二
三
四
总 分
得 分
可能用到的相对原子质量:H—1 O—16 Mg—24 Al—27 Cl—35.5 Fe—56 Cu—64 Zn—65 Ag—108
一、选择题(每题包括15小题,1~10小题每题2分,11~15小题每题3分,共35分)
1.下列金属中,熔点最高的是( )
A.铜
B.汞
C.钨
D.铝
2.下列化学方程式书写正确的是( )
A.2Fe+6HCl===2FeCl3+3H2↑
B.Cu+FeSO4===CuSO4+Fe
C.2Mg+O22MgO
D.Fe2O3+COFe+CO2
3.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条
B.在铁制暖气片上刷“银粉”
C.用“钢丝球”打磨铝锅表面
D.用过的菜刀及时用盐水清洗
4.在柠檬中插入两种不同种类的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )
INCLUDEPICTURE"QC110.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\QC110.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\QC110.EPS"
\
MERGEFORMATINET
5.将甲、乙两种金属片(均不是铜)分别放入CuSO4溶液中,甲表面析出金属Cu,乙表面没有明显现象,据此判断,三种金属的活动性顺序是( )
A.甲>铜>乙
B.铜>甲>乙
C.乙>铜>甲
D.甲>乙>铜
6.下列与金属材料有关的说法中,正确的是( )
A.常温下所有的金属都是固体
B.钢是纯净物,生铁是混合物
C.银能与稀盐酸发生置换反应
D.为防止钢铁制品生锈,可在其表面刷漆
7.金属是一类重要的材料。下列有关金属的说法正确的是( )
A.不锈钢是绝对不会生锈的铁合金
B.武德合金的熔点比其成分金属高
C.日常生活中,钢铁表面刷油漆可以防止生锈
D.“曾青得铁则化为铜”的原理是用铜置换出铁
8.下列有关模拟工业炼铁的叙述不正确的是( )
INCLUDEPICTURE"XC88.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC88.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC88.eps"
\
MERGEFORMATINET
(第8题)
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
9.黄金是Au的单质,化学性质很稳定。而假黄金是铜锌合金,颜色和外形似黄金。下列不能区分黄金与假黄金的方案是( )
A.在空气中灼烧
B.放在盐酸中
C.观察颜色
D.放在AgNO3溶液中
10.“中国高铁,世界第一”。高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO2Ni+CO2↑,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
11.已知R为金属单质,能发生如下反应:R+CuSO4===Cu+RSO4。下列说法错误的是( )
A.该反应为置换反应
B.R的金属活动性比Cu强
C.该金属R可以是Al
D.若R为Fe,反应后溶液的质量会减小
12.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
13.某固体由镁、锌、铁三种金属中的一种或几种组成,现取a
g固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g不含结晶水的固体,则a的取值范围是( )
A.4.8≤a≤13.0
B.11.2<a≤13.0
C.3.6≤a≤11.2
D.4.8≤a<11.2
14.在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是( )
A.向滤渣中加入稀盐酸可能有气泡产生
B.滤渣中一定有Ag,可能有Cu和Zn
C.滤液中一定无AgNO3
D.滤液中可能有四种金属离子
15.下列图像不能正确反映对应变化关系的是( )
INCLUDEPICTURE"CP36.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP36.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP36.EPS"
\
MERGEFORMATINET
(第15题)
A.图①是向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
B.图②是向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量
C.图③是浓硫酸长时间敞口露置于空气中
D.图④是向相同质量、相同质量分数的稀盐酸中分别逐渐加入镁粉和铁粉
二、填空题(本题包括5小题,共36分)
16.(6分)铝是大自然赐予人类的宝物,是现代文明不可缺少的物质基础。
(1)人类冶炼和使用金属铝的时间较晚,可能是因为________(填字母)。
a.地壳中铝元素含量少
b.冶炼铝的技术要求高
(2)用铝锂合金制造“神舟号”航天飞船的一些部件,主要是利用其强度高、耐腐蚀和__________(写一条)等性质。高温下,铝与Li2O反应可置换出金属锂,写出该反应的化学方程式:_____________________________________________。
(3)用砂纸除去铝片表面的氧化膜,将其浸入硫酸铜溶液中,一段时间后,观察到铝片表面有红色物质析出,并有气泡产生,经检验该气体为氢气。
①写出生成红色物质的化学方程式:___________________________________;
②硫酸铜溶液中的阳离子有____________(填离子符号)。
17.(8分)人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的历程。请回答:
(1)我国最早使用的合金是________。
(2)我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜。铁与硫酸铜溶液反应的化学方程式为
__________________________________________________________________。
(3)下列金属矿物中,可以用来炼铁的是________(填字母)。
A.赤铜矿(Cu2O) B.赤铁矿(Fe2O3) C.软锰矿(MnO2)
(4)19世纪初,铝的发现得益于电解技术的应用。下图为用铝土矿炼制铝的生产流程。
(第17题)
现有含Al2O3
51%的铝土矿200
t,经上述反应后可制得铝________t(假设上述各步反应中,铝元素一共损失10%。
18.(8分)金属材料广泛应用于生产、生活中。
INCLUDEPICTURE"XC89.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC89.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC89.eps"
\
MERGEFORMATINET
(第18题)
(1)用铜作导线,利用了铜的延展性和________性。
(2)镁是一种活泼的金属,请写出镁与稀盐酸反应的化学方程式:
__________________________________________________________________。
(3)将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是____________,相对原子质量最大的是________。
(4)向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是________(填字母)。
A.若滤渣只含一种金属,则滤液中的溶质一定有三种
B.若滤液中含有两种金属离子,则滤渣中的固体一定有两种
C.若最终得到的滤渣质量仍为m
g,则滤液中溶质最多有两种
D.若向滤渣中加入稀盐酸,有气泡产生,则滤液中的溶质最多有两种
19.(7分)如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
INCLUDEPICTURE"WG6.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\WG6.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\WG6.EPS"
\
MERGEFORMATINET
(第19题)
(1)用高炉冶铁的主要反应原理是_________________________________________
(用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是________________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中________________(填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性________(填“>”“=”或“<”)镍,判断依据是________________________________________________
(用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是____________,其硬度比纯铜________(填“大”或“小”)。
20.(7分)从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液。其工艺流程如图所示:
INCLUDEPICTURE"XC90.eps"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC90.eps"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\XC90.eps"
\
MERGEFORMATINET
(第20题)
(1)图中“操作”的名称是________。
(2)写出所得贵重金属中任意一种成分的化学式________。
(3)写出①中发生反应的化学方程式:_____________________________________
(任写一个);该反应的基本类型为_____________________________________。
(4)写出②中发生反应的化学方程式:____________________________________。
三、实验探究题(本题包括2小题,共20分)
21.(4分)小亮学完合金后,知道了不锈钢的主要成分是铁,白铜中含有铜和镍(Ni)。他决定探究Fe、Cu、Ni的金属活动性顺序。
(1)【查阅资料】镍能与稀硫酸反应生成能溶于水的NiSO4,并放出氢气。写出镍与稀硫酸反应的化学方程式:________________________________________。
(2)【猜想与假设】根据教材中常见金属的活动性顺序和查阅的资料,对以上三种金属的活动性作出猜想:
猜想①:Fe>Ni>Cu;猜想②:__________________。
(3)【实验探究】把用砂纸打磨过的镍片浸入FeSO4溶液中,过一会儿取出,发现镍片表面无明显变化。证明__________(填“猜想①”或“猜想②”)成立。
(4)【拓展延伸】用铜片、NiSO4溶液和________,通过实验探究也能判断Fe、Cu、Ni的金属活动性顺序。
22.(16分)金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。
【认识铁的腐蚀】
(1)下列环境中的铁制品最容易生锈的是________(填字母)。
A.未擦干的铁锅
B.涂油漆的栏杆
C.盛水的不锈钢水杯
(2)铁锈的主要成分是Fe2O3·xH2O,其中铁元素的化合价是________。
【探究铁的腐蚀】
INCLUDEPICTURE"CP5.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP5.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\CP5.EPS"
\
MERGEFORMATINET
(第22题)
(3)该小组用图甲装置进行实验,起始时量筒内水面处于50
mL刻度处,之后水面缓慢上升。几天后水面最终处于约________(填“40”或“10”)mL刻度处,原因是_____________________________________________________________。
【拓展探究】
(4)小强同学进行如下实验:取铁钉,用砂纸打磨,称其质量,按图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表所示。
温度/℃
10
20
30
40
50
60
70
铁钉质量增加/g
0.02
0.04
0.08
0.16
0.18
0.18
0.18
小强同学的实验是探究______________对铁钉腐蚀快慢的影响,结论是___________________________________________________________________________________________________________________________________。
(5)有同学认为小强的实验未能真实反映50
℃以后铁钉腐蚀的快慢,理由是50
℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:_________________________________________________________________;
改进实验方案证明你的分析:__________________________________________
__________________________________________________________________。
四、计算题(本题包括1小题,共9分)
23.(9分)铜锌合金又叫黄铜,外观酷似黄金,极易以假乱真。某化学兴趣小组用图1所示装置测定黄铜中锌的含量。将足量的稀硫酸全部加入锥形瓶中,充分反应后天平示数的变化如图2所示。请计算:
INCLUDEPICTURE"E30.EPS"
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\E30.EPS"
\
MERGEFORMATINET
INCLUDEPICTURE
\d
"D:\\4.
化学\\21秋
典中点
9
化学
LJ五四\\E30.EPS"
\
MERGEFORMATINET
(第23题)
(1)生成氢气________
g。
(2)黄铜样品中锌的质量分数。(写出计算过程)
参考答案
一、1.
C
2.
C 点拨:铁与盐酸反应时生成FeCl2,而不是FeCl3,A错误;Cu的活动性比Fe弱,Cu不能与FeSO4发生反应,B错误;D中化学方程式未配平。
3.
B 4.
C 5.
A 6.
D
7.
C 点拨:不锈钢并不是绝对不会生锈的铁合金,而是比较难生锈的铁合金,A不正确;武德合金的熔点比其成分金属低,B不正确;日常生活中,钢铁表面刷油漆,可以防止铁与氧气和水接触,防止铁生锈,C正确;“曾青得铁则化为铜”的原理是用铁置换出铜,D不正确。
8.
A 点拨:一氧化碳具有还原性,在高温的条件下,一氧化碳能将氧化铁还原为铁的单质,氧化铁是红色的,铁粉是黑色的,所以观察到红色固体慢慢变成黑色,A错误。
9.
C
10.
D 点拨:由化学方程式可知,反应中NiO失去了氧元素,发生了还原反应,A正确;该反应的反应物是C和NiO,气体产物中可能有CO,B正确;钢是含碳量在0.
03%~2%的铁合金,所以该不锈钢中还含有铁和碳,C正确;由合金的性质可知,该不锈钢合金的硬度大于纯铁,D错误。
11.
C 点拨:Al在化合物中显+3价。
12.
C
13.
A 点拨:反应后所得固体中氯元素的质量为(a+14.
2)g-a
g=14.
2
g,假设原固体全部是镁,则镁的质量为=4.
8
g;假设原固体全部是铁,则铁的质量为=11.
2
g;假设原固体全部是锌,则锌的质量为=13.
0
g。所以a的取值范围是4.
8≤a≤13.
0。故选A。
14.
D 点拨:充分反应后过滤,得到滤渣和蓝色滤液,说明滤液中含有硝酸铜。滤液中含有硝酸铜,则锌不可能有剩余,则向滤渣中加入稀盐酸,不可能有气泡产生,A错误;滤渣中一定有Ag,无法确定硝酸铜是否参加了反应,不能确定是否有Cu,但不可能含有锌,B错误;滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有AgNO3,C错误;滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有AgNO3,则滤液中可能有银离子、铜离子、锌离子、铝离子四种金属离子,D正确。
15.
A 点拨:向AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量,锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银反应完后,锌才能与硝酸铜溶液反应生成硝酸锌溶液和铜。每65份质量的锌可置换出216份质量的银,溶液的质量会先减少,A错误。
二、16.
(1)b (2)密度小(或质轻等);3Li2O+2Al6Li+Al2O3
(3)①2Al+3CuSO4===Al2(SO4)3+3Cu
②H+、Cu2+
点拨:(1)铝是地壳中含量最多的金属元素,人类冶炼和使用金属铝的时间较晚,是因为冶炼铝的技术要求高,故选b。(2)铝锂合金具有强度高、耐腐蚀和密度小等性质。高温下,铝与Li2O反应的化学方程式为3Li2O+2Al6Li+Al2O3。(3)①铝和硫酸铜溶液反应,生成硫酸铝和铜,其化学方程式为2Al+3CuSO4===Al2(SO4)3+3Cu。②硫酸铜溶液中加入铝时,产生氢气,说明溶液中含有氢离子,因此硫酸铜溶液中的阳离子有氢离子和铜离子。
17.
(1)青铜 (2)Fe+CuSO4===Cu+FeSO4
(3)B (4)48.
6
点拨:(1)我国在商代就会制造青铜器,所以我国最早使用的合金是青铜。(2)铁和硫酸铜反应生成硫酸亚铁和铜,据此书写化学方程式。(3)化学反应前后元素种类不变,氧化亚铜、二氧化锰中不含铁元素,所以选项所给金属矿物中,可以用来炼铁的是赤铁矿。
(4)设经上述反应后可制得铝的质量为x。
Al2O3 ~
2Al
102
54
51%×200
t
=
x=48.
6
t。
18.
(1)导电 (2)Mg+
2HCl===MgCl2
+
H2↑
(3)A>C>B;C (4)C、D
点拨:(4)向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,锌会先和硝酸银反应生成硝酸锌和银,再和硝酸亚铁反应,生成铁和硝酸锌,若滤渣中只含一种金属,则一定是银,硝酸银可能部分反应,此时滤液中溶质为硝酸银、硝酸亚铁和硝酸锌,硝酸银也可能完全反应,此时滤液中溶质为硝酸亚铁和硝酸锌,A错;若滤液中含有两种金属离子,则溶质为硝酸锌和硝酸亚铁,硝酸亚铁和锌可能没反应,也可能部分反应,滤渣中固体可能为银,也可能为银和铁,B错;向一定量的硝酸银和硝酸亚铁混合溶液中加入m
g锌粉,若最终得到的滤渣质量仍为m
g,说明锌和硝酸银以及硝酸亚铁都发生了反应,硝酸亚铁可能有剩余也可能完全反应,则滤液中溶质最多有两种,C正确;若向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定有铁,硝酸亚铁可能完全反应,也可能部分反应,则滤液中溶质最多有两种,D正确。
19.
(1)3CO+Fe2O32Fe+3CO2(或4CO+Fe3O43Fe+4CO2)
(2)化合反应 (3)玻璃棒
(4)>;Fe+NiSO4===Ni+FeSO4
(5)铜、镍;大
20.
(1)过滤 (2)Au(或Pt)
(3)Fe+H2SO4===FeSO4+H2↑[或2Al+3H2SO4===Al2(SO4)3+3H2↑];置换反应 (4)2Cu+2H2SO4+O22CuSO4+2H2O
三、21.
(1)Ni+H2SO4===NiSO4+H2↑
(2)Ni>Fe>Cu
(3)猜想①
(4)铁片
22.
(1)A (2)+3 (3)40;铁锈蚀消耗氧气,且氧气约占空气总体积的
(4)温度;其他条件相同时,在一定温度范围内,温度越高,铁钉腐蚀的速率越快
(5)50
℃以后,试管中的氧气耗尽,铁钉的腐蚀停止;用容积较大的容器代替装置乙中的试管,分别在50
℃、60
℃、70
℃下重复上述实验
四、23.
(1)0.
2
(2)解:设黄铜样品中锌的质量分数为x。
Zn+H2SO4===ZnSO4+H2↑
65
2
20.
0
g·x
0.
2
g
= x=32.
5%
答:黄铜样品中锌的质量分数为32.
5%。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
