河北省张家口市2020-2021学年高一下学期期中考试化学试题 (Word版含答案)
文档属性
| 名称 | 河北省张家口市2020-2021学年高一下学期期中考试化学试题 (Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 506.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-10 15:03:58 | ||
图片预览

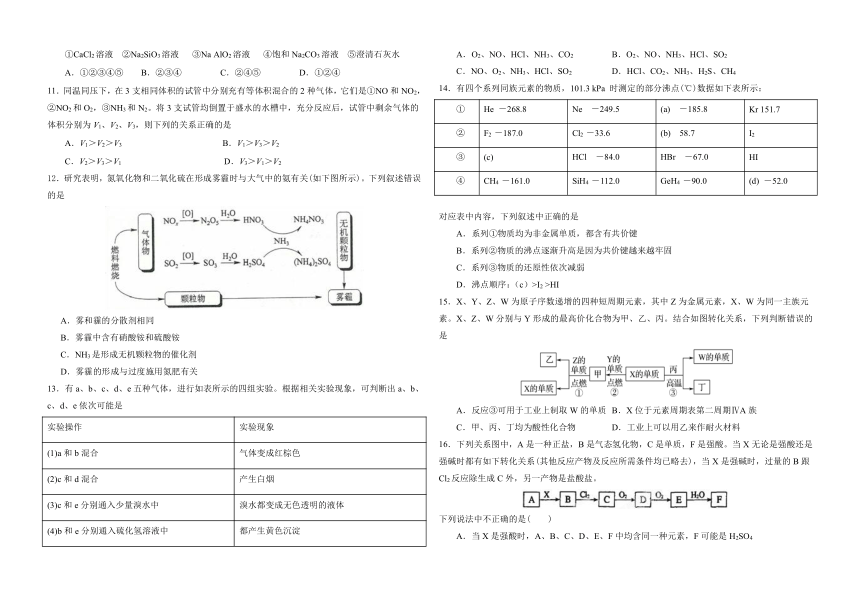
文档简介
张家口市2020-2021学年高一下学期期中考试
化
学
试
卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分,时间75分钟。
注意事项:
1.答卷前,考生务必用0.5
mm
黑色签字笔在答题卷卷头相应位置填写班级、姓名、考场、考号;在答题卡相应栏内填写自己的姓名、准考证号,并用2B铅笔将考试科目、准考证号涂写在答题卡上。
2.II卷内容须用0.5
mm
黑色签字笔写在答题卷相应空格或区域内。
可能用到的相对原子质量:
H
1,C
12,N
14,O
16,S
32,P
31,
Cl
35.5,Na
23,K
39,Ca
40,Fe
56,Cu
64
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括20个小题,每小题3分,共60分。每小题只有一个选项符合题意)
.中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法正确的是)
A.高品质的白瓷晶莹剔透,属于纯净物
B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料
C.氮化硅陶瓷属于传统无机非金属材料
D."窑变"是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化
答案:D
.人类在提高自身生活水平的同时还应关注环境问题,下列叙述不正确的是( )
A.化石燃料的高消耗、森林面积的锐减是造成大气中二氧化碳浓度增高的主要原因
B.氮氧化物和硫的氧化物都是形成酸雨的主要物质
C.冬季取暖大量燃烧煤所释放出的有害气体是造成城市光化学烟雾的最主要原因
D.当进入水体的氮的含量增大时,会造成水体的富营养化从而破坏水质
答案:C
.下列过程中,没有发生化学变化的是
A.工业上用氮气和氢气合成氨
B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C.雷雨天气氮气转化为氮的氧化物
D.液氨常用作制冷剂
答案:D
.下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
答案:B
.通常情况下气体能共存的是
A.N2、O2、SO2
B.NH3、H2、HCl
C.NO、N2、O2
D.H2S、SO2、O2
答案:A
.下列关于硝酸的叙述正确的是
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.硝酸可与活泼金属反应生成盐和氢气
C.浓硝酸显黄色是因为含有NO2
D.浓硝酸与木炭的反应既表现出氧化性又表现出酸性
答案:C
.下列有关物质用途的说法中,不正确的是
A.NH3常用作制冷剂
B.Fe3O4常用于红色油漆和涂料
C.Na2SiO3常用作制木材防火剂
D.NaHCO3常用作面粉发泡剂
答案:B
.下列说法正确的是
A.SiO2溶于水显酸性
B.石灰石是水泥工业和玻璃工业的主要原料之一
C.因为高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D.SiO2是酸性氧化物,它在常温时不溶于任何酸
答案:B
.我国是世界上唯一能够制造实用化的深紫外全固态激光器的国家,其核心材料为KBe2BO3F2(K位于ⅠA族)。下列有关说法错误的是
A.金属性:K>Be
B.非金属性:B<O<F
C.原子半径:K>Be>B>O>F
D.五种组成元素均位于短周期
答案:D
.将过量的CO2分别通入下列溶液中,最终有沉淀(或固体)析出的溶液是
①CaCl2溶液
②Na2SiO3溶液
③Na
AlO2溶液
④饱和Na2CO3溶液
⑤澄清石灰水
A.①②③④⑤
B.②③④
C.②④⑤
D.①②④
答案:B
.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列的关系正确的是
A.V1>V2>V3
B.V1>V3>V2
C.V2>V3>V1
D.V3>V1>V2
答案 B
.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
答案:C
.有a、b、c、d、e五种气体,进行如表所示的四组实验。根据相关实验现象,可判断出a、b、c、d、e依次可能是
实验操作
实验现象
(1)a和b混合
气体变成红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入硫化氢溶液中
都产生黄色沉淀
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
答案:C
.有四个系列同族元素的物质,101.3
kPa
时测定的部分沸点(℃)数据如下表所示:
①
He
-268.8
Ne
-249.5
(a)
-185.8
Kr
151.7
②
F2
-187.0
Cl2
-33.6
(b)
58.7
I2
③
(c)
HCl
-84.0
HBr
-67.0
HI
④
CH4
-161.0
SiH4
-112.0
GeH4
-90.0
(d)
-52.0
对应表中内容,下列叙述中正确的是
A.系列①物质均为非金属单质,都含有共价键
B.系列②物质的沸点逐渐升高是因为共价键越来越牢固
C.系列③物质的还原性依次减弱
D.沸点顺序:(c)>I2
>HI
答案:D
.X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是
A.反应③可用于工业上制取W的单质
B.X位于元素周期表第二周期ⅣA族
C.甲、丙、丁均为酸性化合物
D.工业上可以用乙来作耐火材料
答案:C
.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是(
)
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
答案:D
.下列实验装置不能达到实验目的的是
答案:D
.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
答案:B
.能正确表示下列反应的离子方程式是
A.向Fe(NO3)2
稀溶液中加入盐酸:3Fe2++4H++3Fe3++NO↑+2H2O
B.铜片与浓HNO3:Cu+4HNO3Cu2++2
NO2↑+2H2O
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:+OH-NH3↑+H2O
D.SO2通入BaCl2溶液中:SO2+Ba2++H2OBaSO3↓+2H+
答案:A
.在100
mL
稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4
mol/L,向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.15
mol/L
B.0.24
mol/L
C.0.28
mol/L
D.0.36
mol/L
答案:B
第Ⅱ
卷(非选择题,共40分)
二、非选择题
.实验室利用下列装置模拟工业生产制备少量硝酸。
(1)化学实验室中干燥氨气使用的试剂是
。
(2)B中反应的化学方程式为
。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)
。
A
B
C
(4)高温时,2
NO2(g)2
NO(g)+
O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2
mol
NO2分解时,反应会
(填“吸收”或“放出”)
kJ能量。
(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。产生红棕色气体的化学方程式是
,白烟的化学式是
。
答案:(每空2分,共14分)
(1)碱石灰
(2)3
NO2+H2O2HNO3+NO
(3)A
(4)吸收,113kJ
(5)2
NO+O22
NO2,NH4
NO3
.实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为
。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若
,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择
(填代号)。
a.蒸馏水
b.饱和溶液
c.饱和溶液
d.饱和溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入溶液,产生白色沉淀。
上述方案合理的是方案
(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为
。
装置E的作用是
。装置F中为
溶液。
(共16分,每空2分)(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
SO2+Cl2+2H2O4H++SO+2Cl-
(5)防止倒吸
NaOH(合理即可)
.下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
(1)上表①~⑩十种元素中金属性最强的是
,非金属性最强的是
;(填元素符号)
(2)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程
;
(3)写出元素⑥与元素⑩的形成化合物的电子式
;
(4)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式
;
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:
。
张家口市2020-2021学年高一下学期期中考试
化
学
答
案
一、选择题(本题包括20个小题,每小题3分,共60分。每小题只有一个选项符合题意)
1
2
3
4
5
6
7
8
9
10
D
C
D
B
A
C
B
B
D
B
11
12
13
14
15
16
17
18
19
20
B
C
C
D
C
D
D
B
A
B
二、非选择题
21.(每空2分,共14分)
(1)碱石灰
(2)3
NO2+H2O2HNO3+NO(其他合理答案也可)
(3)A
(4)吸收,113kJ
(5)2
NO+O22
NO2,NH4
NO3
22.(共16分,每空2分)
(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
SO2+Cl2+2H2O4H++SO+2Cl-
(5)防止倒吸
NaOH(合理即可)
23.(共10分,除第(1)问每空1分外,其余每空2分)
(1)K
Cl
(2)
(3)
SiBr4的电子式(略)
(4)3Fe
+
8H+
+
23Fe2+
+
2
NO↑
+
4H2O
(5)
Be(OH)2+2KOHK2BeO2+2H2O
答案:(共10分,除第(1)问每空1分外,其余每空2分)
(1)K
Cl
(2)
(3)
SiBr4的电子式(略)
(4)3Fe
+
8H+
+
23Fe2+
+
2
NO↑
+
4H2O
(5)
Be(OH)2+2KOHK2BeO2+2H2O
化
学
试
卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分,时间75分钟。
注意事项:
1.答卷前,考生务必用0.5
mm
黑色签字笔在答题卷卷头相应位置填写班级、姓名、考场、考号;在答题卡相应栏内填写自己的姓名、准考证号,并用2B铅笔将考试科目、准考证号涂写在答题卡上。
2.II卷内容须用0.5
mm
黑色签字笔写在答题卷相应空格或区域内。
可能用到的相对原子质量:
H
1,C
12,N
14,O
16,S
32,P
31,
Cl
35.5,Na
23,K
39,Ca
40,Fe
56,Cu
64
第Ⅰ卷(选择题,共60分)
一、选择题(本题包括20个小题,每小题3分,共60分。每小题只有一个选项符合题意)
.中国是瓷器的故乡,钧瓷是宋代五大名窑瓷器之一,以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法正确的是)
A.高品质的白瓷晶莹剔透,属于纯净物
B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料
C.氮化硅陶瓷属于传统无机非金属材料
D."窑变"是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化
答案:D
.人类在提高自身生活水平的同时还应关注环境问题,下列叙述不正确的是( )
A.化石燃料的高消耗、森林面积的锐减是造成大气中二氧化碳浓度增高的主要原因
B.氮氧化物和硫的氧化物都是形成酸雨的主要物质
C.冬季取暖大量燃烧煤所释放出的有害气体是造成城市光化学烟雾的最主要原因
D.当进入水体的氮的含量增大时,会造成水体的富营养化从而破坏水质
答案:C
.下列过程中,没有发生化学变化的是
A.工业上用氮气和氢气合成氨
B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C.雷雨天气氮气转化为氮的氧化物
D.液氨常用作制冷剂
答案:D
.下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
答案:B
.通常情况下气体能共存的是
A.N2、O2、SO2
B.NH3、H2、HCl
C.NO、N2、O2
D.H2S、SO2、O2
答案:A
.下列关于硝酸的叙述正确的是
A.NO2溶于水生成硝酸,所以NO2是酸性氧化物
B.硝酸可与活泼金属反应生成盐和氢气
C.浓硝酸显黄色是因为含有NO2
D.浓硝酸与木炭的反应既表现出氧化性又表现出酸性
答案:C
.下列有关物质用途的说法中,不正确的是
A.NH3常用作制冷剂
B.Fe3O4常用于红色油漆和涂料
C.Na2SiO3常用作制木材防火剂
D.NaHCO3常用作面粉发泡剂
答案:B
.下列说法正确的是
A.SiO2溶于水显酸性
B.石灰石是水泥工业和玻璃工业的主要原料之一
C.因为高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
D.SiO2是酸性氧化物,它在常温时不溶于任何酸
答案:B
.我国是世界上唯一能够制造实用化的深紫外全固态激光器的国家,其核心材料为KBe2BO3F2(K位于ⅠA族)。下列有关说法错误的是
A.金属性:K>Be
B.非金属性:B<O<F
C.原子半径:K>Be>B>O>F
D.五种组成元素均位于短周期
答案:D
.将过量的CO2分别通入下列溶液中,最终有沉淀(或固体)析出的溶液是
①CaCl2溶液
②Na2SiO3溶液
③Na
AlO2溶液
④饱和Na2CO3溶液
⑤澄清石灰水
A.①②③④⑤
B.②③④
C.②④⑤
D.①②④
答案:B
.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列的关系正确的是
A.V1>V2>V3
B.V1>V3>V2
C.V2>V3>V1
D.V3>V1>V2
答案 B
.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
答案:C
.有a、b、c、d、e五种气体,进行如表所示的四组实验。根据相关实验现象,可判断出a、b、c、d、e依次可能是
实验操作
实验现象
(1)a和b混合
气体变成红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入硫化氢溶液中
都产生黄色沉淀
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
答案:C
.有四个系列同族元素的物质,101.3
kPa
时测定的部分沸点(℃)数据如下表所示:
①
He
-268.8
Ne
-249.5
(a)
-185.8
Kr
151.7
②
F2
-187.0
Cl2
-33.6
(b)
58.7
I2
③
(c)
HCl
-84.0
HBr
-67.0
HI
④
CH4
-161.0
SiH4
-112.0
GeH4
-90.0
(d)
-52.0
对应表中内容,下列叙述中正确的是
A.系列①物质均为非金属单质,都含有共价键
B.系列②物质的沸点逐渐升高是因为共价键越来越牢固
C.系列③物质的还原性依次减弱
D.沸点顺序:(c)>I2
>HI
答案:D
.X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是
A.反应③可用于工业上制取W的单质
B.X位于元素周期表第二周期ⅣA族
C.甲、丙、丁均为酸性化合物
D.工业上可以用乙来作耐火材料
答案:C
.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是(
)
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
答案:D
.下列实验装置不能达到实验目的的是
答案:D
.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
答案:B
.能正确表示下列反应的离子方程式是
A.向Fe(NO3)2
稀溶液中加入盐酸:3Fe2++4H++3Fe3++NO↑+2H2O
B.铜片与浓HNO3:Cu+4HNO3Cu2++2
NO2↑+2H2O
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:+OH-NH3↑+H2O
D.SO2通入BaCl2溶液中:SO2+Ba2++H2OBaSO3↓+2H+
答案:A
.在100
mL
稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4
mol/L,向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.15
mol/L
B.0.24
mol/L
C.0.28
mol/L
D.0.36
mol/L
答案:B
第Ⅱ
卷(非选择题,共40分)
二、非选择题
.实验室利用下列装置模拟工业生产制备少量硝酸。
(1)化学实验室中干燥氨气使用的试剂是
。
(2)B中反应的化学方程式为
。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)
。
A
B
C
(4)高温时,2
NO2(g)2
NO(g)+
O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2
mol
NO2分解时,反应会
(填“吸收”或“放出”)
kJ能量。
(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。产生红棕色气体的化学方程式是
,白烟的化学式是
。
答案:(每空2分,共14分)
(1)碱石灰
(2)3
NO2+H2O2HNO3+NO
(3)A
(4)吸收,113kJ
(5)2
NO+O22
NO2,NH4
NO3
.实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为
。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若
,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择
(填代号)。
a.蒸馏水
b.饱和溶液
c.饱和溶液
d.饱和溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入溶液,产生白色沉淀。
上述方案合理的是方案
(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为
。
装置E的作用是
。装置F中为
溶液。
(共16分,每空2分)(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
SO2+Cl2+2H2O4H++SO+2Cl-
(5)防止倒吸
NaOH(合理即可)
.下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
(1)上表①~⑩十种元素中金属性最强的是
,非金属性最强的是
;(填元素符号)
(2)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程
;
(3)写出元素⑥与元素⑩的形成化合物的电子式
;
(4)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式
;
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:
。
张家口市2020-2021学年高一下学期期中考试
化
学
答
案
一、选择题(本题包括20个小题,每小题3分,共60分。每小题只有一个选项符合题意)
1
2
3
4
5
6
7
8
9
10
D
C
D
B
A
C
B
B
D
B
11
12
13
14
15
16
17
18
19
20
B
C
C
D
C
D
D
B
A
B
二、非选择题
21.(每空2分,共14分)
(1)碱石灰
(2)3
NO2+H2O2HNO3+NO(其他合理答案也可)
(3)A
(4)吸收,113kJ
(5)2
NO+O22
NO2,NH4
NO3
22.(共16分,每空2分)
(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
SO2+Cl2+2H2O4H++SO+2Cl-
(5)防止倒吸
NaOH(合理即可)
23.(共10分,除第(1)问每空1分外,其余每空2分)
(1)K
Cl
(2)
(3)
SiBr4的电子式(略)
(4)3Fe
+
8H+
+
23Fe2+
+
2
NO↑
+
4H2O
(5)
Be(OH)2+2KOHK2BeO2+2H2O
答案:(共10分,除第(1)问每空1分外,其余每空2分)
(1)K
Cl
(2)
(3)
SiBr4的电子式(略)
(4)3Fe
+
8H+
+
23Fe2+
+
2
NO↑
+
4H2O
(5)
Be(OH)2+2KOHK2BeO2+2H2O
同课章节目录
