第1章第3节怎样学习和研究化学第2课时化学实验基本操作课件-2021-2022学年九年级化学沪教版上册(共24张PPT)
文档属性
| 名称 | 第1章第3节怎样学习和研究化学第2课时化学实验基本操作课件-2021-2022学年九年级化学沪教版上册(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-10 20:25:08 | ||
图片预览








文档简介
(共24张PPT)
2021.9.9
第3节
怎样学习和研究化学
第2课时
化学实验基本操作
化
学
实
验
学习目标
药品的取用
药品的加热
仪器的洗涤
……
化学实验中要注意观察和记录实验现象,观察的内容包括:
变化前
变化中
变化后
原物质的颜色、状态、气味等
变化过程中产生的现象:如物质的状态与颜色的变化、发光、发热、形成烟、雾和放出气体等
生成新物质的颜色、状态、气味等
铜
Cu
青铜器
电路板
铜制鼻托
你知道吗?
久置的铜器表面会有一层绿色的“外衣”
绿色的外衣是什么?它用水可以除去吗?它怕热吗?
“铜绿”的化学性质
探究“铜绿”
的性质
“铜绿”的物理性质
1.主要物理性质:
颜色、状态、溶解性
探究“铜绿”的性质
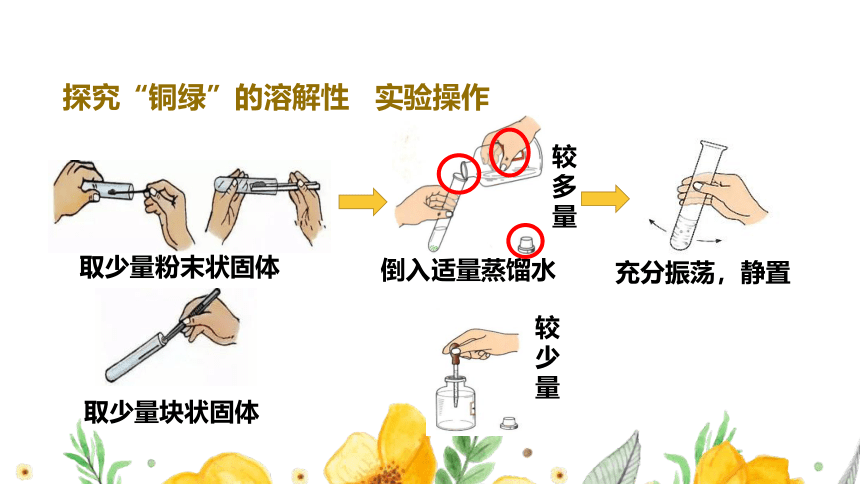
探究“铜绿”的溶解性
实验操作
取少量粉末状固体
倒入适量蒸馏水
充分振荡,静置
取少量块状固体
较多量
较少量
取少量粉末状固体
倒入适量蒸馏水
充分振荡,静置
较多量
现象:
浑浊
结论:
“铜绿”难溶于水
探究“铜绿”的溶解性
实验操作
1.主要物理性质:
绿色粉末状固体
难溶于水
探究“铜绿”的性质
2.
主要化学性质:
(1)“铜绿”能否与稀盐酸反应?
(2)“铜绿”受热后是否发生反应?
探究“铜绿”的性质
(1)“铜绿”与稀盐酸作用
实验操作
先固后液
取少量“铜绿”
倒入适量稀盐酸
振荡后观察现象
(1)“铜绿”能否与稀盐酸反应?
探究“铜绿”的性质
实验现象:
“铜绿”逐渐消失
产生大量气泡
溶液由无色变为蓝色
实验结论:
“铜绿”能与稀盐酸反应
(1)“铜绿”与稀盐酸作用
生活中常用酸溶液可除去铜器表面的绿色物质
化学变化
2.
主要化学性质:
(2)“铜绿”受热后是否发生反应?
探究“铜绿”的性质
(2)加热“铜绿”
实验操作
取少量固体
先下后上,先左后右
组装仪器并加热
先均匀受热,再对准药品部位集中加热
平铺
试管口略向下倾斜
(2)“铜绿”受热后是否发生反应?
试管中药品加热实验操作对比
加热固体
加热液体
略向下倾斜
45度
小于1/3
45度
实验现象:
固体由绿色逐渐变为黑色
试管口有水滴出现
(2)“铜绿”
受热后的变化
澄清石灰水
澄清石灰水变浑浊
实验结论:
“铜绿”受热会分解
(氧化铜)
(水)
(二氧化碳)
润湿
旋转
“铜绿”是由铜、氢、氧、碳等元素组成。
“铜绿”的主要成分是:碱式碳酸铜。
铜绿
碱式碳酸铜
+水
氧化铜
+二氧化碳
加热
文字表达式:
(2)“铜绿”
受热后的变化
通过上述实验,你对“铜绿”的性质有什么认识?
1.主要成分为:碱式碳酸铜
2.物理性质:
绿色粉末状固体,难溶于水
3.化学性质:
(1)能与稀盐酸反应
(2)受热会分解
碱
式
碳
酸
铜
通过上述实验,学习了哪些实验基本操作?
药品的取用
药品的加热
废物的处理
仪器的洗涤
指定的容器
容器内壁有均匀水膜
化学实验通常在实验室里进行,实验室配备有化学实验仪器(见附录一)和化学试剂(药品)。进行化学实验要注意实验安全,遵守实验规则和安全要求(见附录二),养成良好的实验习惯。
耳闻不如一见
一见不如实验
2021.9.9
第3节
怎样学习和研究化学
第2课时
化学实验基本操作
化
学
实
验
学习目标
药品的取用
药品的加热
仪器的洗涤
……
化学实验中要注意观察和记录实验现象,观察的内容包括:
变化前
变化中
变化后
原物质的颜色、状态、气味等
变化过程中产生的现象:如物质的状态与颜色的变化、发光、发热、形成烟、雾和放出气体等
生成新物质的颜色、状态、气味等
铜
Cu
青铜器
电路板
铜制鼻托
你知道吗?
久置的铜器表面会有一层绿色的“外衣”
绿色的外衣是什么?它用水可以除去吗?它怕热吗?
“铜绿”的化学性质
探究“铜绿”
的性质
“铜绿”的物理性质
1.主要物理性质:
颜色、状态、溶解性
探究“铜绿”的性质
探究“铜绿”的溶解性
实验操作
取少量粉末状固体
倒入适量蒸馏水
充分振荡,静置
取少量块状固体
较多量
较少量
取少量粉末状固体
倒入适量蒸馏水
充分振荡,静置
较多量
现象:
浑浊
结论:
“铜绿”难溶于水
探究“铜绿”的溶解性
实验操作
1.主要物理性质:
绿色粉末状固体
难溶于水
探究“铜绿”的性质
2.
主要化学性质:
(1)“铜绿”能否与稀盐酸反应?
(2)“铜绿”受热后是否发生反应?
探究“铜绿”的性质
(1)“铜绿”与稀盐酸作用
实验操作
先固后液
取少量“铜绿”
倒入适量稀盐酸
振荡后观察现象
(1)“铜绿”能否与稀盐酸反应?
探究“铜绿”的性质
实验现象:
“铜绿”逐渐消失
产生大量气泡
溶液由无色变为蓝色
实验结论:
“铜绿”能与稀盐酸反应
(1)“铜绿”与稀盐酸作用
生活中常用酸溶液可除去铜器表面的绿色物质
化学变化
2.
主要化学性质:
(2)“铜绿”受热后是否发生反应?
探究“铜绿”的性质
(2)加热“铜绿”
实验操作
取少量固体
先下后上,先左后右
组装仪器并加热
先均匀受热,再对准药品部位集中加热
平铺
试管口略向下倾斜
(2)“铜绿”受热后是否发生反应?
试管中药品加热实验操作对比
加热固体
加热液体
略向下倾斜
45度
小于1/3
45度
实验现象:
固体由绿色逐渐变为黑色
试管口有水滴出现
(2)“铜绿”
受热后的变化
澄清石灰水
澄清石灰水变浑浊
实验结论:
“铜绿”受热会分解
(氧化铜)
(水)
(二氧化碳)
润湿
旋转
“铜绿”是由铜、氢、氧、碳等元素组成。
“铜绿”的主要成分是:碱式碳酸铜。
铜绿
碱式碳酸铜
+水
氧化铜
+二氧化碳
加热
文字表达式:
(2)“铜绿”
受热后的变化
通过上述实验,你对“铜绿”的性质有什么认识?
1.主要成分为:碱式碳酸铜
2.物理性质:
绿色粉末状固体,难溶于水
3.化学性质:
(1)能与稀盐酸反应
(2)受热会分解
碱
式
碳
酸
铜
通过上述实验,学习了哪些实验基本操作?
药品的取用
药品的加热
废物的处理
仪器的洗涤
指定的容器
容器内壁有均匀水膜
化学实验通常在实验室里进行,实验室配备有化学实验仪器(见附录一)和化学试剂(药品)。进行化学实验要注意实验安全,遵守实验规则和安全要求(见附录二),养成良好的实验习惯。
耳闻不如一见
一见不如实验
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
