二氧化硫
图片预览







文档简介
(共27张PPT)
二 氧 化 硫
一、二氧化硫的性质
(一)、物理性质
无色,有刺激性气味的有毒气体,密度比空气大,易液化(沸点是-10 oC),易溶于水(常温常压下一体积水能溶解40体积的二氧化硫).
【讨论】
实验室制SO2 气体,应注意什么?该如何收集?石蕊试液为什么会变红?
【答案】: 实验室制SO2应防止污染空气!用向上排空气法收集,尾气要吸收(用什么吸收 )。说明SO2溶于水使溶液呈酸性。
(二)、化学性质
1、具有酸性氧化物的通性
(1)、与H2O反应
(2)、与碱反应
SO2+2NaOH=Na2SO3+H2O
实验室制取SO2,选择碱液吸收尾气,防止空气污 染。
亚硫酸是一种不稳定酸,易分解成SO2、H2O。
SO2+H2O H2SO3
【讨论】硫有哪些常见化合价? 根据化合价推测 SO2除具有酸性氧化物的通性外,还应具有的性质。
2、具有还原性
思考:为什么SO2可以使氯水、溴水、碘水褪色?
(2)、SO2+X2+2H2O=H2SO4+2HX
化合价上升,被氧化
化合价降低,被还原
(1)SO2 + H2O2 = H2SO4
2SO2 + O2 = 2SO3
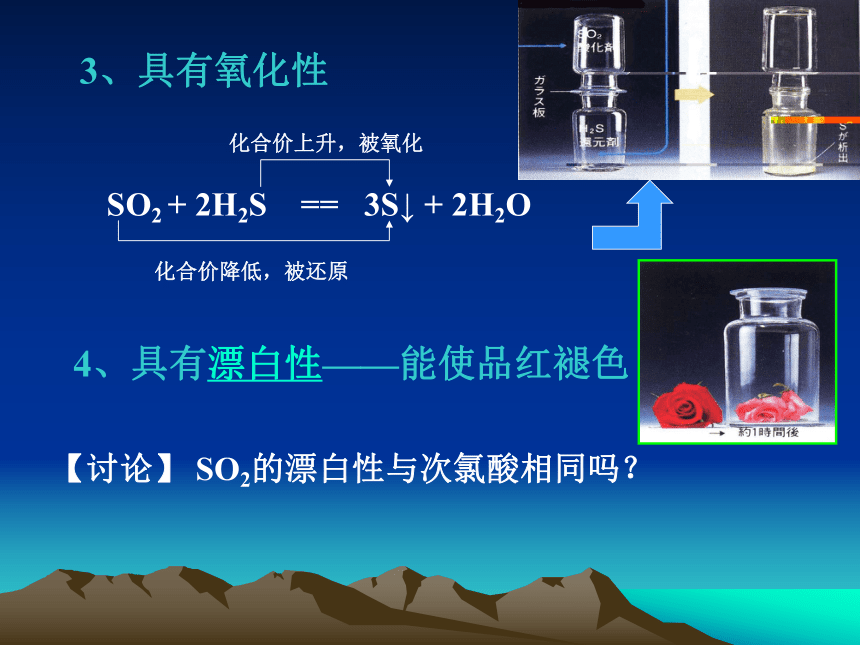
3、具有氧化性
4、具有漂白性——能使品红褪色
【讨论】 SO2的漂白性与次氯酸相同吗?
SO2 + 2H2S == 3S↓ + 2H2O
化合价上升,被氧化
化合价降低,被还原
【SO2的特殊化学性质】
它能与某些有色物质化合成不稳定的无色物质而具有漂白性.它可以用来漂白纸浆、毛、丝、草编制品等。
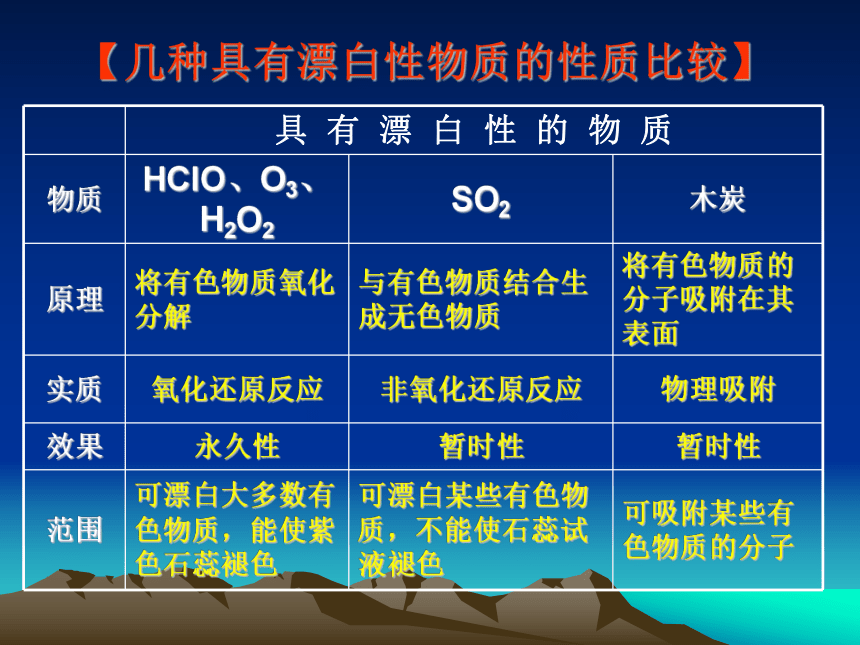
【几种具有漂白性物质的性质比较】
具 有 漂 白 性 的 物 质
物质 HClO、O3、H2O2 SO2 木炭
原理 将有色物质氧化分解 与有色物质结合生成无色物质 将有色物质的分子吸附在其表面
实质 氧化还原反应 非氧化还原反应 物理吸附
效果 永久性 暂时性 暂时性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
【讨论】氯水和SO2都具有漂白作用,则将1molSO2和1molCl2通入同一容器水中,所得溶液的漂白作用加强吗?
提示:SO2+Cl2+2H2O=H2SO4+2HCl
此外,二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂
【讨论】 SO2可以使溴水褪色和SO2使品红褪色原理一样吗?
提示:前者是表现还原性,后者是表现漂 白性。
SO2与澄清石灰水反应与CO2类似。试判断SO2通入澄清石灰水直至过量有何现象,并写出反应方程式。
【讨论】
SO2与CO2怎样鉴别?
提示:利用SO2的漂白性。
(2)、北方市场上,经常见有外面非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜
(1)、为什么长时间放置的报纸和草帽会变黄?
你知道吗?
稀H2SO4
Na2SO3
石灰水
溴水
KMnO4溶液
品红
NaOH溶液
【思考】:
1、发生装置与制Cl2有什么不同?为何有这种不同?
2、尾气处理装置与Cl2的有什么不同?为什么?
【实验探究】
【实验现象及解释】
1、石灰水变浑浊,持续通入,溶液又变澄清。
2、溴水橙色褪去,滴加BaCl2,生成不溶于HNO3白色沉淀。
3、KMnO4溶液的紫红色褪色。
4、品红溶液红色褪色,加热溶液,又恢复原来的红色。
SO2能和Ca(OH)2反应,生成白色不溶物。
SO2被Br2氧化,从而使溶液颜色消失。
SO2具有还原性,被KMnO4氧化,溶液颜色褪去。
SO2能和有色物质结合生成无色不稳定的物质,因此
具有漂白性。
化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
【小结】
二、二氧化硫对环境的污染
空气中的二氧化硫主要来自于化石燃料煤与石油的燃烧、含硫矿石的冶炼以及制造硫酸、磷肥、纸浆等产生的废气。
1、酸雨的概念:
主要指pH值小于5.6的雨水,其主要是含有硫酸和硝酸。
【概念的提出】:1852年英国化学家史密斯发现工业化城市曼彻斯特上空的烟尘污染与雨水的酸性有一定的关系,并于1872年编著的科学著作中首次采用了“酸雨”这一术语。
2、酸雨成因:自然和人为向大气中排放污染物。
酸性污染物
湿沉降
干沉降
【酸雨的形成】
3、酸雨的危害:
故宫太和殿台阶的栏杆上雕刻着各式各样精美浮雕花纹还清晰可见,而现在却模糊不清;巫山在一场大雨过后, 整个山体上暴露的石块全部被腐蚀近1厘米;重庆面山的2.7万亩马尾松死亡过半;……..
1、对人体的直接危害,首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死;
2、引起河流、湖泊的水体酸化,严重影响水生动物生长;
3、破坏土壤、植被、森林;
4、腐蚀金属、油漆、皮革、纺织品及建筑材料等;
5、渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
小 结
4、 我国的酸雨特征:
(1)、主要为硫酸及硫酸盐雨。
(2)、发展速度很快。
(3)、在23个调查的省、市及自治区中有20个出现过酸雨,有不少地区的酸雨已相当严重且逐年增加,据2001年4月9日南京晨报报导:国家环保总局局长解振华讲我国相当多的城市空气污染程度超标,酸雨区面积为国土面积的30%,全国七大水系中有1/3的河段达不到使用功能要求……
(4 )、区域性:西南、中南、华东地区,由北向南加重。
5、如何控制酸雨?
1972年6月5日,具有历史意义的人类环境会议在瑞典首都斯德哥尔摩召开,通过了著名的《人类环境宣言》,并确定每年6月5日为“世界环境日”。
6、主要措施:
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理,如 :选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理以回收SO2.
3、种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等。
省份 2005年排放量(万吨) 2010年分配 (万吨)
全省,其中电力 削减比例(%) 省份 2005年排放量(万吨) 2010年分配 (万吨)
全省,其中电力 削减比例(%)
北京 19.1 15.2 5.0 -20.4 河南 162.5 139.7 73.8 -14.0
天津 26.5 24.0 13.1 -9.4 湖北 71.7 66.1 31.0 -7.8
河北 149.6 127.1 48.1 -15.0 湖南 91.9 83.6 19.6 -9.0
山西 151.6 130.4 59.3 -14.0 广东 129.4 110.0 55.4 -15.0
内蒙古 145.6 140.0 68.7 -3.8 海南 2.2 2.2 1.6 0.0
辽宁 119.7 105.3 37.2 -12.0 广西 102.3 92.2 21.0 -9.9
吉林 38.2 36.4 18.2 -4.7 四川 129.9 114.4 39.5 -11.9
黑龙江 50.8 49.8 33.3 -2.0 重庆 83.7 73.7 17.6 -11.9
上海 51.3 38.0 13.4 -25.9 贵州 135.8 115.4 35.8 -15.0
江苏 137.3 112.6 55.0 -18.0 云南 52.2 50.1 25.3 -4.0
浙江 86.0 73.1 41.9 -15.0 陕西 92.2 81.1 31.2 -12.0
安徽 57.1 54.8 35.7 -4.0 甘肃 56.3 56.3 19.0 0.0
福建 46.1 42.4 17.3 -8.0 青海 12.4 12.4 6.2 0.0
江西 61.3 57.0 19.9 -7.0 宁夏 34.3 31.1 16.2 -9.3
山东 200.3 160.2 75.7 -20.0 新疆 51.9 51.9 16.6 0.0
全国二氧化硫削减10%的总量控制指标为2294.4万吨,实际分配2246.7万吨,国家预留47.7。
【2010年我国二氧化硫总量分配表】
1.下列试剂能否用来鉴别CO2和SO2两瓶气体 为什么
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液 ( )
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不会有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2 说明你的理由.(浓硫酸具强氧化性)
B.C
【答案】 能。因为硫元素在+4和+6价之间无其它的化合价,因此这两者之间不能发生氧化还原反应.即含同种元素两种物质间若不存在中间价态时,它们就不能发生氧化还原反应.
A、E
【练习】
4、一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
(1).请你写出酸雨开始呈酸性的化学方程式.
(2).这种雨水的pH值逐渐减小,其原因何在
(提示:从硫元素的化合价和酸性强弱方面考虑)
测试时间 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH值 4.74 4.63 4.57 4.53 4.53
【答案】 SO2+H2O=H2SO3 ; SO3+H2O=H2SO4
O2+2H2SO3= 2H2SO4
【答案】 空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3氧化成强酸硫酸.
5、某工厂所用的燃料为含硫煤,为防止污染环境和回收SO2,采取将燃烧产生烟道气通入石灰浆的方法,采用这种方法回收效率达95%[如用石灰石代替石灰浆则回收效率也能达到85-90%],您能分析其中的原理吗
【答案】
CaO+SO2=CaSO3
Ca(OH)2+SO2=CaSO3 +H2O
2CaSO3+O2=2CaSO4
【课堂小结】
SO2
1、物理性质
2、化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
祝大家一
切如意!
二 氧 化 硫
一、二氧化硫的性质
(一)、物理性质
无色,有刺激性气味的有毒气体,密度比空气大,易液化(沸点是-10 oC),易溶于水(常温常压下一体积水能溶解40体积的二氧化硫).
【讨论】
实验室制SO2 气体,应注意什么?该如何收集?石蕊试液为什么会变红?
【答案】: 实验室制SO2应防止污染空气!用向上排空气法收集,尾气要吸收(用什么吸收 )。说明SO2溶于水使溶液呈酸性。
(二)、化学性质
1、具有酸性氧化物的通性
(1)、与H2O反应
(2)、与碱反应
SO2+2NaOH=Na2SO3+H2O
实验室制取SO2,选择碱液吸收尾气,防止空气污 染。
亚硫酸是一种不稳定酸,易分解成SO2、H2O。
SO2+H2O H2SO3
【讨论】硫有哪些常见化合价? 根据化合价推测 SO2除具有酸性氧化物的通性外,还应具有的性质。
2、具有还原性
思考:为什么SO2可以使氯水、溴水、碘水褪色?
(2)、SO2+X2+2H2O=H2SO4+2HX
化合价上升,被氧化
化合价降低,被还原
(1)SO2 + H2O2 = H2SO4
2SO2 + O2 = 2SO3
3、具有氧化性
4、具有漂白性——能使品红褪色
【讨论】 SO2的漂白性与次氯酸相同吗?
SO2 + 2H2S == 3S↓ + 2H2O
化合价上升,被氧化
化合价降低,被还原
【SO2的特殊化学性质】
它能与某些有色物质化合成不稳定的无色物质而具有漂白性.它可以用来漂白纸浆、毛、丝、草编制品等。
【几种具有漂白性物质的性质比较】
具 有 漂 白 性 的 物 质
物质 HClO、O3、H2O2 SO2 木炭
原理 将有色物质氧化分解 与有色物质结合生成无色物质 将有色物质的分子吸附在其表面
实质 氧化还原反应 非氧化还原反应 物理吸附
效果 永久性 暂时性 暂时性
范围 可漂白大多数有色物质,能使紫色石蕊褪色 可漂白某些有色物质,不能使石蕊试液褪色 可吸附某些有色物质的分子
【讨论】氯水和SO2都具有漂白作用,则将1molSO2和1molCl2通入同一容器水中,所得溶液的漂白作用加强吗?
提示:SO2+Cl2+2H2O=H2SO4+2HCl
此外,二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂
【讨论】 SO2可以使溴水褪色和SO2使品红褪色原理一样吗?
提示:前者是表现还原性,后者是表现漂 白性。
SO2与澄清石灰水反应与CO2类似。试判断SO2通入澄清石灰水直至过量有何现象,并写出反应方程式。
【讨论】
SO2与CO2怎样鉴别?
提示:利用SO2的漂白性。
(2)、北方市场上,经常见有外面非常白而里面却是黄的馒头和粉丝,里外不一样,它的做法是在一个封闭的容器中先放入馒头或粉丝,再放入燃烧着的硫后熏一下而得到的,您能否马上就食用或用来做菜
(1)、为什么长时间放置的报纸和草帽会变黄?
你知道吗?
稀H2SO4
Na2SO3
石灰水
溴水
KMnO4溶液
品红
NaOH溶液
【思考】:
1、发生装置与制Cl2有什么不同?为何有这种不同?
2、尾气处理装置与Cl2的有什么不同?为什么?
【实验探究】
【实验现象及解释】
1、石灰水变浑浊,持续通入,溶液又变澄清。
2、溴水橙色褪去,滴加BaCl2,生成不溶于HNO3白色沉淀。
3、KMnO4溶液的紫红色褪色。
4、品红溶液红色褪色,加热溶液,又恢复原来的红色。
SO2能和Ca(OH)2反应,生成白色不溶物。
SO2被Br2氧化,从而使溶液颜色消失。
SO2具有还原性,被KMnO4氧化,溶液颜色褪去。
SO2能和有色物质结合生成无色不稳定的物质,因此
具有漂白性。
化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
【小结】
二、二氧化硫对环境的污染
空气中的二氧化硫主要来自于化石燃料煤与石油的燃烧、含硫矿石的冶炼以及制造硫酸、磷肥、纸浆等产生的废气。
1、酸雨的概念:
主要指pH值小于5.6的雨水,其主要是含有硫酸和硝酸。
【概念的提出】:1852年英国化学家史密斯发现工业化城市曼彻斯特上空的烟尘污染与雨水的酸性有一定的关系,并于1872年编著的科学著作中首次采用了“酸雨”这一术语。
2、酸雨成因:自然和人为向大气中排放污染物。
酸性污染物
湿沉降
干沉降
【酸雨的形成】
3、酸雨的危害:
故宫太和殿台阶的栏杆上雕刻着各式各样精美浮雕花纹还清晰可见,而现在却模糊不清;巫山在一场大雨过后, 整个山体上暴露的石块全部被腐蚀近1厘米;重庆面山的2.7万亩马尾松死亡过半;……..
1、对人体的直接危害,首先是它的刺激性,其次是它会形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部,引起肺水肿等疾病而使人致死;
2、引起河流、湖泊的水体酸化,严重影响水生动物生长;
3、破坏土壤、植被、森林;
4、腐蚀金属、油漆、皮革、纺织品及建筑材料等;
5、渗入地下,可引起地下水酸化,酸化后的地下水中铝、铜、锌、镉等对人体有害金属元素的含量会偏高。
小 结
4、 我国的酸雨特征:
(1)、主要为硫酸及硫酸盐雨。
(2)、发展速度很快。
(3)、在23个调查的省、市及自治区中有20个出现过酸雨,有不少地区的酸雨已相当严重且逐年增加,据2001年4月9日南京晨报报导:国家环保总局局长解振华讲我国相当多的城市空气污染程度超标,酸雨区面积为国土面积的30%,全国七大水系中有1/3的河段达不到使用功能要求……
(4 )、区域性:西南、中南、华东地区,由北向南加重。
5、如何控制酸雨?
1972年6月5日,具有历史意义的人类环境会议在瑞典首都斯德哥尔摩召开,通过了著名的《人类环境宣言》,并确定每年6月5日为“世界环境日”。
6、主要措施:
1、改善燃料种类,积极开发新能源;
2、对煤(其中含硫为0.3%-5%)进行处理,如 :选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理以回收SO2.
3、种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等。
省份 2005年排放量(万吨) 2010年分配 (万吨)
全省,其中电力 削减比例(%) 省份 2005年排放量(万吨) 2010年分配 (万吨)
全省,其中电力 削减比例(%)
北京 19.1 15.2 5.0 -20.4 河南 162.5 139.7 73.8 -14.0
天津 26.5 24.0 13.1 -9.4 湖北 71.7 66.1 31.0 -7.8
河北 149.6 127.1 48.1 -15.0 湖南 91.9 83.6 19.6 -9.0
山西 151.6 130.4 59.3 -14.0 广东 129.4 110.0 55.4 -15.0
内蒙古 145.6 140.0 68.7 -3.8 海南 2.2 2.2 1.6 0.0
辽宁 119.7 105.3 37.2 -12.0 广西 102.3 92.2 21.0 -9.9
吉林 38.2 36.4 18.2 -4.7 四川 129.9 114.4 39.5 -11.9
黑龙江 50.8 49.8 33.3 -2.0 重庆 83.7 73.7 17.6 -11.9
上海 51.3 38.0 13.4 -25.9 贵州 135.8 115.4 35.8 -15.0
江苏 137.3 112.6 55.0 -18.0 云南 52.2 50.1 25.3 -4.0
浙江 86.0 73.1 41.9 -15.0 陕西 92.2 81.1 31.2 -12.0
安徽 57.1 54.8 35.7 -4.0 甘肃 56.3 56.3 19.0 0.0
福建 46.1 42.4 17.3 -8.0 青海 12.4 12.4 6.2 0.0
江西 61.3 57.0 19.9 -7.0 宁夏 34.3 31.1 16.2 -9.3
山东 200.3 160.2 75.7 -20.0 新疆 51.9 51.9 16.6 0.0
全国二氧化硫削减10%的总量控制指标为2294.4万吨,实际分配2246.7万吨,国家预留47.7。
【2010年我国二氧化硫总量分配表】
1.下列试剂能否用来鉴别CO2和SO2两瓶气体 为什么
A.品红溶液 B.澄清的石灰水 C.氯化钙溶液 ( )
D.紫色石蕊试液 E.氯化钡和氯水的混合溶液
2.能吸收SO2气体但不会有沉淀产生的溶液是( )
A.Ba(OH)2 B.NaOH C.Na2CO3 D.NaHSO3
3.SO2既具有氧化性又具有还原性,请你判断能否用浓硫
酸来干燥SO2 说明你的理由.(浓硫酸具强氧化性)
B.C
【答案】 能。因为硫元素在+4和+6价之间无其它的化合价,因此这两者之间不能发生氧化还原反应.即含同种元素两种物质间若不存在中间价态时,它们就不能发生氧化还原反应.
A、E
【练习】
4、一个城市的环保部门采集了一份雨水样品,每隔一段时间
测定一次pH值,其结果如下:
(1).请你写出酸雨开始呈酸性的化学方程式.
(2).这种雨水的pH值逐渐减小,其原因何在
(提示:从硫元素的化合价和酸性强弱方面考虑)
测试时间 0小时后 1小时后 2小时后 4小时后 5小时后
雨水的pH值 4.74 4.63 4.57 4.53 4.53
【答案】 SO2+H2O=H2SO3 ; SO3+H2O=H2SO4
O2+2H2SO3= 2H2SO4
【答案】 空气中的氧气在灰尘等存在下能够逐渐将水中的H2SO3氧化成强酸硫酸.
5、某工厂所用的燃料为含硫煤,为防止污染环境和回收SO2,采取将燃烧产生烟道气通入石灰浆的方法,采用这种方法回收效率达95%[如用石灰石代替石灰浆则回收效率也能达到85-90%],您能分析其中的原理吗
【答案】
CaO+SO2=CaSO3
Ca(OH)2+SO2=CaSO3 +H2O
2CaSO3+O2=2CaSO4
【课堂小结】
SO2
1、物理性质
2、化学性质
酸性氧化物的通性
还原性
氧化性
漂白性
祝大家一
切如意!
