2.4 化学反应的调控 课时同步训练 2021-2022学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4 化学反应的调控 课时同步训练 2021-2022学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 914.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-12 21:12:57 | ||
图片预览




文档简介
2.4课时
化学反应的调控
一、选择题(本大题共14小题,每小题所给的4个选项,只有一个答案符合题目要求。)
1.压强变化不会使下列化学反应的平衡发生移动的是(
)
2.可逆反应达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)(
)
A.Q不变,K变大,O2的转化率增大
B.Q不变,K变大,SO2的转化率减小
C.Q减小,K不变,O2的转化率减小
D.Q增大,K不变,SO2的转化率增大
3.下列关于工业合成氨的叙述错误的是(
)
A.在动力、设备,材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中,N2、H2的循环利用可降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
4.铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的变化关系如图所示。下列说法正确的是(
)
A.a点为平衡状态
B.b点和c点时反应处于平衡状态
C.该反应的化学平衡常数K=
D.若温度升高,该反应的化学平衡常数K增大,则该反应的△H<0
5.已知可逆反应A+aBC+2D(a为化学计量数),其中B、C、D为气态物质。反应过程中,当其他条件不变时,C的体积分数(φ)与温度(T)和压强(p)的关系如图甲、乙所示。下列说法不正确的是(
)
A.T2>T1,p2>p1
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应△H的绝对值增大
6.已知。温度为T1时,该反应的平衡常数K(T1)=43;温度为T2时,
K(T2)=48.74。下列说法错误的是(
)
A.该反应为放热反应
B.T1到T2是降温过程
C.T1时,增大c(H2),K(T1)不变
D.T2时,I2(g)的转化率比T1时小
7.已知:2CH3OH(g)
CH3OCH3(g)+H2O(g)
ΔH=-25
kJ·mol-1某温度下的平衡常数为400。此温度下,在1
L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质
CH3OH
CH3OCH3
H2O
c/(mol·L-1)
0.8
1.24
1.24
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,CH3OCH3浓度为1.6
mol·L-1
③平衡时,反应混合物的总能量减少20
kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08
mol·L-1
A.②⑥
B.②④⑥
C.①②④⑤
D.②③④⑥
8.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)
C2H5OH(g)
ΔH。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1
mol;a点容器体积为1
L]。下列分析不正确的是( )
A.乙烯气相直接水合反应的ΔH<0
B.图中a点对应的平衡常数K=L·mol-1
C.图中压强的大小关系为:p1>p2>p3
D.达到平衡状态a、b所需要的时间:a>b
9.下列事实不能用平衡移动原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由、、组成的平衡体系通过缩小体积加压后颜色变深
C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的转化率
10.一定条件下存在反应
C(s)+H2O(g)CO(g)+H2(g)
ΔH>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是(
)
容器
甲
乙
丙
容积
0.5L
0.5L
V
温度
T1℃
T2℃
T1℃
起始量
2molC
1molH2O
1molCO
1molH2
4molC
2molH2O
A.甲容器中,反应在前15min的平均速率v(H2)=0.1mol·L-1·min-1
B.乙容器中,若平衡时n(H2O)=0.4mol,则T2C.当温度为T1℃时,反应的平衡常数K=4.5
D.丙容器的体积V>0.5L
11.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变一个反应条件,测得容器中各物质的浓度、反应速率随时间的变化曲线如图1、2所示:下列说法正确的是(
)
A.30min时降低温度,40min时升高温度
B.0~8min内A的平均反应速率为0.16mol?L-1?min-1
C.化学方程式中的x=1,正反应为吸热反应
D.20~40min内该反应的平衡常数恒为4
12.对于反应,在一密闭容器中加入一定量的和,达到平衡时混合气体的压强为,并使容器体积保持不变,迅速缩小容器体积使混合气体的压强变为,一段时间后达到新的平衡,此时混合气体的压强为,则、、的大小关系是(
)
A.
B.
C.
D.
13.在一体积不变的密闭容器中充入2molNH3,并放入一定量的Fe2O3,发生化学反应:Fe2O3(s)+2NH3(g)2Fe(s)+N2(g)+3H2O(g)
△H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×该气体的物质的量分数。下列说法错误的是(
)
A.该反应的△H>0
B.气体压强:p2>p1
C.平衡后再加入Fe2O3,NH3的转化率增大
D.M点的平衡常K=
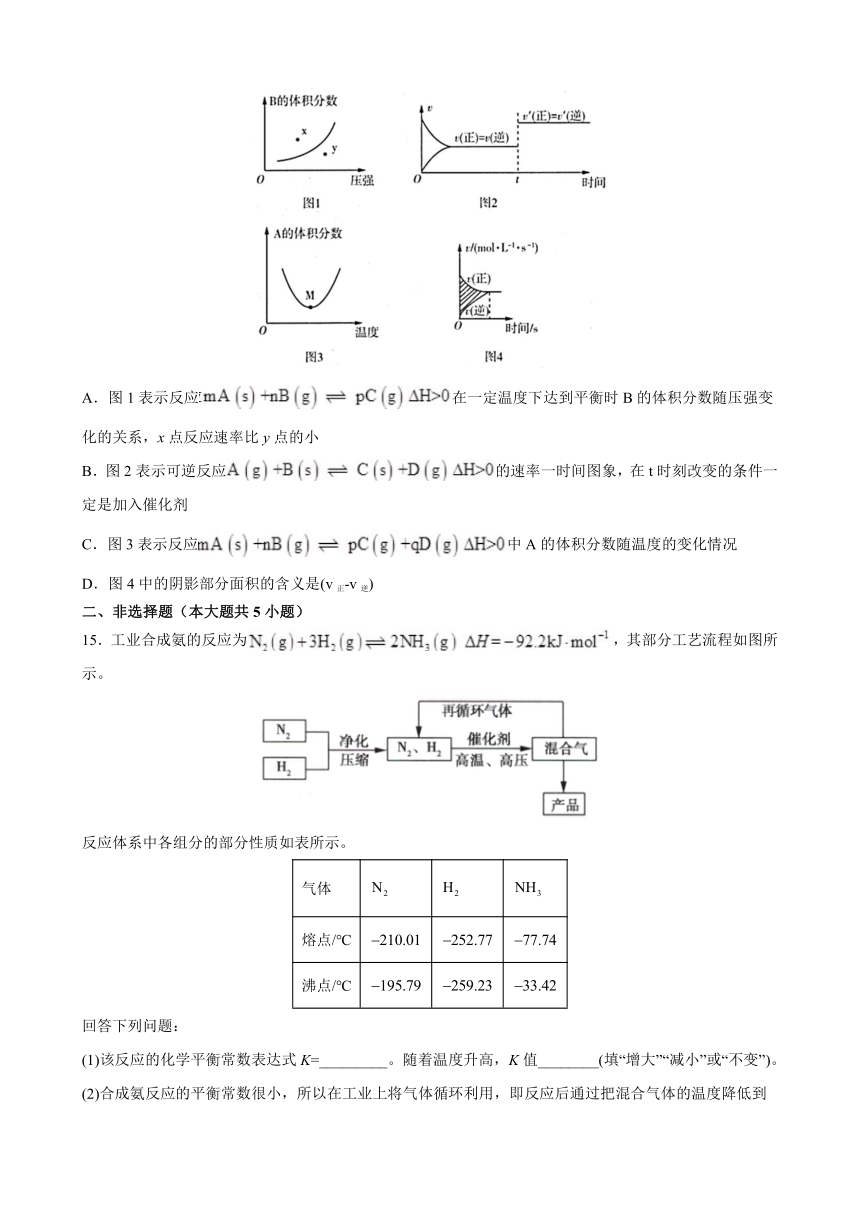
14.下列图示与对应的叙述相符的是(
)
A.图1表示反应在一定温度下达到平衡时B的体积分数随压强变化的关系,x点反应速率比y点的小
B.图2表示可逆反应的速率一时间图象,在t时刻改变的条件一定是加入催化剂
C.图3表示反应中A的体积分数随温度的变化情况
D.图4中的阴影部分面积的含义是(v正-v逆)
二、非选择题(本大题共5小题)
15.工业合成氨的反应为,其部分工艺流程如图所示。
反应体系中各组分的部分性质如表所示。
气体
熔点/℃
沸点/℃
回答下列问题:
(1)该反应的化学平衡常数表达式K=_________。随着温度升高,K值________(填“增大”“减小”或“不变”)。
(2)合成氨反应的平衡常数很小,所以在工业上将气体循环利用,即反应后通过把混合气体的温度降低到_________,将________分离出来;继续循环利用的气体是_________。
16.恒温恒容下,将2mol
A气体和1mol
B气体通入体积为2
L的密闭容器中发生反应:2A(g)+B(g)=xC(g)+2D(s),2
min达平衡,测得平衡时A的物质的量为1.2mol
,C的浓度为0.6mol·L-1。
(1)从开始反应至达到平衡状态,生成B的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.D的质量不再变化
B.压强不再变化
C.气体密度不再变化
D.气体的平均相对分子质量不再变化
E.A的消耗速率与B的消耗速率之比为2∶1
(5)请结合(4)总结化学平衡状态的判断依据有哪些:_____________(至少写出2条)。
17.随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。利用
NH3的还原性可以消除氮氧化物的污染,
其中除去
NO
的主要反应如下:4NH3(g)+6NO(g)
5N2(g)+6H2O(l)△H<0
(1)一定温度下,在恒容密闭容器中按照
n(NH3)︰n(NO)
=2︰3
充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是________________________。
A.c(NH3)︰c(NO)
=2︰3
B.n(NH3)︰n(N2)
不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H
键断裂的同时,生成
1molO—H
键
(2)已知该反应速率正=k
正·c4(NH3)·c6
(NO),
逆=k
逆·cx(N2)·cy(H2O)
(k
正、k
逆分别是正、逆反应速率常数),该反应的平衡常数
K=k
正/k
逆,则
x=___________________,y=____________________。
(3)某研究小组将
2molNH3、3molNO
和一定量的O2充入
2L
密闭容器中,在
Ag2O
催化剂表面发生上述反应,NO
的转化率随温度变化的情况如图所示。
①在
5min
内,温度从
420K
升高到
580K,此时段内NO
的平均反应速率
(NO)=__________________;
②在有氧条件下,温度
580K
之后
NO
生成
N2的转化率降低的原因可能是_____________________。
18.已知
,在一个有催化剂、容积不变的密闭容器中加入和,在500℃时充分反应,达到平衡时的浓度为,放出热量为。
(1)达到平衡时,的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,的转化率将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入,500℃时充分反应达到平衡后,吸收热量,的浓度________(填“”“”或“”),、、之间满足何种关系:________。
(4)改变某一条件,得到如图的变化规律(图中表示温度,表示物质的量),则下列结论正确的是________(填序号)。
A
反应速率:
B
达到平衡时的转化率:
C
D
点对应的状态,和的起始物质的量之比为
(5)若将上述容器改为恒压容器,起始时加入和,500℃时充分反应达平衡后,放出热量,则________(填“”“”或“”)。
(6)下列措施可以同时提高反应速率和转化率的是________(填序号)。
A
选择适当的催化剂
B
增大压强
C
及时分离生成的
D
升高温度
19.Deacon发明的直接氧化法为:。如图为刚性容器中,进料浓度比分别等于1∶1、4∶1、7∶1时平衡转化率随温度变化的关系:
可知反应平衡常数K(300℃)________K(400℃)(填“大于”或“小于”)。设初始浓度为,根据进料浓度比的数据计算K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比过低、过高的不利影响分别是____________、_______________。
参考答案
1.A
【解析】压强变化时,平衡不发生移动,主要考虑两种情况:一是没有气体参加的反应,二是反应前后气体体积不发生改变的反应,B、C、D选项所给方程式反应前后气体的体积发生改变,压强的改变会使平衡发生移动,A项中反应前后气体体积没有改变,所以压强变化时平衡不发生移动,故答案为A。
2.C
【解析】当可逆反应达到平衡状态后,保持温度,则平衡常数不变,浓度商Q=,容器容积不变,向容器中充入一定量的O2,分母变大,所以浓度商减小,平衡正向移动,SO2的转化率增大,但由于充入了O2,所以O2的转化率减小,故答案为C。
3.B
【解析】A.合成氨的正反应为气体体积缩小的反应,压强越大,反应物的转化率越高,则在动力、设备、材料允许的条件下尽可能在高压下进行,故A正确;
B.合成氨的正反应为放热反应,升高温度后不利于氨气的生成,故B错误;
C.合成氨中N2和H2的循环使用,可以提高原料气的利用率,降低成本,故C正确;
D.及时从反应体系中分离出氨气,反应物浓度减小,有利于平衡向正反应方向移动,故D正确;
故选:B。
4.B
【解析】A.
a点时和的浓度相同,但物质浓度随时间变化而变化,不是平衡状态,A错误;
B.
b点和c点时,和的浓度不再变化,化学反应达到平衡状态,B正确;
C.
该反应的化学平衡常数,C错误;
D.
若温度升高,该反应的化学平衡常数K增大,则该反应为吸热反应,,D错误;
故选B。
5.D
【解析】A.
根据“先拐先平数值大”可知,正确;
B.
根据图甲可知,,升高温度C的体积分数降低,平衡左移,所以该反应的正反应为放热反应,正确;
C.
根据图乙可知,,增大压强C的体积分数降低,又因B、C、D为气态物质,若,则A为液态或固态物质才能使平衡左移,正确;
D.
温度和压强一定时,反应的不变,错误;
故选D。
6.D
【解析】A.该反应的,说明反应为放热反应,A项正确;
B.放热反应的平衡常数应该随着温度的升高而降低,K(T1)=43,K(T2)=48.74,所以T1到T2是降温过程,B项正确;
C.平衡常数K只与温度有关,所以T1时,增大c(H2),K(T1)不变,C项正确;
D.因T1到T2是降温过程,该反应为放热反应,降低温度平衡向正反应方向移动,I2(g)的转化率增大,D项错误;
综上所述答案为D。
7.A
【解析】①该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低,故平衡后升高温度,平衡常数<400,①错误;
②由表中数据可知,CH3OH的起始浓度为0.8mol/L+2×1.24mol/L=3.28mol/L,设平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=(3.28-2x)mol/L,c(H2O)=xmol/L,所以x=400,
K=
,解得x=1.6mol/L,②正确;
③反应混合物的总能量减少等于反应放出的热量,由②中可知,平衡时后(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,③错误;
④平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,④错误;
⑤由②中可知,平衡时c(CH3OCH3)=1.6mol/L,不等于1.24mol/L,所以此时刻反应未达到平衡状态,⑤错误;
⑥由②中可知,平衡时C(CH3OH)=(3.28-2x)mol/L=(3.28-2×1.6)mol/L=0.08mol/L,⑥正确;
综上所述,②⑥正确,故选A。
8.C
【解析】A.由图中可以看出,随着温度的不断升高,乙烯气相的转化率不断降低,则表明升温时平衡逆向移动,所以乙烯气相直接水合反应的ΔH<0,A正确;
B.图中a点,乙烯的平衡转化率为20%,则平衡时n(H2O)=n(C2H4)=0.8
mol,n(C2H5OH)=0.2mol,对应的平衡常数K===L·mol-1,B正确;
C.由反应C2H4(g)+H2O(g)
C2H5OH(g)可知,增大压强平衡正向移动,乙烯的平衡转化率增大,则图中压强的大小关系为:p1<p2<p3,C不正确;
D.因为b点时温度高,反应速率快,所以达到平衡状态a、b所需要的时间:a>b,D正确;
故选C。
9.B
【解析】A.啤酒中存在平衡:,开启啤酒瓶,瓶中压强降低,平衡向气体体积增大的方向移动,即向生成气体的方向移动,故A能用平衡移动原理解释;
B.反应是一个反应前后气体分子数不变的反应,压强的改变并不能平衡发生移动,此混合气体加压后颜色变深,是因为的浓度增大,故B不能用平衡移动原理解释;
C.实验室制取乙酸乙酯时,采用加热的方法将生成的乙酸乙酯不断蒸出,从而使平衡向生成乙酸乙酯的方向移动,故C能用平衡移动原理解释;
D.工业生产硫酸的过程中涉及反应,使用过量的空气,平衡正向移动,可以提高的转化率,故D能用平衡移动原理解释;
答案选B。
10.D
【解析】A.
由图可知,15min内甲容器中CO的浓度变化量为1.5mol/L,v(CO)=
=0.1mol?L?1?min?1,速率之比等于化学计量数之比,所以v(H2)=0.1mol?
L?1?min?1,故A正确,但不符合题意;
B.
若甲、乙温度相同,为完全等效平衡,平衡时水的物质的量相同,甲中平衡时生成CO为0.5L×1.5mol/L=0.75mol,则生成平衡时水的物质的量为1mol?0.75mol=0.25mol<0.4mol,则乙相对于甲中平衡向逆反应移动,正反应为吸热反应,降低温度平衡逆向移动,故乙中温度低,即温度T1>T2,故B正确,但不符合题意;
C.
甲容器中:
T1℃时,反应的平衡常数K=
,故C正确,但不符合题意;
D.
丙容器中起始量为甲的二倍,若容积=0.5L,等效为在甲平衡基础上增大压强,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L,平衡时CO浓度为3mol/L,故丙容器的体积V<0.5L,故D错误,符合题意;
故选:D。
11.D
【解析】A.
从图2可知,30min时正反应速率和逆反应速率同时降低。降低反应温度,正反应速率和逆反应速率同时降低,但降低反应温度,平衡向放热反应方向移动。该反应无论正反应方向放热还是吸热,平衡均移动与图中30?40min改变条件后,平衡不移动矛盾,故A错误;
B.?0?8min内,C的反应速率v==0.17mol/(L?min)?1,化学反应速率之比等于方程式的系数之比,所以A的平均反应速率为0.085mol/(L?min)?1,故B错误;
C.
由开始到达到平衡,A.?B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C错误;
D.
由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,所以平衡常数不变,20?30min间,各物质的浓度为:c(A)=c(B)=1mol/L,c(C)=2mol/L,所以,故D正确。
故选D。
12.B
【解析】由反应N2(g)+3H2(g)2NH3(g)可知,在一密闭容器中加入一定量的N2和H2,达到平衡时气体压强为p1,迅速缩小体积使气体压强为p2,则p2>p1;因为反应是气体体积减小的反应,缩小体积压强增大,依据化学平衡移动原理可知,增大压强平衡向气体体积减小的方向进行,使气体压强略有减小,所以p3p1,根据上述分析可知,故B符合题意;
故答案:B。
13.C
【解析】A.
由图可知,随温度升高,氨气的体积分数降低,平衡正向移动,则正反应是吸热反应,该反应的,正确;
B.
由于是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,则气体压强:,正确;
C.
是固体,增加的量对平衡没有影响,平衡后再加入,的转化率不变,错误;
D.
设平衡时生成,则
由图可知M点时氨气的体积分数为25%,则,平衡时气体的总物质的量,图中M点的平衡常数,正确;
故选C。
14.A
【解析】A.x点的压强比y点的低,所以x点反应速率比y点的小,A正确;
B.该反应前后气体的总物质的量不变,故在t时刻改变条件使正逆反应速率仍相等,可能是加入催化剂或增大压强,B错误;
C.M点为平衡状态,随温度的升高,A的体积分数增大,说明平衡逆向移动,则正反应为放热反应,C错误;
D.图中阴影部分的面积表示某一反应物和某一生成物浓度的差值,D错误;
答案选A。
15.
减小
℃
氨
N2和H2
【解析】(1)由合成氨反应的化学方程式可写出平衡常数表达式,此反应的,说明该反应为放热反应,升高温度,平衡逆向移动,减小,和增大,故K值减小;故答案为:;减小。
(2)根据气体熔沸点的大小可知,氨易液化,将温度降低到氨气的沸点(-33.42℃)变为液态后,将氨气从体系中分离出去可使平衡正向移动,剩余的N2和H2可循环利用,提高产率;故答案为:-33.42℃;氨;N2和H2。
16.0.1
mol·L-1·min-1
3
1∶1
ACD
正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变
【解析】(1)v(B)==0.1
mol·L-1·min-1,故答案为:0.1
mol·L-1·min-1;
(2)同一反应用不同的物质表示的反应速率之比=化学计量数之比,故0.4:0.6=2:x,解得:x=3,故答案为:3;
(3)
A的转化率==40%,B的转化率==40%,所以,A的转化率与B的转化率之比为1:1,故答案为:1:1;
(4)
2A(g)+B(g)=3C(g)+2D(s)
A.若反应还未平衡,体系中反应物的质量将减小,生成物的质量将增大,D的质量不变,说明已达到平衡时,A正确;
B.该反应是一个气体分子数不变的反应,压强不变,不能说明已达平衡,B错误;
C.该反应是气体质量减小的反应,容器的体积不变,密度不再变化,说明气体的质量不再变化,说明已达到平衡,C正确;
D.该反应是气体的物质的量不变、气体的质量减小的反应,气体的平均相对分子质量不再变化,说明气体的平均摩尔质量不再变化,那么气体的质量不再变化,已达平衡,D正确;
E.A与B都是反应物,描述的都是正反应速率,不能说明是否平衡,E错误;
故答案为:ACD;
(5)达到平衡时,正反应速率=逆反应速率,体系中各种物质的质量、物质的量均不变,所以,化学平衡状态的判断依据有:正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变,故答案为:正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变。
17.AE
5
0
平衡逆向移动(或氨气被氧化为NO)
【解析】(1)
A.投料比等于化学计量数之比,c(NH3)︰c(NO)
始终等于2︰3,c(NH3)︰c(NO)
=2︰3不一定平衡;
B.NH3反应物、N2是生成物,
n(NH3)︰n(N2)不变,说明浓度不变,反应一定达到平衡状态;
C.反应前后气体系数和不同,压强是变量,容器内压强不变,一定达到平衡状态;
D.由于H2O呈液态,反应前后气体总质量变化、体积不变,密度是变量,容器内混合气体的密度不变,一定达到平衡状态;
E.1molN—H
键断裂的同时,生成
1molO—H
键,都是指正反应速率,不一定平衡;
答案选AE。
(2)
4NH3(g)+6NO(g)
5N2(g)+6H2O(l)平衡常数表达式是
,达到平衡时,正=逆,即k
正·c4(NH3)·c6
(NO)
=k
逆·cx(N2)·cy(H2O),
,则x=5、y=0;
(3)①420K时NO的物质的量变化是3mol×2%,580K时NO的物质的量变化是3mol×59%,在
5min
内NO的物质的量变化是3mol×59%-3mol×2%,此时段内NO
的平均反应速率(NO)=;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是温度升高,平衡逆向移动(或氨气被氧化为NO);
18.
不变
AD
<
B
【解析】(1)已知
,达到平衡后的浓度为,放出热量为,则的平衡转化率为;
(2)达到平衡后,若向原恒容容器中通入少量的氩气,氩气不参与反应,反应物浓度不变,平衡不移动,的转化率不变;
(3)在同一容器中投入和与投入是等效的,达到的平衡状态相同,所以反应达到平衡后,的浓度等于;根据等效平衡原理可知,;
(4)增大反应体系中的物质的量,反应物的浓度变大,反应速率:,故A正确;增大一种反应物的量,则另一种反应物的转化率增大,则达到平衡时的转化率大小为,B错误;正反应是放热反应,所以降低温度,平衡正向移动,的平衡体积分数增大,故,C错误;投料比为化学式前的系数之比时,平衡时产物的体积分数最大,则点对应的状态,和的起始物质的量之比为,D正确;
(5)恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,;
(6)A.选择适当的催化剂,平衡不移动,的转化率不变,故A错误;
B.增大压强,反应速率增大,平衡向正反应方向移动,的转化率增大,故B正确;
C.及时分离生成的,反应速率减小,故C错误;
D.升高温度,平衡向逆反应方向移动,的转化率减小,故D错误;
答案选B。
19.大于
和分离能耗较高
转化率较低
【解析】由题给平衡转化率随温度变化的关系图可知,随温度升高,HCl平衡转化率降低,则此反应为放热反应,温度越高,平衡常数越小,即K(300℃)大于K(400℃)。结合题图可知,、400℃时的平衡转化率为84%,列出三段式:
,则;进料浓度比过低会使体系中含量高,分离和的能耗较高,过高则会造成转化率较低,故答案为:大于;;和分离能耗较高;转化率较低。
化学反应的调控
一、选择题(本大题共14小题,每小题所给的4个选项,只有一个答案符合题目要求。)
1.压强变化不会使下列化学反应的平衡发生移动的是(
)
2.可逆反应达到平衡状态后,保持温度﹑容器容积不变,向容器中充入一定量的O2,下列说法正确的是(K为平衡常数,Q为浓度商)(
)
A.Q不变,K变大,O2的转化率增大
B.Q不变,K变大,SO2的转化率减小
C.Q减小,K不变,O2的转化率减小
D.Q增大,K不变,SO2的转化率增大
3.下列关于工业合成氨的叙述错误的是(
)
A.在动力、设备,材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中,N2、H2的循环利用可降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
4.铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的变化关系如图所示。下列说法正确的是(
)
A.a点为平衡状态
B.b点和c点时反应处于平衡状态
C.该反应的化学平衡常数K=
D.若温度升高,该反应的化学平衡常数K增大,则该反应的△H<0
5.已知可逆反应A+aBC+2D(a为化学计量数),其中B、C、D为气态物质。反应过程中,当其他条件不变时,C的体积分数(φ)与温度(T)和压强(p)的关系如图甲、乙所示。下列说法不正确的是(
)
A.T2>T1,p2>p1
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应△H的绝对值增大
6.已知。温度为T1时,该反应的平衡常数K(T1)=43;温度为T2时,
K(T2)=48.74。下列说法错误的是(
)
A.该反应为放热反应
B.T1到T2是降温过程
C.T1时,增大c(H2),K(T1)不变
D.T2时,I2(g)的转化率比T1时小
7.已知:2CH3OH(g)
CH3OCH3(g)+H2O(g)
ΔH=-25
kJ·mol-1某温度下的平衡常数为400。此温度下,在1
L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质
CH3OH
CH3OCH3
H2O
c/(mol·L-1)
0.8
1.24
1.24
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,CH3OCH3浓度为1.6
mol·L-1
③平衡时,反应混合物的总能量减少20
kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08
mol·L-1
A.②⑥
B.②④⑥
C.①②④⑤
D.②③④⑥
8.乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)
C2H5OH(g)
ΔH。乙烯的平衡转化率随温度、压强的变化关系如下[起始时,n(H2O)=n(C2H4)=1
mol;a点容器体积为1
L]。下列分析不正确的是( )
A.乙烯气相直接水合反应的ΔH<0
B.图中a点对应的平衡常数K=L·mol-1
C.图中压强的大小关系为:p1>p2>p3
D.达到平衡状态a、b所需要的时间:a>b
9.下列事实不能用平衡移动原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由、、组成的平衡体系通过缩小体积加压后颜色变深
C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的转化率
10.一定条件下存在反应
C(s)+H2O(g)CO(g)+H2(g)
ΔH>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是(
)
容器
甲
乙
丙
容积
0.5L
0.5L
V
温度
T1℃
T2℃
T1℃
起始量
2molC
1molH2O
1molCO
1molH2
4molC
2molH2O
A.甲容器中,反应在前15min的平均速率v(H2)=0.1mol·L-1·min-1
B.乙容器中,若平衡时n(H2O)=0.4mol,则T2
D.丙容器的体积V>0.5L
11.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变一个反应条件,测得容器中各物质的浓度、反应速率随时间的变化曲线如图1、2所示:下列说法正确的是(
)
A.30min时降低温度,40min时升高温度
B.0~8min内A的平均反应速率为0.16mol?L-1?min-1
C.化学方程式中的x=1,正反应为吸热反应
D.20~40min内该反应的平衡常数恒为4
12.对于反应,在一密闭容器中加入一定量的和,达到平衡时混合气体的压强为,并使容器体积保持不变,迅速缩小容器体积使混合气体的压强变为,一段时间后达到新的平衡,此时混合气体的压强为,则、、的大小关系是(
)
A.
B.
C.
D.
13.在一体积不变的密闭容器中充入2molNH3,并放入一定量的Fe2O3,发生化学反应:Fe2O3(s)+2NH3(g)2Fe(s)+N2(g)+3H2O(g)
△H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×该气体的物质的量分数。下列说法错误的是(
)
A.该反应的△H>0
B.气体压强:p2>p1
C.平衡后再加入Fe2O3,NH3的转化率增大
D.M点的平衡常K=
14.下列图示与对应的叙述相符的是(
)
A.图1表示反应在一定温度下达到平衡时B的体积分数随压强变化的关系,x点反应速率比y点的小
B.图2表示可逆反应的速率一时间图象,在t时刻改变的条件一定是加入催化剂
C.图3表示反应中A的体积分数随温度的变化情况
D.图4中的阴影部分面积的含义是(v正-v逆)
二、非选择题(本大题共5小题)
15.工业合成氨的反应为,其部分工艺流程如图所示。
反应体系中各组分的部分性质如表所示。
气体
熔点/℃
沸点/℃
回答下列问题:
(1)该反应的化学平衡常数表达式K=_________。随着温度升高,K值________(填“增大”“减小”或“不变”)。
(2)合成氨反应的平衡常数很小,所以在工业上将气体循环利用,即反应后通过把混合气体的温度降低到_________,将________分离出来;继续循环利用的气体是_________。
16.恒温恒容下,将2mol
A气体和1mol
B气体通入体积为2
L的密闭容器中发生反应:2A(g)+B(g)=xC(g)+2D(s),2
min达平衡,测得平衡时A的物质的量为1.2mol
,C的浓度为0.6mol·L-1。
(1)从开始反应至达到平衡状态,生成B的平均反应速率为________。
(2)x=________。
(3)A的转化率与B的转化率之比为________。
(4)下列各项可作为该反应达到平衡状态的标志的是________。
A.D的质量不再变化
B.压强不再变化
C.气体密度不再变化
D.气体的平均相对分子质量不再变化
E.A的消耗速率与B的消耗速率之比为2∶1
(5)请结合(4)总结化学平衡状态的判断依据有哪些:_____________(至少写出2条)。
17.随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。利用
NH3的还原性可以消除氮氧化物的污染,
其中除去
NO
的主要反应如下:4NH3(g)+6NO(g)
5N2(g)+6H2O(l)△H<0
(1)一定温度下,在恒容密闭容器中按照
n(NH3)︰n(NO)
=2︰3
充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是________________________。
A.c(NH3)︰c(NO)
=2︰3
B.n(NH3)︰n(N2)
不变
C.容器内压强不变
D.容器内混合气体的密度不变
E.1molN—H
键断裂的同时,生成
1molO—H
键
(2)已知该反应速率正=k
正·c4(NH3)·c6
(NO),
逆=k
逆·cx(N2)·cy(H2O)
(k
正、k
逆分别是正、逆反应速率常数),该反应的平衡常数
K=k
正/k
逆,则
x=___________________,y=____________________。
(3)某研究小组将
2molNH3、3molNO
和一定量的O2充入
2L
密闭容器中,在
Ag2O
催化剂表面发生上述反应,NO
的转化率随温度变化的情况如图所示。
①在
5min
内,温度从
420K
升高到
580K,此时段内NO
的平均反应速率
(NO)=__________________;
②在有氧条件下,温度
580K
之后
NO
生成
N2的转化率降低的原因可能是_____________________。
18.已知
,在一个有催化剂、容积不变的密闭容器中加入和,在500℃时充分反应,达到平衡时的浓度为,放出热量为。
(1)达到平衡时,的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,的转化率将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入,500℃时充分反应达到平衡后,吸收热量,的浓度________(填“”“”或“”),、、之间满足何种关系:________。
(4)改变某一条件,得到如图的变化规律(图中表示温度,表示物质的量),则下列结论正确的是________(填序号)。
A
反应速率:
B
达到平衡时的转化率:
C
D
点对应的状态,和的起始物质的量之比为
(5)若将上述容器改为恒压容器,起始时加入和,500℃时充分反应达平衡后,放出热量,则________(填“”“”或“”)。
(6)下列措施可以同时提高反应速率和转化率的是________(填序号)。
A
选择适当的催化剂
B
增大压强
C
及时分离生成的
D
升高温度
19.Deacon发明的直接氧化法为:。如图为刚性容器中,进料浓度比分别等于1∶1、4∶1、7∶1时平衡转化率随温度变化的关系:
可知反应平衡常数K(300℃)________K(400℃)(填“大于”或“小于”)。设初始浓度为,根据进料浓度比的数据计算K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比过低、过高的不利影响分别是____________、_______________。
参考答案
1.A
【解析】压强变化时,平衡不发生移动,主要考虑两种情况:一是没有气体参加的反应,二是反应前后气体体积不发生改变的反应,B、C、D选项所给方程式反应前后气体的体积发生改变,压强的改变会使平衡发生移动,A项中反应前后气体体积没有改变,所以压强变化时平衡不发生移动,故答案为A。
2.C
【解析】当可逆反应达到平衡状态后,保持温度,则平衡常数不变,浓度商Q=,容器容积不变,向容器中充入一定量的O2,分母变大,所以浓度商减小,平衡正向移动,SO2的转化率增大,但由于充入了O2,所以O2的转化率减小,故答案为C。
3.B
【解析】A.合成氨的正反应为气体体积缩小的反应,压强越大,反应物的转化率越高,则在动力、设备、材料允许的条件下尽可能在高压下进行,故A正确;
B.合成氨的正反应为放热反应,升高温度后不利于氨气的生成,故B错误;
C.合成氨中N2和H2的循环使用,可以提高原料气的利用率,降低成本,故C正确;
D.及时从反应体系中分离出氨气,反应物浓度减小,有利于平衡向正反应方向移动,故D正确;
故选:B。
4.B
【解析】A.
a点时和的浓度相同,但物质浓度随时间变化而变化,不是平衡状态,A错误;
B.
b点和c点时,和的浓度不再变化,化学反应达到平衡状态,B正确;
C.
该反应的化学平衡常数,C错误;
D.
若温度升高,该反应的化学平衡常数K增大,则该反应为吸热反应,,D错误;
故选B。
5.D
【解析】A.
根据“先拐先平数值大”可知,正确;
B.
根据图甲可知,,升高温度C的体积分数降低,平衡左移,所以该反应的正反应为放热反应,正确;
C.
根据图乙可知,,增大压强C的体积分数降低,又因B、C、D为气态物质,若,则A为液态或固态物质才能使平衡左移,正确;
D.
温度和压强一定时,反应的不变,错误;
故选D。
6.D
【解析】A.该反应的,说明反应为放热反应,A项正确;
B.放热反应的平衡常数应该随着温度的升高而降低,K(T1)=43,K(T2)=48.74,所以T1到T2是降温过程,B项正确;
C.平衡常数K只与温度有关,所以T1时,增大c(H2),K(T1)不变,C项正确;
D.因T1到T2是降温过程,该反应为放热反应,降低温度平衡向正反应方向移动,I2(g)的转化率增大,D项错误;
综上所述答案为D。
7.A
【解析】①该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低,故平衡后升高温度,平衡常数<400,①错误;
②由表中数据可知,CH3OH的起始浓度为0.8mol/L+2×1.24mol/L=3.28mol/L,设平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=(3.28-2x)mol/L,c(H2O)=xmol/L,所以x=400,
K=
,解得x=1.6mol/L,②正确;
③反应混合物的总能量减少等于反应放出的热量,由②中可知,平衡时后(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,③错误;
④平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,④错误;
⑤由②中可知,平衡时c(CH3OCH3)=1.6mol/L,不等于1.24mol/L,所以此时刻反应未达到平衡状态,⑤错误;
⑥由②中可知,平衡时C(CH3OH)=(3.28-2x)mol/L=(3.28-2×1.6)mol/L=0.08mol/L,⑥正确;
综上所述,②⑥正确,故选A。
8.C
【解析】A.由图中可以看出,随着温度的不断升高,乙烯气相的转化率不断降低,则表明升温时平衡逆向移动,所以乙烯气相直接水合反应的ΔH<0,A正确;
B.图中a点,乙烯的平衡转化率为20%,则平衡时n(H2O)=n(C2H4)=0.8
mol,n(C2H5OH)=0.2mol,对应的平衡常数K===L·mol-1,B正确;
C.由反应C2H4(g)+H2O(g)
C2H5OH(g)可知,增大压强平衡正向移动,乙烯的平衡转化率增大,则图中压强的大小关系为:p1<p2<p3,C不正确;
D.因为b点时温度高,反应速率快,所以达到平衡状态a、b所需要的时间:a>b,D正确;
故选C。
9.B
【解析】A.啤酒中存在平衡:,开启啤酒瓶,瓶中压强降低,平衡向气体体积增大的方向移动,即向生成气体的方向移动,故A能用平衡移动原理解释;
B.反应是一个反应前后气体分子数不变的反应,压强的改变并不能平衡发生移动,此混合气体加压后颜色变深,是因为的浓度增大,故B不能用平衡移动原理解释;
C.实验室制取乙酸乙酯时,采用加热的方法将生成的乙酸乙酯不断蒸出,从而使平衡向生成乙酸乙酯的方向移动,故C能用平衡移动原理解释;
D.工业生产硫酸的过程中涉及反应,使用过量的空气,平衡正向移动,可以提高的转化率,故D能用平衡移动原理解释;
答案选B。
10.D
【解析】A.
由图可知,15min内甲容器中CO的浓度变化量为1.5mol/L,v(CO)=
=0.1mol?L?1?min?1,速率之比等于化学计量数之比,所以v(H2)=0.1mol?
L?1?min?1,故A正确,但不符合题意;
B.
若甲、乙温度相同,为完全等效平衡,平衡时水的物质的量相同,甲中平衡时生成CO为0.5L×1.5mol/L=0.75mol,则生成平衡时水的物质的量为1mol?0.75mol=0.25mol<0.4mol,则乙相对于甲中平衡向逆反应移动,正反应为吸热反应,降低温度平衡逆向移动,故乙中温度低,即温度T1>T2,故B正确,但不符合题意;
C.
甲容器中:
T1℃时,反应的平衡常数K=
,故C正确,但不符合题意;
D.
丙容器中起始量为甲的二倍,若容积=0.5L,等效为在甲平衡基础上增大压强,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L,平衡时CO浓度为3mol/L,故丙容器的体积V<0.5L,故D错误,符合题意;
故选:D。
11.D
【解析】A.
从图2可知,30min时正反应速率和逆反应速率同时降低。降低反应温度,正反应速率和逆反应速率同时降低,但降低反应温度,平衡向放热反应方向移动。该反应无论正反应方向放热还是吸热,平衡均移动与图中30?40min改变条件后,平衡不移动矛盾,故A错误;
B.?0?8min内,C的反应速率v==0.17mol/(L?min)?1,化学反应速率之比等于方程式的系数之比,所以A的平均反应速率为0.085mol/(L?min)?1,故B错误;
C.
由开始到达到平衡,A.?B的浓度减少的量相同,由此可知x=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故C错误;
D.
由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,所以平衡常数不变,20?30min间,各物质的浓度为:c(A)=c(B)=1mol/L,c(C)=2mol/L,所以,故D正确。
故选D。
12.B
【解析】由反应N2(g)+3H2(g)2NH3(g)可知,在一密闭容器中加入一定量的N2和H2,达到平衡时气体压强为p1,迅速缩小体积使气体压强为p2,则p2>p1;因为反应是气体体积减小的反应,缩小体积压强增大,依据化学平衡移动原理可知,增大压强平衡向气体体积减小的方向进行,使气体压强略有减小,所以p3
故答案:B。
13.C
【解析】A.
由图可知,随温度升高,氨气的体积分数降低,平衡正向移动,则正反应是吸热反应,该反应的,正确;
B.
由于是气体体积增大的反应,加压平衡逆向移动,氨的体积分数增大,则气体压强:,正确;
C.
是固体,增加的量对平衡没有影响,平衡后再加入,的转化率不变,错误;
D.
设平衡时生成,则
由图可知M点时氨气的体积分数为25%,则,平衡时气体的总物质的量,图中M点的平衡常数,正确;
故选C。
14.A
【解析】A.x点的压强比y点的低,所以x点反应速率比y点的小,A正确;
B.该反应前后气体的总物质的量不变,故在t时刻改变条件使正逆反应速率仍相等,可能是加入催化剂或增大压强,B错误;
C.M点为平衡状态,随温度的升高,A的体积分数增大,说明平衡逆向移动,则正反应为放热反应,C错误;
D.图中阴影部分的面积表示某一反应物和某一生成物浓度的差值,D错误;
答案选A。
15.
减小
℃
氨
N2和H2
【解析】(1)由合成氨反应的化学方程式可写出平衡常数表达式,此反应的,说明该反应为放热反应,升高温度,平衡逆向移动,减小,和增大,故K值减小;故答案为:;减小。
(2)根据气体熔沸点的大小可知,氨易液化,将温度降低到氨气的沸点(-33.42℃)变为液态后,将氨气从体系中分离出去可使平衡正向移动,剩余的N2和H2可循环利用,提高产率;故答案为:-33.42℃;氨;N2和H2。
16.0.1
mol·L-1·min-1
3
1∶1
ACD
正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变
【解析】(1)v(B)==0.1
mol·L-1·min-1,故答案为:0.1
mol·L-1·min-1;
(2)同一反应用不同的物质表示的反应速率之比=化学计量数之比,故0.4:0.6=2:x,解得:x=3,故答案为:3;
(3)
A的转化率==40%,B的转化率==40%,所以,A的转化率与B的转化率之比为1:1,故答案为:1:1;
(4)
2A(g)+B(g)=3C(g)+2D(s)
A.若反应还未平衡,体系中反应物的质量将减小,生成物的质量将增大,D的质量不变,说明已达到平衡时,A正确;
B.该反应是一个气体分子数不变的反应,压强不变,不能说明已达平衡,B错误;
C.该反应是气体质量减小的反应,容器的体积不变,密度不再变化,说明气体的质量不再变化,说明已达到平衡,C正确;
D.该反应是气体的物质的量不变、气体的质量减小的反应,气体的平均相对分子质量不再变化,说明气体的平均摩尔质量不再变化,那么气体的质量不再变化,已达平衡,D正确;
E.A与B都是反应物,描述的都是正反应速率,不能说明是否平衡,E错误;
故答案为:ACD;
(5)达到平衡时,正反应速率=逆反应速率,体系中各种物质的质量、物质的量均不变,所以,化学平衡状态的判断依据有:正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变,故答案为:正反应速率=逆反应速率,体系中各种物质的质量、物质的量不变。
17.AE
5
0
平衡逆向移动(或氨气被氧化为NO)
【解析】(1)
A.投料比等于化学计量数之比,c(NH3)︰c(NO)
始终等于2︰3,c(NH3)︰c(NO)
=2︰3不一定平衡;
B.NH3反应物、N2是生成物,
n(NH3)︰n(N2)不变,说明浓度不变,反应一定达到平衡状态;
C.反应前后气体系数和不同,压强是变量,容器内压强不变,一定达到平衡状态;
D.由于H2O呈液态,反应前后气体总质量变化、体积不变,密度是变量,容器内混合气体的密度不变,一定达到平衡状态;
E.1molN—H
键断裂的同时,生成
1molO—H
键,都是指正反应速率,不一定平衡;
答案选AE。
(2)
4NH3(g)+6NO(g)
5N2(g)+6H2O(l)平衡常数表达式是
,达到平衡时,正=逆,即k
正·c4(NH3)·c6
(NO)
=k
逆·cx(N2)·cy(H2O),
,则x=5、y=0;
(3)①420K时NO的物质的量变化是3mol×2%,580K时NO的物质的量变化是3mol×59%,在
5min
内NO的物质的量变化是3mol×59%-3mol×2%,此时段内NO
的平均反应速率(NO)=;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是温度升高,平衡逆向移动(或氨气被氧化为NO);
18.
不变
AD
<
B
【解析】(1)已知
,达到平衡后的浓度为,放出热量为,则的平衡转化率为;
(2)达到平衡后,若向原恒容容器中通入少量的氩气,氩气不参与反应,反应物浓度不变,平衡不移动,的转化率不变;
(3)在同一容器中投入和与投入是等效的,达到的平衡状态相同,所以反应达到平衡后,的浓度等于;根据等效平衡原理可知,;
(4)增大反应体系中的物质的量,反应物的浓度变大,反应速率:,故A正确;增大一种反应物的量,则另一种反应物的转化率增大,则达到平衡时的转化率大小为,B错误;正反应是放热反应,所以降低温度,平衡正向移动,的平衡体积分数增大,故,C错误;投料比为化学式前的系数之比时,平衡时产物的体积分数最大,则点对应的状态,和的起始物质的量之比为,D正确;
(5)恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,;
(6)A.选择适当的催化剂,平衡不移动,的转化率不变,故A错误;
B.增大压强,反应速率增大,平衡向正反应方向移动,的转化率增大,故B正确;
C.及时分离生成的,反应速率减小,故C错误;
D.升高温度,平衡向逆反应方向移动,的转化率减小,故D错误;
答案选B。
19.大于
和分离能耗较高
转化率较低
【解析】由题给平衡转化率随温度变化的关系图可知,随温度升高,HCl平衡转化率降低,则此反应为放热反应,温度越高,平衡常数越小,即K(300℃)大于K(400℃)。结合题图可知,、400℃时的平衡转化率为84%,列出三段式:
,则;进料浓度比过低会使体系中含量高,分离和的能耗较高,过高则会造成转化率较低,故答案为:大于;;和分离能耗较高;转化率较低。
