第2章《元素与物质世界》测试题(含答案)2021-2022学年鲁科版(2019)化学必修第一册
文档属性
| 名称 | 第2章《元素与物质世界》测试题(含答案)2021-2022学年鲁科版(2019)化学必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 370.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-13 16:22:19 | ||
图片预览



文档简介
第2章《元素与物质世界》测试题
一、单选题(共13题)
1.能用H++OH-=H2O来表示的化学反应是(
)
A.氢氧化铁固体和稀盐酸反应
B.硫酸氢钠滴入氢氧化钡溶液中
C.醋酸滴入烧碱中
D.澄清石灰水和稀硝酸反应
2.“一带一路(One
Belt
And
One
Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易的商品中,其主要成分不属于有机物的是
A.中国丝绸
B.埃及长绒棉
C.乌克兰葵花籽油
D.捷克水晶
3.高氯酸(HClO4,沸点90℃)可用于医药工业方面。工业生产高氯酸的工艺流程如下:
下列说法错误的是
A.反应器I反应产物中有HClO4、ClO2、NaHSO4
B.反应器Ⅱ中是还原剂SO2将氧化剂ClO2还原为ClO
C.若用pH计测定0.1mol·L-1
NaHSO4溶液pH>1,则说明NaHSO4为弱电解质
D.操作I为蒸馏
4.既能跟强酸又能跟强碱溶液反应的盐是(
)
A.NaHCO3
B.Al2O3
C.Al
D.Al(OH)3
5.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是
A.HCl+Na2CO3、HCl+NaHCO3
B.BaCl2+Na2SO4、Ba(OH)2+(NH4)2SO4
C.石灰石与硝酸、石灰石与盐酸
D.KOH+HCl、Ba(OH)2+H2SO4
6.K2FeO4可用作水处理剂,它可由3Cl2
+2Fe(OH)3
+10KOH
=2K2FeO4
+6KCl
+8H2O制得。下列说法不正确的是
A.氧化性:Fe(OH)3
>K2FeO4
B.Cl2是氧化剂,Fe(OH)3在反应中失去电子
C.上述反应的氧化剂与还原剂物质的量之比为3:2
D.每生成l
mol氧化产物转移的电子的物质的量为3
mol
7.下列离子方程书写正确的是
A.向碳酸氢钠溶液中加入足量氢氧化钡溶液:
HCO
+
Ba2+
+
OH-=BaCO3
+H2O
B.Fe2
O3
溶于过量氢碘酸溶液中:
Fe2O3
+6H+=2Fe3+
+3H2O
C.向硫酸铝溶液中加入过量氨水:
Al3+
+4NH3H2O=AlO+4NH
+2H2O
D.电解饱和食盐水:2Cl?
+
2H+
Cl2↑+
H2↑
8.下列物质中属于酸的是
A.NaHCO3
B.HClO3
C.NH3
D.CH4
9.某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO、Cl-、CO和HCO离子中的若干种,取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001
mol·L-1
AgNO3溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液A中一定存在H+、SO和Cl-
B.溶液A中不存在Mg2+、CO和HCO,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断
10.对下列选项中的操作和现象,其解释与结论不正确的是
选项
操作
现象
解释与结论
A
向NaI溶液中滴入少量新制氯水和苯,振荡、静置
上层溶液呈紫红色
I-还原性强于Cl-
B
无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水
溴水褪色
乙烯和溴水发生加成反应
C
向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞
变红,前者红色更深
水解程度:CO>HCO
D
室温下,向浓度均为0.01mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A
B.B
C.C
D.D
11.下列叙述不涉及氧化还原反应的是
A.谷物发酵酿造食醋
B.铜制品、铁制品在潮湿的空气中生锈
C.从海水中提取氯化镁
D.大气中SO2参与酸雨形成
12.下列各组溶液,在强酸性或强碱性溶液中都能大量共存的离子组是
A.Cu2、K、、
B.Ba2、Na、、
C.Na、H、、Cl
D.K、Na、、
13.在无色透明的溶液中,能大量共存的离子组是( )
A.Na+、K+、、OH﹣
B.Mg2+、Al3+、、
C.K+、Cu2+、、
D.H+、Na+、、
二、非选择题(共10题)
14.已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有_____mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为___________g/L。
15.盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在三个反应中,分别表现什么性质:
①Zn+2HCl=ZnCl2+H2↑________;
②NaOH+HCl=NaCl+H2O________;
③2HClH2↑+Cl2↑________;
④KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O________。方程式中氧化剂与还原剂的物质的量之比为________,若有5mol还原剂被氧化,则生成的Cl2为________
mol。
16.(1)写出下列物质在水溶液中电离的电离方程式
氯化铜:_______;硫酸铁:_______;
(2)写出符合离子方程式Ba2++=BaSO4↓的一个化学方程式:_______。
(3)铁是人类使用最广泛的金属。
①一氧化碳在高温下可与氧化铁发生反应:Fe2O3+3CO2Fe+3CO2,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是_______(填化学式),作为还原剂的物质是_______(填化学式)。在该反应中,若消耗了1molFe2O3,则转移了_______mol电子。
②向盛有沸水的烧杯中滴入5-6滴的FeCl3饱和溶液,继续加热至液体呈红褐色,停止加热,得到的分散系属于_______,用红色激光笔照射烧杯中的液体,在与光束垂直的方向可观察到的现象叫_______,反应的化学方程式是:_______。
③氢氧化铁的胶体与悬浊液最本质的区别_______。
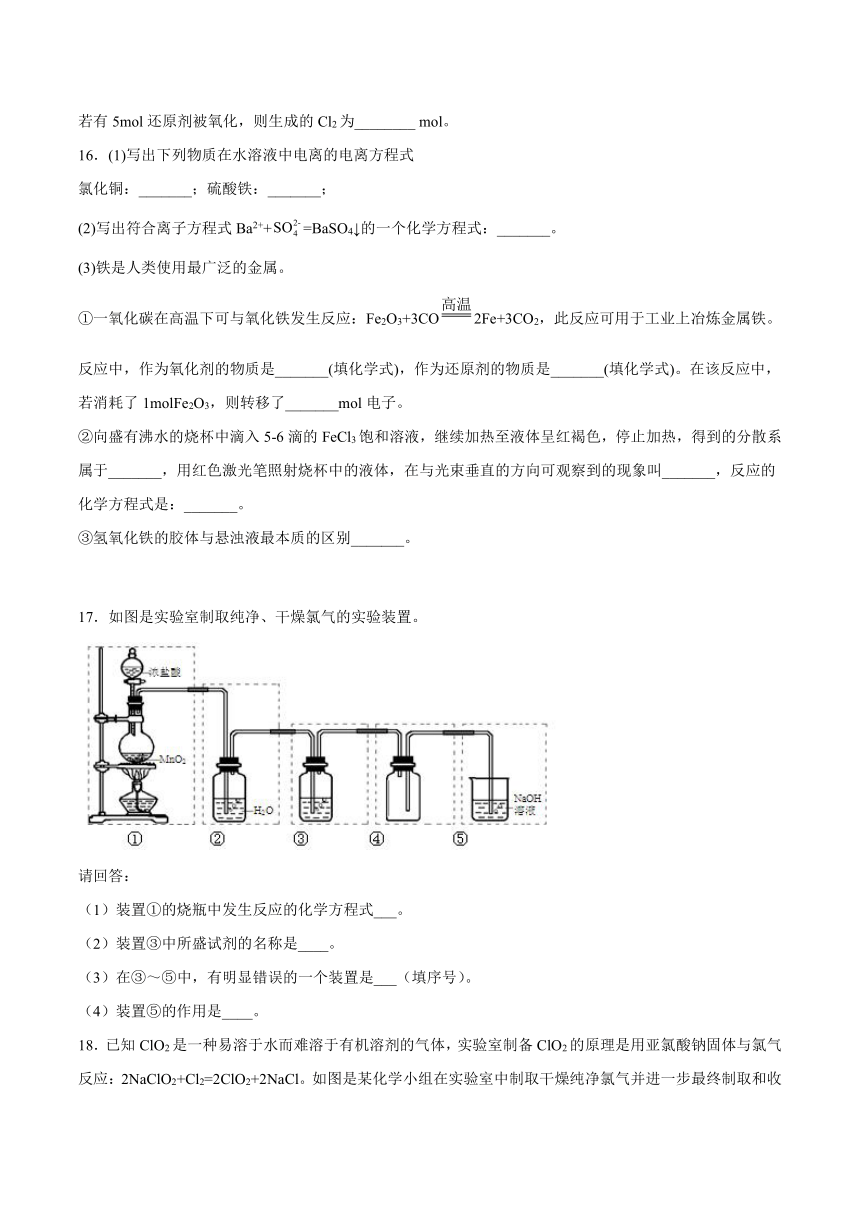
17.如图是实验室制取纯净、干燥氯气的实验装置。
请回答:
(1)装置①的烧瓶中发生反应的化学方程式___。
(2)装置③中所盛试剂的名称是____。
(3)在③~⑤中,有明显错误的一个装置是___(填序号)。
(4)装置⑤的作用是____。
18.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。如图是某化学小组在实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中未反应的Cl2)
(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,从①、②、③中选择合适的装置__________(如图,填序号),仪器P的名称是__________。
(2)写出装置A中瓶内发生反应的离子方程式:__________。
(3)C装置所盛试剂的作用是_____,G的作用是_______。
(4)F为ClO2收集装置应选用的装置是____(如图,填序号),其中与E装置导管相连的导管口是____(填接口字母)。
19.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入硝酸银和稀硝酸混合溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静的燃烧,发出苍白色的火焰并生成D。把无色无刺激气味的气体C通入澄清石灰水时变浑浊。
(1)ABCD的化学式分别为:A
___________,B_________,C
__________,D___________。
(2)写出下列各反应的离子方程式:
B与水_________________________________________________。
B与NaOH溶液_________________________________________。
C与澄清石灰水_________________________________________。
D与AgNO3溶液_______________________________________。
20.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X____;试剂甲:_____,试剂乙:_____
(2)写出下列各步反应的离子方程式:
①______;③______;④_____
21.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X_____,Y_____,Z____,试剂甲____,试剂乙____。
(2)写出①、③、⑤反应的离子方程式:
①____________________________________________。
③____________________________________________。
⑤____________________________________________。
22.请回答以下问题:
(1)氢化钠(NaH)为白色晶体,其中有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目___________;NaH能与水剧烈反应NaH+H2O=NaOH+H2↑,NaH与液氨也有类似反应,写出反应的化学方程式___________。
(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是___________。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___________。
②若生成0.2molAsH3,则转移的电子数为___________。
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___________;
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为___________;
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为,则相同质量的ClO2是Cl2消毒效率的___________倍。
(5)配平反应方程式(答题卡上写出完整的化学方程式)___________________。
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
23.氯气(液氯)、84消毒液、漂白粉等都是含氯消毒剂。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为__________。
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为_______;该反应中氧化剂与还原剂的物质的量之比为________。
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为__________(要求写出简要计算过程)。
参考答案
1.D
2.D
3.C
4.A
5.C
6.A
7.A
8.B
9.B
10.B
11.C
12.D
13.B
14.Ca3(PO4)2
CO
2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4↑+10CO↑
4
24.8
1.64
15.酸性、氧化性
酸性
氧化性、还原性
还原性、酸性
1∶5
3
16.CuCl2=Cu2++2Cl-
Fe2(SO4)3=2Fe3++3
BaCl2+Na2SO4=BaSO4↓
+2NaCl
Fe2O3
CO
6
胶体
丁达尔效应
FeCl3+3H2OFe(OH)3(胶体)+3HCl
分散质粒子大小不同
17.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
浓硫酸
④
吸收多余的氯气,防止污染空气
18.③
分液漏斗
2MnO+16H++10Cl-=2Mn2++5Cl2↑+8H2O
干燥Cl2
防倒吸
②
d
19.H2
Cl2
CO2
HCl
Cl2+H2O=H++Cl-+HClO
Cl2+2OH-═Cl-+ClO-+H2O
CO2+Ca2++2OH-═CaCO3↓+H2O
Ag++Cl-=AgCl↓
20.MgSO4
BaCl2
AgNO3
Ba2++=BaSO4↓
Mg(OH)2+2H+=Mg2++2H2O
Ag+
+
Cl-
=
AgCl↓
21.MgSO4
Mg(OH)
2
MgCl2
BaCl2
AgNO3
Ba2++SO42?===BaSO4↓
Mg(OH)2+2H+===Mg2++2H2O
Ba2++
SO42?===BaSO4↓
22.
NaH+NH3═NaNH2+H2↑
mol
1.2NA
1∶1
73∶34
2.63
10Al+6NaNO3+6H2O=4Al(OH)3+3N2↑+6NaAlO2
23.5:4
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
1:1
一、单选题(共13题)
1.能用H++OH-=H2O来表示的化学反应是(
)
A.氢氧化铁固体和稀盐酸反应
B.硫酸氢钠滴入氢氧化钡溶液中
C.醋酸滴入烧碱中
D.澄清石灰水和稀硝酸反应
2.“一带一路(One
Belt
And
One
Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易的商品中,其主要成分不属于有机物的是
A.中国丝绸
B.埃及长绒棉
C.乌克兰葵花籽油
D.捷克水晶
3.高氯酸(HClO4,沸点90℃)可用于医药工业方面。工业生产高氯酸的工艺流程如下:
下列说法错误的是
A.反应器I反应产物中有HClO4、ClO2、NaHSO4
B.反应器Ⅱ中是还原剂SO2将氧化剂ClO2还原为ClO
C.若用pH计测定0.1mol·L-1
NaHSO4溶液pH>1,则说明NaHSO4为弱电解质
D.操作I为蒸馏
4.既能跟强酸又能跟强碱溶液反应的盐是(
)
A.NaHCO3
B.Al2O3
C.Al
D.Al(OH)3
5.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是
A.HCl+Na2CO3、HCl+NaHCO3
B.BaCl2+Na2SO4、Ba(OH)2+(NH4)2SO4
C.石灰石与硝酸、石灰石与盐酸
D.KOH+HCl、Ba(OH)2+H2SO4
6.K2FeO4可用作水处理剂,它可由3Cl2
+2Fe(OH)3
+10KOH
=2K2FeO4
+6KCl
+8H2O制得。下列说法不正确的是
A.氧化性:Fe(OH)3
>K2FeO4
B.Cl2是氧化剂,Fe(OH)3在反应中失去电子
C.上述反应的氧化剂与还原剂物质的量之比为3:2
D.每生成l
mol氧化产物转移的电子的物质的量为3
mol
7.下列离子方程书写正确的是
A.向碳酸氢钠溶液中加入足量氢氧化钡溶液:
HCO
+
Ba2+
+
OH-=BaCO3
+H2O
B.Fe2
O3
溶于过量氢碘酸溶液中:
Fe2O3
+6H+=2Fe3+
+3H2O
C.向硫酸铝溶液中加入过量氨水:
Al3+
+4NH3H2O=AlO+4NH
+2H2O
D.电解饱和食盐水:2Cl?
+
2H+
Cl2↑+
H2↑
8.下列物质中属于酸的是
A.NaHCO3
B.HClO3
C.NH3
D.CH4
9.某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO、Cl-、CO和HCO离子中的若干种,取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001
mol·L-1
AgNO3溶液,有白色沉淀生成。
下列说法不正确的是
A.溶液A中一定存在H+、SO和Cl-
B.溶液A中不存在Mg2+、CO和HCO,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断
10.对下列选项中的操作和现象,其解释与结论不正确的是
选项
操作
现象
解释与结论
A
向NaI溶液中滴入少量新制氯水和苯,振荡、静置
上层溶液呈紫红色
I-还原性强于Cl-
B
无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水
溴水褪色
乙烯和溴水发生加成反应
C
向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞
变红,前者红色更深
水解程度:CO>HCO
D
室温下,向浓度均为0.01mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A
B.B
C.C
D.D
11.下列叙述不涉及氧化还原反应的是
A.谷物发酵酿造食醋
B.铜制品、铁制品在潮湿的空气中生锈
C.从海水中提取氯化镁
D.大气中SO2参与酸雨形成
12.下列各组溶液,在强酸性或强碱性溶液中都能大量共存的离子组是
A.Cu2、K、、
B.Ba2、Na、、
C.Na、H、、Cl
D.K、Na、、
13.在无色透明的溶液中,能大量共存的离子组是( )
A.Na+、K+、、OH﹣
B.Mg2+、Al3+、、
C.K+、Cu2+、、
D.H+、Na+、、
二、非选择题(共10题)
14.已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有_____mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为___________g/L。
15.盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在三个反应中,分别表现什么性质:
①Zn+2HCl=ZnCl2+H2↑________;
②NaOH+HCl=NaCl+H2O________;
③2HClH2↑+Cl2↑________;
④KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O________。方程式中氧化剂与还原剂的物质的量之比为________,若有5mol还原剂被氧化,则生成的Cl2为________
mol。
16.(1)写出下列物质在水溶液中电离的电离方程式
氯化铜:_______;硫酸铁:_______;
(2)写出符合离子方程式Ba2++=BaSO4↓的一个化学方程式:_______。
(3)铁是人类使用最广泛的金属。
①一氧化碳在高温下可与氧化铁发生反应:Fe2O3+3CO2Fe+3CO2,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是_______(填化学式),作为还原剂的物质是_______(填化学式)。在该反应中,若消耗了1molFe2O3,则转移了_______mol电子。
②向盛有沸水的烧杯中滴入5-6滴的FeCl3饱和溶液,继续加热至液体呈红褐色,停止加热,得到的分散系属于_______,用红色激光笔照射烧杯中的液体,在与光束垂直的方向可观察到的现象叫_______,反应的化学方程式是:_______。
③氢氧化铁的胶体与悬浊液最本质的区别_______。
17.如图是实验室制取纯净、干燥氯气的实验装置。
请回答:
(1)装置①的烧瓶中发生反应的化学方程式___。
(2)装置③中所盛试剂的名称是____。
(3)在③~⑤中,有明显错误的一个装置是___(填序号)。
(4)装置⑤的作用是____。
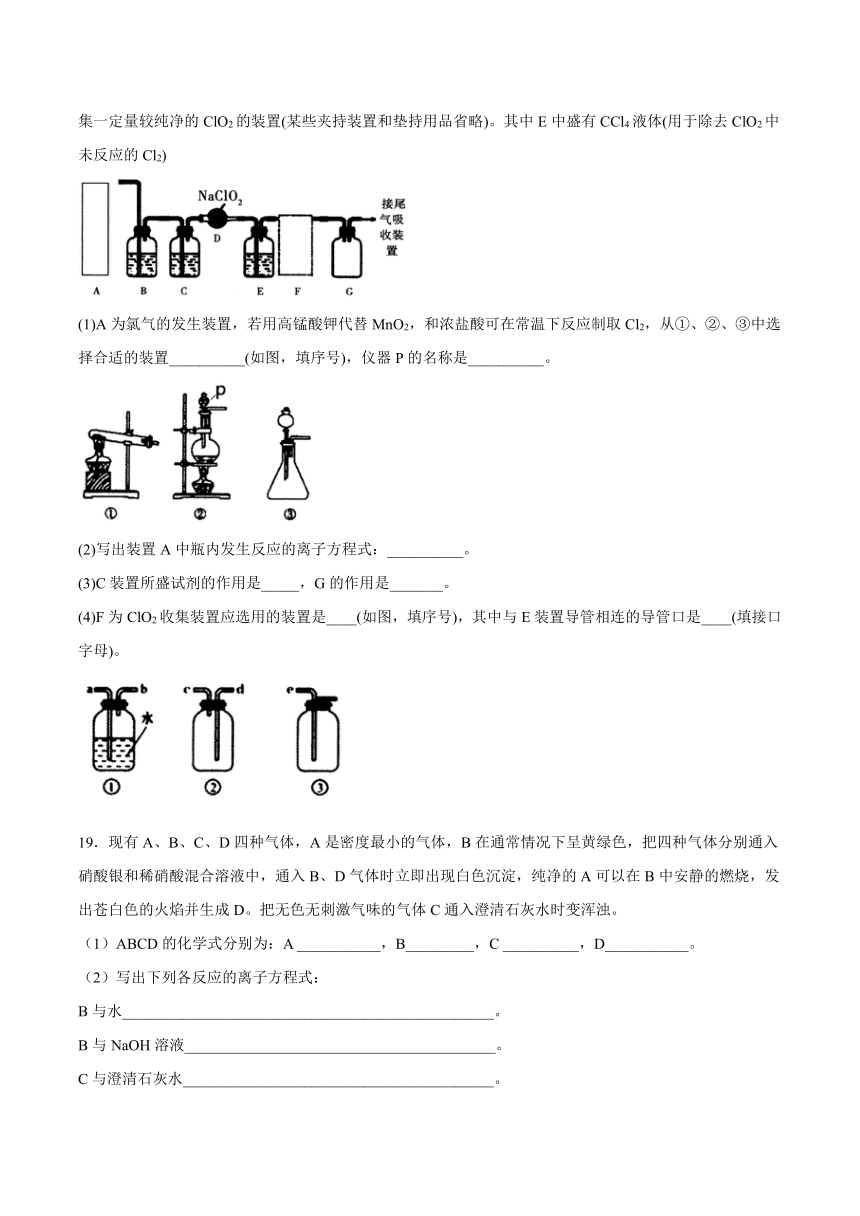
18.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。如图是某化学小组在实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中未反应的Cl2)
(1)A为氯气的发生装置,若用高锰酸钾代替MnO2,和浓盐酸可在常温下反应制取Cl2,从①、②、③中选择合适的装置__________(如图,填序号),仪器P的名称是__________。
(2)写出装置A中瓶内发生反应的离子方程式:__________。
(3)C装置所盛试剂的作用是_____,G的作用是_______。
(4)F为ClO2收集装置应选用的装置是____(如图,填序号),其中与E装置导管相连的导管口是____(填接口字母)。
19.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入硝酸银和稀硝酸混合溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静的燃烧,发出苍白色的火焰并生成D。把无色无刺激气味的气体C通入澄清石灰水时变浑浊。
(1)ABCD的化学式分别为:A
___________,B_________,C
__________,D___________。
(2)写出下列各反应的离子方程式:
B与水_________________________________________________。
B与NaOH溶液_________________________________________。
C与澄清石灰水_________________________________________。
D与AgNO3溶液_______________________________________。
20.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X____;试剂甲:_____,试剂乙:_____
(2)写出下列各步反应的离子方程式:
①______;③______;④_____
21.X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
(1)根据上述转化关系,推断下列物质的化学式:
X_____,Y_____,Z____,试剂甲____,试剂乙____。
(2)写出①、③、⑤反应的离子方程式:
①____________________________________________。
③____________________________________________。
⑤____________________________________________。
22.请回答以下问题:
(1)氢化钠(NaH)为白色晶体,其中有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目___________;NaH能与水剧烈反应NaH+H2O=NaOH+H2↑,NaH与液氨也有类似反应,写出反应的化学方程式___________。
(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是___________。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___________。
②若生成0.2molAsH3,则转移的电子数为___________。
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___________;
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为___________;
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为,则相同质量的ClO2是Cl2消毒效率的___________倍。
(5)配平反应方程式(答题卡上写出完整的化学方程式)___________________。
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
23.氯气(液氯)、84消毒液、漂白粉等都是含氯消毒剂。
(1)实验室中用MnO2或KMnO4与浓盐酸反应制取氯气。若用二者制备等质量的氯气消耗HCl的物质的量之比为__________。
(2)由于氯气不易保存,生活中常用的含氯消毒剂为漂白粉和84消毒液。
①用氯气制漂白粉的化学方程式为_______;该反应中氧化剂与还原剂的物质的量之比为________。
②含氯消毒剂的消毒能力可以用氧化性来衡量。商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某84消毒液产品中含有7.45g次氯酸钠,该产品的有效氯含量为__________(要求写出简要计算过程)。
参考答案
1.D
2.D
3.C
4.A
5.C
6.A
7.A
8.B
9.B
10.B
11.C
12.D
13.B
14.Ca3(PO4)2
CO
2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4↑+10CO↑
4
24.8
1.64
15.酸性、氧化性
酸性
氧化性、还原性
还原性、酸性
1∶5
3
16.CuCl2=Cu2++2Cl-
Fe2(SO4)3=2Fe3++3
BaCl2+Na2SO4=BaSO4↓
+2NaCl
Fe2O3
CO
6
胶体
丁达尔效应
FeCl3+3H2OFe(OH)3(胶体)+3HCl
分散质粒子大小不同
17.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
浓硫酸
④
吸收多余的氯气,防止污染空气
18.③
分液漏斗
2MnO+16H++10Cl-=2Mn2++5Cl2↑+8H2O
干燥Cl2
防倒吸
②
d
19.H2
Cl2
CO2
HCl
Cl2+H2O=H++Cl-+HClO
Cl2+2OH-═Cl-+ClO-+H2O
CO2+Ca2++2OH-═CaCO3↓+H2O
Ag++Cl-=AgCl↓
20.MgSO4
BaCl2
AgNO3
Ba2++=BaSO4↓
Mg(OH)2+2H+=Mg2++2H2O
Ag+
+
Cl-
=
AgCl↓
21.MgSO4
Mg(OH)
2
MgCl2
BaCl2
AgNO3
Ba2++SO42?===BaSO4↓
Mg(OH)2+2H+===Mg2++2H2O
Ba2++
SO42?===BaSO4↓
22.
NaH+NH3═NaNH2+H2↑
mol
1.2NA
1∶1
73∶34
2.63
10Al+6NaNO3+6H2O=4Al(OH)3+3N2↑+6NaAlO2
23.5:4
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
1:1
