2021-2022学年九年级化学沪教版上册 第4章 认识化学变化 单元测试题(word版 含答案)
文档属性
| 名称 | 2021-2022学年九年级化学沪教版上册 第4章 认识化学变化 单元测试题(word版 含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 172.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-12 15:55:18 | ||
图片预览




文档简介
第4章《认识化学变化》测试题
一、单选题
1.下列各反应中,各物质之间的质量比为1:1:2的是
A.
B.
C.
D.
2.下列说法中不正确的是
A.如果不加入催化剂,过氧化氢就不会分解
B.自然界中的物质都在不断运动
C.增大氧气浓度能促进可燃物的燃烧
D.纯净物组成固定
3.有科学家提出:“硅是未来的石油”,硅能在O2中燃烧生成SiO2,并放出大量的热。硅在元素周期表中的相关信息如图所示。下列说法正确的是
A.硅元素属于金属元素
B.硅元素的相对原子质量是28.09g
C.硅原子的核内质子数为14
D.硅在氧气中燃烧的化学方程式为Si+O2=SiO2
4.下列对宏观事实的微观解释不正确的是
A.铁轨夏天缝隙变小一一分子之间间隔变大
B.篮球充入过量气体—一增大压强,分子的间隔变大
C.一氧化碳和二氧化碳的性质不同一一不同种分子性质不相同
D.过氧化氢在催化剂作用下生成水和氧气一—化学反应中分子发生改变
5.为防止煤气逸散使人中毒,常在煤气中加入少量的有特殊刺激性气味的乙硫醇()。乙硫醇在煤气燃烧过程中也可以充分燃烧,其化学方程式为,则X的化学式为
A.
B.
C.
D.
6.食盐水是由氯化钠溶于水配制成的,电解食盐水可获得一种可溶物和两种气体,下列物质中不可能是该反应生成物的是
A.氢氧化钠
B.氢气
C.氯气
D.二氧化碳
7.为防止硝酸厂产生的氮氧化物污染环境,通常用NaOH溶液吸收这些氮氧化物,反应的化学方程式为:NO+X+2NaOH=2NaNO2+H2O,其中X是
A.NO2
B.NO
C.N2O4
D.N2
8.下图是雷雨天气时空气中两种主要气体发生反应的微观示意图。下列说法错误的是
A.反应前后原子种类不变
B.反应前后分子种类不变
C.反应前后元素化合价发生了变化
D.该反应属于化合反应
9.“远离火灾,珍爱生命,共建平安家园”,下列说法错误的是
A.厨房煤气管道漏气,立即关闭阀门并开窗通风
B.面粉在有限的空间遇到明火会急剧燃烧,但不会发生爆炸
C.燃着的酒精灯不慎碰倒而着火,应立即用湿抹布扑盖
D.救火时,不要贸然打开所有门,以免空气对流促进火势蔓延
10.调查统计表明,很多火灾伤亡事故是由于缺乏自救常识造成的。下列自救措施处理不当的是
A.酒精洒在实验台上着火时,立即用湿布盖灭
B.炒菜时油锅中的油不慎着火,立即用锅盖灭火
C.工作中的电器着火时,立即用水进行灭火
D.发现煤气泄漏时,立即关闭煤气阀门,并用湿毛巾捂住口鼻,打开门窗
11.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
物质
a
b
c
d
反应前质量/g
64
32
40
1.0
反应后质量/g
特测
25.6
72
1.0
下列说法中错误的是
A.反应后a物质的质量为46.4g
B.a和b是反应物,d可能是催化剂
C.c物质中元素的种类,一定和a、b两种物质中元素的种类相同
D.若a物质与b物质的式量之比为4:1,则反应中a与b的物质的量之比为1:1
12.已知A+3B=2C+3D中,2.3gA跟4.8gB恰好完全反应生成4.4gC,又知D的相对分子质量为18,则B的相对分子质量为
A.48
B.32
C.16
D.96
13.推理是一种重要的化学学习方法。下列推理正确的是
A.N2、O2、H2是由分子构成的,所以气体都是由分子构成的
B.H2O、MgO、CO2都属于氧化物,所以含有氧元素的化合物都是氧化物
C.任何化学反应都遵循质量守恒定律,所以化学反应前后物质的总质量不变
D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中剧烈燃烧
14.科学家采用组合转化技术,可将二氧化碳在一定条件下转化为有机物一乙烯,其反应的微观过程如图所示。下列说法正确的是
A.乙烯的化学式为CH2
B.图中的物质属于氧化物的只有一种
C.该反应生成了三种物质
D.参加反应的两种分子的个数比是1:3
15.豆腐中含有多种人体所需的氨基酸,其中含量最多的是亮氨酸(化学式C6H13NO2),下列说法正确的是
A.从类别上看:亮氨酸属于氧化物
B.从组成上看:亮氢酸由碳、氢、氮、氧四种元素组成,其中碳元素的质量分数最大
C.从变化上看:亮氨酸完全燃烧只生成一氧化碳和水
D.从构成上看:亮氨酸由
6
个碳原子、13
个氢原子、1
个氮原子、2
个氧原子构成
二、填空题
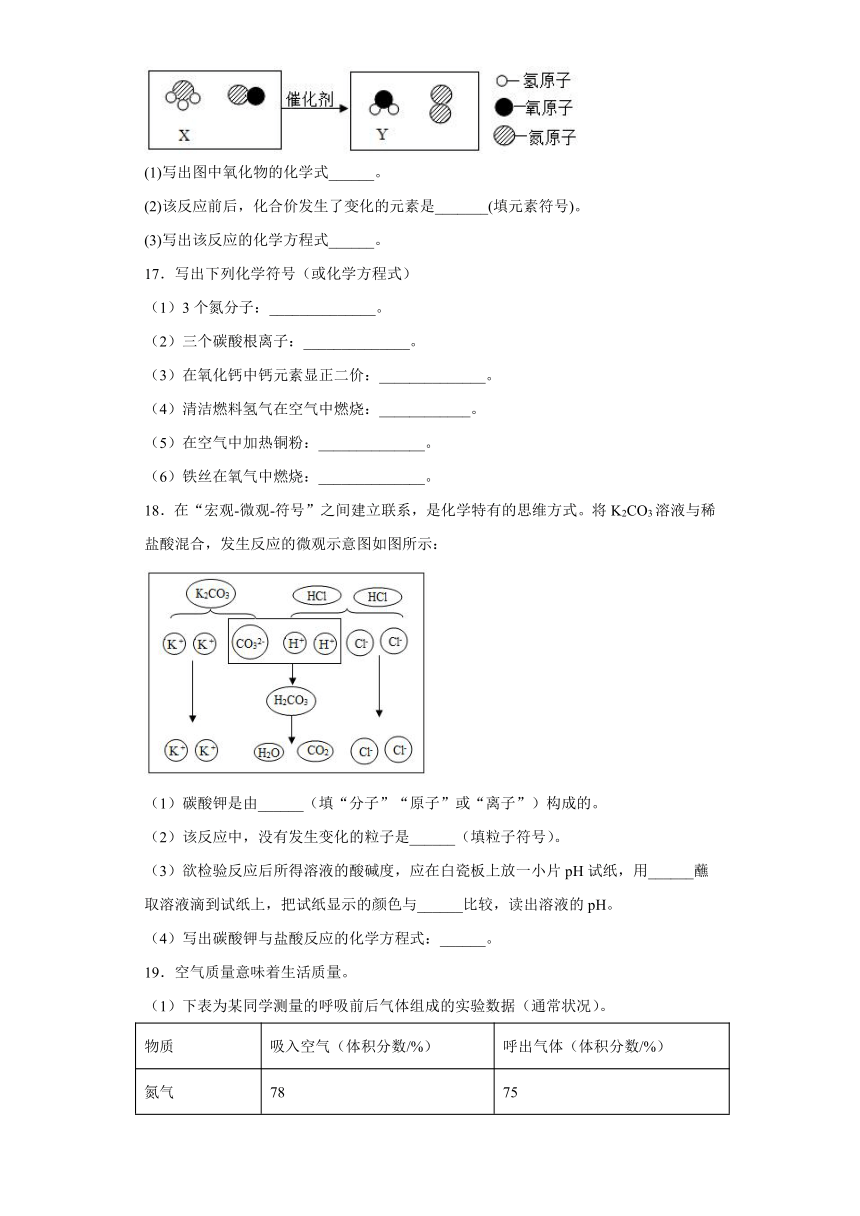
16.如图是某汽车尾气处理过程中发生的一个反应,请回答下列问题。
(1)写出图中氧化物的化学式______。
(2)该反应前后,化合价发生了变化的元素是_______(填元素符号)。
(3)写出该反应的化学方程式______。
17.写出下列化学符号(或化学方程式)
(1)3个氮分子:______________。
(2)三个碳酸根离子:______________。
(3)在氧化钙中钙元素显正二价:______________。
(4)清洁燃料氢气在空气中燃烧:____________。
(5)在空气中加热铜粉:______________。
(6)铁丝在氧气中燃烧:______________。
18.在“宏观-微观-符号”之间建立联系,是化学特有的思维方式。将K2CO3溶液与稀盐酸混合,发生反应的微观示意图如图所示:
(1)碳酸钾是由______(填“分子”“原子”或“离子”)构成的。
(2)该反应中,没有发生变化的粒子是______(填粒子符号)。
(3)欲检验反应后所得溶液的酸碱度,应在白瓷板上放一小片pH试纸,用______蘸取溶液滴到试纸上,把试纸显示的颜色与______比较,读出溶液的pH。
(4)写出碳酸钾与盐酸反应的化学方程式:______。
19.空气质量意味着生活质量。
(1)下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。
物质
吸入空气(体积分数/%)
呼出气体(体积分数/%)
氮气
78
75
氧气
21
16
二氧化碳
0.03
4
水蒸气
a
b
①氮气的化学性质比较______(填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总体积______吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O2产生CO2,该过程______能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较大,实验中其体积分数b______a(填“>”“=”或“<”)。
(2)“远在高空是地球卫士,近在身边是健康杀手。”臭氧(O3)对环境的作用需辩证地认识。
①高空中臭氧层能吸收紫外线,有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(C1),引发以下反应:Ⅰ、Cl+O3=ClO+O2
Ⅱ、,Cl加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是______,该转化过程总反应的化学方程式为______。
②地面附近的臭氧是一种空气污染物,臭氧属于______(填“单质”或“化合物”),O3可表示一个______(填“原子”“分子”或“离子”)。
三、推断题
20.甲、乙、丙是初中化学中常见的物质,其中一种物质为单质,另外两种物质组成元素相同。其转化关系如所示
(1)若甲为单质,则乙为_____;丙为_____。
(2)若丙为单质,则甲为_____;写出③发生反应的化学方程式_____。
21.A~G是初中所学的常见物质,其转化关系如图所示(部分反应物和生成物、反应条件已略去,图中“→”表示生成,“—”表示相互反应),A、B常温下为无色气体且组成元素相同,D为黑色固体,E为红色固体,C是大理石的主要成分。请回答下列问题:
(1)请写出以下物质的化学式:A_______
F_______
G_______;
(2)反应②的基本反应类型是:_______;
(3)写出物质A的一种用途:_______;
(4)写出反应①的化学方程式:_______。
四、实验题
22.下图是实验室常用的装置,请回答下列问题。
(査阅资料)二氧化碳不易溶于饱和碳酸氢钠溶液。
(1)实验室中可用过氧化氢溶液与二氧化锰制取氧气,反应的化学方程式为___________,应选用的发生装置是___________(选填装置字母序号)。
(2)实验室中用石灰石和稀盐酸制取一瓶干燥、纯净的二氧化碳气体,所选装置的连接顺序为:气体发生装置→___________→___________→D(选填装置字母序号)。
(3)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是___________(选填字母序号)。
A
药品容易获得,能生成所要制取的气体
B
反应条件易于控制,反应速率适中
C
操作简使易行,安全可靠,节能环保
D
所要制取气体的颜色和气味
(4)选择序号回答:①与氧气接触②温度达到着火点③有可燃物
图甲所示实验现象,说明燃烧应具备的条件是___________(填序号,下同)。图乙烧杯中蜡烛渐渐熄灭,说明燃烧应具备的条件是_____________。图丙铜片上白磷燃烧红磷不燃烧,说眀燃烧应具备的条件是___________。
23.下图是实验室常用的制备气体的装置。
①仪器a的名称_______________。
②实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应的化学方程式是______________。应选用的发生和收集装置是______________(填序号):图二中,连接仪器的操作,正确的是___________(填序号)。
③能用B、C装置制取的气体是______________。
④实验室常用3%的H2O2溶液在二氧化锰催化作用下获得平稳的氧气流。现有17%的H2O2溶液,能达到此效果的最佳装置是______________。
⑤10g17%H2O2溶液与二氧化锰完全反应,可生成氧气物质的量是__________。(根据化学方程式列式计算)
五、计算题
24.某纯碱样品的主要成分是碳酸钠(
Na2CO3
)和氯化钠(
NaCl
),为测定该纯碱样品中碳酸钠的质量分数。现取8g纯碱样品放入烧杯中并加入92
g稀盐酸,它们二者恰好完全反应。反应后称得烧杯里剩余物质的质量为97.8
g,(提示:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳气体)。
计算:(1)反应生成的CO2的质量是
_____
g。
(2)该纯碱样品中碳酸钠的质量分数是多少?
25.尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下:CO2+2NH3CO(NH2)2+H2O,请计算生产6
t尿素理论上需要氨气的质量。
参考答案
1.C
2.A
3.C
4.B
5.C
6.D
7.A
8.B
9.B
10.C
11.A
12.B
13.C
14.D
15.B
16.H2O和NO
N
17.
(1)3N2
(2)3CO32-
(3)
(4)2H2+O22H2O
(5)2Cu+O22CuO
(6)3Fe+2O2Fe3O4。
18.
(1)离子
(2)K+、Cl-
(3)
玻璃棒
标准比色卡
(4)
19.稳定
>
释放
>
催化作用
单质
分子
20.CO
CO2(合理均可)
H2O2
2H2O2H2↑+O2↑
21.CO
Ca(OH)2
H2O
复分解反应
作燃料
22.
B
G
F
D
③
①
②
23.铁架台
AC
E
CO2或O2等
D
0.025mol
解:10g
17%
H2O2中H2O2物质的量为=0.05mol
设可生成氧气物质的量为x
故填:0.025mol。
24.(1)2.2
(2)解:设纯碱样品中碳酸钠的质量分数是x
答:纯碱样品中碳酸钠的质量分数是66.25%。
25.3.4t
解:设需要氧气质量为x。
x=3.4t
答:氧气质量3.4t。
一、单选题
1.下列各反应中,各物质之间的质量比为1:1:2的是
A.
B.
C.
D.
2.下列说法中不正确的是
A.如果不加入催化剂,过氧化氢就不会分解
B.自然界中的物质都在不断运动
C.增大氧气浓度能促进可燃物的燃烧
D.纯净物组成固定
3.有科学家提出:“硅是未来的石油”,硅能在O2中燃烧生成SiO2,并放出大量的热。硅在元素周期表中的相关信息如图所示。下列说法正确的是
A.硅元素属于金属元素
B.硅元素的相对原子质量是28.09g
C.硅原子的核内质子数为14
D.硅在氧气中燃烧的化学方程式为Si+O2=SiO2
4.下列对宏观事实的微观解释不正确的是
A.铁轨夏天缝隙变小一一分子之间间隔变大
B.篮球充入过量气体—一增大压强,分子的间隔变大
C.一氧化碳和二氧化碳的性质不同一一不同种分子性质不相同
D.过氧化氢在催化剂作用下生成水和氧气一—化学反应中分子发生改变
5.为防止煤气逸散使人中毒,常在煤气中加入少量的有特殊刺激性气味的乙硫醇()。乙硫醇在煤气燃烧过程中也可以充分燃烧,其化学方程式为,则X的化学式为
A.
B.
C.
D.
6.食盐水是由氯化钠溶于水配制成的,电解食盐水可获得一种可溶物和两种气体,下列物质中不可能是该反应生成物的是
A.氢氧化钠
B.氢气
C.氯气
D.二氧化碳
7.为防止硝酸厂产生的氮氧化物污染环境,通常用NaOH溶液吸收这些氮氧化物,反应的化学方程式为:NO+X+2NaOH=2NaNO2+H2O,其中X是
A.NO2
B.NO
C.N2O4
D.N2
8.下图是雷雨天气时空气中两种主要气体发生反应的微观示意图。下列说法错误的是
A.反应前后原子种类不变
B.反应前后分子种类不变
C.反应前后元素化合价发生了变化
D.该反应属于化合反应
9.“远离火灾,珍爱生命,共建平安家园”,下列说法错误的是
A.厨房煤气管道漏气,立即关闭阀门并开窗通风
B.面粉在有限的空间遇到明火会急剧燃烧,但不会发生爆炸
C.燃着的酒精灯不慎碰倒而着火,应立即用湿抹布扑盖
D.救火时,不要贸然打开所有门,以免空气对流促进火势蔓延
10.调查统计表明,很多火灾伤亡事故是由于缺乏自救常识造成的。下列自救措施处理不当的是
A.酒精洒在实验台上着火时,立即用湿布盖灭
B.炒菜时油锅中的油不慎着火,立即用锅盖灭火
C.工作中的电器着火时,立即用水进行灭火
D.发现煤气泄漏时,立即关闭煤气阀门,并用湿毛巾捂住口鼻,打开门窗
11.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
物质
a
b
c
d
反应前质量/g
64
32
40
1.0
反应后质量/g
特测
25.6
72
1.0
下列说法中错误的是
A.反应后a物质的质量为46.4g
B.a和b是反应物,d可能是催化剂
C.c物质中元素的种类,一定和a、b两种物质中元素的种类相同
D.若a物质与b物质的式量之比为4:1,则反应中a与b的物质的量之比为1:1
12.已知A+3B=2C+3D中,2.3gA跟4.8gB恰好完全反应生成4.4gC,又知D的相对分子质量为18,则B的相对分子质量为
A.48
B.32
C.16
D.96
13.推理是一种重要的化学学习方法。下列推理正确的是
A.N2、O2、H2是由分子构成的,所以气体都是由分子构成的
B.H2O、MgO、CO2都属于氧化物,所以含有氧元素的化合物都是氧化物
C.任何化学反应都遵循质量守恒定律,所以化学反应前后物质的总质量不变
D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中剧烈燃烧
14.科学家采用组合转化技术,可将二氧化碳在一定条件下转化为有机物一乙烯,其反应的微观过程如图所示。下列说法正确的是
A.乙烯的化学式为CH2
B.图中的物质属于氧化物的只有一种
C.该反应生成了三种物质
D.参加反应的两种分子的个数比是1:3
15.豆腐中含有多种人体所需的氨基酸,其中含量最多的是亮氨酸(化学式C6H13NO2),下列说法正确的是
A.从类别上看:亮氨酸属于氧化物
B.从组成上看:亮氢酸由碳、氢、氮、氧四种元素组成,其中碳元素的质量分数最大
C.从变化上看:亮氨酸完全燃烧只生成一氧化碳和水
D.从构成上看:亮氨酸由
6
个碳原子、13
个氢原子、1
个氮原子、2
个氧原子构成
二、填空题
16.如图是某汽车尾气处理过程中发生的一个反应,请回答下列问题。
(1)写出图中氧化物的化学式______。
(2)该反应前后,化合价发生了变化的元素是_______(填元素符号)。
(3)写出该反应的化学方程式______。
17.写出下列化学符号(或化学方程式)
(1)3个氮分子:______________。
(2)三个碳酸根离子:______________。
(3)在氧化钙中钙元素显正二价:______________。
(4)清洁燃料氢气在空气中燃烧:____________。
(5)在空气中加热铜粉:______________。
(6)铁丝在氧气中燃烧:______________。
18.在“宏观-微观-符号”之间建立联系,是化学特有的思维方式。将K2CO3溶液与稀盐酸混合,发生反应的微观示意图如图所示:
(1)碳酸钾是由______(填“分子”“原子”或“离子”)构成的。
(2)该反应中,没有发生变化的粒子是______(填粒子符号)。
(3)欲检验反应后所得溶液的酸碱度,应在白瓷板上放一小片pH试纸,用______蘸取溶液滴到试纸上,把试纸显示的颜色与______比较,读出溶液的pH。
(4)写出碳酸钾与盐酸反应的化学方程式:______。
19.空气质量意味着生活质量。
(1)下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。
物质
吸入空气(体积分数/%)
呼出气体(体积分数/%)
氮气
78
75
氧气
21
16
二氧化碳
0.03
4
水蒸气
a
b
①氮气的化学性质比较______(填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总体积______吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O2产生CO2,该过程______能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较大,实验中其体积分数b______a(填“>”“=”或“<”)。
(2)“远在高空是地球卫士,近在身边是健康杀手。”臭氧(O3)对环境的作用需辩证地认识。
①高空中臭氧层能吸收紫外线,有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(C1),引发以下反应:Ⅰ、Cl+O3=ClO+O2
Ⅱ、,Cl加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是______,该转化过程总反应的化学方程式为______。
②地面附近的臭氧是一种空气污染物,臭氧属于______(填“单质”或“化合物”),O3可表示一个______(填“原子”“分子”或“离子”)。
三、推断题
20.甲、乙、丙是初中化学中常见的物质,其中一种物质为单质,另外两种物质组成元素相同。其转化关系如所示
(1)若甲为单质,则乙为_____;丙为_____。
(2)若丙为单质,则甲为_____;写出③发生反应的化学方程式_____。
21.A~G是初中所学的常见物质,其转化关系如图所示(部分反应物和生成物、反应条件已略去,图中“→”表示生成,“—”表示相互反应),A、B常温下为无色气体且组成元素相同,D为黑色固体,E为红色固体,C是大理石的主要成分。请回答下列问题:
(1)请写出以下物质的化学式:A_______
F_______
G_______;
(2)反应②的基本反应类型是:_______;
(3)写出物质A的一种用途:_______;
(4)写出反应①的化学方程式:_______。
四、实验题
22.下图是实验室常用的装置,请回答下列问题。
(査阅资料)二氧化碳不易溶于饱和碳酸氢钠溶液。
(1)实验室中可用过氧化氢溶液与二氧化锰制取氧气,反应的化学方程式为___________,应选用的发生装置是___________(选填装置字母序号)。
(2)实验室中用石灰石和稀盐酸制取一瓶干燥、纯净的二氧化碳气体,所选装置的连接顺序为:气体发生装置→___________→___________→D(选填装置字母序号)。
(3)确定实验室制取气体的反应原理时,下列因素中不需要考虑的是___________(选填字母序号)。
A
药品容易获得,能生成所要制取的气体
B
反应条件易于控制,反应速率适中
C
操作简使易行,安全可靠,节能环保
D
所要制取气体的颜色和气味
(4)选择序号回答:①与氧气接触②温度达到着火点③有可燃物
图甲所示实验现象,说明燃烧应具备的条件是___________(填序号,下同)。图乙烧杯中蜡烛渐渐熄灭,说明燃烧应具备的条件是_____________。图丙铜片上白磷燃烧红磷不燃烧,说眀燃烧应具备的条件是___________。
23.下图是实验室常用的制备气体的装置。
①仪器a的名称_______________。
②实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应的化学方程式是______________。应选用的发生和收集装置是______________(填序号):图二中,连接仪器的操作,正确的是___________(填序号)。
③能用B、C装置制取的气体是______________。
④实验室常用3%的H2O2溶液在二氧化锰催化作用下获得平稳的氧气流。现有17%的H2O2溶液,能达到此效果的最佳装置是______________。
⑤10g17%H2O2溶液与二氧化锰完全反应,可生成氧气物质的量是__________。(根据化学方程式列式计算)
五、计算题
24.某纯碱样品的主要成分是碳酸钠(
Na2CO3
)和氯化钠(
NaCl
),为测定该纯碱样品中碳酸钠的质量分数。现取8g纯碱样品放入烧杯中并加入92
g稀盐酸,它们二者恰好完全反应。反应后称得烧杯里剩余物质的质量为97.8
g,(提示:碳酸钠和盐酸反应生成氯化钠、水和二氧化碳气体)。
计算:(1)反应生成的CO2的质量是
_____
g。
(2)该纯碱样品中碳酸钠的质量分数是多少?
25.尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下:CO2+2NH3CO(NH2)2+H2O,请计算生产6
t尿素理论上需要氨气的质量。
参考答案
1.C
2.A
3.C
4.B
5.C
6.D
7.A
8.B
9.B
10.C
11.A
12.B
13.C
14.D
15.B
16.H2O和NO
N
17.
(1)3N2
(2)3CO32-
(3)
(4)2H2+O22H2O
(5)2Cu+O22CuO
(6)3Fe+2O2Fe3O4。
18.
(1)离子
(2)K+、Cl-
(3)
玻璃棒
标准比色卡
(4)
19.稳定
>
释放
>
催化作用
单质
分子
20.CO
CO2(合理均可)
H2O2
2H2O2H2↑+O2↑
21.CO
Ca(OH)2
H2O
复分解反应
作燃料
22.
B
G
F
D
③
①
②
23.铁架台
AC
E
CO2或O2等
D
0.025mol
解:10g
17%
H2O2中H2O2物质的量为=0.05mol
设可生成氧气物质的量为x
故填:0.025mol。
24.(1)2.2
(2)解:设纯碱样品中碳酸钠的质量分数是x
答:纯碱样品中碳酸钠的质量分数是66.25%。
25.3.4t
解:设需要氧气质量为x。
x=3.4t
答:氧气质量3.4t。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
