2021-2022学年上学期高一化学苏教版(2019)必修第一册专题2《研究物质的基本方法》测试题(含答案)
文档属性
| 名称 | 2021-2022学年上学期高一化学苏教版(2019)必修第一册专题2《研究物质的基本方法》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 379.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-14 06:55:57 | ||
图片预览

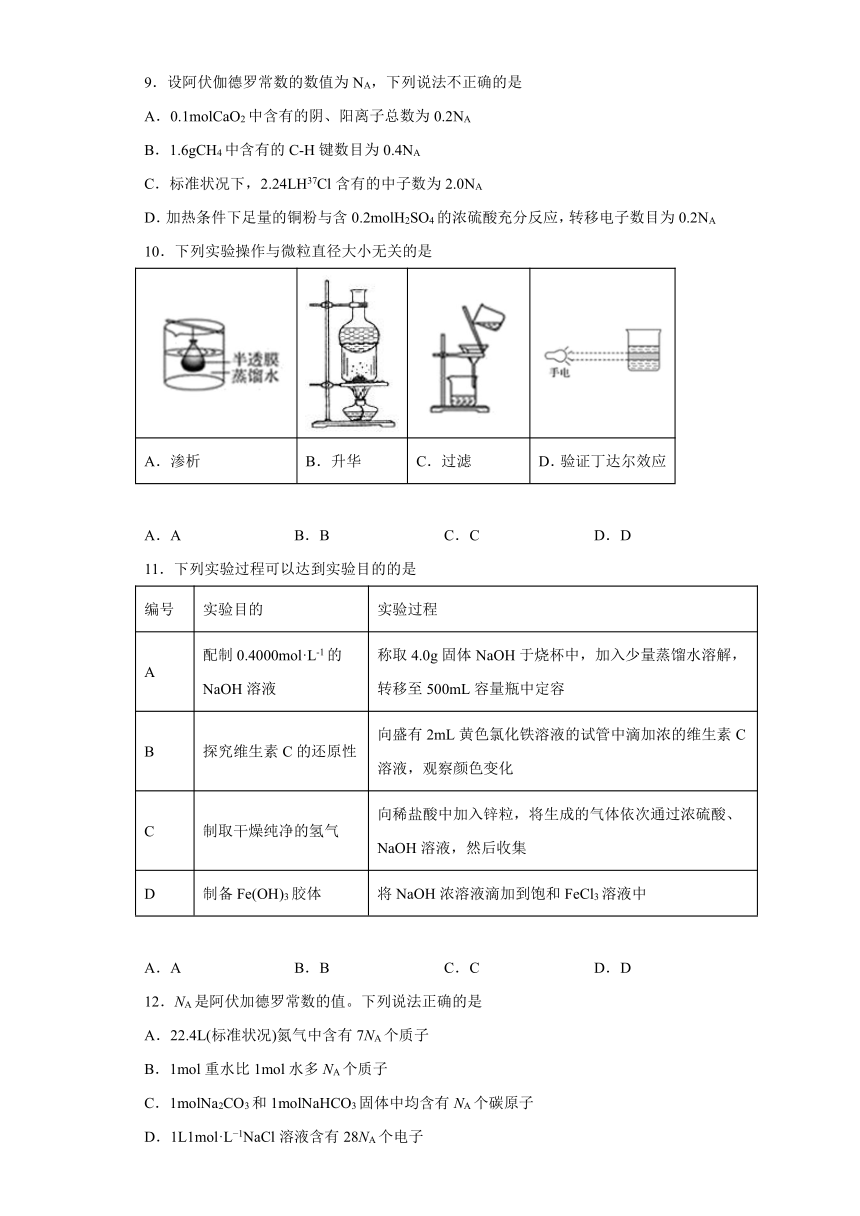

文档简介
专题2《研究物质的基本方法》测试题
一、单选题(共15题)
1.Sr(Sr,中文名“锶”)是一种放射性同位素核电池的能量来源。下列关于Sr的说法中,不正确的是
A.质子数为38
B.核外电子数为90
C.中子数为52
D.质量数为90
2.向含有Hg2+的废水中加入Na2S使其转化为HgS沉淀而除去,采用的处理方法是
A.沉淀法
B.氧化还原法
C.中和法
D.混凝法
3.西安市城市生活垃圾分为(
)
A.可回收物、其他垃圾、有害垃圾、厨余垃圾
B.可回收物、不可回收物、厨余垃圾、玻璃垃圾
C.可降解垃圾、可回收垃圾、有害垃圾、其他垃圾
D.有害垃圾、可回收垃圾、玻璃垃圾、其他垃圾
4.某种化学品安全使用标识如图所示,其示意为
A.易燃类物质
B.爆炸类物质
C.腐蚀类物质
D.毒性物质
5.X元素的化合价是+m价,Y元素的化合价是-n价,那么X元素与Y元素组成的化合物一个分子中,原子个数
A.一定是m个
B.一定是n个
C.一定是(m+n)个
D.可能是(m+n)个
6.下列实验操作正确的是
A.分液时,下层液体从分液漏斗的下端流下
B.使用容量瓶配制溶液,定容时仰视刻度线
C.蒸发时,待混合物中的水分完全蒸干后停止加热
D.向试管中滴加液体时,胶头滴管下端紧贴试管内壁
7.取100mL0.3mol·L-1的硫酸溶液和300mL0.25mol·L-1的硫酸溶液混合后加水稀释至500mL,该混合溶液中H+的物质的量浓度是
A.0.21mol·L-1
B.0.42mol·L-1
C.0.56mol·L-1
D.0.26mol·L-1
8.下列溶液中Cl-的物质的量浓度最大的是
A.500mL5mol·L-1KClO3溶液
B.1000mL2mol·L-1NaCl溶液
C.250mL1mol·L-1AlCl3溶液
D.100mL2mol·L-1MgCl2溶液
9.设阿伏伽德罗常数的数值为NA,下列说法不正确的是
A.0.1molCaO2中含有的阴、阳离子总数为0.2NA
B.1.6gCH4中含有的C-H键数目为0.4NA
C.标准状况下,2.24LH37Cl含有的中子数为2.0NA
D.加热条件下足量的铜粉与含0.2molH2SO4的浓硫酸充分反应,转移电子数目为0.2NA
10.下列实验操作与微粒直径大小无关的是
A.渗析
B.升华
C.过滤
D.验证丁达尔效应
A.A
B.B
C.C
D.D
11.下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000mol·L-1的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容
B
探究维生素C的还原性
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取干燥纯净的氢气
向稀盐酸中加入锌粒,将生成的气体依次通过浓硫酸、NaOH溶液,然后收集
D
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
A.A
B.B
C.C
D.D
12.NA是阿伏加德罗常数的值。下列说法正确的是
A.22.4L(标准状况)氮气中含有7NA个质子
B.1mol重水比1mol水多NA个质子
C.1molNa2CO3和1molNaHCO3固体中均含有NA个碳原子
D.1L1mol·L?1NaCl溶液含有28NA个电子
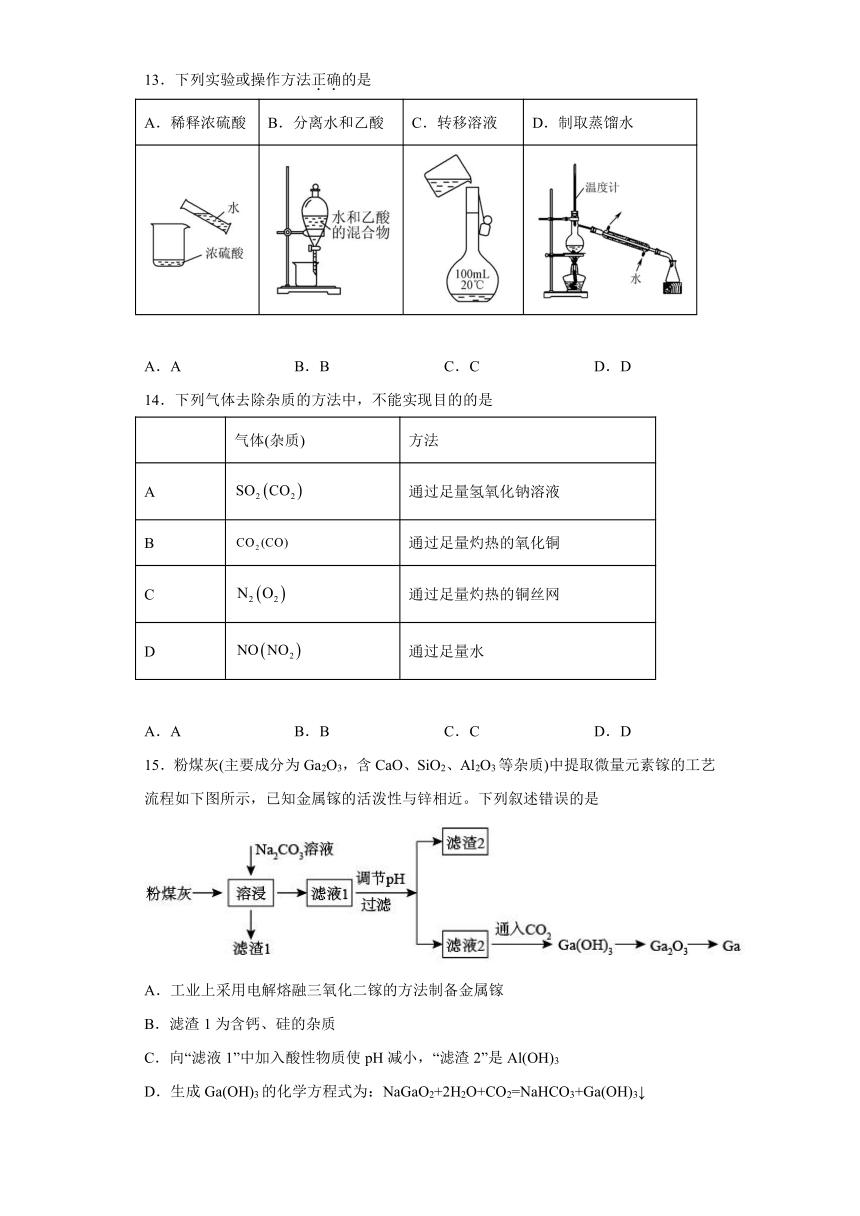
13.下列实验或操作方法正确的是
A.稀释浓硫酸
B.分离水和乙酸
C.转移溶液
D.制取蒸馏水
A.A
B.B
C.C
D.D
14.下列气体去除杂质的方法中,不能实现目的的是
气体(杂质)
方法
A
通过足量氢氧化钠溶液
B
通过足量灼热的氧化铜
C
通过足量灼热的铜丝网
D
通过足量水
A.A
B.B
C.C
D.D
15.粉煤灰(主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质)中提取微量元素镓的工艺流程如下图所示,已知金属镓的活泼性与锌相近。下列叙述错误的是
A.工业上采用电解熔融三氧化二镓的方法制备金属镓
B.滤渣1为含钙、硅的杂质
C.向“滤液1”中加入酸性物质使pH减小,“滤渣2”是Al(OH)3
D.生成Ga(OH)3的化学方程式为:NaGaO2+2H2O+CO2=NaHCO3+Ga(OH)3↓
二、填空题(共8题)
16.用硼镁矿(主要成分为,含、、铁和铝的氧化物等杂质)生产硼酸并回收硫酸镁的工艺流程如图:
加热硫酸镁晶体,得到硫酸镁固体,则硫酸镁晶体的结晶水含量x=_______。
17.完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀
b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸
d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24
L
Cl2的质量为__________;有__________个氯原子。
(3)10.8g
R2O5中氧原子的数目为3.01×1023,
则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a
g某气体中含有的分子数为b,则c
g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl?)之比为____________
。
18.某工业废水中含有大量的Cu2+、Fe2+、Fe3+和,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
请回答:
(1)下列叙述正确的是_______
A.滤渣A为Fe和Cu的混合物
B.试剂b为盐酸
C.步骤II可以分离出Cu,并能得到FeSO4
D.步骤III为蒸发结晶
(2)步骤I发生反应的离子方程式为Fe+Cu2+=Fe2++Cu和_______;
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是_______;
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)____。
19.某化学兴趣小组对坚铝(主要成分是Al、Mg、Cu等)进行如下图所示的实验。
(1)(I)和(II)步骤中分离溶液和沉淀的操作名称是____________;
(2)固体A中主要含有____________;固体B是___________(填化学式);
(3)滤液Y中的阴离子除OH—、Cl—外,还有______________;
(4)写出(IV)步骤反应的化学方程式:_______________________________________。
20.I.(1)标准状况下VmLCH4气体所含a个氢原子则NA=_________。
(2)相同条件下等质量的CO和CO2气体的体积之比_____,密度之比_____。
(3)100mL的硫酸铝溶液中c(Al3+)=__________,5mL该溶液中的数目_____。(设阿伏伽德罗常数为NA)
II.乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
(1)乙酸的摩尔质量为__________。
(2)若该乙酸溶液的密度为,则此乙酸溶液的物质的量浓度表达式为_________。
(3)某实验中要用的乙酸溶液200mL,则需用_______量取上述乙酸溶液______mL进行稀释。
21.酒后驾驶危害极大,根据国家有关规定,车辆驾驶人员血液中的酒精含量达到20mg/100mL以上时,可判定为饮酒驾驶或醉酒驾驶。
请参考宣传图片回答问题:
(1)请用物质的量浓度表示酒后驾车标准:饮酒驾驶___。
(2)在一次执法过程中,交警部门查到某位机动车驾驶员恰好达到醉酒驾车标准,已知成人体内血液总体积平均为5.0L,则该驾驶员体内血液中累积的酒精物质的量至少是__。
22.某同学帮助水质检测站配制480mL0.5mol/LNaOH溶液以备使用。
(1)该同学应选择___mL容量瓶。
(2)该同学应称取NaOH固体___g;将质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在下表中选取所需的砝码___(填字母,下同);图中能正确表示游码位置的是___。
a
b
c
d
e
砝码大小/g
100
50
20
10
5
(3)下列操作对所配溶液中溶质的物质的量浓度大小有何影响?
①转移溶液后未洗涤玻璃棒和烧杯,溶液浓度会___(填"偏大""偏小"或"无影响",下同);②容量瓶中原来有少量蒸馏水,溶液浓度会___;③溶液未冷却就转移至容量瓶,溶液浓度会___。
23.中医药典记载木耳具有“和血养营”功效(治疗贫血症的功效)。项目小组设计并通过下列实验流程检测木耳中是否含有铁元素。
(1)“灼烧”所使用的容器是_______。“灼烧”时,木耳中的有机质先逐步碳化,后逐步氧化为CO和CO2。“灼烧”过程中铁元素可能存在的化合价形态有_______。
(2)“酸浸”时,氧化铁和盐酸反应的化学方程式为_______。加入氯水时发生的离子反应方程式是_______。
(3)“检测”步骤的实验过程为_______。检测铁离子的化学反应方程式为_______。
参考答案
1.B
2.A
3.A
4.D
5.D
6.A
7.B
8.D
9.D
10.B
11.B
12.C
13.D
14.A
15.A
16.7
17.SO2
BaCl2、KOH、CaO
SO2、C2H5OH
bc
7.1g
0.2
NA
14
氮
L
3:13
1:2:3
18.AC
Fe+2Fe3+=3Fe2+
产生白色沉淀,迅速变为灰绿色,最后变成红褐色
取少量绿矾晶体(FeSO4·7H2O)于试管中,加水溶解,再滴加KSCN溶液,若溶液变为血红色,则绿矾晶体有被氧化
19.过滤
Cu(或铜)
Mg(OH)2
[Al(OH)4]-
2Al(OH)3Al2O3+3H2O
20.
11:7
7:11
4
mol/L
0.03NA
60
g·mol-1
100mL量筒
65.4
21.0.0043mol/L
0.087mol
22.500
10.0
cd
c
偏小
无影响
偏大
23.坩埚
+2和+3
取少量过滤后所得的滤液,向其中滴加少量的硫氰化钾溶液,若溶液变为血红色,则可证明干木耳中含有铁元素,否则不含铁元素
一、单选题(共15题)
1.Sr(Sr,中文名“锶”)是一种放射性同位素核电池的能量来源。下列关于Sr的说法中,不正确的是
A.质子数为38
B.核外电子数为90
C.中子数为52
D.质量数为90
2.向含有Hg2+的废水中加入Na2S使其转化为HgS沉淀而除去,采用的处理方法是
A.沉淀法
B.氧化还原法
C.中和法
D.混凝法
3.西安市城市生活垃圾分为(
)
A.可回收物、其他垃圾、有害垃圾、厨余垃圾
B.可回收物、不可回收物、厨余垃圾、玻璃垃圾
C.可降解垃圾、可回收垃圾、有害垃圾、其他垃圾
D.有害垃圾、可回收垃圾、玻璃垃圾、其他垃圾
4.某种化学品安全使用标识如图所示,其示意为
A.易燃类物质
B.爆炸类物质
C.腐蚀类物质
D.毒性物质
5.X元素的化合价是+m价,Y元素的化合价是-n价,那么X元素与Y元素组成的化合物一个分子中,原子个数
A.一定是m个
B.一定是n个
C.一定是(m+n)个
D.可能是(m+n)个
6.下列实验操作正确的是
A.分液时,下层液体从分液漏斗的下端流下
B.使用容量瓶配制溶液,定容时仰视刻度线
C.蒸发时,待混合物中的水分完全蒸干后停止加热
D.向试管中滴加液体时,胶头滴管下端紧贴试管内壁
7.取100mL0.3mol·L-1的硫酸溶液和300mL0.25mol·L-1的硫酸溶液混合后加水稀释至500mL,该混合溶液中H+的物质的量浓度是
A.0.21mol·L-1
B.0.42mol·L-1
C.0.56mol·L-1
D.0.26mol·L-1
8.下列溶液中Cl-的物质的量浓度最大的是
A.500mL5mol·L-1KClO3溶液
B.1000mL2mol·L-1NaCl溶液
C.250mL1mol·L-1AlCl3溶液
D.100mL2mol·L-1MgCl2溶液
9.设阿伏伽德罗常数的数值为NA,下列说法不正确的是
A.0.1molCaO2中含有的阴、阳离子总数为0.2NA
B.1.6gCH4中含有的C-H键数目为0.4NA
C.标准状况下,2.24LH37Cl含有的中子数为2.0NA
D.加热条件下足量的铜粉与含0.2molH2SO4的浓硫酸充分反应,转移电子数目为0.2NA
10.下列实验操作与微粒直径大小无关的是
A.渗析
B.升华
C.过滤
D.验证丁达尔效应
A.A
B.B
C.C
D.D
11.下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000mol·L-1的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容
B
探究维生素C的还原性
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取干燥纯净的氢气
向稀盐酸中加入锌粒,将生成的气体依次通过浓硫酸、NaOH溶液,然后收集
D
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
A.A
B.B
C.C
D.D
12.NA是阿伏加德罗常数的值。下列说法正确的是
A.22.4L(标准状况)氮气中含有7NA个质子
B.1mol重水比1mol水多NA个质子
C.1molNa2CO3和1molNaHCO3固体中均含有NA个碳原子
D.1L1mol·L?1NaCl溶液含有28NA个电子
13.下列实验或操作方法正确的是
A.稀释浓硫酸
B.分离水和乙酸
C.转移溶液
D.制取蒸馏水
A.A
B.B
C.C
D.D
14.下列气体去除杂质的方法中,不能实现目的的是
气体(杂质)
方法
A
通过足量氢氧化钠溶液
B
通过足量灼热的氧化铜
C
通过足量灼热的铜丝网
D
通过足量水
A.A
B.B
C.C
D.D
15.粉煤灰(主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质)中提取微量元素镓的工艺流程如下图所示,已知金属镓的活泼性与锌相近。下列叙述错误的是
A.工业上采用电解熔融三氧化二镓的方法制备金属镓
B.滤渣1为含钙、硅的杂质
C.向“滤液1”中加入酸性物质使pH减小,“滤渣2”是Al(OH)3
D.生成Ga(OH)3的化学方程式为:NaGaO2+2H2O+CO2=NaHCO3+Ga(OH)3↓
二、填空题(共8题)
16.用硼镁矿(主要成分为,含、、铁和铝的氧化物等杂质)生产硼酸并回收硫酸镁的工艺流程如图:
加热硫酸镁晶体,得到硫酸镁固体,则硫酸镁晶体的结晶水含量x=_______。
17.完成下列各题:
(1)现有下列9种物质:①氯气;②二氧化硫;③氢氧化铁胶体;④铁;⑤氯化钡;⑥氢氧化钾;⑦氯化铁溶液;⑧酒精(C2H5OH);⑨氧化钙。
用相应化学式填写下列空白:属于酸性氧化物的有____,属于电解质的是______,属于非电解质的_______。(用相应化学式填空)
下列关于③和⑦的说法正确的是____(填字母序号)。
a.都不稳定,密封静置会产生沉淀
b.③能产生丁达尔效应,而⑦不能
c.分散质粒子都可以通过滤纸
d.加入盐酸都会先产生沉淀,后溶解
(2)标准状况下,2.24
L
Cl2的质量为__________;有__________个氯原子。
(3)10.8g
R2O5中氧原子的数目为3.01×1023,
则元素R的相对原子质量为________;R元素名称是_______。
(4)如果a
g某气体中含有的分子数为b,则c
g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
(6)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为5∶3∶2时,三种溶液中c(Cl?)之比为____________
。
18.某工业废水中含有大量的Cu2+、Fe2+、Fe3+和,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
请回答:
(1)下列叙述正确的是_______
A.滤渣A为Fe和Cu的混合物
B.试剂b为盐酸
C.步骤II可以分离出Cu,并能得到FeSO4
D.步骤III为蒸发结晶
(2)步骤I发生反应的离子方程式为Fe+Cu2+=Fe2++Cu和_______;
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是_______;
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)____。
19.某化学兴趣小组对坚铝(主要成分是Al、Mg、Cu等)进行如下图所示的实验。
(1)(I)和(II)步骤中分离溶液和沉淀的操作名称是____________;
(2)固体A中主要含有____________;固体B是___________(填化学式);
(3)滤液Y中的阴离子除OH—、Cl—外,还有______________;
(4)写出(IV)步骤反应的化学方程式:_______________________________________。
20.I.(1)标准状况下VmLCH4气体所含a个氢原子则NA=_________。
(2)相同条件下等质量的CO和CO2气体的体积之比_____,密度之比_____。
(3)100mL的硫酸铝溶液中c(Al3+)=__________,5mL该溶液中的数目_____。(设阿伏伽德罗常数为NA)
II.乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
(1)乙酸的摩尔质量为__________。
(2)若该乙酸溶液的密度为,则此乙酸溶液的物质的量浓度表达式为_________。
(3)某实验中要用的乙酸溶液200mL,则需用_______量取上述乙酸溶液______mL进行稀释。
21.酒后驾驶危害极大,根据国家有关规定,车辆驾驶人员血液中的酒精含量达到20mg/100mL以上时,可判定为饮酒驾驶或醉酒驾驶。
请参考宣传图片回答问题:
(1)请用物质的量浓度表示酒后驾车标准:饮酒驾驶___。
(2)在一次执法过程中,交警部门查到某位机动车驾驶员恰好达到醉酒驾车标准,已知成人体内血液总体积平均为5.0L,则该驾驶员体内血液中累积的酒精物质的量至少是__。
22.某同学帮助水质检测站配制480mL0.5mol/LNaOH溶液以备使用。
(1)该同学应选择___mL容量瓶。
(2)该同学应称取NaOH固体___g;将质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在下表中选取所需的砝码___(填字母,下同);图中能正确表示游码位置的是___。
a
b
c
d
e
砝码大小/g
100
50
20
10
5
(3)下列操作对所配溶液中溶质的物质的量浓度大小有何影响?
①转移溶液后未洗涤玻璃棒和烧杯,溶液浓度会___(填"偏大""偏小"或"无影响",下同);②容量瓶中原来有少量蒸馏水,溶液浓度会___;③溶液未冷却就转移至容量瓶,溶液浓度会___。
23.中医药典记载木耳具有“和血养营”功效(治疗贫血症的功效)。项目小组设计并通过下列实验流程检测木耳中是否含有铁元素。
(1)“灼烧”所使用的容器是_______。“灼烧”时,木耳中的有机质先逐步碳化,后逐步氧化为CO和CO2。“灼烧”过程中铁元素可能存在的化合价形态有_______。
(2)“酸浸”时,氧化铁和盐酸反应的化学方程式为_______。加入氯水时发生的离子反应方程式是_______。
(3)“检测”步骤的实验过程为_______。检测铁离子的化学反应方程式为_______。
参考答案
1.B
2.A
3.A
4.D
5.D
6.A
7.B
8.D
9.D
10.B
11.B
12.C
13.D
14.A
15.A
16.7
17.SO2
BaCl2、KOH、CaO
SO2、C2H5OH
bc
7.1g
0.2
NA
14
氮
L
3:13
1:2:3
18.AC
Fe+2Fe3+=3Fe2+
产生白色沉淀,迅速变为灰绿色,最后变成红褐色
取少量绿矾晶体(FeSO4·7H2O)于试管中,加水溶解,再滴加KSCN溶液,若溶液变为血红色,则绿矾晶体有被氧化
19.过滤
Cu(或铜)
Mg(OH)2
[Al(OH)4]-
2Al(OH)3Al2O3+3H2O
20.
11:7
7:11
4
mol/L
0.03NA
60
g·mol-1
100mL量筒
65.4
21.0.0043mol/L
0.087mol
22.500
10.0
cd
c
偏小
无影响
偏大
23.坩埚
+2和+3
取少量过滤后所得的滤液,向其中滴加少量的硫氰化钾溶液,若溶液变为血红色,则可证明干木耳中含有铁元素,否则不含铁元素
