2021-2022学年上学期高一化学人教版(2019)必修第一册第4章《物质结构元素周期律》测试题(含答案)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第4章《物质结构元素周期律》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 361.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-14 12:38:37 | ||
图片预览




文档简介
第4章《物质结构元素周期律》测试题
一、单选题(共14题)
1.下列属于离子化合物的是
A.Mg
B.H2O
C.NaCl
D.CO
2.下列化合物中阳离子与阴离子半径比值最大的是
A.CaF2
B.MgI2
C.NaCl
D.KF
3.1869年,俄国化学家门捷列夫制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,随着人们对科学的认识不断深入,终于使门捷列夫元素周期表变得完整。下图是元素周期表的一部分,请回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
下列叙述正确的是
A.元素③的氢化物水溶液呈酸性
B.元素⑥的原子半径在同周期元素中最大
C.元素⑦的氧化物是两性氧化物
D.元素⑤的最高价为+7
4.某工厂的废液中含有CCl4、I2、I-等物质,其提取碘的过程如图所示。下列说法错误的是
A.还原过程发生反应的离子方程式为+I2+H2O=2I-++2H+
B.用淀粉检验所富集碘的溶液中是否含有I-
C.操作X的名称为分液
D.氧化过程通入Cl2是为了提取碘
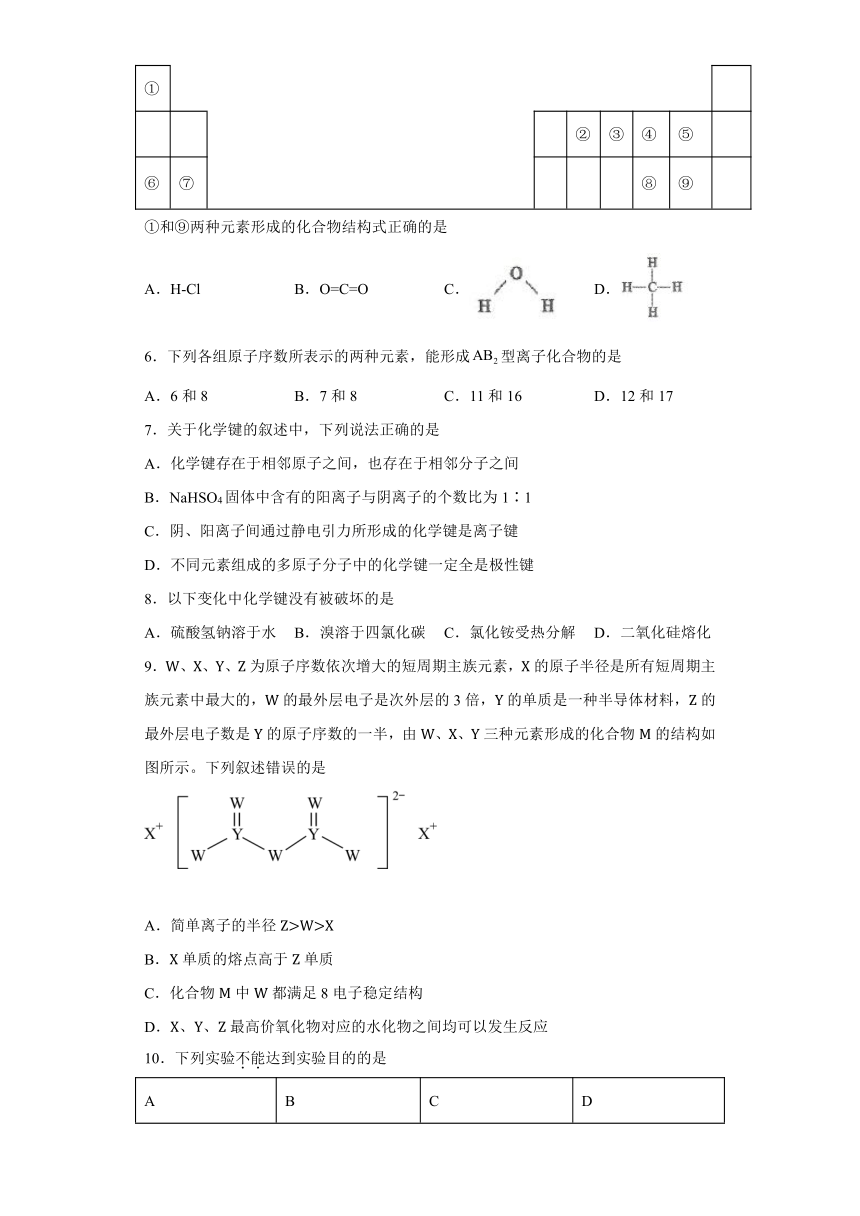
5.1869年,俄国化学家门捷列夫制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,随着人们对科学的认识不断深入,终于使门捷列夫元素周期表变得完整。下图是元素周期表的一部分,请回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
①和⑨两种元素形成的化合物结构式正确的是
A.H-Cl
B.O=C=O
C.
D.
6.下列各组原子序数所表示的两种元素,能形成型离子化合物的是
A.6和8
B.7和8
C.11和16
D.12和17
7.关于化学键的叙述中,下列说法正确的是
A.化学键存在于相邻原子之间,也存在于相邻分子之间
B.NaHSO4固体中含有的阳离子与阴离子的个数比为1∶1
C.阴、阳离子间通过静电引力所形成的化学键是离子键
D.不同元素组成的多原子分子中的化学键一定全是极性键
8.以下变化中化学键没有被破坏的是
A.硫酸氢钠溶于水
B.溴溶于四氯化碳
C.氯化铵受热分解
D.二氧化硅熔化
9.、、、为原子序数依次增大的短周期主族元素,的原子半径是所有短周期主族元素中最大的,的最外层电子是次外层的3倍,的单质是一种半导体材料,的最外层电子数是的原子序数的一半,由、、三种元素形成的化合物的结构如图所示。下列叙述错误的是
A.简单离子的半径
B.单质的熔点高于单质
C.化合物中都满足8电子稳定结构
D.、、最高价氧化物对应的水化物之间均可以发生反应
10.下列实验不能达到实验目的的是
A
B
C
D
证明碳酸钠热稳定性比碳酸氢钠高
收集气体
证明醋酸酸性比硼酸强
证明氧化性:
A.A
B.B
C.C
D.D
11.下列说法正确的是
A.正丁烷和异丁烷是同系物
B.H2O和D2O互为同素异形体
C.和为同一物质
D.235U和238U互为同位素,物理性质几乎相同,化学性质不同
12.W、X、Y、Z是原子序数依次增大的短周期主族元素。a、b、c是由这些元素组成的二元化合物,且均含Z元素;甲是X元素的单质,室温下0.1
mol·L-1丙溶液pH=1,上述物质的转化关系如图所示。下列说法错误的是
A.原子半径:X>Y>Z
B.氢化物的沸点:Z>X
C.最高价氧化物对应水化物的酸性:Y>X
D.W、X、Y、Z形成的化合物可能既含离子键又含共价键
13.下列离子方程式正确的是
A.Fe3O4溶于足量氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=+4+2H2O
C.工业制备漂白粉:Cl2+2OH-=ClO-+Cl-+H2O
D.Ca(OH)2溶液和少量的NaHCO3溶液反应:+Ca2++OH-=CaCO3↓+H2O
14.不能用元素周期律解释的是
A.酸性:H2SO3>H2CO3
B.碱性:LiOH>Be(OH)2
C.热稳定性:HCl>PH3
D.相同条件下与水反应的剧烈程度:Na>Al
二、填空题(共10题)
15.将高温水蒸气通到硫氰化钾的表面,会发生反应:。完成下列填空:
(1)上述反应所涉及的各元素中,简单离子半径最大的是_______(填写离子符号);中含有的化学键类型是_______。
(2)上述反应所涉及的各物质中,属于非电解质的是_______。
(3)写出的电子式_______,其熔沸点比低的原因是_______。
(4)写出实验室制备并检验气体的离子方程式:_______、_______。
(5)接触潮湿银器表面时,出现黑色斑点,其化学反应如下:
__________________________________________
①配平上述反应_____。
②每消耗标准状况下,转移电子的数目为_______。
16.钾云母是一种重要的化工原料,可用氧化物的形式表示为。回答下列问题:
(1)K元素的原子结构示意图为___________;Al在元素周期表中的位置为___________。
(2)上述四种氧化物中,属于典型离子化合物的氧化物的电子式为___________。
(3)H、O、Al、K元素中,形成简单离子的半径由大到小的顺序为___________(填离子符号)。
(4)将大小相同的K、Al分别加入等量水,与水剧烈反应的元素是___________;把剧烈反应后的溶液滴入少量氯化铝溶液中产生的现象是___________。
(5)依据元素周期表的知识和下列试剂,设计实验证明原子得电子能力:C>Si:___________。(可供选择的药品:稀硫酸、浓盐酸、浓硝酸、硅酸钙、木炭、硅酸钠溶液、饱和碳酸氢钠溶液。)
17.某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出,所用试剂均足量),其中E为白色沉淀,I为红褐色沉淀。
(1)写出下列物质的化学式:F___________,G___________。
(2)D→E的转化中,加入过量X可能是___________。
A.饱和NaCl溶液
B.NaOH溶液
C.氨水
D.Ba(OH)2溶液
(3)A→C的化学方程式为___________,该反应的氧化剂为___________(填化学式)。
(4)鉴别G溶液中的金属阳离子时,应滴加的试剂依次是___________、___________,请写出过程中属于氧化还原的离子方程式:___________。
18.A、B、C、D均是由短周期元素原子构成的分子或离子,它们之间有如图所示的转化关系,已知A含18个电子,C含10个电子。完成下列各题:
(1)若常温下A、B、C、D均是气体,其中A、D为单质,则A的电子式是_______,B与C的稳定性由强到弱的顺序为_______(用化学式表示)。
(2)若B、D属同主族元素的单质分子,C常温下是液体,则C的结构式为_______。写出A与B反应的化学方程式:_______。
(3)若A、B均是双核阴离子,则D的离子结构示意图为_______,A与B反应的离子方程式为_______。
19.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
(1)连接上述仪器的正确顺序(填各接口处的字母):E接C;D接A;B接_______;_______接F。
(2)装置中,饱和食盐水的作用是_______。
(3)化学实验中常用湿润的KI?淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到_______。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:_______。
②NaOH溶液中发生的反应:_______。
20.无水广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水,装置如图1,主要步骤如下:
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至分解得无水产品。
已知:和反应剧烈放热;乙醚极易挥发;
具有强吸水性。
请回答下列问题:
仪器D的名称是___________________。冷凝水应该从________填a或口通入;
干燥的可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥,原因是___________;
将装置B改为装置C,可能会导致的后果是_____________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水产品的原因:__________________________;
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:;测定前,先称取无水产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水产品的纯度是_________________以质量分数表示。
21.某小组同学探究I2能否将Fe2+氧化为Fe3+。
试管中加适量铁粉,加入10
mL稀盐酸,充分反应后,铁粉有少量剩余,取适量上层清液于试管中,滴加少量棕黄色的碘水,振荡试管观察到溶液变为黄色。
(1)小组同学认为试管中溶液呈黄色不能说明I2将Fe2+氧化为Fe3+,其理由是:________。
(2)继续进行实验
操作
现象
向试管中继续加入0.5
mL
CCl4,充分振荡,静置
静置后,上层溶液几乎无色,下层溶液为紫色
取出上层溶液,滴加KSCN溶液
溶液变成浅红色
①试管中加入CCl4的目的是________。
②滴加KSCN溶液后,溶液变成浅红色的原因是________。
(3)有同学认为该实验现象不能说明I2将Fe2+氧化为Fe3+,理由是___。
(4)经查阅资料,发现Cl2和Br2都能将Fe2+
氧化,请写出Cl2与Fe2+
反应的离子方程式为________;I2与FeCl2溶液反应的程度很小。
(5)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构解释其原因_______。
22.将一定质量的镁铝合金投入100
mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5
mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
23.填空题
(1)含6.02×1023个中子的的质量是________g。
(2)4
g
D2和20
g
18O2的单质化合时最多能生成__________________g
D218O。
(3)若12.4
g
Na2X中含有0.4
mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
24.现称取一定质量的镁铝合金样品放入500mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
(1)合金中Al的质量为___。
(2)NaOH溶液的物质的量浓度为___。
(3)稀硫酸的物质的量浓度为__。
参考答案
1.C
2.D
3.B
4.B
5.A
6.D
7.B
8.B
9.D
10.B
11.C
12.B
13.D
14.A
15.S2?
离子键和共价键
CO2、H2S、NH3
二氧化碳的相对分子质量比二硫化碳小,范德华力小,因此熔沸点低
FeS+2H+=Fe2++H2S↑
H2S+
Cu2+=CuS↓+2H+
2412=24
0.04
NA
16.
第3周期第ⅢA族
K或钾
先生成白色沉淀,后沉淀溶解
将饱和碳酸氢钠溶液和稀硫酸加入带有导管的试管,把生成的气体通入硅酸钠溶液中,产生白色沉淀,证明原子得电子能力:C大于Si
17.Al2O3
FeCl2
C
2Al+2NaOH+2H2O
=
2NaAlO2+3H2↑
H2O
KSCN溶液
氯水
2Fe2+
+
Cl2
=
2Fe3+
+
2Cl-
18.
HF>HCl
H—O—H
19.H
G
除去氯气中的HCl杂质
试纸变蓝
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
20.球形冷凝管
a
极易挥发
镁屑会与空气中的氧气反应,生成的MgO阻碍反应的继续进行
会将液溴挤压入三颈瓶中,反应加剧大量放热存在安全隐患
镁屑
加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动
21.黄色可能是碘水稀释后的颜色,无法说明反应是否发生
萃取I2,排除I2的干扰
生成Fe3+的浓度较低
亚铁离子与空气接触会被氧化,应该排除空气对实验的影响
2Fe2++Cl2
=
2Fe3++2Cl-
Cl、Br、I位于同一主族,元素从上到下原子最外层电子数相同,电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力减小,得电子能力逐渐减弱,氧化性减弱
22.m(Mg)=4.8
g,m(Al)=0.27
g
0.7
mol/L
23.1.75
22
62
g/mol
16
24.5.4g
4.0mol/L
0.8
mol/L
一、单选题(共14题)
1.下列属于离子化合物的是
A.Mg
B.H2O
C.NaCl
D.CO
2.下列化合物中阳离子与阴离子半径比值最大的是
A.CaF2
B.MgI2
C.NaCl
D.KF
3.1869年,俄国化学家门捷列夫制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,随着人们对科学的认识不断深入,终于使门捷列夫元素周期表变得完整。下图是元素周期表的一部分,请回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
下列叙述正确的是
A.元素③的氢化物水溶液呈酸性
B.元素⑥的原子半径在同周期元素中最大
C.元素⑦的氧化物是两性氧化物
D.元素⑤的最高价为+7
4.某工厂的废液中含有CCl4、I2、I-等物质,其提取碘的过程如图所示。下列说法错误的是
A.还原过程发生反应的离子方程式为+I2+H2O=2I-++2H+
B.用淀粉检验所富集碘的溶液中是否含有I-
C.操作X的名称为分液
D.氧化过程通入Cl2是为了提取碘
5.1869年,俄国化学家门捷列夫制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,随着人们对科学的认识不断深入,终于使门捷列夫元素周期表变得完整。下图是元素周期表的一部分,请回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
①和⑨两种元素形成的化合物结构式正确的是
A.H-Cl
B.O=C=O
C.
D.
6.下列各组原子序数所表示的两种元素,能形成型离子化合物的是
A.6和8
B.7和8
C.11和16
D.12和17
7.关于化学键的叙述中,下列说法正确的是
A.化学键存在于相邻原子之间,也存在于相邻分子之间
B.NaHSO4固体中含有的阳离子与阴离子的个数比为1∶1
C.阴、阳离子间通过静电引力所形成的化学键是离子键
D.不同元素组成的多原子分子中的化学键一定全是极性键
8.以下变化中化学键没有被破坏的是
A.硫酸氢钠溶于水
B.溴溶于四氯化碳
C.氯化铵受热分解
D.二氧化硅熔化
9.、、、为原子序数依次增大的短周期主族元素,的原子半径是所有短周期主族元素中最大的,的最外层电子是次外层的3倍,的单质是一种半导体材料,的最外层电子数是的原子序数的一半,由、、三种元素形成的化合物的结构如图所示。下列叙述错误的是
A.简单离子的半径
B.单质的熔点高于单质
C.化合物中都满足8电子稳定结构
D.、、最高价氧化物对应的水化物之间均可以发生反应
10.下列实验不能达到实验目的的是
A
B
C
D
证明碳酸钠热稳定性比碳酸氢钠高
收集气体
证明醋酸酸性比硼酸强
证明氧化性:
A.A
B.B
C.C
D.D
11.下列说法正确的是
A.正丁烷和异丁烷是同系物
B.H2O和D2O互为同素异形体
C.和为同一物质
D.235U和238U互为同位素,物理性质几乎相同,化学性质不同
12.W、X、Y、Z是原子序数依次增大的短周期主族元素。a、b、c是由这些元素组成的二元化合物,且均含Z元素;甲是X元素的单质,室温下0.1
mol·L-1丙溶液pH=1,上述物质的转化关系如图所示。下列说法错误的是
A.原子半径:X>Y>Z
B.氢化物的沸点:Z>X
C.最高价氧化物对应水化物的酸性:Y>X
D.W、X、Y、Z形成的化合物可能既含离子键又含共价键
13.下列离子方程式正确的是
A.Fe3O4溶于足量氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=+4+2H2O
C.工业制备漂白粉:Cl2+2OH-=ClO-+Cl-+H2O
D.Ca(OH)2溶液和少量的NaHCO3溶液反应:+Ca2++OH-=CaCO3↓+H2O
14.不能用元素周期律解释的是
A.酸性:H2SO3>H2CO3
B.碱性:LiOH>Be(OH)2
C.热稳定性:HCl>PH3
D.相同条件下与水反应的剧烈程度:Na>Al
二、填空题(共10题)
15.将高温水蒸气通到硫氰化钾的表面,会发生反应:。完成下列填空:
(1)上述反应所涉及的各元素中,简单离子半径最大的是_______(填写离子符号);中含有的化学键类型是_______。
(2)上述反应所涉及的各物质中,属于非电解质的是_______。
(3)写出的电子式_______,其熔沸点比低的原因是_______。
(4)写出实验室制备并检验气体的离子方程式:_______、_______。
(5)接触潮湿银器表面时,出现黑色斑点,其化学反应如下:
__________________________________________
①配平上述反应_____。
②每消耗标准状况下,转移电子的数目为_______。
16.钾云母是一种重要的化工原料,可用氧化物的形式表示为。回答下列问题:
(1)K元素的原子结构示意图为___________;Al在元素周期表中的位置为___________。
(2)上述四种氧化物中,属于典型离子化合物的氧化物的电子式为___________。
(3)H、O、Al、K元素中,形成简单离子的半径由大到小的顺序为___________(填离子符号)。
(4)将大小相同的K、Al分别加入等量水,与水剧烈反应的元素是___________;把剧烈反应后的溶液滴入少量氯化铝溶液中产生的现象是___________。
(5)依据元素周期表的知识和下列试剂,设计实验证明原子得电子能力:C>Si:___________。(可供选择的药品:稀硫酸、浓盐酸、浓硝酸、硅酸钙、木炭、硅酸钠溶液、饱和碳酸氢钠溶液。)
17.某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出,所用试剂均足量),其中E为白色沉淀,I为红褐色沉淀。
(1)写出下列物质的化学式:F___________,G___________。
(2)D→E的转化中,加入过量X可能是___________。
A.饱和NaCl溶液
B.NaOH溶液
C.氨水
D.Ba(OH)2溶液
(3)A→C的化学方程式为___________,该反应的氧化剂为___________(填化学式)。
(4)鉴别G溶液中的金属阳离子时,应滴加的试剂依次是___________、___________,请写出过程中属于氧化还原的离子方程式:___________。
18.A、B、C、D均是由短周期元素原子构成的分子或离子,它们之间有如图所示的转化关系,已知A含18个电子,C含10个电子。完成下列各题:
(1)若常温下A、B、C、D均是气体,其中A、D为单质,则A的电子式是_______,B与C的稳定性由强到弱的顺序为_______(用化学式表示)。
(2)若B、D属同主族元素的单质分子,C常温下是液体,则C的结构式为_______。写出A与B反应的化学方程式:_______。
(3)若A、B均是双核阴离子,则D的离子结构示意图为_______,A与B反应的离子方程式为_______。
19.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
(1)连接上述仪器的正确顺序(填各接口处的字母):E接C;D接A;B接_______;_______接F。
(2)装置中,饱和食盐水的作用是_______。
(3)化学实验中常用湿润的KI?淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到_______。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:_______。
②NaOH溶液中发生的反应:_______。
20.无水广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水,装置如图1,主要步骤如下:
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至分解得无水产品。
已知:和反应剧烈放热;乙醚极易挥发;
具有强吸水性。
请回答下列问题:
仪器D的名称是___________________。冷凝水应该从________填a或口通入;
干燥的可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥空气代替干燥,原因是___________;
将装置B改为装置C,可能会导致的后果是_____________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水产品的原因:__________________________;
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:;测定前,先称取无水产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无水产品的纯度是_________________以质量分数表示。
21.某小组同学探究I2能否将Fe2+氧化为Fe3+。
试管中加适量铁粉,加入10
mL稀盐酸,充分反应后,铁粉有少量剩余,取适量上层清液于试管中,滴加少量棕黄色的碘水,振荡试管观察到溶液变为黄色。
(1)小组同学认为试管中溶液呈黄色不能说明I2将Fe2+氧化为Fe3+,其理由是:________。
(2)继续进行实验
操作
现象
向试管中继续加入0.5
mL
CCl4,充分振荡,静置
静置后,上层溶液几乎无色,下层溶液为紫色
取出上层溶液,滴加KSCN溶液
溶液变成浅红色
①试管中加入CCl4的目的是________。
②滴加KSCN溶液后,溶液变成浅红色的原因是________。
(3)有同学认为该实验现象不能说明I2将Fe2+氧化为Fe3+,理由是___。
(4)经查阅资料,发现Cl2和Br2都能将Fe2+
氧化,请写出Cl2与Fe2+
反应的离子方程式为________;I2与FeCl2溶液反应的程度很小。
(5)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构解释其原因_______。
22.将一定质量的镁铝合金投入100
mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5
mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
23.填空题
(1)含6.02×1023个中子的的质量是________g。
(2)4
g
D2和20
g
18O2的单质化合时最多能生成__________________g
D218O。
(3)若12.4
g
Na2X中含有0.4
mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
24.现称取一定质量的镁铝合金样品放入500mL稀硫酸中,固体全部溶解并放出气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
(1)合金中Al的质量为___。
(2)NaOH溶液的物质的量浓度为___。
(3)稀硫酸的物质的量浓度为__。
参考答案
1.C
2.D
3.B
4.B
5.A
6.D
7.B
8.B
9.D
10.B
11.C
12.B
13.D
14.A
15.S2?
离子键和共价键
CO2、H2S、NH3
二氧化碳的相对分子质量比二硫化碳小,范德华力小,因此熔沸点低
FeS+2H+=Fe2++H2S↑
H2S+
Cu2+=CuS↓+2H+
2412=24
0.04
NA
16.
第3周期第ⅢA族
K或钾
先生成白色沉淀,后沉淀溶解
将饱和碳酸氢钠溶液和稀硫酸加入带有导管的试管,把生成的气体通入硅酸钠溶液中,产生白色沉淀,证明原子得电子能力:C大于Si
17.Al2O3
FeCl2
C
2Al+2NaOH+2H2O
=
2NaAlO2+3H2↑
H2O
KSCN溶液
氯水
2Fe2+
+
Cl2
=
2Fe3+
+
2Cl-
18.
HF>HCl
H—O—H
19.H
G
除去氯气中的HCl杂质
试纸变蓝
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
2NaOH+Cl2=NaCl+NaClO+H2O
20.球形冷凝管
a
极易挥发
镁屑会与空气中的氧气反应,生成的MgO阻碍反应的继续进行
会将液溴挤压入三颈瓶中,反应加剧大量放热存在安全隐患
镁屑
加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动
21.黄色可能是碘水稀释后的颜色,无法说明反应是否发生
萃取I2,排除I2的干扰
生成Fe3+的浓度较低
亚铁离子与空气接触会被氧化,应该排除空气对实验的影响
2Fe2++Cl2
=
2Fe3++2Cl-
Cl、Br、I位于同一主族,元素从上到下原子最外层电子数相同,电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力减小,得电子能力逐渐减弱,氧化性减弱
22.m(Mg)=4.8
g,m(Al)=0.27
g
0.7
mol/L
23.1.75
22
62
g/mol
16
24.5.4g
4.0mol/L
0.8
mol/L
