第二章第3节化学反应的速率 课时练习—2021-2022学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章第3节化学反应的速率 课时练习—2021-2022学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 308.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-12 16:55:15 | ||
图片预览




文档简介
第二章第3节化学反应的速率课时练习—2021-2022学年高中化学鲁科版(2019)选择性必修一
一、单选题(共15题)
1.已知:4A(g)+5B(g)=4C(g)+6D(g),如果反应速率分别用V(A)、V(B)、V(C)、V(D)表示,正确的关系是
A.4/5V(B)=V(C)
B.5/6V(B)=V(D)
C.2/3V(A)=V(D)
D.4/5V(A)=V(B)
2.在气体反应中,能使反应物中活化分子数和活化分子百分数都增大的方法有
①增大反应物的浓度②升高温度③增大压强④加入催化剂
A.①②③④
B.②④
C.②③
D.①②
3.一定温度下,对可逆反应A(g)+3B(g)3C(g)的下列叙述中,不能说明反应已达到平衡的是
A.C生成的速率与C分解的速率相等
B.单位时间内消耗amolA,同时生成3amolC
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
4.在反应A?2B中,A、B的浓度变化如图所示,则2min内的平均反应速率为
A.vA=9mol·L-1·min-1
B.vA=4.5mol·L-1·s-1
C.vB=18mol·L-1·min-1
D.vB=9mol·L-1·min-1
5.反应A(s)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是
A.v(D)=0.4mol/(L·s)
B.v(C)=0.6mol/(L·min)
C.v(B)=0.5mol/(L·s)
D.v(A)=0.25mol/(L·s)
6.在一定温度下,可逆反应N2
(g)
+3H2
(g)
2NH3
(g)达到平衡的标志是
A.NH3的生成速率与H2的生成速率相等
B.单位时间内生成n
mol
N2同时生成3n
mol
H2
C.N2,H2,NH3的浓度不再变化
D.N2,H2,NH3的分子数之比为1:3:2
7.一定温度下,在某密闭容器中发生反应:2HI(g)?H2(g)+I2(s)
ΔH>0,若0~15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是
A.0~15s内用I2表示的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
8.反应P(g)+3Q(g)?2R(l)+2S(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(P)=0.15
mol/(L·min)
B.v(Q)=0.6
mol/(L·
min)
C.v(R)=0.
1
mol/(L·s)
D.v(S)=0.45
mol/(L·
min)
9.为探究锌与稀硫酸的反应速率,向反应混合液中加入某物质,下列判断正确的是
A.加入固体,速率不变
B.加入少量硫酸钠固体,速率不变
C.加入固体,速率增大
D.滴加少量溶液,速率减小
10.一定温度下,在
2
L
的恒容密闭容器中发生反应
A(g)+2B(g)
3C(g)。反应过程中的部分数据如下表所示:
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
下列说法正确的是
A.0~5
min
用
A
表示的平均反应速率为
0.09
mol·L?1·min?1
B.容器内压强不变,说明反应已达到平衡状态
C.达到平衡状态时
c(C)=0.6
mol·L?1
且不再发生变化
D.若保持容积不变,反应开始时加入反应物的同时再充入少量氦气(不参与反应),该反应达到平衡的时间会延长
11.CO合成甲醇的反应为:,若该反应在恒温恒容的容器内进行,则可以作为该反应达到化学平衡状态的标志是
A.气体的密度保持不变
B.CO浓度与浓度相等
C.气体的平均摩尔质量保持不变
D.
12.一定温度下在一定体积的密闭容器中,下列叙述能作为可逆反应A(g)+3B(g)
2C(g)达到平衡状态标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a
mol
A,同时生成3a
mol
B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a
mol
A,同时生成3a
mol
B
⑧A、B、C的分子数之比为1∶3∶2
A.①③④⑤⑥⑦
B.①③④⑤⑥⑧
C.①③④⑥⑧
D.①③④⑤⑧
13.在密闭容器中进行反应,、、的起始浓度分别为、、,当平衡时,下列数据肯定不正确的是
A.的物质的量为,的物质的量为
B.的物质的量为
C.的物质的量为,的物质的量为
D.的物质的量为
14.少量铁粉与的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变的产量,可以使用如下方法中的
①加
②加固体
③滴入几滴浓盐酸
④加入少量固体
⑤加溶液
⑥改用的
⑦升高温度(不考虑盐酸挥发)
⑧改用硝酸
A.③④⑤
B.③⑥⑦
C.④⑥⑧
D.⑤⑦⑧
15.下列实验操作、现象及得出的结论均正确的是
选项
实验操作
现象
实验结论
A
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
B
分别向体积均为4
mL的
0.1
mol·L–1和0.2
mol·L–1的酸性KMnO4溶液中各加入2
mL
0.1
mol·L–1
H2C2O4溶液
后者先褪色
反应物浓度越大,反应速率越快,越先褪色
C
向淀粉溶液中加适量20%
H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水
溶液未变蓝色
淀粉已完全水解
D
向CaCO3固体中滴加稀盐酸
产生气泡
非金属性:Cl>C
A.A
B.B
C.C
D.D
二、综合题(共4题)
16.某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表中数据:
t/min
0
1
3
5
9
10
14
X/mol
1.00
0.90
0.75
0.65
0.55
0.55
0.55
Y/mol
2.00
1.80
1.50
1.30
1.10
1.10
1.10
Z/mol
0.00
0.20
0.50
0.70
0.90
0.90
0.90
(1)体系中发生反应的化学方程式是___。
(2)该反应在0~3min内v(Z)=___
(精确到0.001)mol/(L?min)。
(3)该反应达到平衡时反应物X的转化率α等于___。
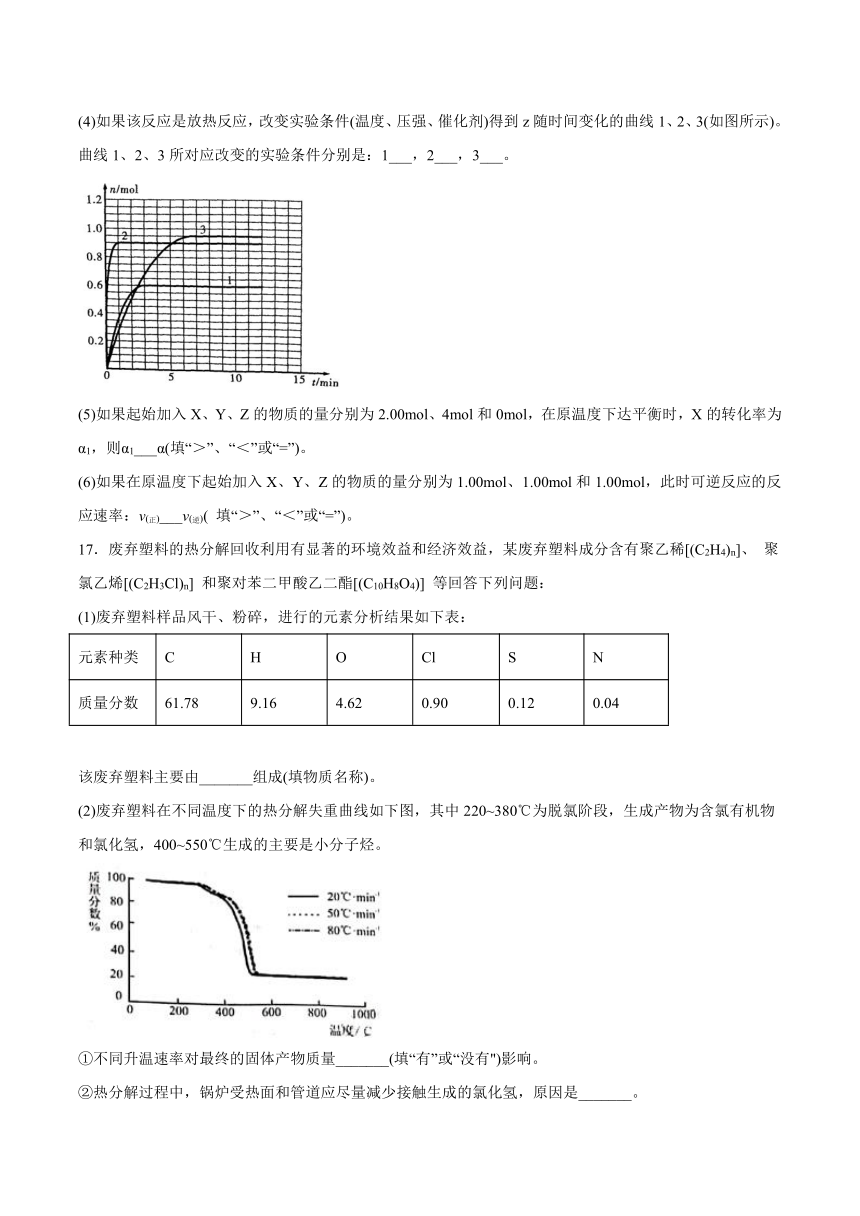
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到z随时间变化的曲线1、2、3(如图所示)。曲线1、2、3所对应改变的实验条件分别是:1___,2___,3___。
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4mol和0mol,在原温度下达平衡时,X的转化率为α1,则α1___α(填“>”、“<”或“=”)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,此时可逆反应的反应速率:v(正)___v(逆)(
填“>”、“<”或“=”)。
17.废弃塑料的热分解回收利用有显著的环境效益和经济效益,某废弃塑料成分含有聚乙稀[(C2H4)n]、
聚氯乙烯[(C2H3Cl)n]
和聚对苯二甲酸乙二酯[(C10H8O4)]
等回答下列问题:
(1)废弃塑料样品风干、粉碎,进行的元素分析结果如下表:
元素种类
C
H
O
Cl
S
N
质量分数
61.78
9.16
4.62
0.90
0.12
0.04
该废弃塑料主要由_______组成(填物质名称)。
(2)废弃塑料在不同温度下的热分解失重曲线如下图,其中220~380℃为脱氯阶段,生成产物为含氯有机物和氯化氢,400~550℃生成的主要是小分子烃。
①不同升温速率对最终的固体产物质量_______(填“有”或“没有")影响。
②热分解过程中,锅炉受热面和管道应尽量减少接触生成的氯化氢,原因是_______。
(3)聚乙烯热分解会发生如下反应nCH2=CH2
?H,相关物质的键能数据如下表:
化学键
C-C
C=C
C-H
键能、(kJ/mol)
347.7
615.0
413.4
该反应的?H=_____kJ·
mol-1
(4)聚氯乙烯热分解过程中,会发生副反应:O2(g)+4HCl(g)2Cl2(g)+2H2O(g)。
①该反应化学平衡常数Kp的表达式为______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在固定容积的容器中,其它条件不变时,下列说法错误的是______(填编号)。
a.升高温度,反应速率增大
b.增大O2分压,反应速率增大
c.增大O2平衡分压,O2的转化率增大
d.减小H2O平衡分压,O2的转化率增大
③若测得不同压强下,HCl平衡转化率(HCl)随反应温度的变化如图所示,则该反应的正反应是______(填““吸热”或者“放热”)反应,P1____P0(填大于”“小于”“等于”或“无法确定”),在图中平衡状态A点时,若测得容器内n(Cl2)=1.0×10-2
mol,则此时容器中n(HCl)=____mol。
18.二氧化碳的资源化利用一直是科学研究的热点领域,工业上可利用反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)制备甲醇。
(1)已知:H2的燃烧热?H1=-285.8
kJ/
mol;
H2O
(g)=H2O
(1)
?H2=-44.0
kJ/
mol
2
CH3OH(g)
+
3O2(g)
=
2CO2(g)
+4
H2O(g)
?H3=-1352.0
kJ/
mol
则反应I的?H=_______
(2)T℃下,将6
mol
CO2和8
mol
H2组成的气态混合物充入2L密闭容器中发生反应Ⅰ,容器中n(H2)随时间的变化如图中实线所示。
①从反应开始至a点,用CO2表示的平均反应速率v(CO2)
=
_______,氢气的转化率为_______。
②该温度下,达到平衡时容器的总压为p总kPa,则此反应的化学平衡常数Kp=_______(kPa)-2(用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数)
(3)若图中虚线表示仅改变温度时n(H2)随时间的变化,则升高温度对应的是曲线_______(填“Ⅰ”或“Ⅱ”),判断的依据是_______。
(4)
在T℃下,提高CO2平衡转化率的一种措施是_______。
19.二氧化锗被广泛用于制作高纯金属锗、锗的化合物、化工催化剂及医药工业,
某工厂用褐煤烟灰(主要成分为C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如
下:
已知:GeO2不溶于水,不跟水反应,是以酸性为主的两性氧化物,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。操作X为蒸馏
(1)褐煤灰中加入NaOH和Na2CO3固体进行焙烧时,要加入过量的粉碎的NaOH和Na2CO3固体,其原因是_________________。写出GeO2与NaOH反应的化学方程式:__________。
(2)为提高含锗化合物的浸出率,除采用水浸取焙烧物2小时外,还可采取的措施有_____________。(写出两条即可)
(3)浸出液中滴加7mol/L盐酸,调节溶液的pH约为11,目的是__________。
(4)滴加7mol/L盐酸使滤液“酸化”,若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,该沉淀物是________________,(写化学式)
(5)GeCl4的沸点是83.1℃,其电子式为______________。
(6)单质锗可用作电子工业的半导体材料。由纯净的GeO2和H2在加热的条件下可制得单质锗.该反应的化学方程式为_________________。
参考答案
1.A
【分析】
根据反应速率之比是化学计量数之比分析解答。
【详解】
A.根据方程式可知4V(B)=5V(C),A正确;
B.应该是6V(B)=5V(D),B错误;
C.应该是3V(A)=2V(D),C错误;
D.应该是5V(A)=4V(B),D错误;
答案选A。
2.B
【详解】
增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,升高温度提高了分子的能量,既能增大活化分子数,又能增大活化分子百分数,加入催化剂,降低了活化能,既能增大活化分子数,又能增大活化分子百分数,故B正确
3.B
【详解】
A.C生成的速率与C分解的速率相等,说明正逆反应速率相等达到平衡状态,故A不选;
B.单位时间内消耗a
mol
A,同时生成3a
mol
C,都体现正反应方向,未体现正与逆的关系,故B选;
C.方程式两端化学计量数不相等,则容器内的压强将随平衡的移动而变化,压强不再变化,说明反应达到平衡状态,故C不选;
D.方程式两端化学计量数不相等,则容器内气体的物质的量将随平衡的移动而变化,混合气体的物质的量不再变化,说明正逆反应速率相等,达平衡状态,故D不选;
故选:B。
4.D
【详解】
由图可知,2min内,,,则,;
故选D。
5.A
【分析】
根据化学反应速率之比等于化学方程式中各物质的化学计量数之比,将不同物质的速率换算为同一物质的速率,然后进行比较。
【详解】
根据化学反应速率之比等于化学方程式中各物质的化学计量数之比,将该反应转化为用反应物B表示的反应速率:
A.
v(D)=0.4mol/(L·s),用B表示为v(B)=
0.4mol/(L·s)×=0.6mol/(L·s)
B.
v(C)=0.6mol/(L·min),用B表示为v(B)=
0.6×mol/(L·s)×=
0.015mol/(L·s)
C.
v(B)=0.5mol/(L·s)
D.反应物A为固体,反应过程中浓度不变,不能计算化学反应速率;
综上,反应速率的大小关系为v(D)>
v(B)>
v(C),答案选A.
6.C
【详解】
A.NH3的生成速率即正向反应,H2的生成速率即逆向反应,NH3的生成速率与H2的生成速率等于计量数之比即2:3时反应达到平衡,故A不符合题意;
B.单位时间内生成n
mol
N2同时生成3n
mol
H2,都是同一个方向,不能说明达到平衡,故B不符合题意;
C.N2,H2,NH3的浓度不再变化,能说明达到平衡,故C符合题意;
D.N2,H2,NH3的分子数之比为1:3:2,不能说明正逆反应速率是否相等,因此不能说明达到平衡,故D不符合题意。
综上所述,答案为C。
7.D
【详解】
A.I2为固体,不能利用固体表示化学反应速率,故A不符合题意;
B.若c(HI)由0.1mol?L-1降到0.07mol?L-1时,需要15s,即减少0.03mol?L-1需要15s,c(HI)由0.07mol?L-1降到0.05mol?L-1时,浓度减少0.02
mol?L-1,当速率与浓度变化成正比时,需要,随着反应的进行,反应物的浓度减小,化学反应速率减小,需要的时间就长,所以需要时间大于10s,故B不符合题意;
C.对于任何化学反应,升高温度,正逆反应速率均加快,故C不符合题意;
D.该反应为气体体积增大的反应,减小体积,即增大压强,化学反应速率加快,故D符合题意;
答案选D。
8.D
【详解】
反应速率之比等于反应方程式计量系数之比,速率与其计量系数比值越大,反应速率越快,
A.?=mol/(L·min)=0.15mol/(L·min)
B.=mol/(L·min)=0.2mol/(L·min)
C.R为纯液体,不能表示反应速率。
D.?=mol/(L·min)=0.225mol/(L·min)
所以反应速率快慢顺序为D>B>A,则最快的是?D。
故选:D。
9.B
【详解】
A.为强酸的酸式盐,向反应混合液中加入固体,由于电离出氢离子而使溶液中的氢离子浓增大,从而化学反应速率增大,故A错;
B.加入少量硫酸钠固体,溶液中的氢离子浓度几乎不变,则化学反应速率也不变,故B正确;
C.为强碱弱酸盐,醋酸根会与溶液中的氢离子结合生成弱电解质醋酸,从而使溶液中的氢离子浓度减小,则化学反应速率减小,故C错;
D.中的在Zn的表面得到电子被还原为单质Cu,从而形成无数个微小的原电池,会加快化学反应速率,故D错;
答案选B。
10.C
【详解】
A.0~5
min内Δn(C)=0.9mol,根据方程式可知Δn(A)=0.3mol,容器体积为2L,所以用
A
表示的平均反应速率为=0.03
mol·L?1·min?1,A错误;
B.该反应前后气体系数之和相等,容器恒容,所以无论是否平衡,压强都不发生变化,压强不变不能说明反应平衡,B错误;
C.10min时Δn(A)=2.0mol-1.6mol=0.4mol,则此时Δn(B)=0.8mol,容器内n(B)=2.4mol-0.8mol=1.6mol,15min时n(B)仍为1.6mol,物质的量不再改变,说明已经达到平衡,此时n(C)=1.2mol,容器体积为2L,则c(C)=0.6
mol·L?1,C正确;
D.容积不变,充入少量氦气,A、B的浓度不变,则反应速率不变,达到平衡时间不变,D错误;
综上所述答案为C。
11.C
【详解】
A.
反应为恒温恒容,气体的密度始终保持不变,故A不符;
B.
CO浓度与浓度相等,不能说明各组分浓度不变,故B不符;
C.
反应各组分均为气体,气体的平均摩尔质量随气体的总物质的量改变而改变,气体的平均摩尔质量保持不变,说明已经达到平衡状态,故C符合;
D.
,说明,没有达到平衡状态,故D不符;
故选C。
12.A
【详解】
①C的生成速率与C的消耗速率相等,说明反应达到平衡状态,故不选①;
②单位时间内生成a
molA,同时生成3a
molB,A、B都是反应物,生成A、B的速率都是逆反应速率,不能说明反应达到平衡状态,故选②;?
③A、B、C的浓度不再变化,说明反应达到平衡状态,故不选③;?
④C的物质的量不再变化,说明各组分浓度不变,反应达到平衡状态,故不选④;?
⑤混合气体的总压强不再变化,反应前后气体体积不相同,压强不变说明各组分浓度不变,反应达到平衡状态,故不选⑤;?
⑥混合气体的总物质的量不再变化,反应前后气体物质的量不相同,气体总物质的量不变说明各组分浓度不变,反应达到平衡状态,故不选⑥;?
⑦单位时间消耗a
mol
A,同时生成3a
molB,说明正逆反应速率相等,反应达到平衡状态,故不选⑦;?
⑧A、B、C的分子数之比决定于开始加入物质的多少,与平衡状态无关,故选⑧;
根据以上分析②⑧不能作为可逆反应A(g)+3B(g)
2C(g)达到平衡状态标志;故选A;
答案为A。
13.A
【详解】
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:,
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
由于为可逆反应,物质不能完全转化,所以平衡时浓度范围为0故选A。
14.B
【分析】
可以通过增大盐酸浓度、升高温度等方法来改变,但改变条件时不能加入和稀盐酸反应生成氢气的物质,据此分析解答。
【详解】
①加H2O,氢离子浓度减小,减慢反应的速率,故错误;
②加NaOH固体,消耗氢离子,氢离子浓度减小,减慢反应的速率,并且还有可能改变H2的产量,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
④滴加少量硫酸铜溶液,消耗铁粉,则生成氢气量减少,故错误;
⑤加NaCl溶液,氢离子浓度降低,反应速率减慢,故错误;
⑥改用的,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
⑦升高温度(不考虑盐酸挥发),增大活化分子百分数,化学反应速率增大,且不影响生成氢气总量,故正确;
⑧改用硝酸,硝酸是氧化性酸,和铁反应不能生成氢气,故错误;
综上所述,③⑥⑦符合题意,故选B。
15.A
【详解】
A.钠在CO2中燃烧生成黑色颗粒,说明有C生成,CO2中碳元素化合价降低,作氧化剂,故A正确;
B.高锰酸钾均过量,不能观测到褪色时间,应控制高锰酸钾量均不足、且浓度不同,故B错误;
C.NaOH过量,碘与NaOH反应,不能检验淀粉的存在,应取少量水解后的溶液加碘水检验,且没有检验葡萄糖,不能确定淀粉是否水解,故C错误;
D.比较元素非金属性强弱应利用其最高价氧化物对应水化物的酸性强弱,而盐酸为无氧酸,故D错误。
答案选A。
16.X(g)
+2Y(g)2Z(g)
0.017
45%
升高温度
使用合适催化剂
增大压强
>
>
【分析】
X和Y反应生成气态物质Z,第9min,各种物质的物质的量不再发生变化,即达到化学平衡状态,根据变化的物质的量之比等于化学计量数之比,可以得到该反应的化学方程式,由此分析。
【详解】
(1)由表中数据可知,X、Y为反应物,Z为生成物,9min时Δn(X)=1mol-0.55mol=0.45mol,Δn(Y)=2mol-1.1mol=0.9mol,Δn(Z)=0.9mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,物质的量变化量之比等于化学计量数之比,n(X):n(Y):n(Z)=0.45:0.9:0.9=1:2:2,故反应方程式为X(g)
+2Y(g)2Z(g);
(2)0-3min内Z的反应速率v(Z)===0.017mol/(L?min);
(3)由图表数据可知反应到9min,反应达到平衡,反应达到平衡时反应物X的转化率=×100%=×100%=45%;
(4)该可逆反应正反应为放热反应,且为气体体积增大的反应,由表中数据可知,平衡时Z的物质的量为0.9mol,由图2可知曲线①平衡后,Z的物质的量为0.6,Z的物质的量减小,故平衡向逆反应移动,应是升高温度;曲线②平衡后,Z的物质的量为0.9mol,Z的物质的量未变,应是使用催化剂;曲线③平衡后,Z的物质的量为0.95mol,Z的物质的量增大,应是增大压强;
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4.00mol和0mol,在原温度下达平衡时,相当于原平衡增大压强,平衡正向进行,X的转化率为α1增大,则α1>α;
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,转化为起始量;
和原平衡比较相当于在原平衡中加入了0.50molX,平衡正向进行,此时可逆反应的反应速率υ(正)>υ(逆)。
17.聚乙烯
没有
热分解过程的锅炉以及管道多为金属材料,生成的氯化氢可能腐蚀设备,所以应尽量减少接触生成的氯化氢
80.4n
c
放热
大于
5.0×10-3
【分析】
(1)根据各种元素的含量多少分析判断所含物质种类;
(2)①根据温度与固体产物的图示分析判断;
②根据设备材料与HCl的性质分析;
(3)根据反应热与反应物、生成物的键能关系计算判断;
(4)①根据平衡常数表达式的含义书写;
②根据外界条件对反应速率和化学平衡的影响分析判断;
③根据温度对HCl的平衡转化率的影响判断反应热效应;利用Cl2的物质的量可计算反应消耗的HCl的物质的量,再根据HCl的平衡转化率可计算出反应开始时HCl的物质的量,进而可得平衡时HCl的物质的量。
【详解】
(1)由质量分析表可知废弃望料中含量最高的是碳和氢元素,氯元素和氧元素含量都是较低的,所以由此判断其主要成分应该是聚乙烯;
(2)①从图中分析可知,只要最终的温度相同,不同的升温速率最终对最后的固体产物的质量都不会产生影响;
②热分解过程的锅炉以及管道多为金属材料,生成的氯化氢可能腐蚀设备,所以应尽量减少接触生成的氯化氢;
(3)根据盖斯定律可知,反应热等于反应物的键能和减去生成物的键能和,一个链节的△H=2×347.7
kJ/mol-615.0
kJ/mol=+80.4
kJ/mol,故该反应的反应热为+80.4n
kJ/mol;
(4)①根据平衡常数的定义,各物质的浓度用平衡分压代替可得平衡常数的表达式为:Kp=;
②在固定容积的容器中进行反应O2(g)+4HCl(g)2Cl2(g)+2H2O(g)。其它条件不变时,
a.升高温度,物质的内能增加,气体分子之间有效碰撞次数加快,反应速率增大,a正确;
b.增大O2分压,O2的浓度增大,单位时间内气体分子之间有效碰撞次数增多,反应速率增大,b正确;
c.增大O2平衡分压,化学反应速率加快,但O2的平衡转化率会减小,c错误;
d.减小H2O平衡分压,化学平衡正向移动,O2的转化率增大,d正确;
故答案选c;
③由图像分析可知,升高温度α(HC1)降低,说明升高温度,化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,所以该反应的正反应是放热反应;再p0和p1两条曲线的位置分析可知,等温时从p0到p1的过程中,α(HCl)增大,说明压强p1大于p0;
平衡状态A点时,n(Cl2)=1.0×10-2
mol,对应的消耗的n(HCl)=2.0×10-2
mol,此时HCl的转化率为80%,所以起始的n(HCl)起始=2.0×10-2÷0.8
mol=0.025
mol,平衡时的容器中的n(HC1)
=
n(HCl)起始-
n(HCl)消耗=0.02
mol-0.025
mol=0.005
mol=5.0×10-3
mol。
【点睛】
本题综合考查了化学反应原理。(3)在计算由聚乙烯变为乙烯的反应热时,要注意结合聚合度及链节变化时每形成1个CH2=CH2分子会同时断裂2个C-C键,形成1和C=C双键分析;在(4)③中计算平衡时HCl的物质的量时,要注意结合物质反应转化消耗关系及物质平衡转化率分析。
18.-49.4
kJ/mol
0.3mol·
L-1·
min-1
45%
12.5
/p2总
?
曲线?反应速率更快且平衡时n(H2)变大,平衡逆向移动
增大n(H2)(或缩小容器体积,增大压强)
【详解】
(1)已知:
H2的燃烧热为?H1=-285.8
kJ/
mol;则反应①:H2的燃烧热化学方程式为:②:H2O
(g)=H2O
(1)
?H2=-44.0
kJ/
mol,③:2
CH3OH(g)
+
3O2(g)
=
2CO2(g)
+4
H2O(g)
?H3=-1352.0
kJ/
mol,根据该斯定律,反应I=,故反应I的?H=-49.4
kJ/mol
(2)①T℃下,将6
mol
CO2和8
mol
H2组成的气态混合物充入2L密闭容器中发生反应Ⅰ,从反应开始至a点,用CO2表示的平均反应速率,氢气的转化率为
故答案为:0.3mol·
L-1·
min-1,45%
②由已知、图示数据可得三段式:
该温度下,达到平衡时容器的总压为总kPa,则此反应的化学平衡常数
故答案为:12.5
/p2总
(3)先拐先平速度快,升温时反应速率增大、CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mo1平衡左移,氢气的物质的量减小,故:若图中虚线表示仅改变温度时n(H2)随时间的高温度对应的是曲线I,反应判断的依据是:曲线I反应速率更快且平衡时n(H2)变大,故答案为:曲线?反应速率更快且平衡时n(H2)变大,平衡逆向移动
(4)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应是气体分子总数减小的反应,在T°C下,提高CO2平衡转化率的一种措施是:体积不变时增大n(H2)或缩小容器的容积,增大压强。故答案为:增大n(H2)(或缩小容器体积,增大压强)
19.使GeO2尽可能转化为Na2GeO3,且加快GeO2与NaOH和碳酸钠反应的速率
GeO2+2NaOH=
Na2GeO3+H2O
搅拌,适当升高温度
使AlO2-和SiO32-形成沉淀而除去
H2GeO3(或GeO2·nH2O)
GeO2+2H2Ge+2H2O
【详解】
(1)加入过量的粉碎的NaOH和Na2CO3固体,可以增大反应物的接触面积,使GeO2尽可能转化为Na2GeO3,且加快GeO2与NaOH和碳酸钠反应的速率,其中GeO2与NaOH反应的化学方程式为GeO2+2NaOH=Na2GeO3+H2O。(2)根据外界条件对反应速率的影响可知,还可采取的措施有搅拌,适当升高温度;(3)由于溶液中含有偏铝酸盐和硅酸盐,所以浸出液中滴加7mol/L盐酸,调节溶液的pH约为11的目的是使AlO2-和SiO32-形成沉淀而除去。(4)如果酸度不够,则锗酸盐容易转化为锗酸沉淀,所以该沉淀物是H2GeO3(或GeO2·nH2O)
;(5)GeCl4的沸点是83.1℃,说明是共价化合物,其电子式为。(6)GeO2和H2在加热的条件下可制得单质锗,另一种生成物是水,该反应的化学方程式为GeO2+2H2Ge+2H2O。
点睛:无机工业流程题能够以真实的工业生产过程为背景,体现能力立意的命题为指导思想,能够综合考查学生各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力,所以这类题成为近年来高考的必考题型。解决本类题目的基本方法和步骤为:(1)从题干中获取有用信息,了解生产的产品。(2)然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。(3)分析流程中的每一步骤,从以下几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。
一、单选题(共15题)
1.已知:4A(g)+5B(g)=4C(g)+6D(g),如果反应速率分别用V(A)、V(B)、V(C)、V(D)表示,正确的关系是
A.4/5V(B)=V(C)
B.5/6V(B)=V(D)
C.2/3V(A)=V(D)
D.4/5V(A)=V(B)
2.在气体反应中,能使反应物中活化分子数和活化分子百分数都增大的方法有
①增大反应物的浓度②升高温度③增大压强④加入催化剂
A.①②③④
B.②④
C.②③
D.①②
3.一定温度下,对可逆反应A(g)+3B(g)3C(g)的下列叙述中,不能说明反应已达到平衡的是
A.C生成的速率与C分解的速率相等
B.单位时间内消耗amolA,同时生成3amolC
C.容器内的压强不再变化
D.混合气体的物质的量不再变化
4.在反应A?2B中,A、B的浓度变化如图所示,则2min内的平均反应速率为
A.vA=9mol·L-1·min-1
B.vA=4.5mol·L-1·s-1
C.vB=18mol·L-1·min-1
D.vB=9mol·L-1·min-1
5.反应A(s)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,反应最快的是
A.v(D)=0.4mol/(L·s)
B.v(C)=0.6mol/(L·min)
C.v(B)=0.5mol/(L·s)
D.v(A)=0.25mol/(L·s)
6.在一定温度下,可逆反应N2
(g)
+3H2
(g)
2NH3
(g)达到平衡的标志是
A.NH3的生成速率与H2的生成速率相等
B.单位时间内生成n
mol
N2同时生成3n
mol
H2
C.N2,H2,NH3的浓度不再变化
D.N2,H2,NH3的分子数之比为1:3:2
7.一定温度下,在某密闭容器中发生反应:2HI(g)?H2(g)+I2(s)
ΔH>0,若0~15s内c(HI)由0.1mol/L降到0.07mol/L,则下列说法正确的是
A.0~15s内用I2表示的平均反应速率为v(I2)=0.001mol·L-1·s-1
B.c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小反应体系的体积,化学反应速率加快
8.反应P(g)+3Q(g)?2R(l)+2S(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(P)=0.15
mol/(L·min)
B.v(Q)=0.6
mol/(L·
min)
C.v(R)=0.
1
mol/(L·s)
D.v(S)=0.45
mol/(L·
min)
9.为探究锌与稀硫酸的反应速率,向反应混合液中加入某物质,下列判断正确的是
A.加入固体,速率不变
B.加入少量硫酸钠固体,速率不变
C.加入固体,速率增大
D.滴加少量溶液,速率减小
10.一定温度下,在
2
L
的恒容密闭容器中发生反应
A(g)+2B(g)
3C(g)。反应过程中的部分数据如下表所示:
n(A)
n(B)
n(C)
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
下列说法正确的是
A.0~5
min
用
A
表示的平均反应速率为
0.09
mol·L?1·min?1
B.容器内压强不变,说明反应已达到平衡状态
C.达到平衡状态时
c(C)=0.6
mol·L?1
且不再发生变化
D.若保持容积不变,反应开始时加入反应物的同时再充入少量氦气(不参与反应),该反应达到平衡的时间会延长
11.CO合成甲醇的反应为:,若该反应在恒温恒容的容器内进行,则可以作为该反应达到化学平衡状态的标志是
A.气体的密度保持不变
B.CO浓度与浓度相等
C.气体的平均摩尔质量保持不变
D.
12.一定温度下在一定体积的密闭容器中,下列叙述能作为可逆反应A(g)+3B(g)
2C(g)达到平衡状态标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a
mol
A,同时生成3a
mol
B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a
mol
A,同时生成3a
mol
B
⑧A、B、C的分子数之比为1∶3∶2
A.①③④⑤⑥⑦
B.①③④⑤⑥⑧
C.①③④⑥⑧
D.①③④⑤⑧
13.在密闭容器中进行反应,、、的起始浓度分别为、、,当平衡时,下列数据肯定不正确的是
A.的物质的量为,的物质的量为
B.的物质的量为
C.的物质的量为,的物质的量为
D.的物质的量为
14.少量铁粉与的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变的产量,可以使用如下方法中的
①加
②加固体
③滴入几滴浓盐酸
④加入少量固体
⑤加溶液
⑥改用的
⑦升高温度(不考虑盐酸挥发)
⑧改用硝酸
A.③④⑤
B.③⑥⑦
C.④⑥⑧
D.⑤⑦⑧
15.下列实验操作、现象及得出的结论均正确的是
选项
实验操作
现象
实验结论
A
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
B
分别向体积均为4
mL的
0.1
mol·L–1和0.2
mol·L–1的酸性KMnO4溶液中各加入2
mL
0.1
mol·L–1
H2C2O4溶液
后者先褪色
反应物浓度越大,反应速率越快,越先褪色
C
向淀粉溶液中加适量20%
H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水
溶液未变蓝色
淀粉已完全水解
D
向CaCO3固体中滴加稀盐酸
产生气泡
非金属性:Cl>C
A.A
B.B
C.C
D.D
二、综合题(共4题)
16.某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表中数据:
t/min
0
1
3
5
9
10
14
X/mol
1.00
0.90
0.75
0.65
0.55
0.55
0.55
Y/mol
2.00
1.80
1.50
1.30
1.10
1.10
1.10
Z/mol
0.00
0.20
0.50
0.70
0.90
0.90
0.90
(1)体系中发生反应的化学方程式是___。
(2)该反应在0~3min内v(Z)=___
(精确到0.001)mol/(L?min)。
(3)该反应达到平衡时反应物X的转化率α等于___。
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到z随时间变化的曲线1、2、3(如图所示)。曲线1、2、3所对应改变的实验条件分别是:1___,2___,3___。
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4mol和0mol,在原温度下达平衡时,X的转化率为α1,则α1___α(填“>”、“<”或“=”)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,此时可逆反应的反应速率:v(正)___v(逆)(
填“>”、“<”或“=”)。
17.废弃塑料的热分解回收利用有显著的环境效益和经济效益,某废弃塑料成分含有聚乙稀[(C2H4)n]、
聚氯乙烯[(C2H3Cl)n]
和聚对苯二甲酸乙二酯[(C10H8O4)]
等回答下列问题:
(1)废弃塑料样品风干、粉碎,进行的元素分析结果如下表:
元素种类
C
H
O
Cl
S
N
质量分数
61.78
9.16
4.62
0.90
0.12
0.04
该废弃塑料主要由_______组成(填物质名称)。
(2)废弃塑料在不同温度下的热分解失重曲线如下图,其中220~380℃为脱氯阶段,生成产物为含氯有机物和氯化氢,400~550℃生成的主要是小分子烃。
①不同升温速率对最终的固体产物质量_______(填“有”或“没有")影响。
②热分解过程中,锅炉受热面和管道应尽量减少接触生成的氯化氢,原因是_______。
(3)聚乙烯热分解会发生如下反应nCH2=CH2
?H,相关物质的键能数据如下表:
化学键
C-C
C=C
C-H
键能、(kJ/mol)
347.7
615.0
413.4
该反应的?H=_____kJ·
mol-1
(4)聚氯乙烯热分解过程中,会发生副反应:O2(g)+4HCl(g)2Cl2(g)+2H2O(g)。
①该反应化学平衡常数Kp的表达式为______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②在固定容积的容器中,其它条件不变时,下列说法错误的是______(填编号)。
a.升高温度,反应速率增大
b.增大O2分压,反应速率增大
c.增大O2平衡分压,O2的转化率增大
d.减小H2O平衡分压,O2的转化率增大
③若测得不同压强下,HCl平衡转化率(HCl)随反应温度的变化如图所示,则该反应的正反应是______(填““吸热”或者“放热”)反应,P1____P0(填大于”“小于”“等于”或“无法确定”),在图中平衡状态A点时,若测得容器内n(Cl2)=1.0×10-2
mol,则此时容器中n(HCl)=____mol。
18.二氧化碳的资源化利用一直是科学研究的热点领域,工业上可利用反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)制备甲醇。
(1)已知:H2的燃烧热?H1=-285.8
kJ/
mol;
H2O
(g)=H2O
(1)
?H2=-44.0
kJ/
mol
2
CH3OH(g)
+
3O2(g)
=
2CO2(g)
+4
H2O(g)
?H3=-1352.0
kJ/
mol
则反应I的?H=_______
(2)T℃下,将6
mol
CO2和8
mol
H2组成的气态混合物充入2L密闭容器中发生反应Ⅰ,容器中n(H2)随时间的变化如图中实线所示。
①从反应开始至a点,用CO2表示的平均反应速率v(CO2)
=
_______,氢气的转化率为_______。
②该温度下,达到平衡时容器的总压为p总kPa,则此反应的化学平衡常数Kp=_______(kPa)-2(用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数)
(3)若图中虚线表示仅改变温度时n(H2)随时间的变化,则升高温度对应的是曲线_______(填“Ⅰ”或“Ⅱ”),判断的依据是_______。
(4)
在T℃下,提高CO2平衡转化率的一种措施是_______。
19.二氧化锗被广泛用于制作高纯金属锗、锗的化合物、化工催化剂及医药工业,
某工厂用褐煤烟灰(主要成分为C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如
下:
已知:GeO2不溶于水,不跟水反应,是以酸性为主的两性氧化物,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。操作X为蒸馏
(1)褐煤灰中加入NaOH和Na2CO3固体进行焙烧时,要加入过量的粉碎的NaOH和Na2CO3固体,其原因是_________________。写出GeO2与NaOH反应的化学方程式:__________。
(2)为提高含锗化合物的浸出率,除采用水浸取焙烧物2小时外,还可采取的措施有_____________。(写出两条即可)
(3)浸出液中滴加7mol/L盐酸,调节溶液的pH约为11,目的是__________。
(4)滴加7mol/L盐酸使滤液“酸化”,若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,该沉淀物是________________,(写化学式)
(5)GeCl4的沸点是83.1℃,其电子式为______________。
(6)单质锗可用作电子工业的半导体材料。由纯净的GeO2和H2在加热的条件下可制得单质锗.该反应的化学方程式为_________________。
参考答案
1.A
【分析】
根据反应速率之比是化学计量数之比分析解答。
【详解】
A.根据方程式可知4V(B)=5V(C),A正确;
B.应该是6V(B)=5V(D),B错误;
C.应该是3V(A)=2V(D),C错误;
D.应该是5V(A)=4V(B),D错误;
答案选A。
2.B
【详解】
增大反应物的浓度和增大压强,只能增大活化分子数,不能增大活化分子百分数,升高温度提高了分子的能量,既能增大活化分子数,又能增大活化分子百分数,加入催化剂,降低了活化能,既能增大活化分子数,又能增大活化分子百分数,故B正确
3.B
【详解】
A.C生成的速率与C分解的速率相等,说明正逆反应速率相等达到平衡状态,故A不选;
B.单位时间内消耗a
mol
A,同时生成3a
mol
C,都体现正反应方向,未体现正与逆的关系,故B选;
C.方程式两端化学计量数不相等,则容器内的压强将随平衡的移动而变化,压强不再变化,说明反应达到平衡状态,故C不选;
D.方程式两端化学计量数不相等,则容器内气体的物质的量将随平衡的移动而变化,混合气体的物质的量不再变化,说明正逆反应速率相等,达平衡状态,故D不选;
故选:B。
4.D
【详解】
由图可知,2min内,,,则,;
故选D。
5.A
【分析】
根据化学反应速率之比等于化学方程式中各物质的化学计量数之比,将不同物质的速率换算为同一物质的速率,然后进行比较。
【详解】
根据化学反应速率之比等于化学方程式中各物质的化学计量数之比,将该反应转化为用反应物B表示的反应速率:
A.
v(D)=0.4mol/(L·s),用B表示为v(B)=
0.4mol/(L·s)×=0.6mol/(L·s)
B.
v(C)=0.6mol/(L·min),用B表示为v(B)=
0.6×mol/(L·s)×=
0.015mol/(L·s)
C.
v(B)=0.5mol/(L·s)
D.反应物A为固体,反应过程中浓度不变,不能计算化学反应速率;
综上,反应速率的大小关系为v(D)>
v(B)>
v(C),答案选A.
6.C
【详解】
A.NH3的生成速率即正向反应,H2的生成速率即逆向反应,NH3的生成速率与H2的生成速率等于计量数之比即2:3时反应达到平衡,故A不符合题意;
B.单位时间内生成n
mol
N2同时生成3n
mol
H2,都是同一个方向,不能说明达到平衡,故B不符合题意;
C.N2,H2,NH3的浓度不再变化,能说明达到平衡,故C符合题意;
D.N2,H2,NH3的分子数之比为1:3:2,不能说明正逆反应速率是否相等,因此不能说明达到平衡,故D不符合题意。
综上所述,答案为C。
7.D
【详解】
A.I2为固体,不能利用固体表示化学反应速率,故A不符合题意;
B.若c(HI)由0.1mol?L-1降到0.07mol?L-1时,需要15s,即减少0.03mol?L-1需要15s,c(HI)由0.07mol?L-1降到0.05mol?L-1时,浓度减少0.02
mol?L-1,当速率与浓度变化成正比时,需要,随着反应的进行,反应物的浓度减小,化学反应速率减小,需要的时间就长,所以需要时间大于10s,故B不符合题意;
C.对于任何化学反应,升高温度,正逆反应速率均加快,故C不符合题意;
D.该反应为气体体积增大的反应,减小体积,即增大压强,化学反应速率加快,故D符合题意;
答案选D。
8.D
【详解】
反应速率之比等于反应方程式计量系数之比,速率与其计量系数比值越大,反应速率越快,
A.?=mol/(L·min)=0.15mol/(L·min)
B.=mol/(L·min)=0.2mol/(L·min)
C.R为纯液体,不能表示反应速率。
D.?=mol/(L·min)=0.225mol/(L·min)
所以反应速率快慢顺序为D>B>A,则最快的是?D。
故选:D。
9.B
【详解】
A.为强酸的酸式盐,向反应混合液中加入固体,由于电离出氢离子而使溶液中的氢离子浓增大,从而化学反应速率增大,故A错;
B.加入少量硫酸钠固体,溶液中的氢离子浓度几乎不变,则化学反应速率也不变,故B正确;
C.为强碱弱酸盐,醋酸根会与溶液中的氢离子结合生成弱电解质醋酸,从而使溶液中的氢离子浓度减小,则化学反应速率减小,故C错;
D.中的在Zn的表面得到电子被还原为单质Cu,从而形成无数个微小的原电池,会加快化学反应速率,故D错;
答案选B。
10.C
【详解】
A.0~5
min内Δn(C)=0.9mol,根据方程式可知Δn(A)=0.3mol,容器体积为2L,所以用
A
表示的平均反应速率为=0.03
mol·L?1·min?1,A错误;
B.该反应前后气体系数之和相等,容器恒容,所以无论是否平衡,压强都不发生变化,压强不变不能说明反应平衡,B错误;
C.10min时Δn(A)=2.0mol-1.6mol=0.4mol,则此时Δn(B)=0.8mol,容器内n(B)=2.4mol-0.8mol=1.6mol,15min时n(B)仍为1.6mol,物质的量不再改变,说明已经达到平衡,此时n(C)=1.2mol,容器体积为2L,则c(C)=0.6
mol·L?1,C正确;
D.容积不变,充入少量氦气,A、B的浓度不变,则反应速率不变,达到平衡时间不变,D错误;
综上所述答案为C。
11.C
【详解】
A.
反应为恒温恒容,气体的密度始终保持不变,故A不符;
B.
CO浓度与浓度相等,不能说明各组分浓度不变,故B不符;
C.
反应各组分均为气体,气体的平均摩尔质量随气体的总物质的量改变而改变,气体的平均摩尔质量保持不变,说明已经达到平衡状态,故C符合;
D.
,说明,没有达到平衡状态,故D不符;
故选C。
12.A
【详解】
①C的生成速率与C的消耗速率相等,说明反应达到平衡状态,故不选①;
②单位时间内生成a
molA,同时生成3a
molB,A、B都是反应物,生成A、B的速率都是逆反应速率,不能说明反应达到平衡状态,故选②;?
③A、B、C的浓度不再变化,说明反应达到平衡状态,故不选③;?
④C的物质的量不再变化,说明各组分浓度不变,反应达到平衡状态,故不选④;?
⑤混合气体的总压强不再变化,反应前后气体体积不相同,压强不变说明各组分浓度不变,反应达到平衡状态,故不选⑤;?
⑥混合气体的总物质的量不再变化,反应前后气体物质的量不相同,气体总物质的量不变说明各组分浓度不变,反应达到平衡状态,故不选⑥;?
⑦单位时间消耗a
mol
A,同时生成3a
molB,说明正逆反应速率相等,反应达到平衡状态,故不选⑦;?
⑧A、B、C的分子数之比决定于开始加入物质的多少,与平衡状态无关,故选⑧;
根据以上分析②⑧不能作为可逆反应A(g)+3B(g)
2C(g)达到平衡状态标志;故选A;
答案为A。
13.A
【详解】
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:,
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
由于为可逆反应,物质不能完全转化,所以平衡时浓度范围为0
14.B
【分析】
可以通过增大盐酸浓度、升高温度等方法来改变,但改变条件时不能加入和稀盐酸反应生成氢气的物质,据此分析解答。
【详解】
①加H2O,氢离子浓度减小,减慢反应的速率,故错误;
②加NaOH固体,消耗氢离子,氢离子浓度减小,减慢反应的速率,并且还有可能改变H2的产量,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
④滴加少量硫酸铜溶液,消耗铁粉,则生成氢气量减少,故错误;
⑤加NaCl溶液,氢离子浓度降低,反应速率减慢,故错误;
⑥改用的,氢离子浓度增大,反应速率加快,且生成氢气量不变,故正确;
⑦升高温度(不考虑盐酸挥发),增大活化分子百分数,化学反应速率增大,且不影响生成氢气总量,故正确;
⑧改用硝酸,硝酸是氧化性酸,和铁反应不能生成氢气,故错误;
综上所述,③⑥⑦符合题意,故选B。
15.A
【详解】
A.钠在CO2中燃烧生成黑色颗粒,说明有C生成,CO2中碳元素化合价降低,作氧化剂,故A正确;
B.高锰酸钾均过量,不能观测到褪色时间,应控制高锰酸钾量均不足、且浓度不同,故B错误;
C.NaOH过量,碘与NaOH反应,不能检验淀粉的存在,应取少量水解后的溶液加碘水检验,且没有检验葡萄糖,不能确定淀粉是否水解,故C错误;
D.比较元素非金属性强弱应利用其最高价氧化物对应水化物的酸性强弱,而盐酸为无氧酸,故D错误。
答案选A。
16.X(g)
+2Y(g)2Z(g)
0.017
45%
升高温度
使用合适催化剂
增大压强
>
>
【分析】
X和Y反应生成气态物质Z,第9min,各种物质的物质的量不再发生变化,即达到化学平衡状态,根据变化的物质的量之比等于化学计量数之比,可以得到该反应的化学方程式,由此分析。
【详解】
(1)由表中数据可知,X、Y为反应物,Z为生成物,9min时Δn(X)=1mol-0.55mol=0.45mol,Δn(Y)=2mol-1.1mol=0.9mol,Δn(Z)=0.9mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,物质的量变化量之比等于化学计量数之比,n(X):n(Y):n(Z)=0.45:0.9:0.9=1:2:2,故反应方程式为X(g)
+2Y(g)2Z(g);
(2)0-3min内Z的反应速率v(Z)===0.017mol/(L?min);
(3)由图表数据可知反应到9min,反应达到平衡,反应达到平衡时反应物X的转化率=×100%=×100%=45%;
(4)该可逆反应正反应为放热反应,且为气体体积增大的反应,由表中数据可知,平衡时Z的物质的量为0.9mol,由图2可知曲线①平衡后,Z的物质的量为0.6,Z的物质的量减小,故平衡向逆反应移动,应是升高温度;曲线②平衡后,Z的物质的量为0.9mol,Z的物质的量未变,应是使用催化剂;曲线③平衡后,Z的物质的量为0.95mol,Z的物质的量增大,应是增大压强;
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4.00mol和0mol,在原温度下达平衡时,相当于原平衡增大压强,平衡正向进行,X的转化率为α1增大,则α1>α;
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,转化为起始量;
和原平衡比较相当于在原平衡中加入了0.50molX,平衡正向进行,此时可逆反应的反应速率υ(正)>υ(逆)。
17.聚乙烯
没有
热分解过程的锅炉以及管道多为金属材料,生成的氯化氢可能腐蚀设备,所以应尽量减少接触生成的氯化氢
80.4n
c
放热
大于
5.0×10-3
【分析】
(1)根据各种元素的含量多少分析判断所含物质种类;
(2)①根据温度与固体产物的图示分析判断;
②根据设备材料与HCl的性质分析;
(3)根据反应热与反应物、生成物的键能关系计算判断;
(4)①根据平衡常数表达式的含义书写;
②根据外界条件对反应速率和化学平衡的影响分析判断;
③根据温度对HCl的平衡转化率的影响判断反应热效应;利用Cl2的物质的量可计算反应消耗的HCl的物质的量,再根据HCl的平衡转化率可计算出反应开始时HCl的物质的量,进而可得平衡时HCl的物质的量。
【详解】
(1)由质量分析表可知废弃望料中含量最高的是碳和氢元素,氯元素和氧元素含量都是较低的,所以由此判断其主要成分应该是聚乙烯;
(2)①从图中分析可知,只要最终的温度相同,不同的升温速率最终对最后的固体产物的质量都不会产生影响;
②热分解过程的锅炉以及管道多为金属材料,生成的氯化氢可能腐蚀设备,所以应尽量减少接触生成的氯化氢;
(3)根据盖斯定律可知,反应热等于反应物的键能和减去生成物的键能和,一个链节的△H=2×347.7
kJ/mol-615.0
kJ/mol=+80.4
kJ/mol,故该反应的反应热为+80.4n
kJ/mol;
(4)①根据平衡常数的定义,各物质的浓度用平衡分压代替可得平衡常数的表达式为:Kp=;
②在固定容积的容器中进行反应O2(g)+4HCl(g)2Cl2(g)+2H2O(g)。其它条件不变时,
a.升高温度,物质的内能增加,气体分子之间有效碰撞次数加快,反应速率增大,a正确;
b.增大O2分压,O2的浓度增大,单位时间内气体分子之间有效碰撞次数增多,反应速率增大,b正确;
c.增大O2平衡分压,化学反应速率加快,但O2的平衡转化率会减小,c错误;
d.减小H2O平衡分压,化学平衡正向移动,O2的转化率增大,d正确;
故答案选c;
③由图像分析可知,升高温度α(HC1)降低,说明升高温度,化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,所以该反应的正反应是放热反应;再p0和p1两条曲线的位置分析可知,等温时从p0到p1的过程中,α(HCl)增大,说明压强p1大于p0;
平衡状态A点时,n(Cl2)=1.0×10-2
mol,对应的消耗的n(HCl)=2.0×10-2
mol,此时HCl的转化率为80%,所以起始的n(HCl)起始=2.0×10-2÷0.8
mol=0.025
mol,平衡时的容器中的n(HC1)
=
n(HCl)起始-
n(HCl)消耗=0.02
mol-0.025
mol=0.005
mol=5.0×10-3
mol。
【点睛】
本题综合考查了化学反应原理。(3)在计算由聚乙烯变为乙烯的反应热时,要注意结合聚合度及链节变化时每形成1个CH2=CH2分子会同时断裂2个C-C键,形成1和C=C双键分析;在(4)③中计算平衡时HCl的物质的量时,要注意结合物质反应转化消耗关系及物质平衡转化率分析。
18.-49.4
kJ/mol
0.3mol·
L-1·
min-1
45%
12.5
/p2总
?
曲线?反应速率更快且平衡时n(H2)变大,平衡逆向移动
增大n(H2)(或缩小容器体积,增大压强)
【详解】
(1)已知:
H2的燃烧热为?H1=-285.8
kJ/
mol;则反应①:H2的燃烧热化学方程式为:②:H2O
(g)=H2O
(1)
?H2=-44.0
kJ/
mol,③:2
CH3OH(g)
+
3O2(g)
=
2CO2(g)
+4
H2O(g)
?H3=-1352.0
kJ/
mol,根据该斯定律,反应I=,故反应I的?H=-49.4
kJ/mol
(2)①T℃下,将6
mol
CO2和8
mol
H2组成的气态混合物充入2L密闭容器中发生反应Ⅰ,从反应开始至a点,用CO2表示的平均反应速率,氢气的转化率为
故答案为:0.3mol·
L-1·
min-1,45%
②由已知、图示数据可得三段式:
该温度下,达到平衡时容器的总压为总kPa,则此反应的化学平衡常数
故答案为:12.5
/p2总
(3)先拐先平速度快,升温时反应速率增大、CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.4kJ/mo1平衡左移,氢气的物质的量减小,故:若图中虚线表示仅改变温度时n(H2)随时间的高温度对应的是曲线I,反应判断的依据是:曲线I反应速率更快且平衡时n(H2)变大,故答案为:曲线?反应速率更快且平衡时n(H2)变大,平衡逆向移动
(4)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的正反应是气体分子总数减小的反应,在T°C下,提高CO2平衡转化率的一种措施是:体积不变时增大n(H2)或缩小容器的容积,增大压强。故答案为:增大n(H2)(或缩小容器体积,增大压强)
19.使GeO2尽可能转化为Na2GeO3,且加快GeO2与NaOH和碳酸钠反应的速率
GeO2+2NaOH=
Na2GeO3+H2O
搅拌,适当升高温度
使AlO2-和SiO32-形成沉淀而除去
H2GeO3(或GeO2·nH2O)
GeO2+2H2Ge+2H2O
【详解】
(1)加入过量的粉碎的NaOH和Na2CO3固体,可以增大反应物的接触面积,使GeO2尽可能转化为Na2GeO3,且加快GeO2与NaOH和碳酸钠反应的速率,其中GeO2与NaOH反应的化学方程式为GeO2+2NaOH=Na2GeO3+H2O。(2)根据外界条件对反应速率的影响可知,还可采取的措施有搅拌,适当升高温度;(3)由于溶液中含有偏铝酸盐和硅酸盐,所以浸出液中滴加7mol/L盐酸,调节溶液的pH约为11的目的是使AlO2-和SiO32-形成沉淀而除去。(4)如果酸度不够,则锗酸盐容易转化为锗酸沉淀,所以该沉淀物是H2GeO3(或GeO2·nH2O)
;(5)GeCl4的沸点是83.1℃,说明是共价化合物,其电子式为。(6)GeO2和H2在加热的条件下可制得单质锗,另一种生成物是水,该反应的化学方程式为GeO2+2H2Ge+2H2O。
点睛:无机工业流程题能够以真实的工业生产过程为背景,体现能力立意的命题为指导思想,能够综合考查学生各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力,所以这类题成为近年来高考的必考题型。解决本类题目的基本方法和步骤为:(1)从题干中获取有用信息,了解生产的产品。(2)然后整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。(3)分析流程中的每一步骤,从以下几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
