第三单元 课题2 第1课时 原子的构成 相对原子质量 课件(28张PPT)—2021-2022学年九年级化学人教版化上册
文档属性
| 名称 | 第三单元 课题2 第1课时 原子的构成 相对原子质量 课件(28张PPT)—2021-2022学年九年级化学人教版化上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 35.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-13 21:48:46 | ||
图片预览







文档简介
课题2 原子的结构
人教版九年级上册 第三单元
第一课时
知识目标
新课导入
课程讲授
习题练习
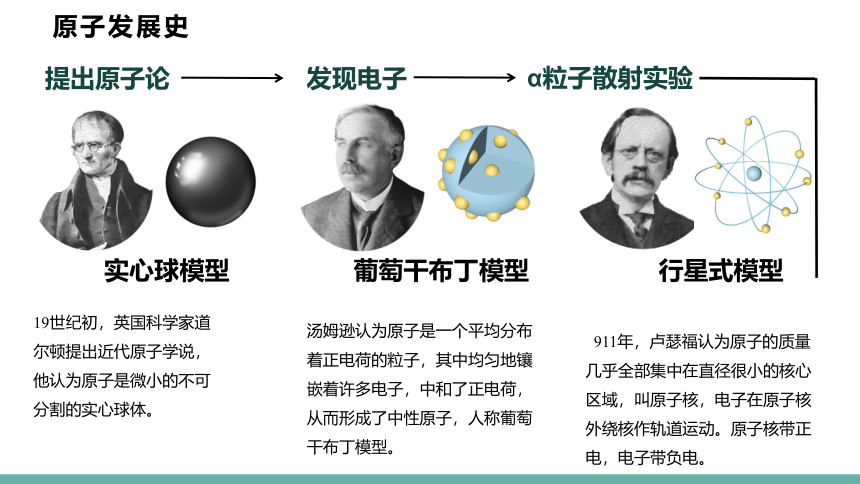
实心球模型
提出原子论
发现电子
葡萄干布丁模型
行星式模型
α粒子散射实验
原子发展史
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
汤姆逊认为原子是一个平均分布着正电荷的粒子,其中均匀地镶嵌着许多电子,中和了正电荷,从而形成了中性原子,人称葡萄干布丁模型。
1911年,卢瑟福认为原子的质量几乎全部集中在直径很小的核心区域,叫原子核,电子在原子核外绕核作轨道运动。原子核带正电,电子带负电。
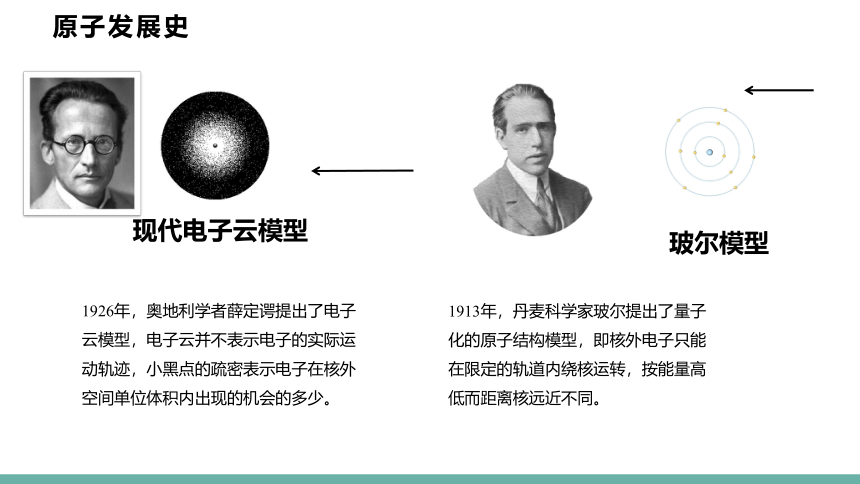
玻尔模型
现代电子云模型
1913年,丹麦科学家玻尔提出了量子化的原子结构模型,即核外电子只能在限定的轨道内绕核运转,按能量高低而距离核远近不同。
1926年,奥地利学者薛定谔提出了电子云模型,电子云并不表示电子的实际运动轨迹,小黑点的疏密表示电子在核外空间单位体积内出现的机会的多少。
原子发展史
课程讲授
知识目标
初步认识
1.知道原子的构成以及构成粒子之间的关系。
2.知道相对原子质量的含义,并学会查相对原子质量表。
3.能运用相对原子质量的两个公式进行相关计算。
1.48cm
这条线段分成一亿等份,每一份长度才和一个氧原子的直径相等。
原子实在太小了,不能再分了!
科学发展永无止境,原子确实可以再分,今天我们一起来学习原子的构成问题。
新课导入
1、原子的内部结构 :
原子
原子核
核外电子
质子
中子
:每个电子带一个单位的负电荷
:每个质子带一个单位的正电荷
:不带电
一、原子的构成
课程讲授
新课推进
+
+
+
-
-
-
10-15~10-14m
约10-10m
电子
原子核
注意:原子不是一个实心球体。
原子核:小而重,集中了原子几乎
全部质量和所有正电荷。
原子核
核外电子
原子核的体积仅占原子体积的几干亿分之ー。如果把原子比作一个庞大的体育场,原子核只相当于体育场中的一只蚂蚁,电子在原子核外很大的空间做高速运动。
核外电子:高速运动,
每个都带一个单位负电荷。
课程讲授
新课推进
2.原子中各微粒电性
电子带一个单位负电荷,中子不带电,质子带一个单位正电荷,由于质子(原子核)与电子所带电荷数相等,但电性相反,所以整个原子不显电性。
-
+
+
-
质子
中子
核外电子
课程讲授
新课推进
3.构成原子的粒子的电性和质量
粒子种类
电性
质量
质子
1个单位正电荷
1.6726×10-27kg
中子
不带电
1.6749×10-27kg
电子
1个单位负电荷
质子质量的1/1836
(1)一个质子和一个电子所带的电量相等,电性相反。
(2)一个质子和一个中子的质量约相等。
(3)原子的质量主要集中在原子核上。
课程讲授
新课推进
思 考
从下列表格中你可以得到哪些结论?
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
课程讲授
新课推进
原子中:
1、核电荷数=质子数=核外电子数。
2、质子数不一定等于中子数。
3、不是所有的原子都有中子。
4、原子种类不同,核内质子数不同。
氢原子没有中子
课程讲授
新课推进
紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
A. 10 B. 34 C. 44 D. 78
B
例
课程讲授
新课推进
导引:原子中质子、中子、电子间的数量关系可运用推理法得出结论。原子由带正电荷的原子核与核外带负电荷的电子构成,原子不显电性,因此,原子核所带正电荷数与核外电子所带负电荷数相等,中子不带电,所以质子数、核电荷数与核外电子数均相等。
课程讲授
新课推进
质子:
质子数=核电荷数=核外电子数
(与中子数无关)
中子:
不带电
每个带一个单位正电荷
(不带电)
原子
原子核
小而重、带正电
核外电子
每个电子带一个单位负电荷
(核电荷数)
核电荷数 = 核外电子数
核电荷数=质子数
课程讲授
课堂小结
二、相对原子质量
1.原子的实际质量
{5940675A-B579-460E-94D1-54222C63F5DA}原子种类
原子质量
氢
1.67ⅹ10-27 kg
氧
2.657×10-26 kg
碳
1.993×10-26 kg
铁
9.288×10-26 kg
(1)不同原子的质量不同;
(2)原子的质量很小;
(3)如此小的数据书写、使用均不方便。
课程讲授
新课推进
二、相对原子质量
课程讲授
新课推进
以一种碳12原子质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar )。
H
H
H
H
H
H
H
H
H
H
H
H
C
12个氢原子
1个碳原子
2.相对原子质量
Ar=
该原子的质量
碳原子质量
表达式
作为相对原子质量标准的1个碳原子的质量是1.993×10-26 kg,已知1个钙原子的质量是6.64×10-26 kg,则钙原子的相对原子质量是 ( )
A.6.64×10-26 kg B.3.33 C.40 g D.40
【解题思路】 本题考查相对原子质量的计算。根据题意,钙原子的相对原子质量是6.64×10-26 kg÷(112×1.993×10-26 kg)≈40,故选D。
?
课程讲授
新课推进
例
D
3.相对原子质量和质子数、中子数之间的关系
原子种类
相对原子质量
质子数
中子数
氢
1
1
0
碳
12
6
6
氧
16
8
8
钠
23
11
12
磷
31
15
16
硫
32
16
16
铁
56
26
30
课程讲授
新课推进
在原子中,核电荷数=核内质子数=核外电子数
跟质子、中子相比,电子质量很小,约为质子质量的1/1836,通常忽略不计,原子的质量主要集中在原子核上。质子和中子的质量跟相对原子质量标准相比较,均约等于1。
相对原子质量≈质子数+中子数
课程讲授
新课推进
课程讲授
新课推进
相对原子质量与原子质量有什么区别?
①相对原子质量不等于原子的实际质量,是个比值。
②原子实际质量越大,它的相对原子质量数值越大。
③相对原子质量的单位:“1”(书写时一般不写出)。原子实际质量的单位是:千克。
课程讲授
新课推进
原子的构成、
相对原子质量
原子的构成
相对原子质量
原子
核电荷数=质子数=核外电子数
原子核
核外电子
质子
中子
定义
相对原子质量=质子数+中子数
1.原子的构成示意图如图所示,下列叙述正确的是( )
A.原子是实心球体
B.质子、中子、电子均匀分散在原子中
C.质子与电子质量相等
D.整个原子的质量主要集中在原子核上
【解题思路】 由题图可知,原子是由居于原子中心的原子核和核外电子构成的,原子核中有质子和中子,原子核的体积很小,电子在原子核外空间运动,因此,原子不是实心球体,质子、中子、电子也不是均匀分散在原子中的,A、B错误;1个质子和1个中子的质量近乎相等,而1个电子的质量约是1个质子质量的11?836,因此,整个原子的质量主要集中在原子核上,C错误,D正确。
?
课堂练习
D
2. 下列对原子性质和构成的叙述:①原子是化学变化中的最小粒子;②原子在不停地运动;③物质都是由原子构成的;④原子核都是由质子和中子构成的;⑤原子不显电性。其中不正确的是( )
A.①② B.③④ C.③⑤ D.只有④
【解析】本题运用筛选法解答,即对每一个选项进行逐一分析,筛选出符合题目要求的选项。构成物质的粒子有分子、原子和离子等,原子只是其中的一种,故③错;普通氢原子核内不含中子,故④错。
【答案】B
B
课堂练习
3.[2021江苏宜兴期中]我国著名科学家张青莲教授主持测定了铕等9种元素的相对原子质量新值,已知铕原子的中子数为89,核外电子数为63,则铕原子核内的质子数为 ( )
A.152 B.89 C.63 D.215
【解题思路】 因为原子中核电荷数=核内质子数=核外电子数,由题意铕原子的核外电子数为63,故铕原子核内的质子数为63。
C
课堂练习
4. [2020江苏泰州中考改编]制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的中子数为 ( )
A.22 B.48 C.70 D.26
【解题思路】 相对原子质量≈质子数+中子数,已知钛原子的质子数为22,相对原子质量为48,则钛原子的中子数为48-22=26。
D
课堂练习
6.(2021·揭东质检) 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( )
课堂练习
5.(2021·潮州质检)美国劳伦斯·利费莫尔国家实验室于2006年10月16日宣布,该实验室科学家与俄罗斯科学家成功合成了核电荷数为118号超重元素,该元素的相对原子质量为297。则该元素的电子数和中子数分别是( )
A.118、297 B.118、179 C.297、118 D.179、118
B
A
7.(2019·常州)已知某氧原子的实际质量为m g,其相对原子质量为16,有一种铕(Eu)原子的相对原子质量为152,铕(Eu)原子的质量为( )
A. B.
C. D.
【解析】解答本题可采用内涵分析法,即结合相对原子质量的概念解答。设铕(Eu)原子的质量为x,由相对原子质量之比等于原子质量之比,则
A
课堂练习
人教版九年级上册 第三单元
第一课时
知识目标
新课导入
课程讲授
习题练习
实心球模型
提出原子论
发现电子
葡萄干布丁模型
行星式模型
α粒子散射实验
原子发展史
19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
汤姆逊认为原子是一个平均分布着正电荷的粒子,其中均匀地镶嵌着许多电子,中和了正电荷,从而形成了中性原子,人称葡萄干布丁模型。
1911年,卢瑟福认为原子的质量几乎全部集中在直径很小的核心区域,叫原子核,电子在原子核外绕核作轨道运动。原子核带正电,电子带负电。
玻尔模型
现代电子云模型
1913年,丹麦科学家玻尔提出了量子化的原子结构模型,即核外电子只能在限定的轨道内绕核运转,按能量高低而距离核远近不同。
1926年,奥地利学者薛定谔提出了电子云模型,电子云并不表示电子的实际运动轨迹,小黑点的疏密表示电子在核外空间单位体积内出现的机会的多少。
原子发展史
课程讲授
知识目标
初步认识
1.知道原子的构成以及构成粒子之间的关系。
2.知道相对原子质量的含义,并学会查相对原子质量表。
3.能运用相对原子质量的两个公式进行相关计算。
1.48cm
这条线段分成一亿等份,每一份长度才和一个氧原子的直径相等。
原子实在太小了,不能再分了!
科学发展永无止境,原子确实可以再分,今天我们一起来学习原子的构成问题。
新课导入
1、原子的内部结构 :
原子
原子核
核外电子
质子
中子
:每个电子带一个单位的负电荷
:每个质子带一个单位的正电荷
:不带电
一、原子的构成
课程讲授
新课推进
+
+
+
-
-
-
10-15~10-14m
约10-10m
电子
原子核
注意:原子不是一个实心球体。
原子核:小而重,集中了原子几乎
全部质量和所有正电荷。
原子核
核外电子
原子核的体积仅占原子体积的几干亿分之ー。如果把原子比作一个庞大的体育场,原子核只相当于体育场中的一只蚂蚁,电子在原子核外很大的空间做高速运动。
核外电子:高速运动,
每个都带一个单位负电荷。
课程讲授
新课推进
2.原子中各微粒电性
电子带一个单位负电荷,中子不带电,质子带一个单位正电荷,由于质子(原子核)与电子所带电荷数相等,但电性相反,所以整个原子不显电性。
-
+
+
-
质子
中子
核外电子
课程讲授
新课推进
3.构成原子的粒子的电性和质量
粒子种类
电性
质量
质子
1个单位正电荷
1.6726×10-27kg
中子
不带电
1.6749×10-27kg
电子
1个单位负电荷
质子质量的1/1836
(1)一个质子和一个电子所带的电量相等,电性相反。
(2)一个质子和一个中子的质量约相等。
(3)原子的质量主要集中在原子核上。
课程讲授
新课推进
思 考
从下列表格中你可以得到哪些结论?
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
课程讲授
新课推进
原子中:
1、核电荷数=质子数=核外电子数。
2、质子数不一定等于中子数。
3、不是所有的原子都有中子。
4、原子种类不同,核内质子数不同。
氢原子没有中子
课程讲授
新课推进
紫薯中含有被誉为“抗癌大王”的硒元素。已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
A. 10 B. 34 C. 44 D. 78
B
例
课程讲授
新课推进
导引:原子中质子、中子、电子间的数量关系可运用推理法得出结论。原子由带正电荷的原子核与核外带负电荷的电子构成,原子不显电性,因此,原子核所带正电荷数与核外电子所带负电荷数相等,中子不带电,所以质子数、核电荷数与核外电子数均相等。
课程讲授
新课推进
质子:
质子数=核电荷数=核外电子数
(与中子数无关)
中子:
不带电
每个带一个单位正电荷
(不带电)
原子
原子核
小而重、带正电
核外电子
每个电子带一个单位负电荷
(核电荷数)
核电荷数 = 核外电子数
核电荷数=质子数
课程讲授
课堂小结
二、相对原子质量
1.原子的实际质量
{5940675A-B579-460E-94D1-54222C63F5DA}原子种类
原子质量
氢
1.67ⅹ10-27 kg
氧
2.657×10-26 kg
碳
1.993×10-26 kg
铁
9.288×10-26 kg
(1)不同原子的质量不同;
(2)原子的质量很小;
(3)如此小的数据书写、使用均不方便。
课程讲授
新课推进
二、相对原子质量
课程讲授
新课推进
以一种碳12原子质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar )。
H
H
H
H
H
H
H
H
H
H
H
H
C
12个氢原子
1个碳原子
2.相对原子质量
Ar=
该原子的质量
碳原子质量
表达式
作为相对原子质量标准的1个碳原子的质量是1.993×10-26 kg,已知1个钙原子的质量是6.64×10-26 kg,则钙原子的相对原子质量是 ( )
A.6.64×10-26 kg B.3.33 C.40 g D.40
【解题思路】 本题考查相对原子质量的计算。根据题意,钙原子的相对原子质量是6.64×10-26 kg÷(112×1.993×10-26 kg)≈40,故选D。
?
课程讲授
新课推进
例
D
3.相对原子质量和质子数、中子数之间的关系
原子种类
相对原子质量
质子数
中子数
氢
1
1
0
碳
12
6
6
氧
16
8
8
钠
23
11
12
磷
31
15
16
硫
32
16
16
铁
56
26
30
课程讲授
新课推进
在原子中,核电荷数=核内质子数=核外电子数
跟质子、中子相比,电子质量很小,约为质子质量的1/1836,通常忽略不计,原子的质量主要集中在原子核上。质子和中子的质量跟相对原子质量标准相比较,均约等于1。
相对原子质量≈质子数+中子数
课程讲授
新课推进
课程讲授
新课推进
相对原子质量与原子质量有什么区别?
①相对原子质量不等于原子的实际质量,是个比值。
②原子实际质量越大,它的相对原子质量数值越大。
③相对原子质量的单位:“1”(书写时一般不写出)。原子实际质量的单位是:千克。
课程讲授
新课推进
原子的构成、
相对原子质量
原子的构成
相对原子质量
原子
核电荷数=质子数=核外电子数
原子核
核外电子
质子
中子
定义
相对原子质量=质子数+中子数
1.原子的构成示意图如图所示,下列叙述正确的是( )
A.原子是实心球体
B.质子、中子、电子均匀分散在原子中
C.质子与电子质量相等
D.整个原子的质量主要集中在原子核上
【解题思路】 由题图可知,原子是由居于原子中心的原子核和核外电子构成的,原子核中有质子和中子,原子核的体积很小,电子在原子核外空间运动,因此,原子不是实心球体,质子、中子、电子也不是均匀分散在原子中的,A、B错误;1个质子和1个中子的质量近乎相等,而1个电子的质量约是1个质子质量的11?836,因此,整个原子的质量主要集中在原子核上,C错误,D正确。
?
课堂练习
D
2. 下列对原子性质和构成的叙述:①原子是化学变化中的最小粒子;②原子在不停地运动;③物质都是由原子构成的;④原子核都是由质子和中子构成的;⑤原子不显电性。其中不正确的是( )
A.①② B.③④ C.③⑤ D.只有④
【解析】本题运用筛选法解答,即对每一个选项进行逐一分析,筛选出符合题目要求的选项。构成物质的粒子有分子、原子和离子等,原子只是其中的一种,故③错;普通氢原子核内不含中子,故④错。
【答案】B
B
课堂练习
3.[2021江苏宜兴期中]我国著名科学家张青莲教授主持测定了铕等9种元素的相对原子质量新值,已知铕原子的中子数为89,核外电子数为63,则铕原子核内的质子数为 ( )
A.152 B.89 C.63 D.215
【解题思路】 因为原子中核电荷数=核内质子数=核外电子数,由题意铕原子的核外电子数为63,故铕原子核内的质子数为63。
C
课堂练习
4. [2020江苏泰州中考改编]制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的中子数为 ( )
A.22 B.48 C.70 D.26
【解题思路】 相对原子质量≈质子数+中子数,已知钛原子的质子数为22,相对原子质量为48,则钛原子的中子数为48-22=26。
D
课堂练习
6.(2021·揭东质检) 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( )
课堂练习
5.(2021·潮州质检)美国劳伦斯·利费莫尔国家实验室于2006年10月16日宣布,该实验室科学家与俄罗斯科学家成功合成了核电荷数为118号超重元素,该元素的相对原子质量为297。则该元素的电子数和中子数分别是( )
A.118、297 B.118、179 C.297、118 D.179、118
B
A
7.(2019·常州)已知某氧原子的实际质量为m g,其相对原子质量为16,有一种铕(Eu)原子的相对原子质量为152,铕(Eu)原子的质量为( )
A. B.
C. D.
【解析】解答本题可采用内涵分析法,即结合相对原子质量的概念解答。设铕(Eu)原子的质量为x,由相对原子质量之比等于原子质量之比,则
A
课堂练习
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
