第三单元 到实验室去 配制一定溶质质量分数的溶液课件--2021-2022学年九年级化学鲁教版上册(22张PPT)
文档属性
| 名称 | 第三单元 到实验室去 配制一定溶质质量分数的溶液课件--2021-2022学年九年级化学鲁教版上册(22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 883.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-13 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
×
100%
溶质质量
+
溶剂质量
溶质质量
溶液质量
溶质质量分数
溶质质量
×100%
=
=
课堂回顾
溶质质量=溶液质量×溶质质量分数
溶液质量=溶质质量÷溶质质量分数
溶剂质量=溶液质量-溶质质量
溶液稀释,常用方法
:
(1)加水。
溶质质量不变;溶剂质量增大;溶液质量增大
。
(2)减少溶质;
(3)加更稀的溶液
溶液增浓,常用的方法:
(1)加溶质:溶质质量增大,溶剂质量不变,溶液质量增大;
(2)蒸发溶剂:溶质质量不变,溶剂质量减小,溶液质量减小;
(3)加入更浓的溶液。溶质、溶剂、溶液都增大。
课堂回顾
白酒的“度”数,是体积分数
课堂回顾
医疗上,生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
那么如何配制一定溶质质量分数的溶液呢?
实验室是怎样配制溶液的呢?
如:配制50g16%的氯化钠溶液
思考:现欲配制这种氯化钠溶液,需要哪些仪器?操作步骤是什么?
用固体溶质来配制溶液
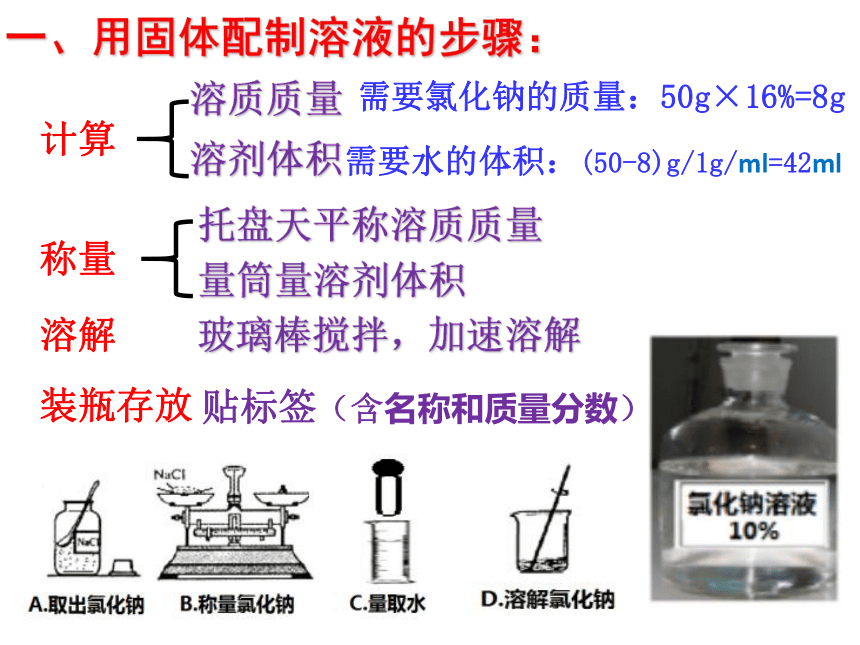
计算
称量
溶解
溶质质量
溶剂体积
托盘天平称溶质质量
量筒量溶剂体积
玻璃棒搅拌,加速溶解
装瓶存放
一、用固体配制溶液的步骤:
需要氯化钠的质量:50g×16%=8g
需要水的体积:(50-8)g/1g/ml=42ml
贴标签(含名称和质量分数)
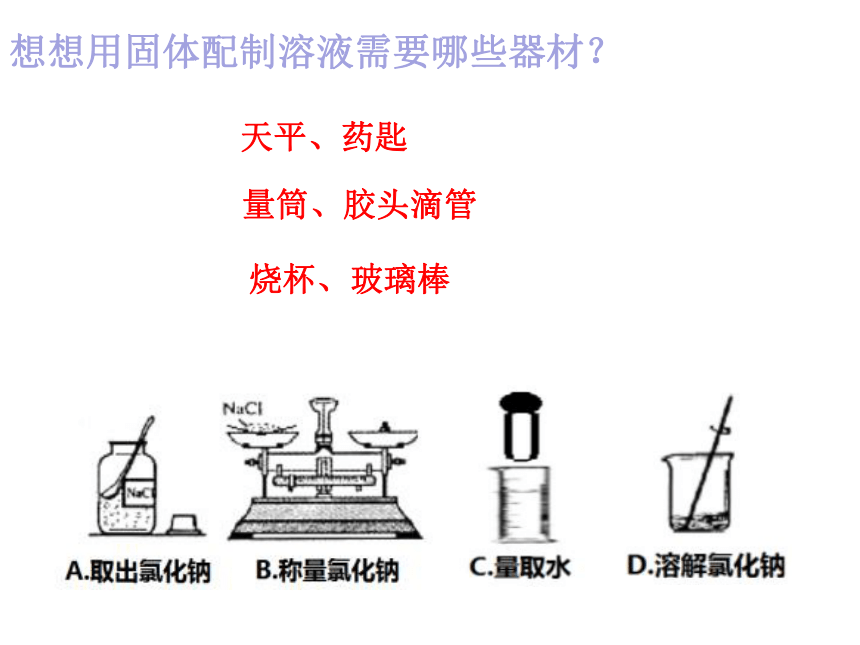
天平、药匙
想想用固体配制溶液需要哪些器材?
烧杯、玻璃棒
量筒、胶头滴管
疑点探究:
1、如果所配溶液的溶质质量分数小于16%,你认为可能的原因有哪些?
分析:从溶质偏少角度去思考。。。。。。
从溶剂偏多角度去思考。。。。。。
小结:药品不纯;
物码倒置且使用了游码;
转移称好的药品时洒落;
仰视量筒读数;
盛溶液的烧杯中原先就有水等。
疑点探究:
2、如果所配溶液的溶质质量分数大于16%,你认为可能的原因有哪些?
分析:从溶质偏多角度去思考。。。。。。
从溶剂偏少角度去思考。。。。。。
小结:读数时天平指针偏左;
俯视量筒读数等
疑点探究:
3、溶解步骤完成之后,在转移到细口瓶中装瓶存放时,不小心将溶液洒落了,这样得到的溶液质量分数会偏大或偏小吗?
分析:溶液具有均一性。因此洒落一部分,不会改变其浓度。
小结:不改变溶质的质量分数。
二、配制一定质量分数的溶液误差分析:
溶质质量分数偏小的原因:
溶质质量分数偏大的原因:
药品不纯;物码倒置且使用了游码;转移称好的药品时洒落;仰视量筒读数;烧杯中原先就有水等
天平读取质量时指针偏左;俯视量筒读数等
归纳一下:
三、用浓溶液来配制稀溶液(即稀释)
如将100ml98%的浓硫酸溶液(密度为1.84g/cm3)配制成10%的稀硫酸溶液,应该怎样操作?
⑴
计算
⑵
量取
⑶
稀释
⑷
装瓶存放
用浓溶液配制稀溶液的步骤:
浓溶液体积
溶剂水体积
100ml
1.84g/ml×100ml×98%
10%
-1.84g/ml×100ml
÷1g/ml
量筒量浓溶液体积和溶剂水体积
倾倒混合
贴标签
对比一下:
用固体配制溶液的步骤:
用浓溶液配制稀溶液的步骤:
计算
称量
溶解
装瓶存放
计算
量取
稀释
装瓶存放
后者不需称质量
(即后者不用托盘天平)
计算
称量
溶解
装瓶存放
计算
量取
稀释
装瓶存放
配制
溶液的步骤
课堂总结:
例题分析:
例1.
下列是小刚“配制50g溶质质量分数为8%的氢氧化钠溶液”的实验过程,其中正确的是(提示:氢氧化钠有强腐蚀性)
(
)
A.计算需要氢氧化钠4g、水46g
B.将氢氧化钠放在托盘天平左盘的纸上称量
C.将称取的氢氧化钠放入量筒中溶解
D.将配制好的溶液转移一半后,小刚认为剩余溶液溶质质量分数为4%
A
例2.
在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有(
)
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
A
例3.化学是一门以实验为基础的自然学科,如图是实验室常用的部分实验仪器图,请按要求回答:
(1)现用氯化钠固体配置50g质量分数为10%的氯化钠溶液,整个配置过程中不需要的实验仪器有 _________(填编号).
(2)主要的实验步骤是:
①计算:计算所需氯化钠固体的质量和水的体积.
②称量:
a.使用称量仪器的第一步是(写出操作过程)_________.
b.称取 _________g氯化钠固体,量取所需水的体积时应选用 _________ ml(填“10”、“50”或“100”)的计量仪器.
③溶解:将称好的氯化钠固体导入容器中,然后加水使其溶解,并不断搅拌.
④瓶装:将配置好的溶液装入上述仪器_________(填仪器名称)并贴上标签.
⑤误差分析:在量取水的体积时俯视读数,则导致溶液中溶质质量分数 _________ (填“偏大”、“偏小”或“不变”).
CH
取橡胶垫,放纸片,调平
5.0
50
滴瓶
偏大
例4.某实验小组欲配制200g溶质质量分数为15%的氯化钠溶液,按下述步骤操作,请填空。
(1)计算:需氯化钠_________g,水_________ml。
(2)称量:调节天平平衡后称量所需的氯化钠时,发现托盘天平的指针偏右,此时应_________。
A、增加适量氯化钠
B、减少适量氯化钠
C、调节天平平衡螺母
(3)配制溶液:用量筒取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌(其目的是___________________)。这样得到的溶液即为200g15%的氯化钠溶液。
(4)装瓶、贴标签:将配制好的溶液装入试剂瓶中,盖好瓶盖并贴上标签。标签应写_____________和_____。
30
170
A
加速氯化钠溶解
氯化钠溶液
10%
1.下图是某同学配制500g的0.9%生理盐水的全过程:
(1)请找出上图中的错误(至少指出三点):
①
;
②
;
③
。
瓶塞未倒放
砝码与药品位置放反
水未沿烧杯壁倒下
(2)若配制的生理盐水中含NaCl的质量分数小于0.9%,则可能造成误差的原因有(至少举出两点):
①
;②
。
倒已称好的NaCl时洒落
量水时仰视读数
称取的NaCl不纯;
物码倒置且使了游码;
盛溶液的烧杯内原先就有水
巩固练习:
2.某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量是
g,水为的质量
g。
②称量:用托盘天平称量氯化钠时,氯化钠应放在
(填“左盘”或“右盘”)。
③溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是
(从下列中选用:10ml、25ml、50
ml、100ml)。量取液体时,量筒必须放平,视线与液体的
保持水平。溶解氯化钠要用到玻璃棒,其作用是
。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会
(填“偏大”、“偏小”或“无影响”)。
11.7
88.3
左盘
100ml
凹液面最低处
搅拌加速溶解
偏小
3.实验室按如图步骤配制100
g质量分数为22%的蔗糖溶液。
回答下列问题。
(1)所需蔗糖的质量为___________。
(2)用规格为______(填“50”“100”或“500”)ml的量筒量取_______ml蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1
g/cm3)
(3)溶解时玻璃棒的作用是______________。
(4)下列情况会导致所配溶液中溶质的质量分数偏大的是_______(填字母)。
A.所用的蔗糖不干燥
B.用量筒量取水时仰视读数
C.量筒中的水倒入烧杯时有少量水溅出
D.配好的溶液装瓶后,烧杯内有溶液残留
22g
100
78
加速蔗糖溶解
C
白酒的“度”实际上指白酒中酒精的含量,这里的含量不是指质量分数,而是体积分数。
白酒的“度”是怎么回事?
多识一点
56度:每100毫升的酒中含有酒精56毫升。
×
100%
溶质质量
+
溶剂质量
溶质质量
溶液质量
溶质质量分数
溶质质量
×100%
=
=
课堂回顾
溶质质量=溶液质量×溶质质量分数
溶液质量=溶质质量÷溶质质量分数
溶剂质量=溶液质量-溶质质量
溶液稀释,常用方法
:
(1)加水。
溶质质量不变;溶剂质量增大;溶液质量增大
。
(2)减少溶质;
(3)加更稀的溶液
溶液增浓,常用的方法:
(1)加溶质:溶质质量增大,溶剂质量不变,溶液质量增大;
(2)蒸发溶剂:溶质质量不变,溶剂质量减小,溶液质量减小;
(3)加入更浓的溶液。溶质、溶剂、溶液都增大。
课堂回顾
白酒的“度”数,是体积分数
课堂回顾
医疗上,生理盐水的溶质质量分数是0.9%,太浓或者太稀都会带来生命危险。
那么如何配制一定溶质质量分数的溶液呢?
实验室是怎样配制溶液的呢?
如:配制50g16%的氯化钠溶液
思考:现欲配制这种氯化钠溶液,需要哪些仪器?操作步骤是什么?
用固体溶质来配制溶液
计算
称量
溶解
溶质质量
溶剂体积
托盘天平称溶质质量
量筒量溶剂体积
玻璃棒搅拌,加速溶解
装瓶存放
一、用固体配制溶液的步骤:
需要氯化钠的质量:50g×16%=8g
需要水的体积:(50-8)g/1g/ml=42ml
贴标签(含名称和质量分数)
天平、药匙
想想用固体配制溶液需要哪些器材?
烧杯、玻璃棒
量筒、胶头滴管
疑点探究:
1、如果所配溶液的溶质质量分数小于16%,你认为可能的原因有哪些?
分析:从溶质偏少角度去思考。。。。。。
从溶剂偏多角度去思考。。。。。。
小结:药品不纯;
物码倒置且使用了游码;
转移称好的药品时洒落;
仰视量筒读数;
盛溶液的烧杯中原先就有水等。
疑点探究:
2、如果所配溶液的溶质质量分数大于16%,你认为可能的原因有哪些?
分析:从溶质偏多角度去思考。。。。。。
从溶剂偏少角度去思考。。。。。。
小结:读数时天平指针偏左;
俯视量筒读数等
疑点探究:
3、溶解步骤完成之后,在转移到细口瓶中装瓶存放时,不小心将溶液洒落了,这样得到的溶液质量分数会偏大或偏小吗?
分析:溶液具有均一性。因此洒落一部分,不会改变其浓度。
小结:不改变溶质的质量分数。
二、配制一定质量分数的溶液误差分析:
溶质质量分数偏小的原因:
溶质质量分数偏大的原因:
药品不纯;物码倒置且使用了游码;转移称好的药品时洒落;仰视量筒读数;烧杯中原先就有水等
天平读取质量时指针偏左;俯视量筒读数等
归纳一下:
三、用浓溶液来配制稀溶液(即稀释)
如将100ml98%的浓硫酸溶液(密度为1.84g/cm3)配制成10%的稀硫酸溶液,应该怎样操作?
⑴
计算
⑵
量取
⑶
稀释
⑷
装瓶存放
用浓溶液配制稀溶液的步骤:
浓溶液体积
溶剂水体积
100ml
1.84g/ml×100ml×98%
10%
-1.84g/ml×100ml
÷1g/ml
量筒量浓溶液体积和溶剂水体积
倾倒混合
贴标签
对比一下:
用固体配制溶液的步骤:
用浓溶液配制稀溶液的步骤:
计算
称量
溶解
装瓶存放
计算
量取
稀释
装瓶存放
后者不需称质量
(即后者不用托盘天平)
计算
称量
溶解
装瓶存放
计算
量取
稀释
装瓶存放
配制
溶液的步骤
课堂总结:
例题分析:
例1.
下列是小刚“配制50g溶质质量分数为8%的氢氧化钠溶液”的实验过程,其中正确的是(提示:氢氧化钠有强腐蚀性)
(
)
A.计算需要氢氧化钠4g、水46g
B.将氢氧化钠放在托盘天平左盘的纸上称量
C.将称取的氢氧化钠放入量筒中溶解
D.将配制好的溶液转移一半后,小刚认为剩余溶液溶质质量分数为4%
A
例2.
在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有(
)
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
A
例3.化学是一门以实验为基础的自然学科,如图是实验室常用的部分实验仪器图,请按要求回答:
(1)现用氯化钠固体配置50g质量分数为10%的氯化钠溶液,整个配置过程中不需要的实验仪器有 _________(填编号).
(2)主要的实验步骤是:
①计算:计算所需氯化钠固体的质量和水的体积.
②称量:
a.使用称量仪器的第一步是(写出操作过程)_________.
b.称取 _________g氯化钠固体,量取所需水的体积时应选用 _________ ml(填“10”、“50”或“100”)的计量仪器.
③溶解:将称好的氯化钠固体导入容器中,然后加水使其溶解,并不断搅拌.
④瓶装:将配置好的溶液装入上述仪器_________(填仪器名称)并贴上标签.
⑤误差分析:在量取水的体积时俯视读数,则导致溶液中溶质质量分数 _________ (填“偏大”、“偏小”或“不变”).
CH
取橡胶垫,放纸片,调平
5.0
50
滴瓶
偏大
例4.某实验小组欲配制200g溶质质量分数为15%的氯化钠溶液,按下述步骤操作,请填空。
(1)计算:需氯化钠_________g,水_________ml。
(2)称量:调节天平平衡后称量所需的氯化钠时,发现托盘天平的指针偏右,此时应_________。
A、增加适量氯化钠
B、减少适量氯化钠
C、调节天平平衡螺母
(3)配制溶液:用量筒取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌(其目的是___________________)。这样得到的溶液即为200g15%的氯化钠溶液。
(4)装瓶、贴标签:将配制好的溶液装入试剂瓶中,盖好瓶盖并贴上标签。标签应写_____________和_____。
30
170
A
加速氯化钠溶解
氯化钠溶液
10%
1.下图是某同学配制500g的0.9%生理盐水的全过程:
(1)请找出上图中的错误(至少指出三点):
①
;
②
;
③
。
瓶塞未倒放
砝码与药品位置放反
水未沿烧杯壁倒下
(2)若配制的生理盐水中含NaCl的质量分数小于0.9%,则可能造成误差的原因有(至少举出两点):
①
;②
。
倒已称好的NaCl时洒落
量水时仰视读数
称取的NaCl不纯;
物码倒置且使了游码;
盛溶液的烧杯内原先就有水
巩固练习:
2.某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量是
g,水为的质量
g。
②称量:用托盘天平称量氯化钠时,氯化钠应放在
(填“左盘”或“右盘”)。
③溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是
(从下列中选用:10ml、25ml、50
ml、100ml)。量取液体时,量筒必须放平,视线与液体的
保持水平。溶解氯化钠要用到玻璃棒,其作用是
。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会
(填“偏大”、“偏小”或“无影响”)。
11.7
88.3
左盘
100ml
凹液面最低处
搅拌加速溶解
偏小
3.实验室按如图步骤配制100
g质量分数为22%的蔗糖溶液。
回答下列问题。
(1)所需蔗糖的质量为___________。
(2)用规格为______(填“50”“100”或“500”)ml的量筒量取_______ml蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1
g/cm3)
(3)溶解时玻璃棒的作用是______________。
(4)下列情况会导致所配溶液中溶质的质量分数偏大的是_______(填字母)。
A.所用的蔗糖不干燥
B.用量筒量取水时仰视读数
C.量筒中的水倒入烧杯时有少量水溅出
D.配好的溶液装瓶后,烧杯内有溶液残留
22g
100
78
加速蔗糖溶解
C
白酒的“度”实际上指白酒中酒精的含量,这里的含量不是指质量分数,而是体积分数。
白酒的“度”是怎么回事?
多识一点
56度:每100毫升的酒中含有酒精56毫升。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
