高中化学人教版(2019)选择性必修第一册2.2.3 影响化学平衡的因素 教案
文档属性
| 名称 | 高中化学人教版(2019)选择性必修第一册2.2.3 影响化学平衡的因素 教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 635.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-17 00:00:00 | ||
图片预览


文档简介
第二章
化学反应速率与化学平衡
第二节
化学平衡
第2课时
教学设计
教学目标
1、明确化学平衡移动的含义,会根据反应速率的变化判断化学平衡的移动方向。
2、通过实验探究,认识外界条件(浓度、温度、压强等)对化学平衡的影响规律。 3、了解催化剂在生活、生产和科学领域中的重要作用。
教学重难点
1.重点:化学平衡的影响因素
2.难点:勒夏特列原理
教学过程
一、导入新课
[导入]在一定条件下,当一个可逆反应达到平衡状态后,如果改变浓度、压强、温度等反应条件,化学平衡状态是否会发生变化?如何变化?请大家带着这个问题随老师一起进入今天的学习!
二、讲授新课
知识点一
化学平衡的移动
[教师活动]指导学生阅读课本找到平衡移动的概念。
[讲解]当一个可逆反应达到平衡状态后,如果改变浓度、压强、温度等反应条件,原来的平衡状态会被破坏(正、逆反应速率不再相等),直至正、逆反应速率再次相等,在新的条件下达到新的化学平衡状态。这种现象称作平衡状态的移动,简称平衡移动。
[提问]那平衡移动的具体过程是怎样的呢?请看图示。
[投影]
[讲解]那么由此可以看出化学平衡移动的根本原因就是条件发生了改变,导致正反应与逆反应的速率不相等,从而破坏了原有的平衡,导致平衡发生了移动。
[提问]化学移动的方向我们如何来判断呢?
[讲解]①若v正>v逆,平衡向正反应方向移动;②若v正<v逆,平衡向逆反应方向移动;③若v正=v逆,平衡不移动。
[补充]是的,我们可以根据反应速率判断,还可以根据化学平衡常数进行判断。当条件改变时,若Q>K:平衡向逆反应方向移动;若Q=K:反应达到平衡状态,平衡不移动。若Q知识点二
影响化学平衡的因素
[过渡]回到刚上课时老师提出的那个问题,在一定条件下,当一个可逆反应达到化学平衡状态后,如果改变浓度、压强、温度等条件,化学平衡状态是否会发生变化?如何变化呢?
[投影]1、浓度对化学平衡的影响
(1)实验依据Fe3+与SCN-存在的平衡:
Fe3+
+
3SCN-
Fe(SCN)3
(浅黄色)(无色)
(红色)
[教师活动]演示实验
[师]请同学们认真观察实验现象并思考,填写学案。
[投影]
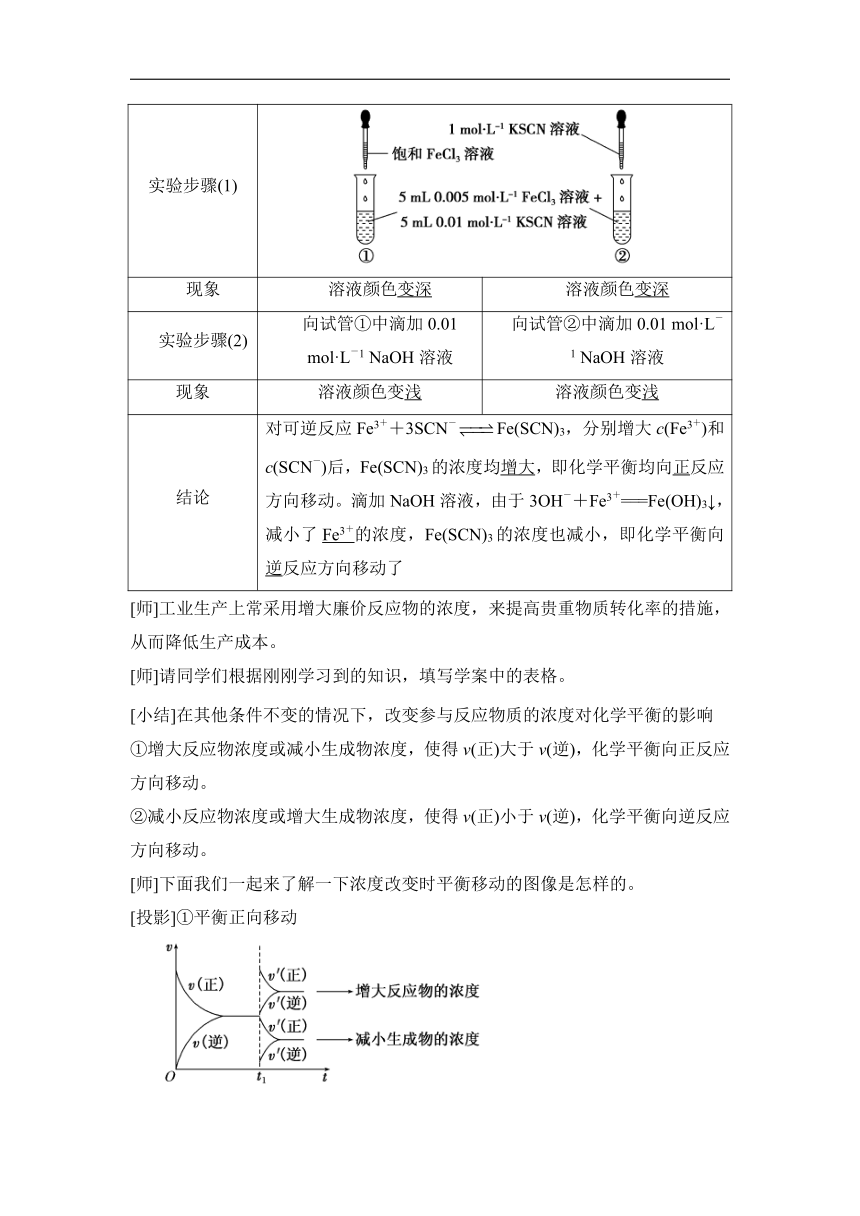
实验步骤(1)
现象
溶液颜色变深
溶液颜色变深
实验步骤(2)
向试管①中滴加0.01
mol·L-1
NaOH溶液
向试管②中滴加0.01
mol·L-1
NaOH溶液
现象
溶液颜色变浅
溶液颜色变浅
结论
对可逆反应Fe3++3SCN-Fe(SCN)3,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动。滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,减小了Fe3+的浓度,Fe(SCN)3的浓度也减小,即化学平衡向逆反应方向移动了
[师]工业生产上常采用增大廉价反应物的浓度,来提高贵重物质转化率的措施,从而降低生产成本。
[师]请同学们根据刚刚学习到的知识,填写学案中的表格。
[小结]在其他条件不变的情况下,改变参与反应物质的浓度对化学平衡的影响
①增大反应物浓度或减小生成物浓度,使得v(正)大于v(逆),化学平衡向正反应方向移动。
②减小反应物浓度或增大生成物浓度,使得v(正)小于v(逆),化学平衡向逆反应方向移动。
[师]下面我们一起来了解一下浓度改变时平衡移动的图像是怎样的。
[投影]①平衡正向移动
②平衡逆向移动
[过渡]压强对化学平衡会有怎样的影响呢?我们由接下来的实验进行探讨。
[投影]
原理
2NO2(红棕色)N2O4(无色)
实验步骤
实验现象
混合气体颜色瞬间加深,又逐渐变浅
实验结论
混合气体颜色加深,说明NO2浓度增大(体积压缩);混合气体颜色颜色变浅,说明NO2浓度减小?,即平衡向正反应方向移动
[讲解]实验表明,把注射器的活塞往外拉,管内容积增大,气体的压强减小,浓度减小,混合气体的颜色先变浅又逐渐变深。颜色逐渐变深是因为生成了更多的NO2。把注射器的活塞往里推,管内容积减小,气体的压强增大,浓度增大,混合气体的颜色先变深又逐渐变浅。颜色逐渐变浅是因为消耗了更多的NO2。
[小结]在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动
[师]无气态物质存在的化学平衡,由于改变压强不能改变化学反应速率,所以改变压强不能使无气态物质存在的化学平衡发生移动。
[过渡]对于放热或吸热的可逆反应,当反应达到平衡后,改变温度也会使平衡发生移动。
[教师活动]演示实验2-3。
[学生活动]认真观看实验并填写学案相关部分。
[投影]3、温度对化学平衡的影响
原理
2NO2(红棕色)N2O4(无色) ΔH=-56.9
kJ/mol
实验步骤
实验现象
热水中混合气体颜色加深,冰水中混合气体颜色变浅
实验结论
混合气体受热颜色加深,说明NO2浓度增大,即平衡向逆反应方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小?,即平衡向正反应方向移动
[讲解]实验表明,浸泡在热水中的烧瓶内红棕色加深,说明升高温度,NO2的浓度增大;浸泡在冰水中的烧瓶内红棕色变浅,说明降低温度,NO2的浓度减小。
知识点三
勒夏特列原理(又称为平衡移动原理)
[小结]大量实验证明,在其他条件不变的情况下,升高温度,会使化学平衡向吸热反应的方向移动;降低温度,会使化学平衡向放热反应的方向移动。
[师]任何化学反应都伴随着能量的变化(放热或吸热),因此,改变温度,化学平衡一定发生移动。
[讲解]催化剂能够同等程度地改变正反应速率和逆反应速率,因此,它对化学平衡的移动没有影响。也就是说,催化剂不能改变达到化学平衡状态的反应混合物的组成,但是,使用催化剂能改变反应达到平衡所需的时间。
[师]综上所述,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。法国化学家勒夏特列曾就此总结出一条经验规律:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
[师]化学平衡移动原理是经过反复验证的,在化学工业和环境保护等领域有十分重要的应用。根据化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
板书设计
2.2.2
影响化学平衡的因素
一、化学平衡的移动
1、定义
2、图示:
3、化学平衡移动的根本原因:条件改变,v正≠v逆。
4、化学平衡移动的方向判断
二、影响化学平衡的因素
1、浓度对化学平衡的影响
2、压强对化学平衡的影响
3、温度对化学平衡的影响
4、催化剂与化学平衡
三、勒夏特列原理(又称为平衡移动原理)
1、内容
2、适用范围
化学反应速率与化学平衡
第二节
化学平衡
第2课时
教学设计
教学目标
1、明确化学平衡移动的含义,会根据反应速率的变化判断化学平衡的移动方向。
2、通过实验探究,认识外界条件(浓度、温度、压强等)对化学平衡的影响规律。 3、了解催化剂在生活、生产和科学领域中的重要作用。
教学重难点
1.重点:化学平衡的影响因素
2.难点:勒夏特列原理
教学过程
一、导入新课
[导入]在一定条件下,当一个可逆反应达到平衡状态后,如果改变浓度、压强、温度等反应条件,化学平衡状态是否会发生变化?如何变化?请大家带着这个问题随老师一起进入今天的学习!
二、讲授新课
知识点一
化学平衡的移动
[教师活动]指导学生阅读课本找到平衡移动的概念。
[讲解]当一个可逆反应达到平衡状态后,如果改变浓度、压强、温度等反应条件,原来的平衡状态会被破坏(正、逆反应速率不再相等),直至正、逆反应速率再次相等,在新的条件下达到新的化学平衡状态。这种现象称作平衡状态的移动,简称平衡移动。
[提问]那平衡移动的具体过程是怎样的呢?请看图示。
[投影]
[讲解]那么由此可以看出化学平衡移动的根本原因就是条件发生了改变,导致正反应与逆反应的速率不相等,从而破坏了原有的平衡,导致平衡发生了移动。
[提问]化学移动的方向我们如何来判断呢?
[讲解]①若v正>v逆,平衡向正反应方向移动;②若v正<v逆,平衡向逆反应方向移动;③若v正=v逆,平衡不移动。
[补充]是的,我们可以根据反应速率判断,还可以根据化学平衡常数进行判断。当条件改变时,若Q>K:平衡向逆反应方向移动;若Q=K:反应达到平衡状态,平衡不移动。若Q
影响化学平衡的因素
[过渡]回到刚上课时老师提出的那个问题,在一定条件下,当一个可逆反应达到化学平衡状态后,如果改变浓度、压强、温度等条件,化学平衡状态是否会发生变化?如何变化呢?
[投影]1、浓度对化学平衡的影响
(1)实验依据Fe3+与SCN-存在的平衡:
Fe3+
+
3SCN-
Fe(SCN)3
(浅黄色)(无色)
(红色)
[教师活动]演示实验
[师]请同学们认真观察实验现象并思考,填写学案。
[投影]
实验步骤(1)
现象
溶液颜色变深
溶液颜色变深
实验步骤(2)
向试管①中滴加0.01
mol·L-1
NaOH溶液
向试管②中滴加0.01
mol·L-1
NaOH溶液
现象
溶液颜色变浅
溶液颜色变浅
结论
对可逆反应Fe3++3SCN-Fe(SCN)3,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动。滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,减小了Fe3+的浓度,Fe(SCN)3的浓度也减小,即化学平衡向逆反应方向移动了
[师]工业生产上常采用增大廉价反应物的浓度,来提高贵重物质转化率的措施,从而降低生产成本。
[师]请同学们根据刚刚学习到的知识,填写学案中的表格。
[小结]在其他条件不变的情况下,改变参与反应物质的浓度对化学平衡的影响
①增大反应物浓度或减小生成物浓度,使得v(正)大于v(逆),化学平衡向正反应方向移动。
②减小反应物浓度或增大生成物浓度,使得v(正)小于v(逆),化学平衡向逆反应方向移动。
[师]下面我们一起来了解一下浓度改变时平衡移动的图像是怎样的。
[投影]①平衡正向移动
②平衡逆向移动
[过渡]压强对化学平衡会有怎样的影响呢?我们由接下来的实验进行探讨。
[投影]
原理
2NO2(红棕色)N2O4(无色)
实验步骤
实验现象
混合气体颜色瞬间加深,又逐渐变浅
实验结论
混合气体颜色加深,说明NO2浓度增大(体积压缩);混合气体颜色颜色变浅,说明NO2浓度减小?,即平衡向正反应方向移动
[讲解]实验表明,把注射器的活塞往外拉,管内容积增大,气体的压强减小,浓度减小,混合气体的颜色先变浅又逐渐变深。颜色逐渐变深是因为生成了更多的NO2。把注射器的活塞往里推,管内容积减小,气体的压强增大,浓度增大,混合气体的颜色先变深又逐渐变浅。颜色逐渐变浅是因为消耗了更多的NO2。
[小结]在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动
[师]无气态物质存在的化学平衡,由于改变压强不能改变化学反应速率,所以改变压强不能使无气态物质存在的化学平衡发生移动。
[过渡]对于放热或吸热的可逆反应,当反应达到平衡后,改变温度也会使平衡发生移动。
[教师活动]演示实验2-3。
[学生活动]认真观看实验并填写学案相关部分。
[投影]3、温度对化学平衡的影响
原理
2NO2(红棕色)N2O4(无色) ΔH=-56.9
kJ/mol
实验步骤
实验现象
热水中混合气体颜色加深,冰水中混合气体颜色变浅
实验结论
混合气体受热颜色加深,说明NO2浓度增大,即平衡向逆反应方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小?,即平衡向正反应方向移动
[讲解]实验表明,浸泡在热水中的烧瓶内红棕色加深,说明升高温度,NO2的浓度增大;浸泡在冰水中的烧瓶内红棕色变浅,说明降低温度,NO2的浓度减小。
知识点三
勒夏特列原理(又称为平衡移动原理)
[小结]大量实验证明,在其他条件不变的情况下,升高温度,会使化学平衡向吸热反应的方向移动;降低温度,会使化学平衡向放热反应的方向移动。
[师]任何化学反应都伴随着能量的变化(放热或吸热),因此,改变温度,化学平衡一定发生移动。
[讲解]催化剂能够同等程度地改变正反应速率和逆反应速率,因此,它对化学平衡的移动没有影响。也就是说,催化剂不能改变达到化学平衡状态的反应混合物的组成,但是,使用催化剂能改变反应达到平衡所需的时间。
[师]综上所述,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。法国化学家勒夏特列曾就此总结出一条经验规律:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
[师]化学平衡移动原理是经过反复验证的,在化学工业和环境保护等领域有十分重要的应用。根据化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
板书设计
2.2.2
影响化学平衡的因素
一、化学平衡的移动
1、定义
2、图示:
3、化学平衡移动的根本原因:条件改变,v正≠v逆。
4、化学平衡移动的方向判断
二、影响化学平衡的因素
1、浓度对化学平衡的影响
2、压强对化学平衡的影响
3、温度对化学平衡的影响
4、催化剂与化学平衡
三、勒夏特列原理(又称为平衡移动原理)
1、内容
2、适用范围
