高中化学人教版(2019)选择性必修一2.1化学反应速率(共52张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修一2.1化学反应速率(共52张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 20.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-18 08:38:48 | ||
图片预览











文档简介
(共52张PPT)
高档车型对安全更为重视,六气囊和多气帘的配置可以全方位的保护乘员。气帘会分布在前后挡风玻璃处、侧窗处等等位置
钟乳石平均生长速度为每10年增加约1mm
我们知道,不同化学反应的速率有大有小。
交
与
考
思
流
定向爆破
有的化学反应进行得快,
有的化学反应进行得慢。
自然界的岩石风化、
澳大利亚:一个很美的国家公园,其中最有名的就是这个自然之窗,被风化而形成像一个窗户的红岩石
湖南湘西龙山县乌龙山大峡谷“世界溶洞博物馆镇馆之宝”惹迷洞一角)
溶洞形成需要百年甚至千年才能完成。
化学反应的快慢与我们的生产、生活、科研、环境等关系很密切。
第一节
化学反应速率
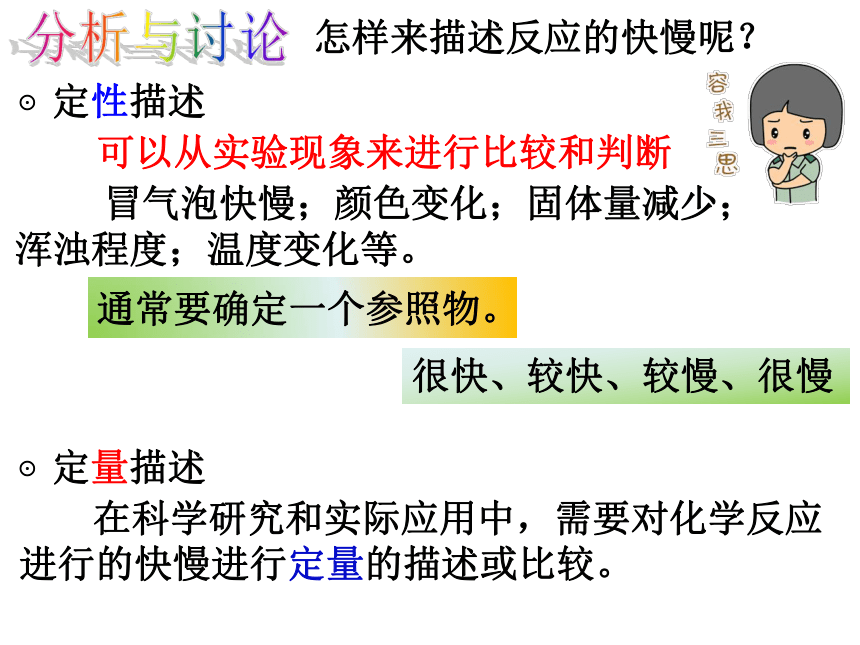
分析与讨论
怎样来描述反应的快慢呢?
可以从实验现象来进行比较和判断
冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
⊙定性描述
很快、较快、较慢、很慢
通常要确定一个参照物。
⊙定量描述
在科学研究和实际应用中,需要对化学反应进行的快慢进行定量的描述或比较。
物理学中描述物体运动的快慢用“速度”来表示,
迁移
化学反应进行的快慢用“化学反应速率”来表示。
任何化学反应的快慢都表现为有关物质的量随着时间变化的多少。
一、化学反应速率
⒈概念:
⒉表示:
⒊数学表达式:
用来衡量化学反应进行快慢程度的物理量
用单位时间、单位体积中反应物或生成物的物质的量变化来表示。
如果反应体系的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
注意:
只对气体、溶液适用
⒋单位:
mol/(L·s)或mol/(L·min)
在应用化学方程式进行有关化学反应速率的计算时,一定要弄清三个量:起始量、变化量、某时刻的量,其中:变化量之比等于化学计量数之比。
问题⒈
v(N2)、v(H2)与
v(NH3)的数值
是否相同?
问题⒉
是否都能表示此反应的化学反应速率?
问题⒊
由上述计算题的结果,数值上有何规律?
你会得出什么结论?
因此,表示化学反应速率时,必须指明是用反应体系中的哪种物质作为标准。
结论:
在同一个反应中,各物质的反应速率之比等于化学方程式中各物质的化学计量数之比。
特别强调
对于在一个容器中的一般反应:
mA
+
nB
=
pC
+
qD来说
v(A):v(B):v(C):v(D)=
m
:n
:p
:q
化学反应中发生变化的是体系中的化学物质(包括反应物和生成物),所以与其中任何一种化学物质浓度有关的可观测量都可以加以利用。
化学反应速率是可以通过实验测定的。
化学反应速率的测定
1.能够直接观察的某些性质(如气体的体积、体系的压强);
2.必须依靠科学仪器测量(如颜色的深浅、光的吸收和发射、导电能力等);
在物质的诸多性质中,特别是在溶液中,当反应物或生成物本身有比较明显的颜色时,常利用颜色变化与浓度变化间的比例关系来测量反应速率。
二、影响化学反应速率的因素
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
食品包装袋中为什么加入除氧剂?
用双氧水制备氧气为什么要加入二氧化锰粉末
食品为什么放在冰箱储存?
与铜片反应浓硝酸为什么比稀硝酸更快
除了物质本身的结构、性质外,我们发现外界因素也会对化学反应速率造成影响,也就是说化学反应速率还与外界条件有关
内因(决定作用)
不同的化学反应具有不同的反应速率。
外因(外界条件)
参加反应的物质本身的结构和性质(无法改变)。
因素
其他因素
内因
决定性因素
浓度
催化剂
压强
温度
浓度、压强、温度及催化剂等因素也会影响反应速率,实验中可以通过定性观察的方法来比较化学反应速率的大小。
除定性观察外,也可通过实验进行定量测定。
Na2S2O3
+
H2SO4
=
Na2SO4
+
S↓+
SO2↑+
H2O
⒈定性与定量研究影响化学反应速率的因素
实验原理
2H2O2
=
2H2O
+
O2↑
设计思路
⒈选取同一个反应,探究不同因素产生的影响。
⒉选取不同的反应,探究同一因素产生的影响。
⑴定性研究影响化学反应速率的因素(探究).mp4
0.1mol/L
Na2S2O3溶液与0.5mol/L
H2SO4混合时先出现黄色浑浊
其它条件相同时,增大反应物浓度,反应速率增大;降低反应物浓度,反应速率减小。
⒈此规律只适用于有气体参加或在溶液中进行的反应,对于固体或纯液体反应物,一般情况下其浓度视为常数,因此改变它们的量不会改变化学反应速率。
⒉气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。
例如:铁或铝与硫酸的反应
其他条件相同时,升高
温度,反应速率增大。
热水浴中先出现黄色浑浊
滴入FeCl3溶液的试管中产生大量气泡,反应剧烈;滴入蒸馏水的试管中无明显现象
其它条件不变时,加入催化剂可以增大化学反应速率。
如何测量锌和不同浓度的稀硫酸反应的速率?
⑴测定收集一定体积的H2时所用的时间;
⑵测定一定时间内产生H2的体积;
⑶测定一段时间内溶液中H+浓度的变化;
⑷测定一段时间内锌粒质量的变化。
⑸测定一段时间内体系压强的变化。
⒈确定变量
——稀硫酸的浓度不同
⒉找出某种易于测量的某种物理量或性质的变化
⒊控制不变的因素——锌粒的表面积、温度、时间或氢气的体积
⑵定量研究影响化学反应速率的因素
定量研究影响化学反应速率的因素(探究).mp4
其它条件相同时,增大反应物浓度,反应速率增大。
①何时计时,用何仪器计时;
a.保持导气管顺畅
b.液体快速滴下
c.滴完后迅速关闭分液漏斗活塞
注意事项:
②稀硫酸滴入时注意:
③注射器读数到什么位置,是10mL处吗?
上述实验探究中,你对探究影响化学反应速率的因素有哪些新的认识?你用到了哪些科学方法?
可以用同一个反应研究不同因素对反应速率的影响,也可以用不同反应研究同一个因素对反应速率的影响。
问题与讨论
控制变量法、科学归纳法、对照实验法、定性观察法、定量测定法。
【小结】在一般情况下,当其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。升高温度,化学反应速率增大;降低温度,化学反应速率减小。
催化剂可以改变化学反应速率。对于有气体参加的化学反应,改变压强同样可以改变化学反应速率。
v2
v1
=(2~4)
t2-t1
10
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著。
⒈对于反应M
+
N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为
(
)
A.2min
B.3min
C.6min
D.9min
⒉把除去氧化膜的
Mg
条,投入到盛有稀盐酸的试管中,发现
H2
的产生速率(v)与时间(t)的变化情况如右图所示,
t1-t2速率变化的主要原因是:_______
t2-t3速率变化的主要原因是:_______
v
t1
t2
t3
三、活
化
能
如何解释浓度、压强、温度及催化剂等因素
对反应速率的影响呢?
对活化能本质的认识
100多年来,为了正确认识活化能的科学意义,并力争从理论上进行计算,科学家们一直在进行探讨并提出了若干个化学反应速率理论,其中,最著名的是基元反应碰撞理论和基元反应过渡态理论。
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
基元反应碰撞理论
这其中的每一步反应都称为基元反应。这两个先后进行的基元反应反映了2HI
=
H2
+
I2
的反应历程。反应历程又称反应机理。
实际过程
例如,
基元反应发生的先决条件:反应物的分子必须发生碰撞。
化学反应发生的先决条件是反应物的分子必须发生碰撞。
例如:NO2
+
CO
=
NO
+
CO2
⑴设想
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,
⒈简化后的有效碰撞模型
忽略分子与分子之间的相互作用力,分子之间不存在牵制关系,
因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
在运动中会发生碰撞
⑵模型的基本构架
在一个洁净的容器中,使反应气体混合,气体分子因自由运动而不断相互碰撞(互相接触),
假设与事实:
研究结果表明,从分子的热运动看,任何气体中分子间发生碰撞的机会很多。如在通常情况下,当气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次
交
与
考
思
流
是不是反应物分子间的任何一次碰撞都会引发化学反应呢?
假如反应物分子间的任何一次碰撞都能发生化学反应,那么反应只需10-5秒即可完成,但事实并非如此。
结论:
并不是反应物分子的每一次碰撞都会发生化学反应,只有其中部分气体分子间的碰撞才会发生化学反应。
在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;
足够的能量
⑴中,运动员没有提供足够的能量,球没有落入篮筐;
⑵中,球虽然具有足够的能量,但没有合适的取向,球也没有落入篮筐;
合适的取向
⑶中,球具有足够的能量和合适的取向,球落入篮筐,这与导致发生反应的分子(或离子)间的碰撞相类似。
反应物分子要具有什么条件才能发生有效碰
撞呢?
投球
以碘化氢的分解为例,分析分子发生有效碰撞需要满足的条件。
分子有效碰撞的动画演示.swf
发生有效碰撞需要满足
能量因素和空间因素
⒉活化分子、活化能
⑴活化分子
①概念:
具有足够的能量,能够发生有效碰撞的分子
②特点:
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是一定的。
活化分子数(n活)
反应物分子总数(n总)
活化分子百分数
=
×100%
⑵活化能
活化分子具有的平均能量与反应物分子具有的平均能量之差(活化分子所多出的那部分能量)。
活化能
活化分子变成生成物分子放出的能量
活化能与反应热有关吗?
该反应是吸热反应还是放热反应?
E1-E2表示反应热
①概念:
②意义:
活化能的大小决定了化学反应的难易,活化能越小,则一般分子成为活化分子越容易。
化学反应速率与活化能、活化分子、有效碰撞之间的关系
单位体积内反应物中活化分子数的越多→单位体积、单位时间内有效碰撞的次数越多→化学反应的速率越大
单位体积内活化分子数增多
单位时间内有效碰撞的次数增加
反应速率增大
单位体积内反应物分子总数增多
反应物浓度增大
微观解释
浓度对反应速率的影响
对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。
微观解释
压强对化学反应速率的影响实质上是通过改变气体反应物的浓度来实现的。
压强对反应速率的影响
适用范围:
仅适用于反应体系中有气体物质参加的反应。
如果反应物是固体、液体或溶液时,改变压强对它们有什么影响吗?
思考与交流
恒容条件下,往合成氨的反应中充入He气,体系的压强如何改变?反应速率是否改变?恒压呢?
N2
+
3H2
2NH3
高温高压
催化剂
归纳总结
⒈压强影响,仅适用于反应体系中有气体物质参加的反应,当然并不一定全部是气体参加的反应。
⒉压强对反应速率的影响是通过对浓度的影响实现的。当用不同方法改变反应的压强时,应从本质出发,具体分析。
P
→
C
→
ν
结论:
对于压强的改变,只有引起反应体系中物质浓度的变化,才对反应速率产生影响。
微观解释
T↑→普通分子变为活化分子→活%↑
温度对反应速率的影响
影响规律:一般是加快反应速率。使用时要注意温度及防止催化剂中毒
在其他条件不变时,使用催化剂,改变了反应的历程,使发生的每一次反应所需的活化能降低,这就使更多的反应物分子成为活化分子,增大了单位体积内反应物分子中活化分子的数目,化学反应速率增大。
催化剂对反应速率的影响
对于一个化学反应,不同的催化剂,催化作用不同。实验时应选用合适的催化剂。
⒈使用催化剂能改变反应的路径,改变反应所需的活化能,从而改变反应速率,但反应热不变。
⒉使用适当的催化剂能减少过程中的能耗。
催化剂在生产和化学实验上的意义
⒊理想的催化剂还可以大幅度提高目标产物在最终产物中的比率。
⒋催化剂有一定的选择性和活化温度。
⒌催化剂只能催化可能发生的反应,对不发生的反应无作用。
浓度、压强、温度、催化剂的改变影响单位体积内的活化分子数;温度和催化剂的改变影响活化分子的百分数。
在现代化学工业中,催化剂的应用十分普遍。就近年来化学工业生产与技术的发展趋势而言,催化剂往往成为技术改造和更新的关键,从事这方面研究的科学家多次获得诺贝尔奖。在生命现象中也存在着大量的催化作用。……,所以催化剂的研究一直是高科技领域的重要内容。
在各种外界条件中,温度对反应速率的影响能适应所有的反应。
巧记
【知识拓展】除了改变浓度、温度、压强及选用催化剂等,还有很多改变化学反应速率的方法。例如,
改变固体反应物表面积的大小、反应物的状态、溶剂的性质、扩散速率等都可以改变化学反应速率。
通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等改变化学反应速率。总之,向反应体系输入能量,都有可能改变化学反应速率。
要想反应快加速,增浓加压升温度;
催化增大表面积,反应也可加速度。
高档车型对安全更为重视,六气囊和多气帘的配置可以全方位的保护乘员。气帘会分布在前后挡风玻璃处、侧窗处等等位置
钟乳石平均生长速度为每10年增加约1mm
我们知道,不同化学反应的速率有大有小。
交
与
考
思
流
定向爆破
有的化学反应进行得快,
有的化学反应进行得慢。
自然界的岩石风化、
澳大利亚:一个很美的国家公园,其中最有名的就是这个自然之窗,被风化而形成像一个窗户的红岩石
湖南湘西龙山县乌龙山大峡谷“世界溶洞博物馆镇馆之宝”惹迷洞一角)
溶洞形成需要百年甚至千年才能完成。
化学反应的快慢与我们的生产、生活、科研、环境等关系很密切。
第一节
化学反应速率
分析与讨论
怎样来描述反应的快慢呢?
可以从实验现象来进行比较和判断
冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
⊙定性描述
很快、较快、较慢、很慢
通常要确定一个参照物。
⊙定量描述
在科学研究和实际应用中,需要对化学反应进行的快慢进行定量的描述或比较。
物理学中描述物体运动的快慢用“速度”来表示,
迁移
化学反应进行的快慢用“化学反应速率”来表示。
任何化学反应的快慢都表现为有关物质的量随着时间变化的多少。
一、化学反应速率
⒈概念:
⒉表示:
⒊数学表达式:
用来衡量化学反应进行快慢程度的物理量
用单位时间、单位体积中反应物或生成物的物质的量变化来表示。
如果反应体系的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
注意:
只对气体、溶液适用
⒋单位:
mol/(L·s)或mol/(L·min)
在应用化学方程式进行有关化学反应速率的计算时,一定要弄清三个量:起始量、变化量、某时刻的量,其中:变化量之比等于化学计量数之比。
问题⒈
v(N2)、v(H2)与
v(NH3)的数值
是否相同?
问题⒉
是否都能表示此反应的化学反应速率?
问题⒊
由上述计算题的结果,数值上有何规律?
你会得出什么结论?
因此,表示化学反应速率时,必须指明是用反应体系中的哪种物质作为标准。
结论:
在同一个反应中,各物质的反应速率之比等于化学方程式中各物质的化学计量数之比。
特别强调
对于在一个容器中的一般反应:
mA
+
nB
=
pC
+
qD来说
v(A):v(B):v(C):v(D)=
m
:n
:p
:q
化学反应中发生变化的是体系中的化学物质(包括反应物和生成物),所以与其中任何一种化学物质浓度有关的可观测量都可以加以利用。
化学反应速率是可以通过实验测定的。
化学反应速率的测定
1.能够直接观察的某些性质(如气体的体积、体系的压强);
2.必须依靠科学仪器测量(如颜色的深浅、光的吸收和发射、导电能力等);
在物质的诸多性质中,特别是在溶液中,当反应物或生成物本身有比较明显的颜色时,常利用颜色变化与浓度变化间的比例关系来测量反应速率。
二、影响化学反应速率的因素
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
食品包装袋中为什么加入除氧剂?
用双氧水制备氧气为什么要加入二氧化锰粉末
食品为什么放在冰箱储存?
与铜片反应浓硝酸为什么比稀硝酸更快
除了物质本身的结构、性质外,我们发现外界因素也会对化学反应速率造成影响,也就是说化学反应速率还与外界条件有关
内因(决定作用)
不同的化学反应具有不同的反应速率。
外因(外界条件)
参加反应的物质本身的结构和性质(无法改变)。
因素
其他因素
内因
决定性因素
浓度
催化剂
压强
温度
浓度、压强、温度及催化剂等因素也会影响反应速率,实验中可以通过定性观察的方法来比较化学反应速率的大小。
除定性观察外,也可通过实验进行定量测定。
Na2S2O3
+
H2SO4
=
Na2SO4
+
S↓+
SO2↑+
H2O
⒈定性与定量研究影响化学反应速率的因素
实验原理
2H2O2
=
2H2O
+
O2↑
设计思路
⒈选取同一个反应,探究不同因素产生的影响。
⒉选取不同的反应,探究同一因素产生的影响。
⑴定性研究影响化学反应速率的因素(探究).mp4
0.1mol/L
Na2S2O3溶液与0.5mol/L
H2SO4混合时先出现黄色浑浊
其它条件相同时,增大反应物浓度,反应速率增大;降低反应物浓度,反应速率减小。
⒈此规律只适用于有气体参加或在溶液中进行的反应,对于固体或纯液体反应物,一般情况下其浓度视为常数,因此改变它们的量不会改变化学反应速率。
⒉气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。
例如:铁或铝与硫酸的反应
其他条件相同时,升高
温度,反应速率增大。
热水浴中先出现黄色浑浊
滴入FeCl3溶液的试管中产生大量气泡,反应剧烈;滴入蒸馏水的试管中无明显现象
其它条件不变时,加入催化剂可以增大化学反应速率。
如何测量锌和不同浓度的稀硫酸反应的速率?
⑴测定收集一定体积的H2时所用的时间;
⑵测定一定时间内产生H2的体积;
⑶测定一段时间内溶液中H+浓度的变化;
⑷测定一段时间内锌粒质量的变化。
⑸测定一段时间内体系压强的变化。
⒈确定变量
——稀硫酸的浓度不同
⒉找出某种易于测量的某种物理量或性质的变化
⒊控制不变的因素——锌粒的表面积、温度、时间或氢气的体积
⑵定量研究影响化学反应速率的因素
定量研究影响化学反应速率的因素(探究).mp4
其它条件相同时,增大反应物浓度,反应速率增大。
①何时计时,用何仪器计时;
a.保持导气管顺畅
b.液体快速滴下
c.滴完后迅速关闭分液漏斗活塞
注意事项:
②稀硫酸滴入时注意:
③注射器读数到什么位置,是10mL处吗?
上述实验探究中,你对探究影响化学反应速率的因素有哪些新的认识?你用到了哪些科学方法?
可以用同一个反应研究不同因素对反应速率的影响,也可以用不同反应研究同一个因素对反应速率的影响。
问题与讨论
控制变量法、科学归纳法、对照实验法、定性观察法、定量测定法。
【小结】在一般情况下,当其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。升高温度,化学反应速率增大;降低温度,化学反应速率减小。
催化剂可以改变化学反应速率。对于有气体参加的化学反应,改变压强同样可以改变化学反应速率。
v2
v1
=(2~4)
t2-t1
10
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著。
⒈对于反应M
+
N→P,如果温度每升高10℃,反应速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为
(
)
A.2min
B.3min
C.6min
D.9min
⒉把除去氧化膜的
Mg
条,投入到盛有稀盐酸的试管中,发现
H2
的产生速率(v)与时间(t)的变化情况如右图所示,
t1-t2速率变化的主要原因是:_______
t2-t3速率变化的主要原因是:_______
v
t1
t2
t3
三、活
化
能
如何解释浓度、压强、温度及催化剂等因素
对反应速率的影响呢?
对活化能本质的认识
100多年来,为了正确认识活化能的科学意义,并力争从理论上进行计算,科学家们一直在进行探讨并提出了若干个化学反应速率理论,其中,最著名的是基元反应碰撞理论和基元反应过渡态理论。
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
基元反应碰撞理论
这其中的每一步反应都称为基元反应。这两个先后进行的基元反应反映了2HI
=
H2
+
I2
的反应历程。反应历程又称反应机理。
实际过程
例如,
基元反应发生的先决条件:反应物的分子必须发生碰撞。
化学反应发生的先决条件是反应物的分子必须发生碰撞。
例如:NO2
+
CO
=
NO
+
CO2
⑴设想
气体分子之间通常存在着比气体分子本身的体积要大得多的空间,
⒈简化后的有效碰撞模型
忽略分子与分子之间的相互作用力,分子之间不存在牵制关系,
因此,在常温常压下,可以认为气体分子的运动是自由的,因而,它们之间的碰撞可以视为是随机的。
在运动中会发生碰撞
⑵模型的基本构架
在一个洁净的容器中,使反应气体混合,气体分子因自由运动而不断相互碰撞(互相接触),
假设与事实:
研究结果表明,从分子的热运动看,任何气体中分子间发生碰撞的机会很多。如在通常情况下,当气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次
交
与
考
思
流
是不是反应物分子间的任何一次碰撞都会引发化学反应呢?
假如反应物分子间的任何一次碰撞都能发生化学反应,那么反应只需10-5秒即可完成,但事实并非如此。
结论:
并不是反应物分子的每一次碰撞都会发生化学反应,只有其中部分气体分子间的碰撞才会发生化学反应。
在化学上,把能够发生化学反应的碰撞叫有效碰撞;不能发生化学反应的碰撞叫无效碰撞;
足够的能量
⑴中,运动员没有提供足够的能量,球没有落入篮筐;
⑵中,球虽然具有足够的能量,但没有合适的取向,球也没有落入篮筐;
合适的取向
⑶中,球具有足够的能量和合适的取向,球落入篮筐,这与导致发生反应的分子(或离子)间的碰撞相类似。
反应物分子要具有什么条件才能发生有效碰
撞呢?
投球
以碘化氢的分解为例,分析分子发生有效碰撞需要满足的条件。
分子有效碰撞的动画演示.swf
发生有效碰撞需要满足
能量因素和空间因素
⒉活化分子、活化能
⑴活化分子
①概念:
具有足够的能量,能够发生有效碰撞的分子
②特点:
对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是一定的。
活化分子数(n活)
反应物分子总数(n总)
活化分子百分数
=
×100%
⑵活化能
活化分子具有的平均能量与反应物分子具有的平均能量之差(活化分子所多出的那部分能量)。
活化能
活化分子变成生成物分子放出的能量
活化能与反应热有关吗?
该反应是吸热反应还是放热反应?
E1-E2表示反应热
①概念:
②意义:
活化能的大小决定了化学反应的难易,活化能越小,则一般分子成为活化分子越容易。
化学反应速率与活化能、活化分子、有效碰撞之间的关系
单位体积内反应物中活化分子数的越多→单位体积、单位时间内有效碰撞的次数越多→化学反应的速率越大
单位体积内活化分子数增多
单位时间内有效碰撞的次数增加
反应速率增大
单位体积内反应物分子总数增多
反应物浓度增大
微观解释
浓度对反应速率的影响
对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。
微观解释
压强对化学反应速率的影响实质上是通过改变气体反应物的浓度来实现的。
压强对反应速率的影响
适用范围:
仅适用于反应体系中有气体物质参加的反应。
如果反应物是固体、液体或溶液时,改变压强对它们有什么影响吗?
思考与交流
恒容条件下,往合成氨的反应中充入He气,体系的压强如何改变?反应速率是否改变?恒压呢?
N2
+
3H2
2NH3
高温高压
催化剂
归纳总结
⒈压强影响,仅适用于反应体系中有气体物质参加的反应,当然并不一定全部是气体参加的反应。
⒉压强对反应速率的影响是通过对浓度的影响实现的。当用不同方法改变反应的压强时,应从本质出发,具体分析。
P
→
C
→
ν
结论:
对于压强的改变,只有引起反应体系中物质浓度的变化,才对反应速率产生影响。
微观解释
T↑→普通分子变为活化分子→活%↑
温度对反应速率的影响
影响规律:一般是加快反应速率。使用时要注意温度及防止催化剂中毒
在其他条件不变时,使用催化剂,改变了反应的历程,使发生的每一次反应所需的活化能降低,这就使更多的反应物分子成为活化分子,增大了单位体积内反应物分子中活化分子的数目,化学反应速率增大。
催化剂对反应速率的影响
对于一个化学反应,不同的催化剂,催化作用不同。实验时应选用合适的催化剂。
⒈使用催化剂能改变反应的路径,改变反应所需的活化能,从而改变反应速率,但反应热不变。
⒉使用适当的催化剂能减少过程中的能耗。
催化剂在生产和化学实验上的意义
⒊理想的催化剂还可以大幅度提高目标产物在最终产物中的比率。
⒋催化剂有一定的选择性和活化温度。
⒌催化剂只能催化可能发生的反应,对不发生的反应无作用。
浓度、压强、温度、催化剂的改变影响单位体积内的活化分子数;温度和催化剂的改变影响活化分子的百分数。
在现代化学工业中,催化剂的应用十分普遍。就近年来化学工业生产与技术的发展趋势而言,催化剂往往成为技术改造和更新的关键,从事这方面研究的科学家多次获得诺贝尔奖。在生命现象中也存在着大量的催化作用。……,所以催化剂的研究一直是高科技领域的重要内容。
在各种外界条件中,温度对反应速率的影响能适应所有的反应。
巧记
【知识拓展】除了改变浓度、温度、压强及选用催化剂等,还有很多改变化学反应速率的方法。例如,
改变固体反应物表面积的大小、反应物的状态、溶剂的性质、扩散速率等都可以改变化学反应速率。
通过光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨等改变化学反应速率。总之,向反应体系输入能量,都有可能改变化学反应速率。
要想反应快加速,增浓加压升温度;
催化增大表面积,反应也可加速度。
