2021-2022学年高二上学期化学人教版(2019)选择性必修1 第三章第三节 盐类的水解(第二课时)课件(18张ppt))
文档属性
| 名称 | 2021-2022学年高二上学期化学人教版(2019)选择性必修1 第三章第三节 盐类的水解(第二课时)课件(18张ppt)) |  | |
| 格式 | zip | ||
| 文件大小 | 691.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-18 08:42:20 | ||
图片预览


文档简介
(共18张PPT)
盐类水解
第2课时——影响盐类水解的主要因素、盐类水解的应用
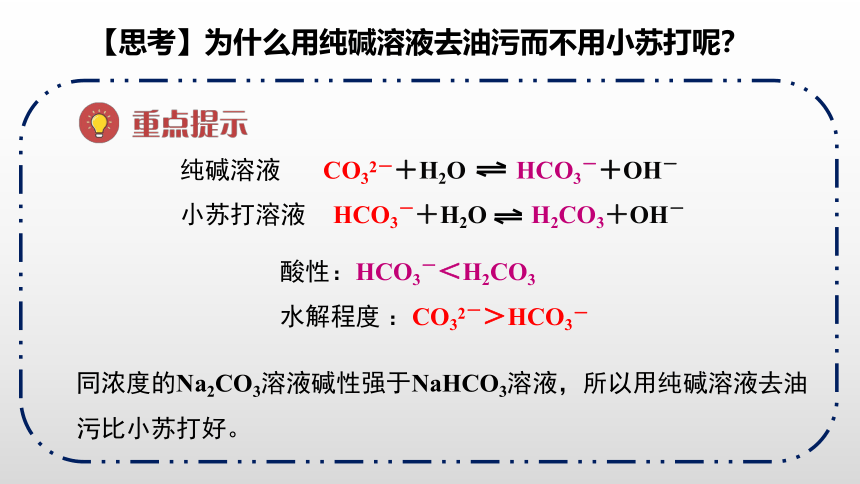
【思考】为什么用纯碱溶液去油污而不用小苏打呢?
CO32-+H2O
HCO3-+OH-
HCO3-+H2O
H2CO3+OH-
纯碱溶液
小苏打溶液
酸性:HCO3-<H2CO3
水解程度
:CO32->HCO3-
同浓度的Na2CO3溶液碱性强于NaHCO3溶液,所以用纯碱溶液去油污比小苏打好。
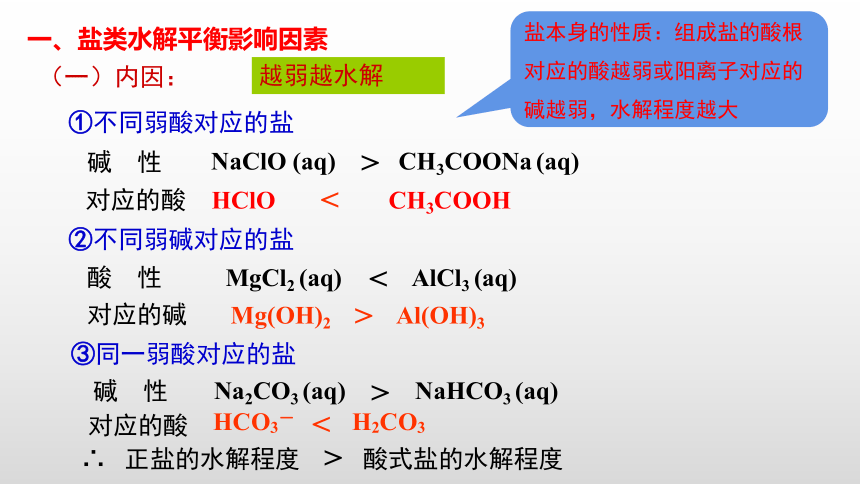
一、盐类水解平衡影响因素
(一)内因:
①不同弱酸对应的盐
NaClO
(aq)
CH3COONa
(aq)
MgCl2
(aq)
AlCl3
(aq)
对应的酸
HClO
CH3COOH
<
>
碱
性
②不同弱碱对应的盐
对应的碱
酸
性
Mg(OH)2
Al(OH)3
<
>
③同一弱酸对应的盐
Na2CO3
(aq)
NaHCO3
(aq)
对应的酸
HCO3-
H2CO3
<
>
碱
性
∴
正盐的水解程度
酸式盐的水解程度
>
越弱越水解
盐本身的性质:组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度越大
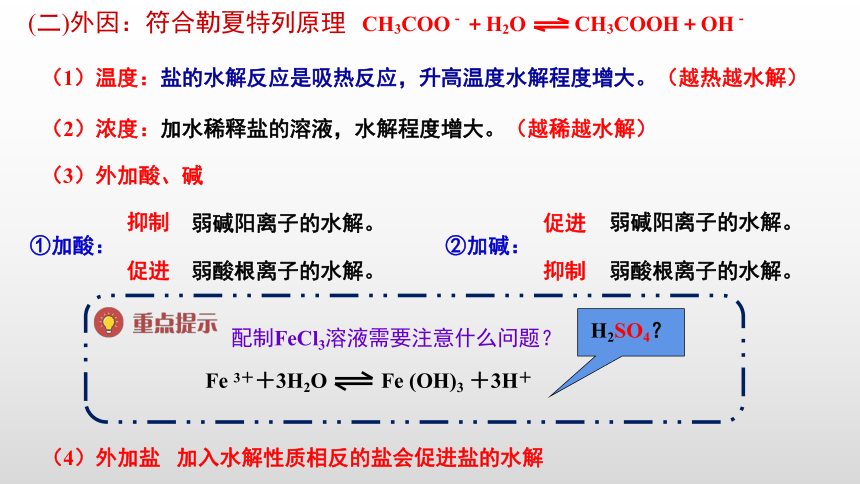
(二)外因:符合勒夏特列原理
(1)温度:盐的水解反应是吸热反应,升高温度水解程度增大。(越热越水解)
(2)浓度:加水稀释盐的溶液,水解程度增大。(越稀越水解)
①加酸:
弱碱阳离子的水解。
弱酸根离子的水解。
抑制
促进
②加碱:
弱碱阳离子的水解。
弱酸根离子的水解。
促进
抑制
配制FeCl3溶液需要注意什么问题?
加入一定量的
,抑制FeCl3的水解。
Fe
3++3H2O
Fe
(OH)3
+3H+
HCl
H2SO4?
CH3COO-+H2O
CH3COOH+OH-
(3)外加酸、碱
(4)外加盐
加入水解性质相反的盐会促进盐的水解
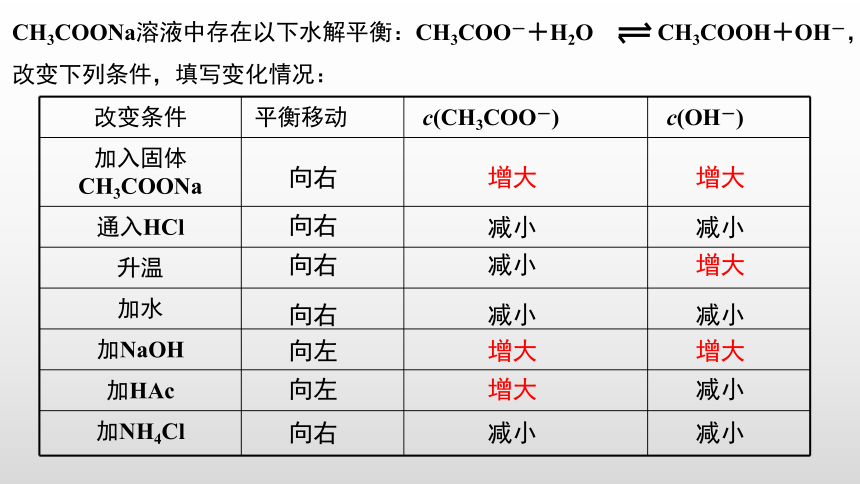
CH3COONa溶液中存在以下水解平衡:CH3COO-+H2O
CH3COOH+OH-,改变下列条件,填写变化情况:
改变条件
平衡移动
c(CH3COO-)
c(OH-)
加入固体CH3COONa
通入HCl
升温
加水
加NaOH
加HAc
加NH4Cl
向右
增大
增大
向右
减小
减小
向右
减小
增大
向右
减小
减小
向左
向左
增大
增大
增大
减小
向右
减小
减小
影响盐类水解的因素
因素
对盐类水解程度的影响
内因
外界条件
温度
浓度
外加酸碱
外加盐
盐组成中对应的酸或碱越弱,水解程度越大(越弱越水解)
升高温度能够促进水解
盐溶液浓度越小,水解程度越大
水解显酸性的盐溶液,加碱会促进水解,加酸会抑制水解,反之亦然
加入与盐的水解性质相反的盐会促进盐的水解
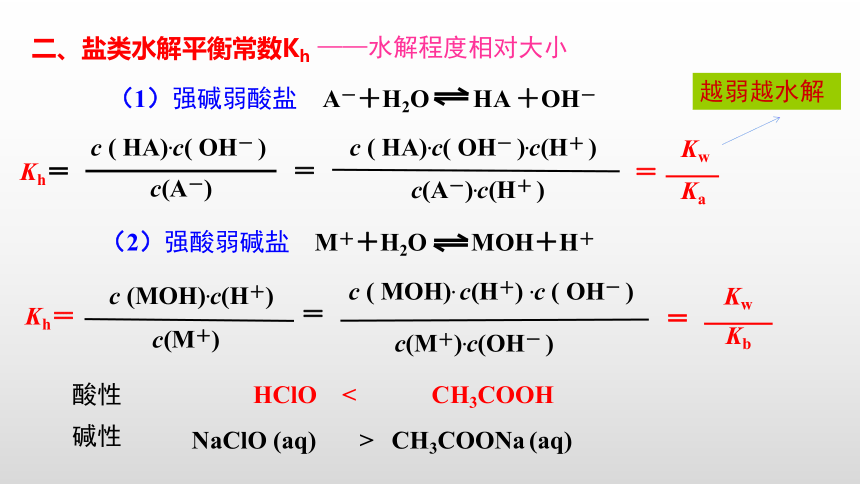
二、盐类水解平衡常数Kh
——水解程度相对大小
(1)强碱弱酸盐
A-+H2O
HA
+OH-
Kh=
c
(
HA).c(
OH-
)
c(A-)
=
c
(
HA).c(
OH-
).c(H+
)
c(A-).c(H+
)
=
Kw
Ka
越弱越水解
(2)强酸弱碱盐
M++H2O
MOH+H+
Kh=
c
(MOH).c(H+)
c(M+)
=
c
(
MOH).
c(H+)
.c
(
OH-
)
c(M+).c(OH-
)
=
Kw
Kb
NaClO
(aq)
CH3COONa
(aq)
酸性
HClO
<
CH3COOH
>
碱性
弱酸
电离常数
弱酸
电离常数
H2CO3
K1=4.4×10-7
K2=4.7×10-11
H2C2O4
(草酸)
K1=5.4×10-2
K2=5.4×10-5
H3PO4
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
H3C6H5O7
(柠檬酸)
K1=7.4×10-4
K2=1.73×10-5
K3=4×10-7
几种多元弱酸的电离常数(25℃)
(1)NaHCO3
①水解
②电离
程度:
>
∴溶液呈
性
碱
①HCO3
-+H2O
H2CO3+OH-
Kh
②HCO3-+H2O
CO32-+H3O+
Ka2=4.7×10-11
Kh=
c(H2CO3).c(OH-)
c(HCO3-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(HCO3-).c(H+)
c(H2CO3)
=
10-14
4.4×10-7
=2.3×10-8
Ka2=4.7×10-11
∴Kh>Ka2
(2)NaH2PO4
①H2PO4
-+H2O
H3PO4+OH-
Kh
=
10-14
7.1×10-3
=1.4×10-12
Ka2=6.3×10-8
∴Ka2>Kh
Kh=
c
(H3PO4).c(OH-)
c(H2PO4-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(H2PO4-).c(H+)
c(H3PO4)
②电离
①水解
程度:
>
∴溶液呈
性
酸
③HPO42-
PO43-+H+
Ka3
②H2PO4-
HPO42-+H+
Ka2=6.3×10-8
(3)Na2HPO4
①HPO4
2-+H2O
H2PO4-+OH-
Kh
②HPO42-
PO43-+H+
Ka3=4.2×10-13
=
10-14
6.3×10-8
=1.6×10-7
Ka3=4.2×10-13
Kh=
c
(H2PO4-).c(
OH-
)
c(HPO42-)
=
Kw
Ka2
=
c(
OH-
).c(H+
)
c(HPO42-).c(H+
)
c(H2PO4-)
程度:
∴Kh>Ka3
①水解
②电离
>
∴溶液呈
性
碱
2.弱酸酸式盐溶液的酸碱性取决于电离和水解程度的相对大小
显酸性(电离大于水解):NaH2PO4
NaHSO3
NaHC2O4
显碱性(水解大于电离):NaHCO3
Na2HPO4
NaHS
★酸式盐溶液酸碱性判断(记!!)
1.强酸酸式盐(NaHSO4)只电离不水解,溶液呈酸性
归纳总结
影响盐类水解的因素
(一)内因:
(二)外因:
盐类水解平衡常数
越弱越水解
符合勒夏特列原理
(越热越水解)
(越稀越水解)
Kh
=
Kw
Ka
(1)强碱弱酸盐
(2)强酸弱碱盐
Kh
=
Kw
Kb
三、盐类水解的应用
1.
热纯碱溶液去油污:纯碱水解的离子方程式为
。加热促进CO32-的水解,溶液碱性增强,去油污能力增强,去污能力增强。
CO32-+H2O
HCO3-+OH-
2.
盐溶液的配制和保存:配制、保存FeCl3等易水解的盐溶液时,加入少量盐酸的目的是抑制Fe3+的水解。
3.
盐类作净水剂:铝盐、铁盐等部分盐类水解生成胶体,有较强的吸附性,常用作净水剂。
如明矾水解的离子方程式为Al3++3H2O
Al(OH)3(胶体)+3H+
4.
制备胶体:向沸水中滴加FeCl3饱和溶液,并加热至沸腾以增大Fe3+的水解程度,从而制备Fe(OH)3胶体。
5.
制备无机化合物:如用TiCl4制备TiO2.其反应方程式为
TiCl4+
(x+2)H2O(过量)
TiO2?x
H2O↓
+
4HCl
6.
泡沫灭火器原理:Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生CO2气体和Al(OH)3沉淀,将燃烧物质与空气隔离开来。离子方程式
Al3++3HCO3-
=
Al(OH)3↓+3CO2↑
7.
不同类型盐蒸干产物的判断
盐类水解
第2课时——影响盐类水解的主要因素、盐类水解的应用
【思考】为什么用纯碱溶液去油污而不用小苏打呢?
CO32-+H2O
HCO3-+OH-
HCO3-+H2O
H2CO3+OH-
纯碱溶液
小苏打溶液
酸性:HCO3-<H2CO3
水解程度
:CO32->HCO3-
同浓度的Na2CO3溶液碱性强于NaHCO3溶液,所以用纯碱溶液去油污比小苏打好。
一、盐类水解平衡影响因素
(一)内因:
①不同弱酸对应的盐
NaClO
(aq)
CH3COONa
(aq)
MgCl2
(aq)
AlCl3
(aq)
对应的酸
HClO
CH3COOH
<
>
碱
性
②不同弱碱对应的盐
对应的碱
酸
性
Mg(OH)2
Al(OH)3
<
>
③同一弱酸对应的盐
Na2CO3
(aq)
NaHCO3
(aq)
对应的酸
HCO3-
H2CO3
<
>
碱
性
∴
正盐的水解程度
酸式盐的水解程度
>
越弱越水解
盐本身的性质:组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度越大
(二)外因:符合勒夏特列原理
(1)温度:盐的水解反应是吸热反应,升高温度水解程度增大。(越热越水解)
(2)浓度:加水稀释盐的溶液,水解程度增大。(越稀越水解)
①加酸:
弱碱阳离子的水解。
弱酸根离子的水解。
抑制
促进
②加碱:
弱碱阳离子的水解。
弱酸根离子的水解。
促进
抑制
配制FeCl3溶液需要注意什么问题?
加入一定量的
,抑制FeCl3的水解。
Fe
3++3H2O
Fe
(OH)3
+3H+
HCl
H2SO4?
CH3COO-+H2O
CH3COOH+OH-
(3)外加酸、碱
(4)外加盐
加入水解性质相反的盐会促进盐的水解
CH3COONa溶液中存在以下水解平衡:CH3COO-+H2O
CH3COOH+OH-,改变下列条件,填写变化情况:
改变条件
平衡移动
c(CH3COO-)
c(OH-)
加入固体CH3COONa
通入HCl
升温
加水
加NaOH
加HAc
加NH4Cl
向右
增大
增大
向右
减小
减小
向右
减小
增大
向右
减小
减小
向左
向左
增大
增大
增大
减小
向右
减小
减小
影响盐类水解的因素
因素
对盐类水解程度的影响
内因
外界条件
温度
浓度
外加酸碱
外加盐
盐组成中对应的酸或碱越弱,水解程度越大(越弱越水解)
升高温度能够促进水解
盐溶液浓度越小,水解程度越大
水解显酸性的盐溶液,加碱会促进水解,加酸会抑制水解,反之亦然
加入与盐的水解性质相反的盐会促进盐的水解
二、盐类水解平衡常数Kh
——水解程度相对大小
(1)强碱弱酸盐
A-+H2O
HA
+OH-
Kh=
c
(
HA).c(
OH-
)
c(A-)
=
c
(
HA).c(
OH-
).c(H+
)
c(A-).c(H+
)
=
Kw
Ka
越弱越水解
(2)强酸弱碱盐
M++H2O
MOH+H+
Kh=
c
(MOH).c(H+)
c(M+)
=
c
(
MOH).
c(H+)
.c
(
OH-
)
c(M+).c(OH-
)
=
Kw
Kb
NaClO
(aq)
CH3COONa
(aq)
酸性
HClO
<
CH3COOH
>
碱性
弱酸
电离常数
弱酸
电离常数
H2CO3
K1=4.4×10-7
K2=4.7×10-11
H2C2O4
(草酸)
K1=5.4×10-2
K2=5.4×10-5
H3PO4
K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
H3C6H5O7
(柠檬酸)
K1=7.4×10-4
K2=1.73×10-5
K3=4×10-7
几种多元弱酸的电离常数(25℃)
(1)NaHCO3
①水解
②电离
程度:
>
∴溶液呈
性
碱
①HCO3
-+H2O
H2CO3+OH-
Kh
②HCO3-+H2O
CO32-+H3O+
Ka2=4.7×10-11
Kh=
c(H2CO3).c(OH-)
c(HCO3-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(HCO3-).c(H+)
c(H2CO3)
=
10-14
4.4×10-7
=2.3×10-8
Ka2=4.7×10-11
∴Kh>Ka2
(2)NaH2PO4
①H2PO4
-+H2O
H3PO4+OH-
Kh
=
10-14
7.1×10-3
=1.4×10-12
Ka2=6.3×10-8
∴Ka2>Kh
Kh=
c
(H3PO4).c(OH-)
c(H2PO4-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(H2PO4-).c(H+)
c(H3PO4)
②电离
①水解
程度:
>
∴溶液呈
性
酸
③HPO42-
PO43-+H+
Ka3
②H2PO4-
HPO42-+H+
Ka2=6.3×10-8
(3)Na2HPO4
①HPO4
2-+H2O
H2PO4-+OH-
Kh
②HPO42-
PO43-+H+
Ka3=4.2×10-13
=
10-14
6.3×10-8
=1.6×10-7
Ka3=4.2×10-13
Kh=
c
(H2PO4-).c(
OH-
)
c(HPO42-)
=
Kw
Ka2
=
c(
OH-
).c(H+
)
c(HPO42-).c(H+
)
c(H2PO4-)
程度:
∴Kh>Ka3
①水解
②电离
>
∴溶液呈
性
碱
2.弱酸酸式盐溶液的酸碱性取决于电离和水解程度的相对大小
显酸性(电离大于水解):NaH2PO4
NaHSO3
NaHC2O4
显碱性(水解大于电离):NaHCO3
Na2HPO4
NaHS
★酸式盐溶液酸碱性判断(记!!)
1.强酸酸式盐(NaHSO4)只电离不水解,溶液呈酸性
归纳总结
影响盐类水解的因素
(一)内因:
(二)外因:
盐类水解平衡常数
越弱越水解
符合勒夏特列原理
(越热越水解)
(越稀越水解)
Kh
=
Kw
Ka
(1)强碱弱酸盐
(2)强酸弱碱盐
Kh
=
Kw
Kb
三、盐类水解的应用
1.
热纯碱溶液去油污:纯碱水解的离子方程式为
。加热促进CO32-的水解,溶液碱性增强,去油污能力增强,去污能力增强。
CO32-+H2O
HCO3-+OH-
2.
盐溶液的配制和保存:配制、保存FeCl3等易水解的盐溶液时,加入少量盐酸的目的是抑制Fe3+的水解。
3.
盐类作净水剂:铝盐、铁盐等部分盐类水解生成胶体,有较强的吸附性,常用作净水剂。
如明矾水解的离子方程式为Al3++3H2O
Al(OH)3(胶体)+3H+
4.
制备胶体:向沸水中滴加FeCl3饱和溶液,并加热至沸腾以增大Fe3+的水解程度,从而制备Fe(OH)3胶体。
5.
制备无机化合物:如用TiCl4制备TiO2.其反应方程式为
TiCl4+
(x+2)H2O(过量)
TiO2?x
H2O↓
+
4HCl
6.
泡沫灭火器原理:Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生CO2气体和Al(OH)3沉淀,将燃烧物质与空气隔离开来。离子方程式
Al3++3HCO3-
=
Al(OH)3↓+3CO2↑
7.
不同类型盐蒸干产物的判断
