江苏省常熟市2021-2022学年高二上学期9月学生暑期自主学习调查考试化学试题(Word版含答案)
文档属性
| 名称 | 江苏省常熟市2021-2022学年高二上学期9月学生暑期自主学习调查考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 770.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-16 22:47:10 | ||
图片预览

文档简介
常熟市2021-2022学年学生暑期自主学习调查
高二化学
2021.9
注意事项:
1.
本试卷分为选择题和非选择题两部分,试卷满分100分。考试时间75分钟。
2.
将选择题答案填涂在答题卡的对应位置上,非选择题的答案写在答题卡的指定题目内。
可能用到的相对原子质量:-1
-12
-14
-16
-35.5
-23
-32
-55
-56
-
137
选择题
共39分
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.
在抗击新冠病毒的战役中,化学知识起到了重要作用。下列说法正确的是(
)
A.
组成新冠病毒中的蛋白质仅含有、、
B.
疫情期间适当用牛奶代替白粥可增强免疫力
C.
“84”消毒液和酒精同时使用可增强杀菌效果
D.
生产型口罩的核心材料聚丙烯属于无机非金属材料
2.
下列有关化学用语使用正确的是(
)
A.
乙酸的结构简式:
B.
一氯甲烷的电子式:
C.
丙烷分子的空间充填模型:
D.
聚氯乙烯的结构简式:
3.
设阿伏伽德罗常数为,下列叙述正确的是(
)
A.
常温常压下,所含原子数为
B.
常温常压下,与足量反应,转移电子数为
C.
常温常压下,和混合物中含有分子数为
D.
常温常压下,中所含阴阳离子总数为
4.
下列反应的离子方程式书写正确的是(
)
A.
三氯化铁溶液与铜粉反应:
B.
溶液与足量溶液反应
C.
氢氧化钡溶液与硫酸铜溶液反应:
D.
与过量的氨水反应:
5.
下列物质的转化在给定条件下能实现的是(
)
A.
B.
C.
D.
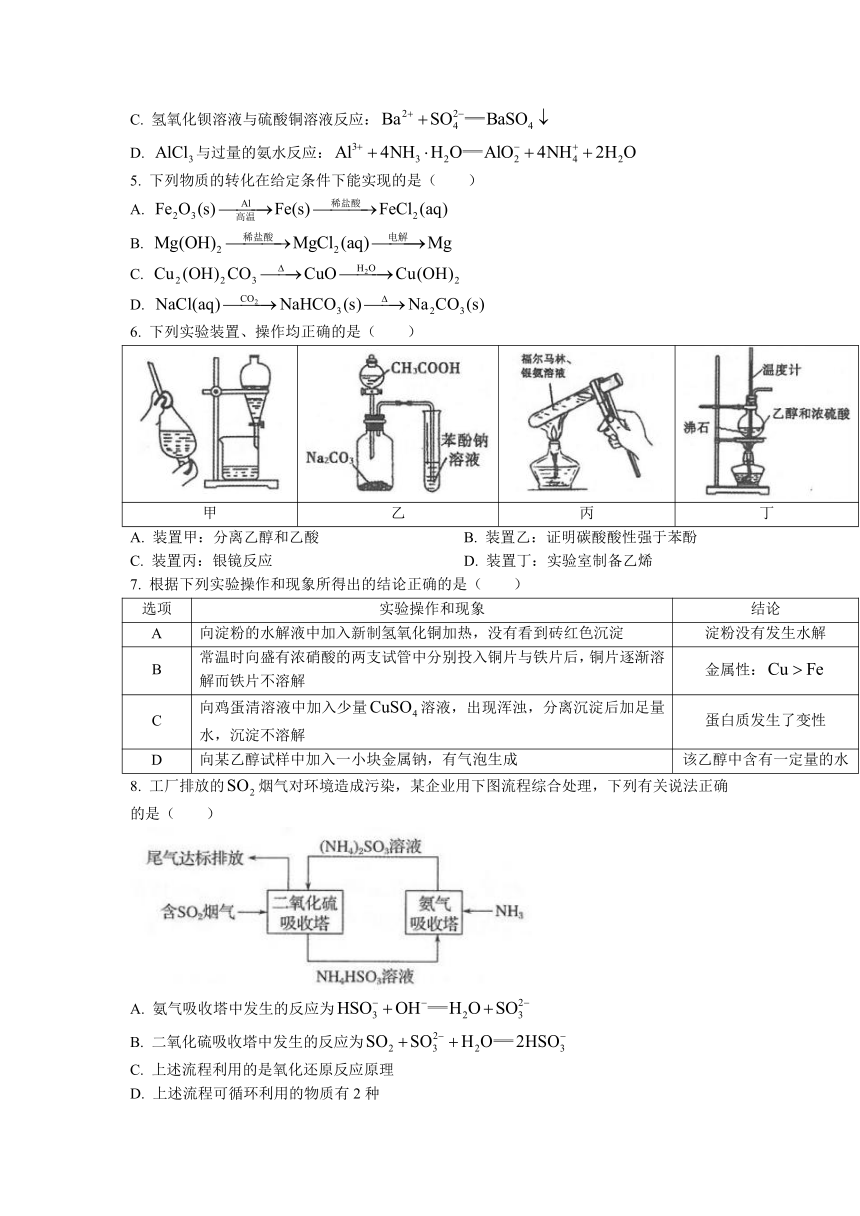
6.
下列实验装置、操作均正确的是(
)
甲
乙
丙
丁
A.
装置甲:分离乙醇和乙酸
B.
装置乙:证明碳酸酸性强于苯酚
C.
装置丙:银镜反应
D.
装置丁:实验室制备乙烯
7.
根据下列实验操作和现象所得出的结论正确的是(
)
选项
实验操作和现象
结论
A
向淀粉的水解液中加入新制氢氧化铜加热,没有看到砖红色沉淀
淀粉没有发生水解
B
常温时向盛有浓硝酸的两支试管中分别投入铜片与铁片后,铜片逐渐溶解而铁片不溶解
金属性:
C
向鸡蛋清溶液中加入少量溶液,出现浑浊,分离沉淀后加足量水,沉淀不溶解
蛋白质发生了变性
D
向某乙醇试样中加入一小块金属钠,有气泡生成
该乙醇中含有一定量的水
8.
工厂排放的烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是(
)
A.
氨气吸收塔中发生的反应为
B.
二氧化硫吸收塔中发生的反应为
C.
上述流程利用的是氧化还原反应原理
D.
上述流程可循环利用的物质有2种
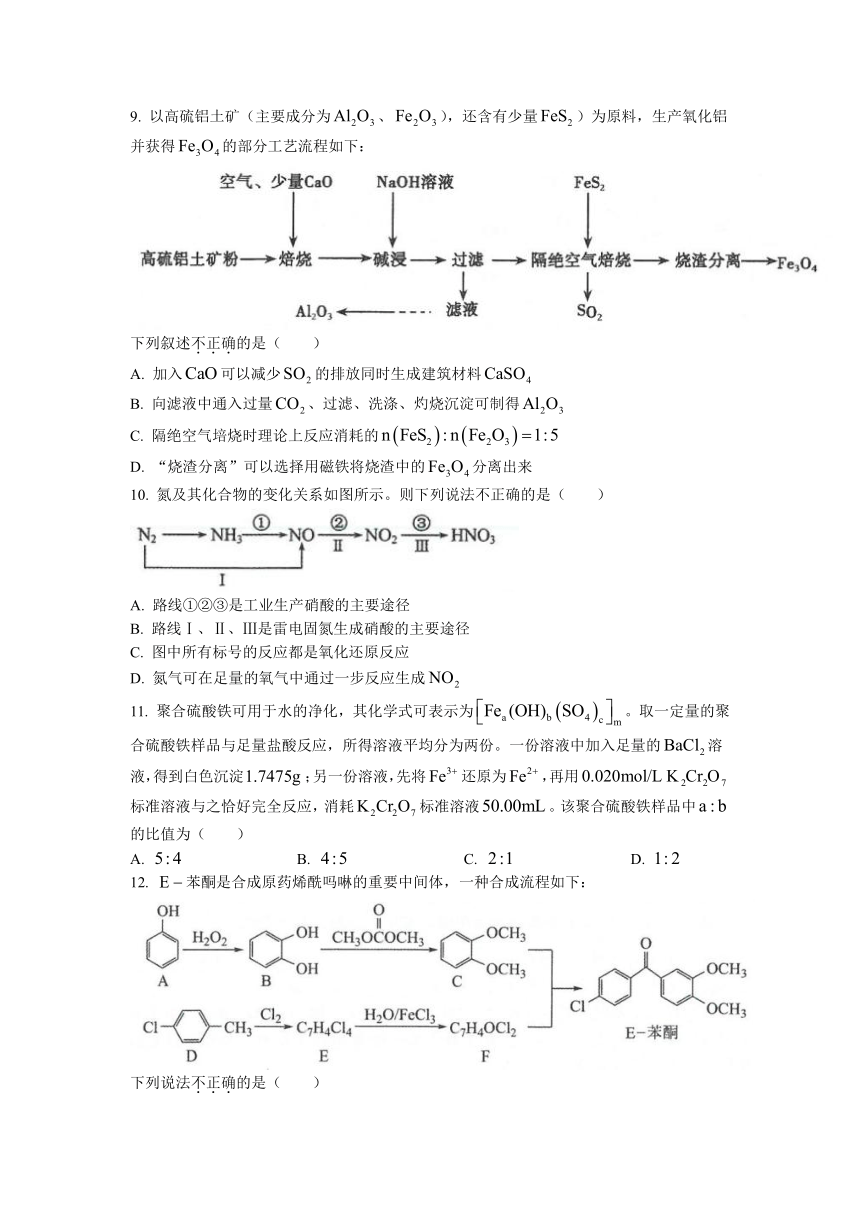
9.
以高硫铝土矿(主要成分为、),还含有少量)为原料,生产氧化铝并获得的部分工艺流程如下:
下列叙述不正确的是(
)
A.
加入可以减少的排放同时生成建筑材料
B.
向滤液中通入过量、过滤、洗涤、灼烧沉淀可制得
C.
隔绝空气培烧时理论上反应消耗的
D.
“烧渣分离”可以选择用磁铁将烧渣中的分离出来
10.
氮及其化合物的变化关系如图所示。则下列说法不正确的是(
)
A.
路线①②③是工业生产硝酸的主要途径
B.
路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.
图中所有标号的反应都是氧化还原反应
D.
氮气可在足量的氧气中通过一步反应生成
11.
聚合硫酸铁可用于水的净化,其化学式可表示为。取一定量的聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的溶液,得到白色沉淀;另一份溶液,先将还原为,再用标准溶液与之恰好完全反应,消耗标准溶液。该聚合硫酸铁样品中的比值为(
)
A.
B.
C.
D.
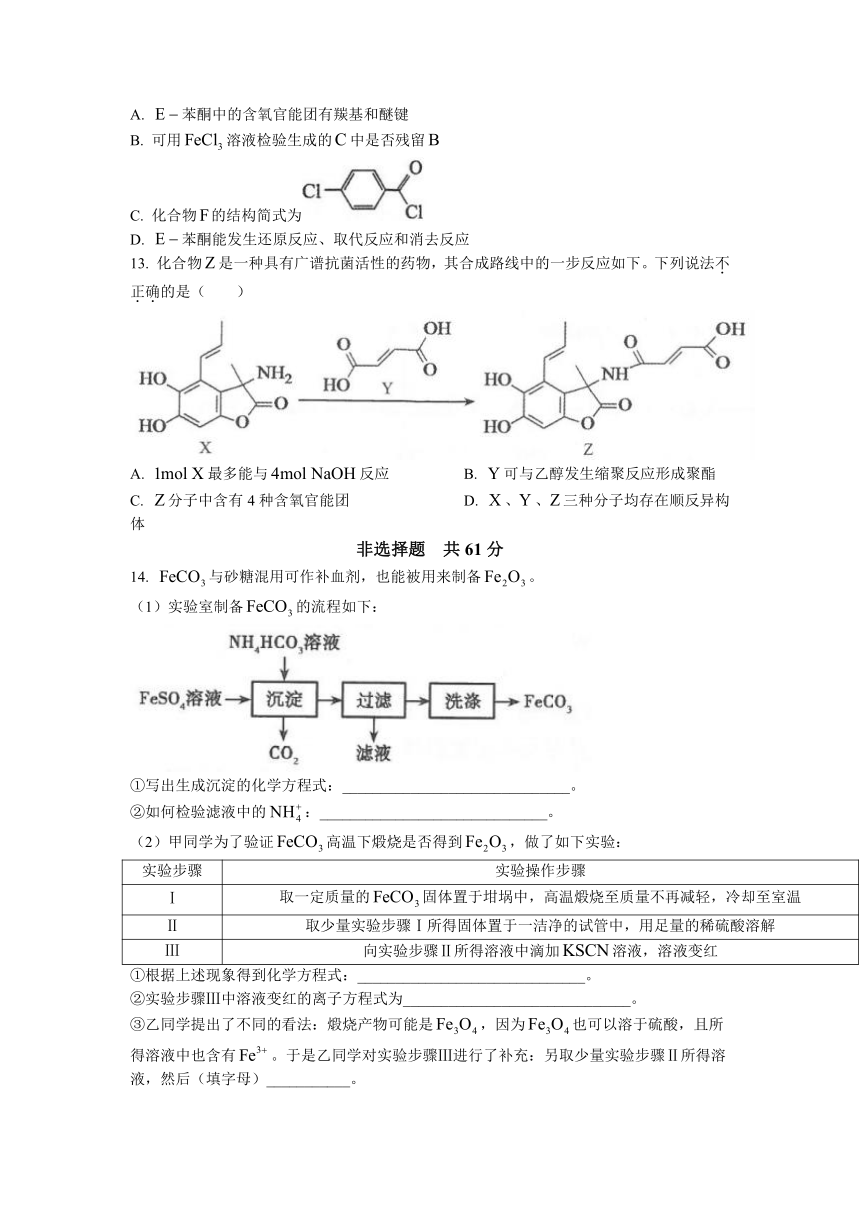
12.
苯酮是合成原药烯酰吗啉的重要中间体,一种合成流程如下:
下列说法不正确的是(
)
A.
苯酮中的含氧官能团有羰基和醚键
B.
可用溶液检验生成的中是否残留
C.
化合物的结构简式为
D.
苯酮能发生还原反应、取代反应和消去反应
13.
化合物是一种具有广谱抗菌活性的药物,其合成路线中的一步反应如下。下列说法不正确的是(
)
A.
最多能与反应
B.
可与乙醇发生缩聚反应形成聚酯
C.
分子中含有4种含氧官能团
D.
、、三种分子均存在顺反异构体
非选择题
共61分
14.
与砂糖混用可作补血剂,也能被用来制备。
(1)实验室制备的流程如下:
①写出生成沉淀的化学方程式:______________________________。
②如何检验滤液中的:______________________________。
(2)甲同学为了验证高温下煅烧是否得到,做了如下实验:
实验步骤
实验操作步骤
Ⅰ
取一定质量的固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温
Ⅱ
取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解
Ⅲ
向实验步骤Ⅱ所得溶液中滴加溶液,溶液变红
①根据上述现象得到化学方程式:______________________________。
②实验步骤Ⅲ中溶液变红的离子方程式为______________________________。
③乙同学提出了不同的看法:煅烧产物可能是,因为也可以溶于硫酸,且所得溶液中也含有。于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后(填字母)___________。
A.
滴加氯水
B.
滴加溶液
C.
先滴加溶液后滴加氯水
D.
滴加酸性溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物中含有+2价铁元素。于是他设计了由制备的方案。先向粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到.请写出和双氧水有关的离子方程式:______________________________。
15.
、和等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)的处理。是硝酸生产中氨催化氧化的副产物,用特种催化剂能使分解。与在加热和催化剂作用下生成的化学方程式为_______________________________。
(2)和的处理。已除去的硝酸尾气可用溶液吸收,主要反应为
①下列措施能提高尾气中和去除率的有___________(填字母)。
A.
加快通入尾气的速率
B.
采用气、液逆流的方式吸收尾气
C.
吸收尾气过程中定期补加适量溶液
②吸收后的溶液经浓缩、结晶、过滤,得到晶体,该晶体中的主要杂质是__________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是_____________(填化学式)。
(3)的氧化吸收。用溶液吸收硝酸尾气,可提高尾气中的去除率。其他条件相同,转化为的转化率随溶液初始(用稀盐酸调节)的变化如图所示。
在酸性溶液中,氧化生成和,其离子方程式为____________________。
16.
丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:
①取丙烯酸和甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入溶液洗至中性。
③分液,取上层油状液体,再用无水干燥后蒸馏,收集馏分。可能用到的信息:
沸点
溶解性
毒性
丙烯酸
与水互溶,易溶于有机溶剂
有毒
甲醇
与水互溶,易溶于有机溶剂
易挥发,有毒
丙烯酸甲酯
难溶于水,易溶于有机溶剂
易挥发
回答下列问题:
(1)仪器的名称是_____________________。
(2)混合液用溶液洗涤的目的是______________________________。
(3)请写出配制溶液所使用的玻璃仪器_____________________。
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出____________________。
(5)为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入的溶液,加热使之完全水解。
②用酚酞作指示剂,向冷却后的溶液中滴加的溶液,中和过量的,滴到终点时共消耗盐酸。
计算本次酯化反应丙烯酸的转化率___________。
17.
白黎芦醇具有抗氧化和预防心血管疾病的作用。可通过以下方法合成:
(1)下列说法正确的是___________。
A.
、的反应类型分别为取代反应、消去反应
B.
可以用溶液检验化合物中是否含有
C.
化合物中含有1个手性碳原子
D.
白黎芦醇最多能消耗溴水中
(2)的结构简式为__________。
(3)写出同时满足下列条件的的一种同分异构体的结构简式:__________。
①能发生银镜反应,与溶液不显色;
②能发生水解反应,水解产物之一能与溶液显色;
③分子中含有4种不同化学环境的氢。
(4)请写出以苯甲酸、甲醇为原料制备的合成路线流程图,无机试剂可任选,合成示例见本题题干。
学生暑期自主学习调查
高二化学参考答案
2021.9
选择题(每空3分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
D
B
B
A
D
C
B
C
D
C
D
B
非选择题
14.(14分,(1)中每空3分,其余每空2分)
(1)①
②取少量滤液于试管中,加入足量溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有铵根离子
(2)①
②
③
(3)
15.(15分,每空3分)
(1)
(2)①BC
②
(3)
16.(16分,(3)4分,其余每空3分)
(1)分液漏斗
(2)除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度)
(3)烧杯、玻璃棒、量筒、胶头滴管
(4)温度计水银球位置、接液管与锥形瓶接口密封
(5)
17.(16分)
(1)AC(3分)
(2)(3分)
(3)或(4分)
(4)(6分)
高二化学
2021.9
注意事项:
1.
本试卷分为选择题和非选择题两部分,试卷满分100分。考试时间75分钟。
2.
将选择题答案填涂在答题卡的对应位置上,非选择题的答案写在答题卡的指定题目内。
可能用到的相对原子质量:-1
-12
-14
-16
-35.5
-23
-32
-55
-56
-
137
选择题
共39分
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.
在抗击新冠病毒的战役中,化学知识起到了重要作用。下列说法正确的是(
)
A.
组成新冠病毒中的蛋白质仅含有、、
B.
疫情期间适当用牛奶代替白粥可增强免疫力
C.
“84”消毒液和酒精同时使用可增强杀菌效果
D.
生产型口罩的核心材料聚丙烯属于无机非金属材料
2.
下列有关化学用语使用正确的是(
)
A.
乙酸的结构简式:
B.
一氯甲烷的电子式:
C.
丙烷分子的空间充填模型:
D.
聚氯乙烯的结构简式:
3.
设阿伏伽德罗常数为,下列叙述正确的是(
)
A.
常温常压下,所含原子数为
B.
常温常压下,与足量反应,转移电子数为
C.
常温常压下,和混合物中含有分子数为
D.
常温常压下,中所含阴阳离子总数为
4.
下列反应的离子方程式书写正确的是(
)
A.
三氯化铁溶液与铜粉反应:
B.
溶液与足量溶液反应
C.
氢氧化钡溶液与硫酸铜溶液反应:
D.
与过量的氨水反应:
5.
下列物质的转化在给定条件下能实现的是(
)
A.
B.
C.
D.
6.
下列实验装置、操作均正确的是(
)
甲
乙
丙
丁
A.
装置甲:分离乙醇和乙酸
B.
装置乙:证明碳酸酸性强于苯酚
C.
装置丙:银镜反应
D.
装置丁:实验室制备乙烯
7.
根据下列实验操作和现象所得出的结论正确的是(
)
选项
实验操作和现象
结论
A
向淀粉的水解液中加入新制氢氧化铜加热,没有看到砖红色沉淀
淀粉没有发生水解
B
常温时向盛有浓硝酸的两支试管中分别投入铜片与铁片后,铜片逐渐溶解而铁片不溶解
金属性:
C
向鸡蛋清溶液中加入少量溶液,出现浑浊,分离沉淀后加足量水,沉淀不溶解
蛋白质发生了变性
D
向某乙醇试样中加入一小块金属钠,有气泡生成
该乙醇中含有一定量的水
8.
工厂排放的烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是(
)
A.
氨气吸收塔中发生的反应为
B.
二氧化硫吸收塔中发生的反应为
C.
上述流程利用的是氧化还原反应原理
D.
上述流程可循环利用的物质有2种
9.
以高硫铝土矿(主要成分为、),还含有少量)为原料,生产氧化铝并获得的部分工艺流程如下:
下列叙述不正确的是(
)
A.
加入可以减少的排放同时生成建筑材料
B.
向滤液中通入过量、过滤、洗涤、灼烧沉淀可制得
C.
隔绝空气培烧时理论上反应消耗的
D.
“烧渣分离”可以选择用磁铁将烧渣中的分离出来
10.
氮及其化合物的变化关系如图所示。则下列说法不正确的是(
)
A.
路线①②③是工业生产硝酸的主要途径
B.
路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.
图中所有标号的反应都是氧化还原反应
D.
氮气可在足量的氧气中通过一步反应生成
11.
聚合硫酸铁可用于水的净化,其化学式可表示为。取一定量的聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的溶液,得到白色沉淀;另一份溶液,先将还原为,再用标准溶液与之恰好完全反应,消耗标准溶液。该聚合硫酸铁样品中的比值为(
)
A.
B.
C.
D.
12.
苯酮是合成原药烯酰吗啉的重要中间体,一种合成流程如下:
下列说法不正确的是(
)
A.
苯酮中的含氧官能团有羰基和醚键
B.
可用溶液检验生成的中是否残留
C.
化合物的结构简式为
D.
苯酮能发生还原反应、取代反应和消去反应
13.
化合物是一种具有广谱抗菌活性的药物,其合成路线中的一步反应如下。下列说法不正确的是(
)
A.
最多能与反应
B.
可与乙醇发生缩聚反应形成聚酯
C.
分子中含有4种含氧官能团
D.
、、三种分子均存在顺反异构体
非选择题
共61分
14.
与砂糖混用可作补血剂,也能被用来制备。
(1)实验室制备的流程如下:
①写出生成沉淀的化学方程式:______________________________。
②如何检验滤液中的:______________________________。
(2)甲同学为了验证高温下煅烧是否得到,做了如下实验:
实验步骤
实验操作步骤
Ⅰ
取一定质量的固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温
Ⅱ
取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解
Ⅲ
向实验步骤Ⅱ所得溶液中滴加溶液,溶液变红
①根据上述现象得到化学方程式:______________________________。
②实验步骤Ⅲ中溶液变红的离子方程式为______________________________。
③乙同学提出了不同的看法:煅烧产物可能是,因为也可以溶于硫酸,且所得溶液中也含有。于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后(填字母)___________。
A.
滴加氯水
B.
滴加溶液
C.
先滴加溶液后滴加氯水
D.
滴加酸性溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物中含有+2价铁元素。于是他设计了由制备的方案。先向粉末中依次加入试剂:稀硫酸、双氧水、氢氧化钠溶液;然后再过滤、洗涤、灼烧即可得到.请写出和双氧水有关的离子方程式:______________________________。
15.
、和等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)的处理。是硝酸生产中氨催化氧化的副产物,用特种催化剂能使分解。与在加热和催化剂作用下生成的化学方程式为_______________________________。
(2)和的处理。已除去的硝酸尾气可用溶液吸收,主要反应为
①下列措施能提高尾气中和去除率的有___________(填字母)。
A.
加快通入尾气的速率
B.
采用气、液逆流的方式吸收尾气
C.
吸收尾气过程中定期补加适量溶液
②吸收后的溶液经浓缩、结晶、过滤,得到晶体,该晶体中的主要杂质是__________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是_____________(填化学式)。
(3)的氧化吸收。用溶液吸收硝酸尾气,可提高尾气中的去除率。其他条件相同,转化为的转化率随溶液初始(用稀盐酸调节)的变化如图所示。
在酸性溶液中,氧化生成和,其离子方程式为____________________。
16.
丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图所示:
①取丙烯酸和甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
②充分反应后,冷却,向混合液中加入溶液洗至中性。
③分液,取上层油状液体,再用无水干燥后蒸馏,收集馏分。可能用到的信息:
沸点
溶解性
毒性
丙烯酸
与水互溶,易溶于有机溶剂
有毒
甲醇
与水互溶,易溶于有机溶剂
易挥发,有毒
丙烯酸甲酯
难溶于水,易溶于有机溶剂
易挥发
回答下列问题:
(1)仪器的名称是_____________________。
(2)混合液用溶液洗涤的目的是______________________________。
(3)请写出配制溶液所使用的玻璃仪器_____________________。
(4)关于产品的蒸馏操作(夹持装置未画出),下图中有2处错误,请分别写出____________________。
(5)为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入的溶液,加热使之完全水解。
②用酚酞作指示剂,向冷却后的溶液中滴加的溶液,中和过量的,滴到终点时共消耗盐酸。
计算本次酯化反应丙烯酸的转化率___________。
17.
白黎芦醇具有抗氧化和预防心血管疾病的作用。可通过以下方法合成:
(1)下列说法正确的是___________。
A.
、的反应类型分别为取代反应、消去反应
B.
可以用溶液检验化合物中是否含有
C.
化合物中含有1个手性碳原子
D.
白黎芦醇最多能消耗溴水中
(2)的结构简式为__________。
(3)写出同时满足下列条件的的一种同分异构体的结构简式:__________。
①能发生银镜反应,与溶液不显色;
②能发生水解反应,水解产物之一能与溶液显色;
③分子中含有4种不同化学环境的氢。
(4)请写出以苯甲酸、甲醇为原料制备的合成路线流程图,无机试剂可任选,合成示例见本题题干。
学生暑期自主学习调查
高二化学参考答案
2021.9
选择题(每空3分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
D
B
B
A
D
C
B
C
D
C
D
B
非选择题
14.(14分,(1)中每空3分,其余每空2分)
(1)①
②取少量滤液于试管中,加入足量溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有铵根离子
(2)①
②
③
(3)
15.(15分,每空3分)
(1)
(2)①BC
②
(3)
16.(16分,(3)4分,其余每空3分)
(1)分液漏斗
(2)除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度)
(3)烧杯、玻璃棒、量筒、胶头滴管
(4)温度计水银球位置、接液管与锥形瓶接口密封
(5)
17.(16分)
(1)AC(3分)
(2)(3分)
(3)或(4分)
(4)(6分)
同课章节目录
