2.3制取氧气 课课练(含解析)
图片预览



文档简介
中小学教育资源及组卷应用平台
氧气的制备
1.工业上制备大量的氧气是根据空气中氧气(-183℃)和氮气(-196℃)沸点不同而采用分离液态空气的方法。首先将空气除尘净化,除去其中的二氧化碳和水蒸气,然后加压降温使空气___________,通过控制温度蒸发液态空气,最后_________先蒸发出来。
2.下列关于实验室制取氧气的实验过程中,操作”先"、“后"顺序不合理的是(
)
A.实验室用高锰酸钾制取氧气的实验过程中,先固定试管,后调整酒精灯的高度
B.制取氧气实验中,先检查装置的气密性,后再装入药品
C.用排水法收集氧气时,先在集气瓶内装满水,后将导管伸入取出集气瓶口内
D.加热氯酸钾用排水法制氧气实验结束时,应先把导气管移出水面,然后再熄灭酒精灯
3.如图所示装置可用于收集氧气,请回答下列问题。
(1)用向上排空气法收集氧气,则氧气应从_________端导管通入。若要检查已收集满氧气,可将带火星的木条放在__________端导管口处。
(2)若用排水法收集氧气,可使集气瓶中装满水,氧气从__________端导管通入,水从__________端导管排出。
4.四种制取氧气的方法如图所示,下列有关四种氧气制取方法的说法,错误的是(
)
A.四种方法都是利用含氧化合物分解来制取O2
B.H2O2制备氧气需要加入二氧化锰,因此不属于分解反应
C.反应时加入的MnO2不能增加产生氧气的质量
D.从安全、环保、节能、简便等方面考虑,最佳方法是H2O2分解制取O2
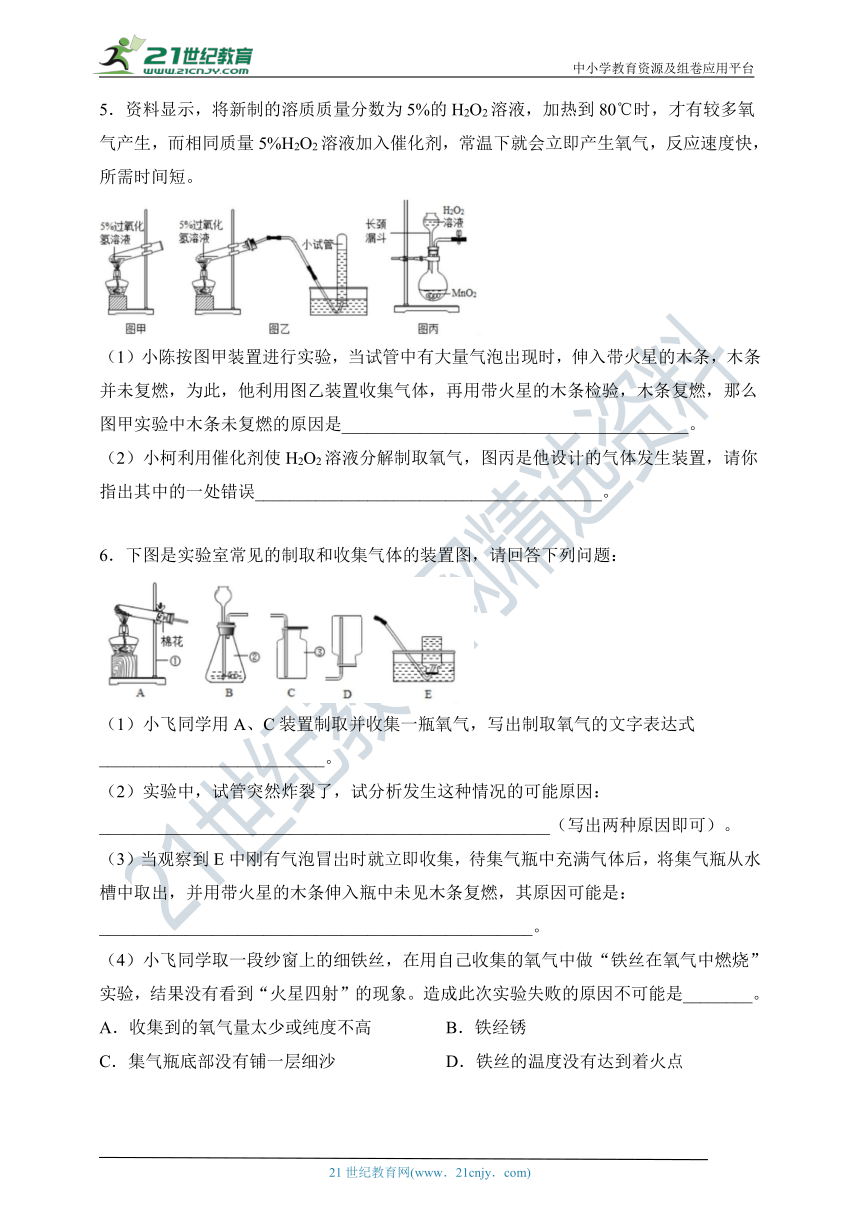
5.资料显示,将新制的溶质质量分数为5%的H2O2溶液,加热到80℃时,才有较多氧气产生,而相同质量5%H2O2溶液加入催化剂,常温下就会立即产生氧气,反应速度快,所需时间短。
(1)小陈按图甲装置进行实验,当试管中有大量气泡岀现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中木条未复燃的原因是________________________________________。
(2)小柯利用催化剂使H2O2溶液分解制取氧气,图丙是他设计的气体发生装置,请你指出其中的一处错误________________________________________。
6.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
(1)小飞同学用A、C装置制取并收集一瓶氧气,写出制取氧气的文字表达式__________________________。
(2)实验中,试管突然炸裂了,试分析发生这种情况的可能原因:____________________________________________________(写出两种原因即可)。
(3)当观察到E中刚有气泡冒岀时就立即收集,待集气瓶中充满气体后,将集气瓶从水槽中取出,并用带火星的木条伸入瓶中未见木条复燃,其原因可能是:__________________________________________________。
(4)小飞同学取一段纱窗上的细铁丝,在用自己收集的氧气中做“铁丝在氧气中燃烧”实验,结果没有看到“火星四射”的现象。造成此次实验失败的原因不可能是________。
A.收集到的氧气量太少或纯度不高
B.铁经锈
C.集气瓶底部没有铺一层细沙
D.铁丝的温度没有达到着火点
7.下图能正确反映其对应操作中各种量的变化关系是(
)
A.①加热一定质量的氯酸钾和二氧化锰的混合固体,生成氧气(符号为O2)的质量与反应时间的关系
B.②一定质量的硫粉在含有足量氧气的密闭容器中燃烧,容器中固体的质量随反应时间的变化关系
C.③用两份等质量、等浓度的过氧化氢溶液分别制取氧气(符号为O2)
D.④加热一定质量的高锰酸钾制取氧气,试管中剩余固体的质量随反应时间的变化关系
8.小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃。为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
【设计实验】小君设计了如图的装置,该装置的圆底烧瓶中放入25mL水的目的是________________________________________。
【实验研究】第一组实验:取3只集气瓶,编号为①②③,分别装入15%、30%和45%的水,盖上盖玻片倒置在水槽中。当气泡_______放出后,导管口伸入集气瓶把其中的水全部排岀。将相同的3
支带火星竹签分别插入①-③号瓶中,记录下实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象。两组实验数据和现象见下表:
实验分组
第一组
第二组
实验序号
①
②
③
④
⑤
⑥
集气瓶装水的体积分数/%
15
30
45
34
38
42
带火星竹签状况
亮
很亮
复燃
很亮
复燃
复燃
得岀上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是________%。
【实验结论】再经过数次实验后,小君发现瓶内装水体积分数为35%时,木条恰好复燃,此时瓶内氧气的体积分数为________(精确至0.1%)。
【继续探究】小君认为该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进措施是________________________________________________。
9.关于催化剂的正确说法是(
)
A.使用催化剂可增加生成物的质量
B.使用催化剂反应速率一定加快
C.不用催化剂就不能发生化学反应
D.使用催化剂能改变物质化学反应速率
10.关于实验室用过氧化氢、氯酸钾、高锰酸钾制取氧气的反应,相同之处是(
)
A.都需要加热
B.都需要催化剂
C.都有氧化物生成
D.都属于分解反应
11.下图是创新实验小组对“MnO2催化H2O2分解实验装置的创新设计”,实验过程如下:
①一支球形干燥管水平放置,用滴管吸取3mLH2O2溶液加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥的进气管的管壁上。
②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象。
(1)可观察带到火星的棒香立即__________________;
(2)MnO2催化H2O2分解的文字表达式是________________________;
(3)下列各项是同学们对该创新实验的评价,为评价不合理的是___________(填序号)。
A.实验中所用的仪器、材料及药品均易得到
B.实验使用的药品用量太大
C.反应速率太慢,耽误时间
D.实验现象明显,整个装置好似点燃的灯塔,趣味性强
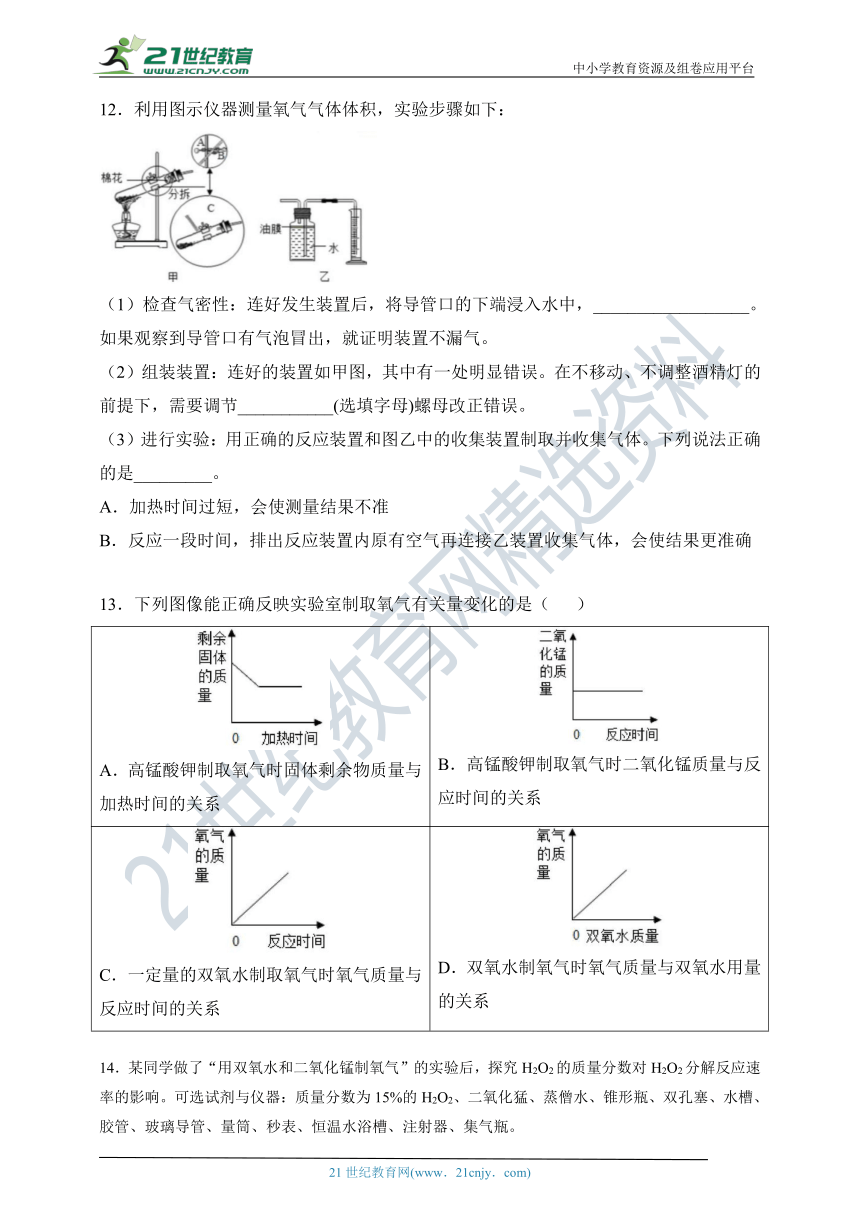
12.利用图示仪器测量氧气气体体积,实验步骤如下:
(1)检查气密性:连好发生装置后,将导管口的下端浸入水中,__________________。如果观察到导管口有气泡冒出,就证明装置不漏气。
(2)组装装置:连好的装置如甲图,其中有一处明显错误。在不移动、不调整酒精灯的前提下,需要调节___________(选填字母)螺母改正错误。
(3)进行实验:用正确的反应装置和图乙中的收集装置制取并收集气体。下列说法正确的是_________。
A.加热时间过短,会使测量结果不准
B.反应一段时间,排出反应装置内原有空气再连接乙装置收集气体,会使结果更准确
13.下列图像能正确反映实验室制取氧气有关量变化的是(
)
A.高锰酸钾制取氧气时固体剩余物质量与加热时间的关系
B.高锰酸钾制取氧气时二氧化锰质量与反应时间的关系
C.一定量的双氧水制取氧气时氧气质量与反应时间的关系
D.双氧水制氧气时氧气质量与双氧水用量的关系
14.某同学做了“用双氧水和二氧化锰制氧气”的实验后,探究H2O2的质量分数对H2O2分解反应速率的影响。可选试剂与仪器:质量分数为15%的H2O2、二氧化猛、蒸僧水、锥形瓶、双孔塞、水槽、
胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器、集气瓶。
(1)设计实验方案:在不同质量分数的H2O2下,测定_____________(要求所测得的数据能直接体现反应速率大小)。
(2)设计实验装置。如下图是未完成的实验装置示意图,在虚线框中可以选择下列哪些装置?
_____________。
为什么要把锥形瓶浸在恒温水浴槽中?__________________________。
(3)拟定实验表格:完整体现实验方案,要列出所选试剂体积或质量、需记录的待测量和所拟定的数据,数据用字母表示。请将下表补充完整:
15.下图虚线是采用质量分数为5%的H2O2溶液加热分解制取氧气的曲线,请你在该图中用实线画出添加催化剂制取氧气的大致曲线。
16.下列说法中,不正确的是(
)
A.在氯酸钾的分解反应中,二氧化锰起催化作用
B.要使过氧化氢分解放出氧气,必须加入二氧化锰,否则反应就不能发生
C.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
D.制取气体时,要先检查装置的气密性,然后再装药品
17.从事科学实验的重要环节是进行科学实验的设计。请你按照以下科学实验的正确步骤和装置图,完成实验室常用“双氧水和二氧化锰制取氧气“的实验设计:
【步骤1】明确实验目的:在实验室里用双氧水和二氧化锰制取氧气。
【步骤2】收集有关资料:过氧化氢(H2O2)是一种无色液体,二氧化锰(MnO2)是一种黑色固体;
过氧化氢在二氧化锰的催化作用下,不需要加热,就能迅速分解出氧气,同时生成水:所以实验室常用这种方法来制取氧气。氧气的密度_____于(选填"大"或"小")空气的密度,且不易溶于水。
【步骤3】设计合理方案:应选用的发生装置是______________;应选用的收集装置是
______________。(选填装置图的序号)
【步骤4】进行科学实验:过氧化氢和二氧化锰混合制取氧气的文字表达式为________________属于______________反应。
【步骤5】用收集的氧气做铁丝在氧气中燃烧的实验:
请描述燃烧现象_________________________;文字表达式为:_____________________。
18.下图是某同学用高锰酸钾制取氧气的装置。
(1)此装置的错误有(至少说出3处):
①__________________________________________________;
②__________________________________________________;
③__________________________________________________。
(2)检验氧气是否已收集满的方法_________________________________。
19.如图表示一定质量的氯酸钾和二氧化锰固体混合物受热过程中,随时间的变化趋势,纵坐标表示的是(
)
A.固体中氧元素的质量
B.生成O2的质量
C.固体中MnO2的质量分数
D.固体中钾元素的质量
20.某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究活动,并填空:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了两组对比实验:
I.将3.0g氯酸钾和0.5g二氧化锰粉末均匀混合加热
II.将3.0g氯酸钾和X
g氧化铜粉末均匀混合加热
①在相同条件下比较上述两组实验产生氧气的快慢,实验II中X的值应为____________。
②若氧化铜可以催化氯酸钾分解,写出反应的文字表达式_________________________。
(2)乙同学探究“红砖粉末是否也可以作为过氧化氢分解的催化剂”。
【提出问题】红砖粉末能不能做“过氧化氢分解”的催化剂呢?
【做出猜想】红砖粉末能做“过氧化氢分解”的催化剂。
【实验验证】
实验步骤
实验现象
实验结论
①将带火星的木条伸入装有过氧化氢溶液的试管中
木条不复燃
常温下过氧化氢分解速率很慢
②在上述试管中加入0.2g红砖粉末,然后将带火
星的木条伸入试管中
木条复燃
①______________
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管
在化学反应前后,红砖粉末的②__________没有改变。
【实验讨论】
有同学认为:仅凭上述实验还不能证明红砖粉末能做过氧化氢分解的催化剂,还需要增加一个实验________________________________,则说明红砖粉末可以作为过氧化氢分解的催化剂。
【实验拓展】查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化齐啲说法中正确的是________________(填字母)。
A.催化剂能增加生成物的量
B.在工业生产中催化剂起到极大的作用
C.催化剂只能加快化学反应的速率
D.同一个化学反应可以有多种催化剂
21.某化学兴趣小组用如图所示的装置来制取干燥的氧气,并测定生成氧气的体积。装置气密性良好,图I中的锥形瓶内盛有质量为m的H2O2溶液,燃烧匙内装有二氧化锰,燃烧匙可以上下移动,干燥管内装有足量碱石灰(CaO和NaOH的混合物,可以干燥氧气)。下列说法正确的是(
)
A.将装置I分别与装置II、III、IV、V连接,均能达到实验目的
B.装置I反应可以控制反应的进程,并且可以得到干燥的氧气
C.若用装置IV收集氧气,可将带火星的木条放置在b导管口处验满
D.若用装置V测量生成氧气的体积,集气瓶上方原有的空气会使测量结果偏大
22.如图所示,过氧化氢(H2O2)在催化剂二氧化锰的作用下迅速分解放出大量氧气,下列想象正确的是(
)
A.出胀大,红墨水左移
B.床缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移
23.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
下列有关实验中的说法错误的是(
)
A.实验2中应加入5%H2O2
40毫升
B.可通过相同的时间内注射器内气体的体积来比较H2O2分解反应速率的大小
C.实验2中因为水浴温度控制在80℃,所以测定的反应速率会比真实值偏大
D.实验结束后若要将MnO2从混合物中分离出来,可采取的方法是过滤、蒸发、结晶
24.小柯为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,井使用传感器测定收集到的氧气浓度,数据见表。
收集方法
向上排空气法
排水法
氧气浓度%
79.6
79.7
79.9
90.9
89.8
89.3
氧气平均浓度%
79.7
89.7
(1)小柯用向上排空气法收集氧气时,以能使放置在集气瓶瓶口的带火星木条复燃为氧气集满的标准;用排水法收集氧气时,以观察到__________________为氧气集满的标准。
(2)以上两种方法中,__________________法收集到的氧气更纯净。
(3)向上排空气法收集到的氧气浓度只有80%左右原因有__________________。
A.氧气的密度略大于空气的密度
B
.加热高锰酸钾固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
答案:
1.液化;液态氮
2.A
3.(1)A;B。
(2)B;A。
4.B
5.(1)加热过氧化氢溶液的同时,溶液中的水蒸气与氧气一同逸出,氧气含量小;
(2)长颈漏斗下端没有伸入液面
6.(1)高锰酸钾=加热=锰酸钾+二氧化锰+氧气;
(2)试管底部与灯芯接触,试管外壁有水珠、没有先预热;
(3)氧气不纯;
(4)C
7.B
8.稀释过氧化氢溶液,减缓过氧化氢的分解速率;
连续、均匀;36;
48.7%;
收集氧气前增加气体的干燥装置,在用排油法收集氧气。
9.D
10.D
11.(1)复燃;
(2)过氧化氢=二氧化锰=水+氧气
(3)BC
12.(1)用手紧握试管;
(2)AB;
(3)A。
13.D
14.(1)收集相同体积的氧气所需的时间或者相同时间所收集氧气的体积;
(2)BCD;排除温度对实验的影响;
(3)氧气体积/ml;时间/s;
a;b;
15.
16.B
17.大;
A;
D或者E;
过氧化氢=二氧化锰=水+氧气;
分解;
剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
铁+氧气=点燃=四氧化三铁。
18.试管口向下倾斜;
试管口没有塞棉花;
导管深入试管过长;
将带火星的木条放在集气瓶口,木条复燃则说明已收集满。
19.C
20.(1)①0.5;②氯酸钾=氧化铜/加热=氯化钾+氧气;
(2)①红砖粉末加速了过氧化氢的分解;②化学性质
【实验结论】将红砖粉末过滤洗涤烘干后,称得其质量仍为0.2g
【实验拓展】BD
21.B
22.D
23.D
24.(1)当气泡从瓶口冒出时或观察到瓶中水排尽时;
(2)排水;
(3)ACD。
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
氧气的制备
1.工业上制备大量的氧气是根据空气中氧气(-183℃)和氮气(-196℃)沸点不同而采用分离液态空气的方法。首先将空气除尘净化,除去其中的二氧化碳和水蒸气,然后加压降温使空气___________,通过控制温度蒸发液态空气,最后_________先蒸发出来。
2.下列关于实验室制取氧气的实验过程中,操作”先"、“后"顺序不合理的是(
)
A.实验室用高锰酸钾制取氧气的实验过程中,先固定试管,后调整酒精灯的高度
B.制取氧气实验中,先检查装置的气密性,后再装入药品
C.用排水法收集氧气时,先在集气瓶内装满水,后将导管伸入取出集气瓶口内
D.加热氯酸钾用排水法制氧气实验结束时,应先把导气管移出水面,然后再熄灭酒精灯
3.如图所示装置可用于收集氧气,请回答下列问题。
(1)用向上排空气法收集氧气,则氧气应从_________端导管通入。若要检查已收集满氧气,可将带火星的木条放在__________端导管口处。
(2)若用排水法收集氧气,可使集气瓶中装满水,氧气从__________端导管通入,水从__________端导管排出。
4.四种制取氧气的方法如图所示,下列有关四种氧气制取方法的说法,错误的是(
)
A.四种方法都是利用含氧化合物分解来制取O2
B.H2O2制备氧气需要加入二氧化锰,因此不属于分解反应
C.反应时加入的MnO2不能增加产生氧气的质量
D.从安全、环保、节能、简便等方面考虑,最佳方法是H2O2分解制取O2
5.资料显示,将新制的溶质质量分数为5%的H2O2溶液,加热到80℃时,才有较多氧气产生,而相同质量5%H2O2溶液加入催化剂,常温下就会立即产生氧气,反应速度快,所需时间短。
(1)小陈按图甲装置进行实验,当试管中有大量气泡岀现时,伸入带火星的木条,木条并未复燃,为此,他利用图乙装置收集气体,再用带火星的木条检验,木条复燃,那么图甲实验中木条未复燃的原因是________________________________________。
(2)小柯利用催化剂使H2O2溶液分解制取氧气,图丙是他设计的气体发生装置,请你指出其中的一处错误________________________________________。
6.下图是实验室常见的制取和收集气体的装置图,请回答下列问题:
(1)小飞同学用A、C装置制取并收集一瓶氧气,写出制取氧气的文字表达式__________________________。
(2)实验中,试管突然炸裂了,试分析发生这种情况的可能原因:____________________________________________________(写出两种原因即可)。
(3)当观察到E中刚有气泡冒岀时就立即收集,待集气瓶中充满气体后,将集气瓶从水槽中取出,并用带火星的木条伸入瓶中未见木条复燃,其原因可能是:__________________________________________________。
(4)小飞同学取一段纱窗上的细铁丝,在用自己收集的氧气中做“铁丝在氧气中燃烧”实验,结果没有看到“火星四射”的现象。造成此次实验失败的原因不可能是________。
A.收集到的氧气量太少或纯度不高
B.铁经锈
C.集气瓶底部没有铺一层细沙
D.铁丝的温度没有达到着火点
7.下图能正确反映其对应操作中各种量的变化关系是(
)
A.①加热一定质量的氯酸钾和二氧化锰的混合固体,生成氧气(符号为O2)的质量与反应时间的关系
B.②一定质量的硫粉在含有足量氧气的密闭容器中燃烧,容器中固体的质量随反应时间的变化关系
C.③用两份等质量、等浓度的过氧化氢溶液分别制取氧气(符号为O2)
D.④加热一定质量的高锰酸钾制取氧气,试管中剩余固体的质量随反应时间的变化关系
8.小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃。为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
【设计实验】小君设计了如图的装置,该装置的圆底烧瓶中放入25mL水的目的是________________________________________。
【实验研究】第一组实验:取3只集气瓶,编号为①②③,分别装入15%、30%和45%的水,盖上盖玻片倒置在水槽中。当气泡_______放出后,导管口伸入集气瓶把其中的水全部排岀。将相同的3
支带火星竹签分别插入①-③号瓶中,记录下实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象。两组实验数据和现象见下表:
实验分组
第一组
第二组
实验序号
①
②
③
④
⑤
⑥
集气瓶装水的体积分数/%
15
30
45
34
38
42
带火星竹签状况
亮
很亮
复燃
很亮
复燃
复燃
得岀上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是________%。
【实验结论】再经过数次实验后,小君发现瓶内装水体积分数为35%时,木条恰好复燃,此时瓶内氧气的体积分数为________(精确至0.1%)。
【继续探究】小君认为该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进措施是________________________________________________。
9.关于催化剂的正确说法是(
)
A.使用催化剂可增加生成物的质量
B.使用催化剂反应速率一定加快
C.不用催化剂就不能发生化学反应
D.使用催化剂能改变物质化学反应速率
10.关于实验室用过氧化氢、氯酸钾、高锰酸钾制取氧气的反应,相同之处是(
)
A.都需要加热
B.都需要催化剂
C.都有氧化物生成
D.都属于分解反应
11.下图是创新实验小组对“MnO2催化H2O2分解实验装置的创新设计”,实验过程如下:
①一支球形干燥管水平放置,用滴管吸取3mLH2O2溶液加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥的进气管的管壁上。
②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象。
(1)可观察带到火星的棒香立即__________________;
(2)MnO2催化H2O2分解的文字表达式是________________________;
(3)下列各项是同学们对该创新实验的评价,为评价不合理的是___________(填序号)。
A.实验中所用的仪器、材料及药品均易得到
B.实验使用的药品用量太大
C.反应速率太慢,耽误时间
D.实验现象明显,整个装置好似点燃的灯塔,趣味性强
12.利用图示仪器测量氧气气体体积,实验步骤如下:
(1)检查气密性:连好发生装置后,将导管口的下端浸入水中,__________________。如果观察到导管口有气泡冒出,就证明装置不漏气。
(2)组装装置:连好的装置如甲图,其中有一处明显错误。在不移动、不调整酒精灯的前提下,需要调节___________(选填字母)螺母改正错误。
(3)进行实验:用正确的反应装置和图乙中的收集装置制取并收集气体。下列说法正确的是_________。
A.加热时间过短,会使测量结果不准
B.反应一段时间,排出反应装置内原有空气再连接乙装置收集气体,会使结果更准确
13.下列图像能正确反映实验室制取氧气有关量变化的是(
)
A.高锰酸钾制取氧气时固体剩余物质量与加热时间的关系
B.高锰酸钾制取氧气时二氧化锰质量与反应时间的关系
C.一定量的双氧水制取氧气时氧气质量与反应时间的关系
D.双氧水制氧气时氧气质量与双氧水用量的关系
14.某同学做了“用双氧水和二氧化锰制氧气”的实验后,探究H2O2的质量分数对H2O2分解反应速率的影响。可选试剂与仪器:质量分数为15%的H2O2、二氧化猛、蒸僧水、锥形瓶、双孔塞、水槽、
胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器、集气瓶。
(1)设计实验方案:在不同质量分数的H2O2下,测定_____________(要求所测得的数据能直接体现反应速率大小)。
(2)设计实验装置。如下图是未完成的实验装置示意图,在虚线框中可以选择下列哪些装置?
_____________。
为什么要把锥形瓶浸在恒温水浴槽中?__________________________。
(3)拟定实验表格:完整体现实验方案,要列出所选试剂体积或质量、需记录的待测量和所拟定的数据,数据用字母表示。请将下表补充完整:
15.下图虚线是采用质量分数为5%的H2O2溶液加热分解制取氧气的曲线,请你在该图中用实线画出添加催化剂制取氧气的大致曲线。
16.下列说法中,不正确的是(
)
A.在氯酸钾的分解反应中,二氧化锰起催化作用
B.要使过氧化氢分解放出氧气,必须加入二氧化锰,否则反应就不能发生
C.细铁丝在氧气中燃烧时,火星四射,生成黑色固体
D.制取气体时,要先检查装置的气密性,然后再装药品
17.从事科学实验的重要环节是进行科学实验的设计。请你按照以下科学实验的正确步骤和装置图,完成实验室常用“双氧水和二氧化锰制取氧气“的实验设计:
【步骤1】明确实验目的:在实验室里用双氧水和二氧化锰制取氧气。
【步骤2】收集有关资料:过氧化氢(H2O2)是一种无色液体,二氧化锰(MnO2)是一种黑色固体;
过氧化氢在二氧化锰的催化作用下,不需要加热,就能迅速分解出氧气,同时生成水:所以实验室常用这种方法来制取氧气。氧气的密度_____于(选填"大"或"小")空气的密度,且不易溶于水。
【步骤3】设计合理方案:应选用的发生装置是______________;应选用的收集装置是
______________。(选填装置图的序号)
【步骤4】进行科学实验:过氧化氢和二氧化锰混合制取氧气的文字表达式为________________属于______________反应。
【步骤5】用收集的氧气做铁丝在氧气中燃烧的实验:
请描述燃烧现象_________________________;文字表达式为:_____________________。
18.下图是某同学用高锰酸钾制取氧气的装置。
(1)此装置的错误有(至少说出3处):
①__________________________________________________;
②__________________________________________________;
③__________________________________________________。
(2)检验氧气是否已收集满的方法_________________________________。
19.如图表示一定质量的氯酸钾和二氧化锰固体混合物受热过程中,随时间的变化趋势,纵坐标表示的是(
)
A.固体中氧元素的质量
B.生成O2的质量
C.固体中MnO2的质量分数
D.固体中钾元素的质量
20.某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究活动,并填空:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了两组对比实验:
I.将3.0g氯酸钾和0.5g二氧化锰粉末均匀混合加热
II.将3.0g氯酸钾和X
g氧化铜粉末均匀混合加热
①在相同条件下比较上述两组实验产生氧气的快慢,实验II中X的值应为____________。
②若氧化铜可以催化氯酸钾分解,写出反应的文字表达式_________________________。
(2)乙同学探究“红砖粉末是否也可以作为过氧化氢分解的催化剂”。
【提出问题】红砖粉末能不能做“过氧化氢分解”的催化剂呢?
【做出猜想】红砖粉末能做“过氧化氢分解”的催化剂。
【实验验证】
实验步骤
实验现象
实验结论
①将带火星的木条伸入装有过氧化氢溶液的试管中
木条不复燃
常温下过氧化氢分解速率很慢
②在上述试管中加入0.2g红砖粉末,然后将带火
星的木条伸入试管中
木条复燃
①______________
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管
在化学反应前后,红砖粉末的②__________没有改变。
【实验讨论】
有同学认为:仅凭上述实验还不能证明红砖粉末能做过氧化氢分解的催化剂,还需要增加一个实验________________________________,则说明红砖粉末可以作为过氧化氢分解的催化剂。
【实验拓展】查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化齐啲说法中正确的是________________(填字母)。
A.催化剂能增加生成物的量
B.在工业生产中催化剂起到极大的作用
C.催化剂只能加快化学反应的速率
D.同一个化学反应可以有多种催化剂
21.某化学兴趣小组用如图所示的装置来制取干燥的氧气,并测定生成氧气的体积。装置气密性良好,图I中的锥形瓶内盛有质量为m的H2O2溶液,燃烧匙内装有二氧化锰,燃烧匙可以上下移动,干燥管内装有足量碱石灰(CaO和NaOH的混合物,可以干燥氧气)。下列说法正确的是(
)
A.将装置I分别与装置II、III、IV、V连接,均能达到实验目的
B.装置I反应可以控制反应的进程,并且可以得到干燥的氧气
C.若用装置IV收集氧气,可将带火星的木条放置在b导管口处验满
D.若用装置V测量生成氧气的体积,集气瓶上方原有的空气会使测量结果偏大
22.如图所示,过氧化氢(H2O2)在催化剂二氧化锰的作用下迅速分解放出大量氧气,下列想象正确的是(
)
A.出胀大,红墨水左移
B.床缩小,红墨水右移
C.气球胀大,红墨水右移
D.气球缩小,红墨水左移
23.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
下列有关实验中的说法错误的是(
)
A.实验2中应加入5%H2O2
40毫升
B.可通过相同的时间内注射器内气体的体积来比较H2O2分解反应速率的大小
C.实验2中因为水浴温度控制在80℃,所以测定的反应速率会比真实值偏大
D.实验结束后若要将MnO2从混合物中分离出来,可采取的方法是过滤、蒸发、结晶
24.小柯为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,井使用传感器测定收集到的氧气浓度,数据见表。
收集方法
向上排空气法
排水法
氧气浓度%
79.6
79.7
79.9
90.9
89.8
89.3
氧气平均浓度%
79.7
89.7
(1)小柯用向上排空气法收集氧气时,以能使放置在集气瓶瓶口的带火星木条复燃为氧气集满的标准;用排水法收集氧气时,以观察到__________________为氧气集满的标准。
(2)以上两种方法中,__________________法收集到的氧气更纯净。
(3)向上排空气法收集到的氧气浓度只有80%左右原因有__________________。
A.氧气的密度略大于空气的密度
B
.加热高锰酸钾固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
答案:
1.液化;液态氮
2.A
3.(1)A;B。
(2)B;A。
4.B
5.(1)加热过氧化氢溶液的同时,溶液中的水蒸气与氧气一同逸出,氧气含量小;
(2)长颈漏斗下端没有伸入液面
6.(1)高锰酸钾=加热=锰酸钾+二氧化锰+氧气;
(2)试管底部与灯芯接触,试管外壁有水珠、没有先预热;
(3)氧气不纯;
(4)C
7.B
8.稀释过氧化氢溶液,减缓过氧化氢的分解速率;
连续、均匀;36;
48.7%;
收集氧气前增加气体的干燥装置,在用排油法收集氧气。
9.D
10.D
11.(1)复燃;
(2)过氧化氢=二氧化锰=水+氧气
(3)BC
12.(1)用手紧握试管;
(2)AB;
(3)A。
13.D
14.(1)收集相同体积的氧气所需的时间或者相同时间所收集氧气的体积;
(2)BCD;排除温度对实验的影响;
(3)氧气体积/ml;时间/s;
a;b;
15.
16.B
17.大;
A;
D或者E;
过氧化氢=二氧化锰=水+氧气;
分解;
剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
铁+氧气=点燃=四氧化三铁。
18.试管口向下倾斜;
试管口没有塞棉花;
导管深入试管过长;
将带火星的木条放在集气瓶口,木条复燃则说明已收集满。
19.C
20.(1)①0.5;②氯酸钾=氧化铜/加热=氯化钾+氧气;
(2)①红砖粉末加速了过氧化氢的分解;②化学性质
【实验结论】将红砖粉末过滤洗涤烘干后,称得其质量仍为0.2g
【实验拓展】BD
21.B
22.D
23.D
24.(1)当气泡从瓶口冒出时或观察到瓶中水排尽时;
(2)排水;
(3)ACD。
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
