第2章 物质转化与材料利用 单元测试 自我综合评价--2021—2022学年浙教版九上科学(含答案)
文档属性
| 名称 | 第2章 物质转化与材料利用 单元测试 自我综合评价--2021—2022学年浙教版九上科学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 304.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-16 23:31:24 | ||
图片预览


文档简介
第2章自我综合评价
一、选择题(每小题3分,共45分)
1.[2019·杭州模拟]
制作下列常见的生活物品所用的主要材料属于金属材料的是
( )
2.下列说法不正确的是( )
A.聚乙烯塑料很难自然分解
B.淀粉[(C6H10O5)n]中氧元素和氢元素的质量比是8∶1
C.人体需要的维生素可以从蔬菜、水果中获得
D.海鲜食品可用甲醛溶液浸泡以保鲜
3.[2019·义乌模拟]
按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径。现有下列物质:①纯碱、②生石灰、③盐酸、④熟石灰、⑤甲烷、⑥铁、⑦石墨。对上述物质的分类正确的是( )
A.属于有机物的有③⑤
B.属于单质的有②⑥⑦
C.属于碱的有①④
D.属于氧化物的有②
4.铁在下列哪种情况下最容易生锈
( )
A.在干燥的空气中
B.部分浸入食盐水中
C.在潮湿的空气中
D.浸没在植物油中
5.如图所示,“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质,部分反应物、生成物及反应条件未标出。下列说法错误的是
( )
A.若甲是酸,乙和丙可以是金属
B.若甲是碳,乙和丙可以是氧化物
C.甲的物质类别只能是单质或酸
D.甲、乙、丙、丁可分属不同类别的物质
6.为了给三瓶失去标签的无色溶液Na2CO3、CaCl2、HCl溶液贴上正确的标签,某同学首先给三瓶溶液编号为A、B、C,然后用滴管分别取少量A、B、C溶液两两混合后产生如下现象:①A与B混合无明显现象;②A与C混合后产生白色沉淀;③B与C混合后产生气泡。由此该同学推断出A、B、C三种溶液分别是( )
A.Na2CO3、CaCl2、HCl溶液
B.CaCl2、Na2CO3、HCl溶液
C.CaCl2、HCl、Na2CO3溶液
D.HCl、CaCl2、Na2CO3溶液
7.用实验探究Al和Cu的金属活动性强弱,若提供的试剂只有CuCl2溶液、AlCl3溶液、Al、Cu和稀盐酸。下列有关说法正确的是( )
A.只能设计一种实验方案
B.CuCl2溶液是不可或缺的试剂
C.选用两种合适的试剂即可实现实验目的
D.向AlCl3溶液中加入Cu不能探究金属活动性强弱
8.[2019·上城区二模]
用纯净的木炭粉还原氧化铜粉末时,可能发生的化学反应是:C+2CuO2Cu+CO2↑,C+CuOCu+CO↑。某同学设计实验,欲证明氧化铜中含有氧元素,实验装置如图。有关说法不正确的是( )
A.实验前先通入N2的目的是排尽玻璃管中的空气,防止干扰实验
B.本实验能证明氧化铜中含氧元素的证据是澄清石灰水变浑浊
C.硬质玻璃管中黑色固体变红,可以证明氧化铜中含有氧元素
D.本实验的不足是没有处理尾气
9.如图所示装置可用于气体的收集、检验、除杂和体积的测量等,利用该装置,不能完成的实验是( )
A.气体从a端通入,收集氧气
B.瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳
C.瓶内装有适量水,除去氢气中混有的少量氯化氢气体
D.在b端接量筒,瓶内装满水,测量气体的体积
10.[2019·宁波]
将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中
( )
A.一定有银,可能有铜和锌
B.一定有银,可能有铜,一定没有锌
C.一定有银和铜,可能有锌
D.一定有银和铜,一定没有锌
11.[2019·杭州]
下列实验中,实验原理和主要操作方法都符合实验目的的是
( )
选项
实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
分离水与酒精的混合物
各成分的密度差异
蒸馏
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡快慢
D
除去硫酸亚铁和硫酸铜混合溶液中的硫酸铜
金属活动性差异
加过量铁粉,充分反应后过滤
12.[2019·富阳区模拟]
某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小金同学设计了如图所示方案(所加试剂均过量)。下列判断不正确的是
( )
A.固体a是混合物
B.溶液B中含有的盐是Ba(NO3)2
和
NaNO3
C.X可能是Na2CO3
D.若回收到6.4
g固体a,则加入的铁屑质量为
5.6
g
13.下列各组转化中,一定条件下均能一步实现的组合是( )
A.①②
B.②③
C.①③
D.①②③
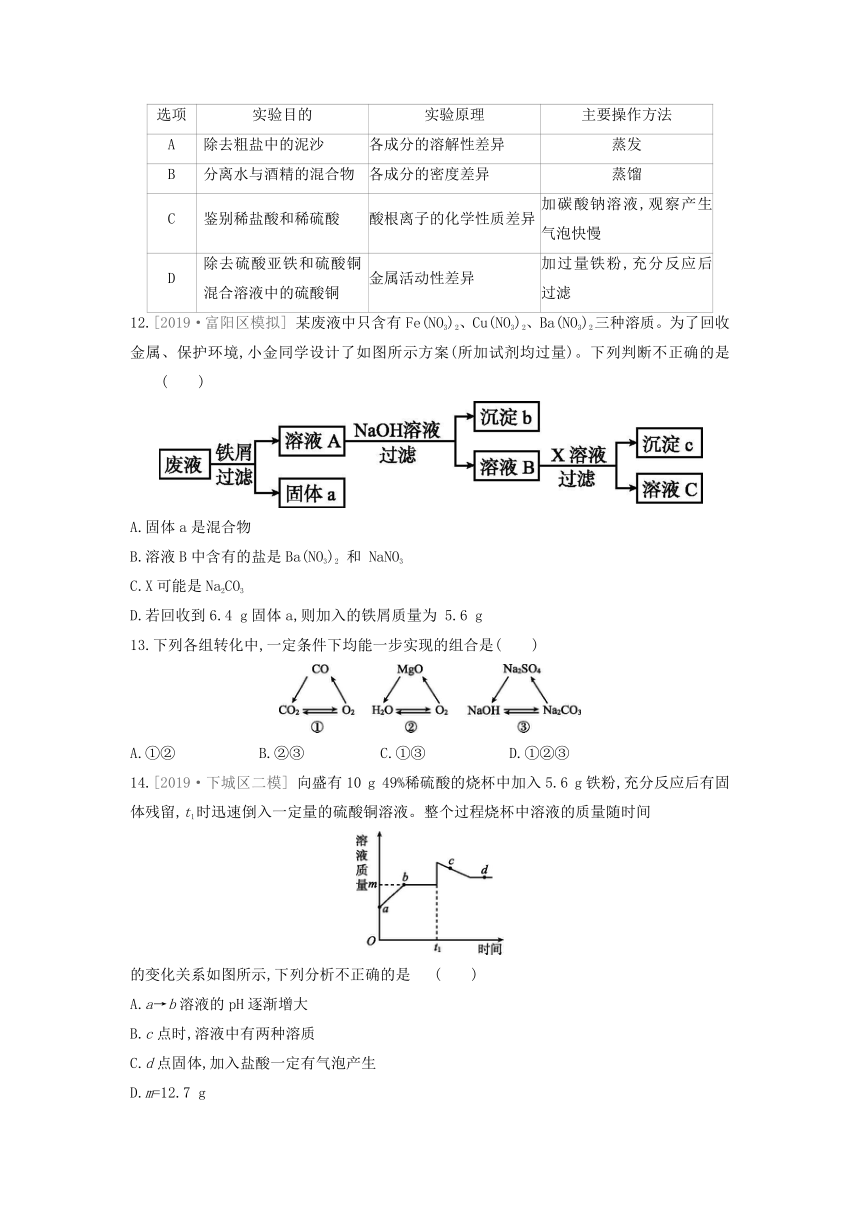
14.[2019·下城区二模]
向盛有10
g
49%稀硫酸的烧杯中加入5.6
g铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间
的变化关系如图所示,下列分析不正确的是
( )
A.a→b溶液的pH逐渐增大
B.c点时,溶液中有两种溶质
C.d点固体,加入盐酸一定有气泡产生
D.m=12.7
g
15.
下列各组物质的溶液,不另加试剂就不能鉴别出来的一组是
( )
A.CuSO4 NaOH KNO3
B.FeCl3 AgNO3 NaNO3
C.Na2CO3 HCl BaCl2
D.
CaCl2 K2CO3 NaCl
二、填空题(每空2分,共28分)
16.铁是生活中最常见的金属,根据图回答下列问题。
(1)不粘锅利用了铁的 (填“导电”或“导热”)性。?
(2)不粘锅手柄应选择热固性塑料制作,它属于 (填“金属”或“有机合成”)材料。?
(3)鸡蛋清提供的营养素主要是 (填字母)。?
A.糖类 B.油脂 C.蛋白质
(4)聚四氟乙烯内衬还能防止铁锅生锈,其原因是
。?
17.[2019·杭州]
某小组用耐强碱的反应管等仪器组装成如图所示实验装置,以研究高铜酸钠(NaCuO2)跟H2的反应,实验中观察到如下现象:①固体中出现紫红色物质;②试管中无水硫酸铜由白色变成蓝色。
请回答:
(1)经检验紫红色物质为一种金属单质,完成下列反应的化学方程式:2NaCuO2+3H22NaOH+
+ 。?
(2)若实验过程中包含下列步骤(没有根据操作顺序排列):①停止通H2;②通纯净H2排净装置内的空气;③点燃酒精灯加热;④熄灭酒精灯停止加热。正确的操作顺序是 。?
(3)根据题干中给出的实验现象 (填“①”或“②”)可直接判断氢气发生了化学变化。?
(4)完全反应后,为了测定固体中产物Cu的质量,要用蒸馏水多次洗涤后晾干、称重。在洗涤过程中判断洗涤干净的操作方法是 。?
18.客家围屋如同城堡,可以抵御外敌入侵。现有A、B、C、D、E
五种物质作为围屋的守护“卫士”,它们分别由氢、碳、氧、钠、钙中的两种或三种元素组成。五种物质间建立起如图
所示的关系才能组成守护的防线,其中物质A和B是常用的灭火剂。
(1)物质A的化学式为 。?
(2)生成物质D的化学方程式为?
。?
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是 。?
①铁
②稀盐酸
③氧化铁
④稀硫酸
(4)室温下,将稀盐酸慢慢滴入装有D溶液的烧杯中,利用温度传感器测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示。
①请解释xy段温度变化的原因: 。?
②在z处溶液中的溶质是 (填化学式)。?
三、实验探究题(共15分)
19.(6分)[2019·衢州]
某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其他成分对实验无干扰),开展了以下探究活动。
[提出问题]锡纸中的金属是什么?
[建立猜想]根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
[探究过程]
步骤
活动内容
收集证据
分析并得出结论
步骤一
①查阅资料:金属锌在室温下很脆
锡纸没有破损
锡纸中的金属不是锌
②取锡纸反复折叠
步骤二
用磁铁靠近锡纸
锡纸没有被磁铁吸引
锡纸中的金属不是?
步骤三
①取锡纸条放入浓度为20%的盐酸中,除去可能存在的氧化膜。当观察到 时,取出锡纸条并用蒸馏水清洗。②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察?
②中锡纸条表面无明显现象
说明锡纸中的金属活动性比锌弱,则锡纸中的金属不是铝,而是锡
[交流评价]
小科对实验结论提出怀疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO43Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变反应原理的前提下运用定量方法完善实验方案,并根据预期结果得出相应结论:?
? 。?
[继续探究]运用完善后的方案进行实验,分析实验结果,得出初步结论:锡纸中的金属是铝。
20.(9分)小明在学习了金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?
[提出问题]
镁是否能与水反应?
[实验探究]
在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图所示。
[反思与总结]
(1)小明得出的实验结论是
。?
(2)小明发现B试管放置在空气中一会儿,溶液的红色会褪去,这说明溶液的碱性减弱了,于是他大胆作出了一个猜想并设计了验证方案。
猜想
验证方案
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度减小,从而导致溶液的碱性减弱
将褪色后的溶液 ,如果溶液变红,说明小明的猜想正确?
小明通过实验证明了自己的猜想是正确的。
(3)一段时间后,小明观察到镁条在热水中无现象,但当他想到实验室制取二氧化碳不能用稀硫酸与大理石反应时,便有了解释,他的解释是
。?
四、解答题(共12分)
21.(6分)某科学兴趣小组同学为回收一块质量为40
g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去100
g稀硫酸,烧杯内剩余固体27
g。请完成下列分析和计算。
(1)40
g铜锌合金中锌的质量是 g。?
(2)计算所用稀硫酸中溶质的质量分数。
22.(6分)小莉同学家里有一只破损的手镯(银锌合金),她想探究此手镯中银的含量,于是请科学老师一起探究。首先称得手镯的质量为22.8
g,再用足量的稀硫酸分多次与此手镯充分反应,实验结果如下表。
实验次数
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
20
20
20
20
20
充分反应后剩余
固体质量/g
21.5
20.2
18.9
18.5
18.5
根据上表中的数据分析,完成下列问题。
(1)手镯中银的质量是 g。
?
(2)所用稀硫酸的溶质质量分数是多少?
1.D
2.D [解析]
甲醛溶液有毒,能破坏蛋白质的结构,使蛋白质变性,不能用来浸泡食品以保鲜。
3.D [解析]
有机物指含碳的化合物,碳的氧化物、碳酸、碳酸盐除外,盐酸中不含碳元素,不属于有机物。单质是由同种元素组成的纯净物,生石灰是由两种元素组成的纯净物,属于化合物。碱是电离时生成的阴离子全部是氢氧根离子的化合物,纯碱是碳酸钠,属于盐。
4.B
5.C [解析]
若甲是酸,乙和丙可以是活动性较强的金属,如锌和铁,则丁可以是氯化铜等;若甲是碳,则乙和丙可以是金属氧化物,如氧化铜、氧化铁,则丁是一氧化碳;甲不仅可以是酸或单质,还可以是盐,如碳酸钠,乙、丙分别是氢氧化钙和氢氧化钡中的一种,丁是二氧化碳;若甲是盐酸,乙是氢氧化钠,丙是铁,丁是氯化铜,也可满足图中反应与转化关系,即甲、乙、丙、丁可以是不同类别的物质。
6.C
7.C [解析]
对于Al和Cu的金属活动性的探究,题目给了CuCl2溶液、AlCl3溶液、Al、Cu和稀盐酸。可以设计的方案有:①Al、Cu和稀盐酸,Al可以与稀盐酸反应,得出Al>H,Cu和稀盐酸不反应,得出H>Cu,故Al>Cu;②Al、CuCl2溶液,Al可以置换出CuCl2溶液中的Cu,得出Al>Cu;③Cu、AlCl3溶液,Cu和AlCl3不反应;得出Al>Cu。
8.C [解析]
实验前先通入N2的目的是排尽玻璃管中的空气,防止氧气对证明氧化铜中含有氧元素造成干扰。二氧化碳中含有氧元素,二氧化碳使澄清石灰水变浑浊,可以证明氧化铜中含有氧元素。硬质玻璃管中黑色固体变红,说明生成了铜,不能证明氧化铜中含有氧元素。实验中可能有一氧化碳生成,一氧化碳有毒,会污染空气,本实验的不足是没有处理尾气。
9.D [解析]
氧气密度大于空气,气体从a端通入,可以收集氧气;瓶内装有澄清石灰水,从a端通入,可以检验氧气中是否混有二氧化碳;瓶内装有适量水,气体从a端通入,可以除去氢气中混有的少量氯化氢气体;在a端接量筒,瓶内装满水,可以测量气体的体积。
10.B [解析]
由于金属的活动性锌>铜>银,将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,锌先与硝酸银反应生成硝酸锌和银,当锌反应完后,铜再与硝酸银反应生成硝酸铜和银。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明滤渣中不含锌,滤液中不含硝酸银。所以滤渣中一定含有银,可能含有铜,一定没有锌。
11.D [解析]
根据各成分的溶解性差异,可以通过过滤除去粗盐中的泥沙,该选项操作方法不正确;根据沸点不同,通过蒸馏可以分离水与酒精的混合物,该选项实验原理不正确;稀盐酸和稀硫酸都能和碳酸钠反应生成二氧化碳气体,产生气泡快慢和酸溶液浓度有关,该选项实验原理、实验操作都不正确;加过量铁粉,由于金属活动性差异,即铁比铜活泼,可以除去硫酸亚铁、硫酸铜混合溶液中的硫酸铜,充分反应后过滤得到硫酸亚铁溶液,该选项实验原理、操作方法均正确。
12.D [解析]
由于铁的金属活动性强于铜,向废液中加入过量的铁屑,铁能与硝酸铜反应生成铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成氢氧化亚铁沉淀和硝酸钠。为了除去钡离子,应加入硫酸钠、碳酸钠等。若回收的6.4
g固体a全为铜,则加入的铁屑质量为5.6
g,但加入的铁屑过量,固体a中含铁屑和铜,加入铁屑的质量应大于5.6
g。
13.D
14.C [解析]
向盛有10
g
49%稀硫酸的烧杯中加入5.6
g铁粉,铁粉有剩余,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应,溶液的质量减小。由上述分析和图像可知,a→b溶液的酸性减弱,其pH逐渐增大;c点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种;由于硫酸铜的量不能确定,d点时,烧杯中固体一定有铜,可能有铁,加入盐酸不一定有气泡产生;设铁与硫酸反应时溶液增加的质量为x。
Fe+H2SO4FeSO4+H2↑ 溶液质量增加
56
98
2
56-2=54
10
g×49%
x
=
x=2.7
g
所以m=10
g+2.7
g=12.7
g。
15.D [解析]
硫酸铜溶液呈蓝色,将蓝色的硫酸铜溶液分别滴入剩余的两种无色溶液中,产生蓝色沉淀的是氢氧化钠溶液,无现象的是硝酸钾溶液,不另加试剂可以鉴别;氯化铁溶液呈黄色,将黄色的氯化铁溶液分别滴入剩余的两种无色溶液中,产生白色沉淀的是硝酸银溶液,无现象的是硝酸钠溶液,不另加试剂可以鉴别;C中任取一种无色溶液分别加入剩下的两种溶液中,当出现一种溶液中产生气泡,一种溶液中产生白色沉淀,可知加入的试剂是碳酸钠溶液,产生气泡的溶液是盐酸,产生沉淀的溶液是氯化钡,可以达到实验目的;氯化钙、碳酸钾、氯化钠溶液都是无色的,氯化钙与碳酸钾反应生成碳酸钙白色沉淀,氯化钠与氯化钙、碳酸钾均不发生反应,用组内的试剂无法鉴别出氯化钙和碳酸钾,如增加稀盐酸就可将三种试剂区别开来。
16.(1)导热
(2)有机合成
(3)C
(4)隔绝空气中的水蒸气和氧气
17.(1)2Cu 2H2O
(2)②③④①
(3)②
(4)取最后一次洗涤液,检测pH,若pH等于7,证明已洗涤干净(合理即可)
[解析]
(1)经检验紫红色物质为一种金属单质,根据质量守恒定律可知生成了铜,同时由于试管中无水硫酸铜由白色变为蓝色,说明生成了水,所以是高铜酸钠(NaCuO2)跟H2反应生成氢氧化钠、铜和水,配平得到对应的化学方程式为2NaCuO2+3H22NaOH+2Cu+2H2O。(2)由于氢气具有可燃性,与空气混合点燃可能发生爆炸,所以是先通后停,实验过程和一氧化碳还原氧化铜或氢气还原氧化铜相同。(3)根据题干中给出的实验现象②,可直接判断氢气发生了化学变化。(4)完全反应后,为了测定固体产物中Cu的质量,要用蒸馏水多次洗涤后晾干、称量。在洗涤环节中判断是否洗涤干净也就是看铜表面是否残留氢氧化钠,而氢氧化钠显碱性,所以可取最后一次洗涤液,检测pH是否等于7。
18.(1)CO2
(2)Ca(OH)2+Na2CO3CaCO3↓+2NaOH
(3)②④
(4)①氢氧化钠与盐酸反应放热
②NaCl和HCl
19.[探究过程]
铁 锡纸条表面产生较多气泡
[交流评价]
取一定量锡纸,用盐酸除去可能存在的氧化膜,取出后用蒸馏水清洗并晾干,称得质量为m1。将锡纸放入烧杯中,加入一定量饱和ZnSO4溶液浸没锡纸,充分反应后,取出锡纸用蒸馏水清洗并晾干,再次称得锡纸质量为m2。如果m2>m1,则锡纸中的金属为铝;如果m2=m1,则锡纸中的金属为锡
20.(1)镁不能与冷水反应,能与热水反应
(2)加热 (3)镁条表面覆盖了难溶于水的氢氧化镁导致反应终止
[解析]
(1)根据图可知,镁条放入冷水中,表面没有气泡产生,且加入酚酞试液也没有出现红色;而镁条加入热水中,镁条表面产生气泡,且加入酚酞试液变成了红色,由此可知,镁不能与冷水反应,能与热水反应。(2)因为猜想中提出了溶液褪色可能是因为温度降低造成的,所以可以将褪色后的溶液加热来观察其是否变红。(3)镁与水反应生成氢氧化镁白色沉淀和氢气,生成的氢氧化镁会覆盖在镁条的表面,阻碍反应的进一步发生。
21.(1)13
(2)解:设100
g稀硫酸中溶质的质量为x。
Zn
+
H2SO4ZnSO4+H2↑
65
98
13
g
x
=
x=19.6
g
稀硫酸中溶质的质量分数为×100%=19.6%。
答:所用稀硫酸中溶质的质量分数为19.6%。
22.(1)18.5
(2)解:设20
g稀硫酸中溶质的质量为x。
第1次反应时消耗锌的质量为
22.8
g-21.5
g=1.3
g。
Zn + H2SO4ZnSO4+H2↑
65
98
1.3
g
x
=
x=1.96
g
所用稀硫酸的溶质质量分数为×100%=9.8%。
答:所用稀硫酸的溶质质量分数是9.8%。
一、选择题(每小题3分,共45分)
1.[2019·杭州模拟]
制作下列常见的生活物品所用的主要材料属于金属材料的是
( )
2.下列说法不正确的是( )
A.聚乙烯塑料很难自然分解
B.淀粉[(C6H10O5)n]中氧元素和氢元素的质量比是8∶1
C.人体需要的维生素可以从蔬菜、水果中获得
D.海鲜食品可用甲醛溶液浸泡以保鲜
3.[2019·义乌模拟]
按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径。现有下列物质:①纯碱、②生石灰、③盐酸、④熟石灰、⑤甲烷、⑥铁、⑦石墨。对上述物质的分类正确的是( )
A.属于有机物的有③⑤
B.属于单质的有②⑥⑦
C.属于碱的有①④
D.属于氧化物的有②
4.铁在下列哪种情况下最容易生锈
( )
A.在干燥的空气中
B.部分浸入食盐水中
C.在潮湿的空气中
D.浸没在植物油中
5.如图所示,“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质,部分反应物、生成物及反应条件未标出。下列说法错误的是
( )
A.若甲是酸,乙和丙可以是金属
B.若甲是碳,乙和丙可以是氧化物
C.甲的物质类别只能是单质或酸
D.甲、乙、丙、丁可分属不同类别的物质
6.为了给三瓶失去标签的无色溶液Na2CO3、CaCl2、HCl溶液贴上正确的标签,某同学首先给三瓶溶液编号为A、B、C,然后用滴管分别取少量A、B、C溶液两两混合后产生如下现象:①A与B混合无明显现象;②A与C混合后产生白色沉淀;③B与C混合后产生气泡。由此该同学推断出A、B、C三种溶液分别是( )
A.Na2CO3、CaCl2、HCl溶液
B.CaCl2、Na2CO3、HCl溶液
C.CaCl2、HCl、Na2CO3溶液
D.HCl、CaCl2、Na2CO3溶液
7.用实验探究Al和Cu的金属活动性强弱,若提供的试剂只有CuCl2溶液、AlCl3溶液、Al、Cu和稀盐酸。下列有关说法正确的是( )
A.只能设计一种实验方案
B.CuCl2溶液是不可或缺的试剂
C.选用两种合适的试剂即可实现实验目的
D.向AlCl3溶液中加入Cu不能探究金属活动性强弱
8.[2019·上城区二模]
用纯净的木炭粉还原氧化铜粉末时,可能发生的化学反应是:C+2CuO2Cu+CO2↑,C+CuOCu+CO↑。某同学设计实验,欲证明氧化铜中含有氧元素,实验装置如图。有关说法不正确的是( )
A.实验前先通入N2的目的是排尽玻璃管中的空气,防止干扰实验
B.本实验能证明氧化铜中含氧元素的证据是澄清石灰水变浑浊
C.硬质玻璃管中黑色固体变红,可以证明氧化铜中含有氧元素
D.本实验的不足是没有处理尾气
9.如图所示装置可用于气体的收集、检验、除杂和体积的测量等,利用该装置,不能完成的实验是( )
A.气体从a端通入,收集氧气
B.瓶内装有澄清石灰水,检验氧气中是否混有二氧化碳
C.瓶内装有适量水,除去氢气中混有的少量氯化氢气体
D.在b端接量筒,瓶内装满水,测量气体的体积
10.[2019·宁波]
将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中
( )
A.一定有银,可能有铜和锌
B.一定有银,可能有铜,一定没有锌
C.一定有银和铜,可能有锌
D.一定有银和铜,一定没有锌
11.[2019·杭州]
下列实验中,实验原理和主要操作方法都符合实验目的的是
( )
选项
实验目的
实验原理
主要操作方法
A
除去粗盐中的泥沙
各成分的溶解性差异
蒸发
B
分离水与酒精的混合物
各成分的密度差异
蒸馏
C
鉴别稀盐酸和稀硫酸
酸根离子的化学性质差异
加碳酸钠溶液,观察产生气泡快慢
D
除去硫酸亚铁和硫酸铜混合溶液中的硫酸铜
金属活动性差异
加过量铁粉,充分反应后过滤
12.[2019·富阳区模拟]
某废液中只含有Fe(NO3)2、Cu(NO3)2、Ba(NO3)2三种溶质。为了回收金属、保护环境,小金同学设计了如图所示方案(所加试剂均过量)。下列判断不正确的是
( )
A.固体a是混合物
B.溶液B中含有的盐是Ba(NO3)2
和
NaNO3
C.X可能是Na2CO3
D.若回收到6.4
g固体a,则加入的铁屑质量为
5.6
g
13.下列各组转化中,一定条件下均能一步实现的组合是( )
A.①②
B.②③
C.①③
D.①②③
14.[2019·下城区二模]
向盛有10
g
49%稀硫酸的烧杯中加入5.6
g铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间
的变化关系如图所示,下列分析不正确的是
( )
A.a→b溶液的pH逐渐增大
B.c点时,溶液中有两种溶质
C.d点固体,加入盐酸一定有气泡产生
D.m=12.7
g
15.
下列各组物质的溶液,不另加试剂就不能鉴别出来的一组是
( )
A.CuSO4 NaOH KNO3
B.FeCl3 AgNO3 NaNO3
C.Na2CO3 HCl BaCl2
D.
CaCl2 K2CO3 NaCl
二、填空题(每空2分,共28分)
16.铁是生活中最常见的金属,根据图回答下列问题。
(1)不粘锅利用了铁的 (填“导电”或“导热”)性。?
(2)不粘锅手柄应选择热固性塑料制作,它属于 (填“金属”或“有机合成”)材料。?
(3)鸡蛋清提供的营养素主要是 (填字母)。?
A.糖类 B.油脂 C.蛋白质
(4)聚四氟乙烯内衬还能防止铁锅生锈,其原因是
。?
17.[2019·杭州]
某小组用耐强碱的反应管等仪器组装成如图所示实验装置,以研究高铜酸钠(NaCuO2)跟H2的反应,实验中观察到如下现象:①固体中出现紫红色物质;②试管中无水硫酸铜由白色变成蓝色。
请回答:
(1)经检验紫红色物质为一种金属单质,完成下列反应的化学方程式:2NaCuO2+3H22NaOH+
+ 。?
(2)若实验过程中包含下列步骤(没有根据操作顺序排列):①停止通H2;②通纯净H2排净装置内的空气;③点燃酒精灯加热;④熄灭酒精灯停止加热。正确的操作顺序是 。?
(3)根据题干中给出的实验现象 (填“①”或“②”)可直接判断氢气发生了化学变化。?
(4)完全反应后,为了测定固体中产物Cu的质量,要用蒸馏水多次洗涤后晾干、称重。在洗涤过程中判断洗涤干净的操作方法是 。?
18.客家围屋如同城堡,可以抵御外敌入侵。现有A、B、C、D、E
五种物质作为围屋的守护“卫士”,它们分别由氢、碳、氧、钠、钙中的两种或三种元素组成。五种物质间建立起如图
所示的关系才能组成守护的防线,其中物质A和B是常用的灭火剂。
(1)物质A的化学式为 。?
(2)生成物质D的化学方程式为?
。?
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是 。?
①铁
②稀盐酸
③氧化铁
④稀硫酸
(4)室温下,将稀盐酸慢慢滴入装有D溶液的烧杯中,利用温度传感器测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示。
①请解释xy段温度变化的原因: 。?
②在z处溶液中的溶质是 (填化学式)。?
三、实验探究题(共15分)
19.(6分)[2019·衢州]
某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其他成分对实验无干扰),开展了以下探究活动。
[提出问题]锡纸中的金属是什么?
[建立猜想]根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
[探究过程]
步骤
活动内容
收集证据
分析并得出结论
步骤一
①查阅资料:金属锌在室温下很脆
锡纸没有破损
锡纸中的金属不是锌
②取锡纸反复折叠
步骤二
用磁铁靠近锡纸
锡纸没有被磁铁吸引
锡纸中的金属不是?
步骤三
①取锡纸条放入浓度为20%的盐酸中,除去可能存在的氧化膜。当观察到 时,取出锡纸条并用蒸馏水清洗。②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察?
②中锡纸条表面无明显现象
说明锡纸中的金属活动性比锌弱,则锡纸中的金属不是铝,而是锡
[交流评价]
小科对实验结论提出怀疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO43Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变反应原理的前提下运用定量方法完善实验方案,并根据预期结果得出相应结论:?
? 。?
[继续探究]运用完善后的方案进行实验,分析实验结果,得出初步结论:锡纸中的金属是铝。
20.(9分)小明在学习了金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?
[提出问题]
镁是否能与水反应?
[实验探究]
在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图所示。
[反思与总结]
(1)小明得出的实验结论是
。?
(2)小明发现B试管放置在空气中一会儿,溶液的红色会褪去,这说明溶液的碱性减弱了,于是他大胆作出了一个猜想并设计了验证方案。
猜想
验证方案
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度减小,从而导致溶液的碱性减弱
将褪色后的溶液 ,如果溶液变红,说明小明的猜想正确?
小明通过实验证明了自己的猜想是正确的。
(3)一段时间后,小明观察到镁条在热水中无现象,但当他想到实验室制取二氧化碳不能用稀硫酸与大理石反应时,便有了解释,他的解释是
。?
四、解答题(共12分)
21.(6分)某科学兴趣小组同学为回收一块质量为40
g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去100
g稀硫酸,烧杯内剩余固体27
g。请完成下列分析和计算。
(1)40
g铜锌合金中锌的质量是 g。?
(2)计算所用稀硫酸中溶质的质量分数。
22.(6分)小莉同学家里有一只破损的手镯(银锌合金),她想探究此手镯中银的含量,于是请科学老师一起探究。首先称得手镯的质量为22.8
g,再用足量的稀硫酸分多次与此手镯充分反应,实验结果如下表。
实验次数
第1次
第2次
第3次
第4次
第5次
滴入稀硫酸的质量/g
20
20
20
20
20
充分反应后剩余
固体质量/g
21.5
20.2
18.9
18.5
18.5
根据上表中的数据分析,完成下列问题。
(1)手镯中银的质量是 g。
?
(2)所用稀硫酸的溶质质量分数是多少?
1.D
2.D [解析]
甲醛溶液有毒,能破坏蛋白质的结构,使蛋白质变性,不能用来浸泡食品以保鲜。
3.D [解析]
有机物指含碳的化合物,碳的氧化物、碳酸、碳酸盐除外,盐酸中不含碳元素,不属于有机物。单质是由同种元素组成的纯净物,生石灰是由两种元素组成的纯净物,属于化合物。碱是电离时生成的阴离子全部是氢氧根离子的化合物,纯碱是碳酸钠,属于盐。
4.B
5.C [解析]
若甲是酸,乙和丙可以是活动性较强的金属,如锌和铁,则丁可以是氯化铜等;若甲是碳,则乙和丙可以是金属氧化物,如氧化铜、氧化铁,则丁是一氧化碳;甲不仅可以是酸或单质,还可以是盐,如碳酸钠,乙、丙分别是氢氧化钙和氢氧化钡中的一种,丁是二氧化碳;若甲是盐酸,乙是氢氧化钠,丙是铁,丁是氯化铜,也可满足图中反应与转化关系,即甲、乙、丙、丁可以是不同类别的物质。
6.C
7.C [解析]
对于Al和Cu的金属活动性的探究,题目给了CuCl2溶液、AlCl3溶液、Al、Cu和稀盐酸。可以设计的方案有:①Al、Cu和稀盐酸,Al可以与稀盐酸反应,得出Al>H,Cu和稀盐酸不反应,得出H>Cu,故Al>Cu;②Al、CuCl2溶液,Al可以置换出CuCl2溶液中的Cu,得出Al>Cu;③Cu、AlCl3溶液,Cu和AlCl3不反应;得出Al>Cu。
8.C [解析]
实验前先通入N2的目的是排尽玻璃管中的空气,防止氧气对证明氧化铜中含有氧元素造成干扰。二氧化碳中含有氧元素,二氧化碳使澄清石灰水变浑浊,可以证明氧化铜中含有氧元素。硬质玻璃管中黑色固体变红,说明生成了铜,不能证明氧化铜中含有氧元素。实验中可能有一氧化碳生成,一氧化碳有毒,会污染空气,本实验的不足是没有处理尾气。
9.D [解析]
氧气密度大于空气,气体从a端通入,可以收集氧气;瓶内装有澄清石灰水,从a端通入,可以检验氧气中是否混有二氧化碳;瓶内装有适量水,气体从a端通入,可以除去氢气中混有的少量氯化氢气体;在a端接量筒,瓶内装满水,可以测量气体的体积。
10.B [解析]
由于金属的活动性锌>铜>银,将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,锌先与硝酸银反应生成硝酸锌和银,当锌反应完后,铜再与硝酸银反应生成硝酸铜和银。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明滤渣中不含锌,滤液中不含硝酸银。所以滤渣中一定含有银,可能含有铜,一定没有锌。
11.D [解析]
根据各成分的溶解性差异,可以通过过滤除去粗盐中的泥沙,该选项操作方法不正确;根据沸点不同,通过蒸馏可以分离水与酒精的混合物,该选项实验原理不正确;稀盐酸和稀硫酸都能和碳酸钠反应生成二氧化碳气体,产生气泡快慢和酸溶液浓度有关,该选项实验原理、实验操作都不正确;加过量铁粉,由于金属活动性差异,即铁比铜活泼,可以除去硫酸亚铁、硫酸铜混合溶液中的硫酸铜,充分反应后过滤得到硫酸亚铁溶液,该选项实验原理、操作方法均正确。
12.D [解析]
由于铁的金属活动性强于铜,向废液中加入过量的铁屑,铁能与硝酸铜反应生成铜和硝酸亚铁,过滤时得到的固体a中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸亚铁能与氢氧化钠反应生成氢氧化亚铁沉淀和硝酸钠。为了除去钡离子,应加入硫酸钠、碳酸钠等。若回收的6.4
g固体a全为铜,则加入的铁屑质量为5.6
g,但加入的铁屑过量,固体a中含铁屑和铜,加入铁屑的质量应大于5.6
g。
13.D
14.C [解析]
向盛有10
g
49%稀硫酸的烧杯中加入5.6
g铁粉,铁粉有剩余,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应,溶液的质量减小。由上述分析和图像可知,a→b溶液的酸性减弱,其pH逐渐增大;c点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种;由于硫酸铜的量不能确定,d点时,烧杯中固体一定有铜,可能有铁,加入盐酸不一定有气泡产生;设铁与硫酸反应时溶液增加的质量为x。
Fe+H2SO4FeSO4+H2↑ 溶液质量增加
56
98
2
56-2=54
10
g×49%
x
=
x=2.7
g
所以m=10
g+2.7
g=12.7
g。
15.D [解析]
硫酸铜溶液呈蓝色,将蓝色的硫酸铜溶液分别滴入剩余的两种无色溶液中,产生蓝色沉淀的是氢氧化钠溶液,无现象的是硝酸钾溶液,不另加试剂可以鉴别;氯化铁溶液呈黄色,将黄色的氯化铁溶液分别滴入剩余的两种无色溶液中,产生白色沉淀的是硝酸银溶液,无现象的是硝酸钠溶液,不另加试剂可以鉴别;C中任取一种无色溶液分别加入剩下的两种溶液中,当出现一种溶液中产生气泡,一种溶液中产生白色沉淀,可知加入的试剂是碳酸钠溶液,产生气泡的溶液是盐酸,产生沉淀的溶液是氯化钡,可以达到实验目的;氯化钙、碳酸钾、氯化钠溶液都是无色的,氯化钙与碳酸钾反应生成碳酸钙白色沉淀,氯化钠与氯化钙、碳酸钾均不发生反应,用组内的试剂无法鉴别出氯化钙和碳酸钾,如增加稀盐酸就可将三种试剂区别开来。
16.(1)导热
(2)有机合成
(3)C
(4)隔绝空气中的水蒸气和氧气
17.(1)2Cu 2H2O
(2)②③④①
(3)②
(4)取最后一次洗涤液,检测pH,若pH等于7,证明已洗涤干净(合理即可)
[解析]
(1)经检验紫红色物质为一种金属单质,根据质量守恒定律可知生成了铜,同时由于试管中无水硫酸铜由白色变为蓝色,说明生成了水,所以是高铜酸钠(NaCuO2)跟H2反应生成氢氧化钠、铜和水,配平得到对应的化学方程式为2NaCuO2+3H22NaOH+2Cu+2H2O。(2)由于氢气具有可燃性,与空气混合点燃可能发生爆炸,所以是先通后停,实验过程和一氧化碳还原氧化铜或氢气还原氧化铜相同。(3)根据题干中给出的实验现象②,可直接判断氢气发生了化学变化。(4)完全反应后,为了测定固体产物中Cu的质量,要用蒸馏水多次洗涤后晾干、称量。在洗涤环节中判断是否洗涤干净也就是看铜表面是否残留氢氧化钠,而氢氧化钠显碱性,所以可取最后一次洗涤液,检测pH是否等于7。
18.(1)CO2
(2)Ca(OH)2+Na2CO3CaCO3↓+2NaOH
(3)②④
(4)①氢氧化钠与盐酸反应放热
②NaCl和HCl
19.[探究过程]
铁 锡纸条表面产生较多气泡
[交流评价]
取一定量锡纸,用盐酸除去可能存在的氧化膜,取出后用蒸馏水清洗并晾干,称得质量为m1。将锡纸放入烧杯中,加入一定量饱和ZnSO4溶液浸没锡纸,充分反应后,取出锡纸用蒸馏水清洗并晾干,再次称得锡纸质量为m2。如果m2>m1,则锡纸中的金属为铝;如果m2=m1,则锡纸中的金属为锡
20.(1)镁不能与冷水反应,能与热水反应
(2)加热 (3)镁条表面覆盖了难溶于水的氢氧化镁导致反应终止
[解析]
(1)根据图可知,镁条放入冷水中,表面没有气泡产生,且加入酚酞试液也没有出现红色;而镁条加入热水中,镁条表面产生气泡,且加入酚酞试液变成了红色,由此可知,镁不能与冷水反应,能与热水反应。(2)因为猜想中提出了溶液褪色可能是因为温度降低造成的,所以可以将褪色后的溶液加热来观察其是否变红。(3)镁与水反应生成氢氧化镁白色沉淀和氢气,生成的氢氧化镁会覆盖在镁条的表面,阻碍反应的进一步发生。
21.(1)13
(2)解:设100
g稀硫酸中溶质的质量为x。
Zn
+
H2SO4ZnSO4+H2↑
65
98
13
g
x
=
x=19.6
g
稀硫酸中溶质的质量分数为×100%=19.6%。
答:所用稀硫酸中溶质的质量分数为19.6%。
22.(1)18.5
(2)解:设20
g稀硫酸中溶质的质量为x。
第1次反应时消耗锌的质量为
22.8
g-21.5
g=1.3
g。
Zn + H2SO4ZnSO4+H2↑
65
98
1.3
g
x
=
x=1.96
g
所用稀硫酸的溶质质量分数为×100%=9.8%。
答:所用稀硫酸的溶质质量分数是9.8%。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
