1.4化学方程式的简单计算培优练习——2021-2022学年华东师大版科学九年级上学期(含答案)
文档属性
| 名称 | 1.4化学方程式的简单计算培优练习——2021-2022学年华东师大版科学九年级上学期(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 162.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-16 16:38:57 | ||
图片预览




文档简介
2021-2022学年华师大版科学化学方程式的简单计算培优练习
一.选择题(共3小题)
1.氢气和氧气的混合气体12g,点燃充分反应后,还剩余了3g氢气,则混合气体中含有氢气( )g.
A.4
B.5
C.6
D.7
2.在2A+B=C+D的反应中,用40g的A与足量的B充分反应,生成53g的C和9g的D,已知A物质的相对分子质量为40,则B的相对分子质量是( )
A.22
B.33
C.44
D.66
3.某同学为了测定黄铜屑(由锌和铜形成的合金)样品的组成,取4份黄铜屑分别加稀硫酸反应,其实验数据记录如下表.下列关于第三组样品相关说法正确的是( )
样品
第一组
第二组
第三组
第四组
黄铜屑质量g
25.0
25.0
25.0
25.0
稀硫酸质量g
20.0
40.0
60.0
80.0
产生气体质量g
0.2
0.4
0.5
0.5
A.锌有剩余稀硫酸反应完
B.稀硫酸有剩余锌反应完
C.锌和稀硫酸刚好反应完
D.铜和锌都反应完
二.填空题(共5小题)
4.加热氯酸钾和二氧化锰的混合物10g,使其完全反应.在一定温度下,向反应后固体中加5g水,充分溶解.过滤后得饱和溶液7g,将滤纸上剩余物干燥后称量为5.12g,且剩余物为混合物.(提示:二氧化锰不溶解于水)求:
(1)生成氧气的质量为 g.
(2)原混合物中氯酸钾的质量分数.
5.向盛有22.3
g
Na2CO3和NaCl固体混合物的烧杯中加入216.1g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300
g.
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 s
(2)完全反应后,产生二氧化碳气体质量 g.
(3)反应后,得到室温下的不饱和溶液.所得溶液中溶质的质量分数为多少?
6.实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数.现取8g稀硫酸样品,将10%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液液的pH的变化如图所示.试回答:
(1)a点溶液中含有的溶质有
(填化学式);此时,滴加
,溶液变成红色;
溶液恰好中和,则该溶液中的溶质是
(填化学式)
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为
.
(3)计算稀硫酸中的溶质质量分数.
7.某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,并将60g稀盐酸分四次加入,每次加入情况如表,请回答下列问题:
实验次数
一
二
三
四
所加盐酸的量/g
15
15
15
15
产生气体的质量/g
1.32
1.32
m
0.44
(1)m的值是
;
(2)纯碱样品中的Na2CO3的质量分数是多少?(计算结果保留1位小数).
8.某兴趣小组从废铝锅底部剪一块铝片,将它放入20%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其他杂质不与酸反应).请回答:
(1)从图中看出,该反应产生了H2
g.
(2)产生氢气的化学方程式为:
;铝片中铝单质的质量为
.
三.计算题(共8小题)
9.(2011春?潍坊月考)小强同学前往某地的石灰石矿区进行调查,他取回了若干矿石样品,对样品中碳酸钙的质量分数进行监测,采取了以下办法:取用8克这种石灰石样品,把40克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中所含的杂质不溶于水,也不与盐酸反应)
请计算:
(1)如表中
m的数值是
序号
加入稀盐酸的质量/g
剩余固体质量/g
第一次
10
5.5
第二次
10
m
第三次
10
1.2
第四次
10
1.2
(2)石灰石样品中碳酸钙的质量分数是 (写出简单计算过程)
(3)要制得280千克的氧化钙,需要质量分数为80%的石灰石多少千克?
10.为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80mL(密度为1.1g/cm3)的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的体积与反应后剩余固体的质量见下表.
次
数
一
二
三
四
加入盐酸的体积/mL
20
20
20
20
剩余固体的质量/g
14
8
3
3
计算:(1)样品中杂质的质量是
克.
(2)样品中碳酸钙的质量分数?
(3)20g此样品与足量盐酸反应最多生成二氧化碳的质量?
11.实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃
时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.计算当滴入碳酸钠溶液至100g时,所得溶液中溶质质量分数.
12.取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。
13.碳酸氢钠是小苏打的主要成分。在医疗上,它是治疗胃酸(主要成分是盐酸)过多的药剂之一,反应的化学方程式:NaHCO3+HCl═NaCl+H2O+CO2↑,化学实验小组取27g小苏打样品(含有少量不与HCl反应的杂质)进行测定实验。现将小苏打样品平均分为3份,分别进行3次实验。实验数据如表。
实验次数
第一次
第二次
第三次
小苏打样品的质量/g
9
9
9
加入稀盐酸的质量/g
50
100
150
生成气体的质量/g
2.2
4.4
4.4
(1)第 次实验中NaHCO3和HCl恰好完全反应。
(2)计算27g小苏打样品中碳酸氢钠的质量。(写出计算过程。结果精确到0.1g)
14.今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数
第一次
第二次
第三次
加入稀硫酸质量/g
20
20
20
生成氢气的质量/g
0.08
0.08
0.04
试计算:
(1)共制得氢气 g和共加入 g锌粒。
(2)实验所用稀硫酸中溶质的质量分数。(写出计算过程)
15.氢氧化钙久置会逐渐变质为碳酸钙。实验室有一瓶部分变质的氢氧化钙样品,为测定其中碳酸钙的质量分数,取16.2g样品于烧杯中,加足量的水,再将100g稀盐酸逐渐缓慢加入烧杯中并不断搅拌,获得相关数据如表(提示:氢氧化钙先与盐酸反应时无气体产生),请回答问题并计算。
加入稀盐酸的质量/g
20.0
40.0
60.0
80.0
100
生成CO2的质量/g
0
2.2
4.4
m
5.5
(1)氢氧化钙变质是它与空气中的 发生了反应。
(2)表中m的数值为 。
(3)试计算样品中碳酸钙的质量分数(请在答题卡上写出计算过程,计算结果精确到0.1%)。
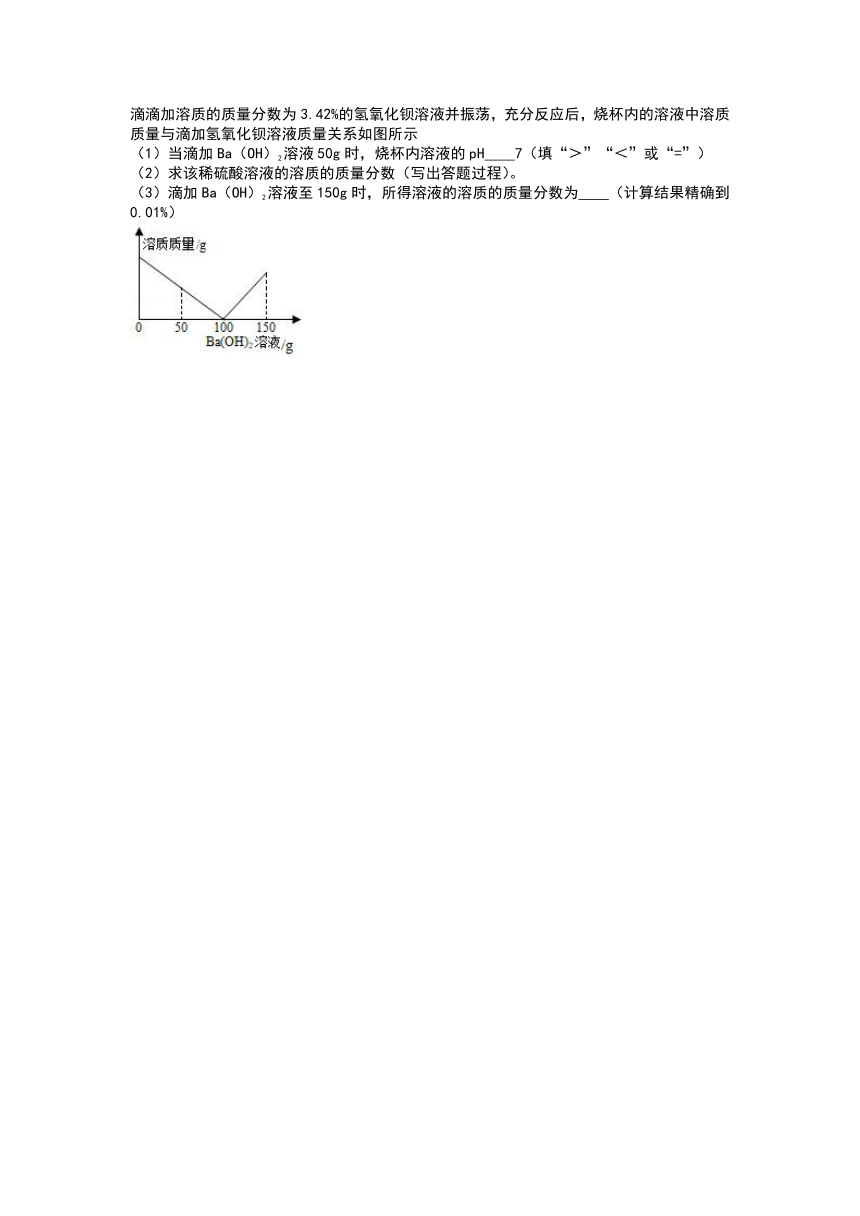
(4)请在坐标中画出加入稀盐酸的质量与生成CO2的质量之间的变化关系图。
16.某化学兴趣小组对失去标签的稀硫酸溶液的浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加溶质的质量分数为3.42%的氢氧化钡溶液并振荡,充分反应后,烧杯内的溶液中溶质质量与滴加氢氧化钡溶液质量关系如图所示
(1)当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH 7(填“>”“<”或“=”)
(2)求该稀硫酸溶液的溶质的质量分数(写出答题过程)。
(3)滴加Ba(OH)2溶液至150g时,所得溶液的溶质的质量分数为 (计算结果精确到0.01%)
2021-2022学年华师大版科学化学方程式的简单计算培优练习
参考答案与试题解析
一.选择题(共3小题)
1.A.
2.C.
3.B.
二.填空题(共5小题)
4.解:(1)处理前的总质量为10g+5g,变化后和溶解后总计7g+5.12g.差值为氧气的质量:(10g+5g)﹣(7g+5.12g)=2.88g
故答案为:2.88
(2)设10g混合物中氯酸钾的质量为x
2KClO32KCl+3O2↑
245
96
x
2.88g
x=7.35g
原混合物中氯酸钾的质量分数为×100%=73.5%
答:原混合物中氯酸钾的质量分数为73.5%
5.解:(1)从反应物之间关系的曲线图可以看出,到20s时,反应曲线变成直线,说明反应物和生成物的质量不再变化,说明此时已是完全反应,故答案为:20.
(2)300g﹣259.6g=4.4g.故答案为:4.4.
(3)解:设参与反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+CO2↑+H2O.
106
117
44
x
y
4.4g
∴,
解得:x=10.6g,y=11.7g,
烧杯里不饱和溶液中溶质总质量为:11.7g+(22.3g﹣10.6g)=23.4g,
烧杯里不饱和溶液的质量为:22.3g+216.1g﹣4.4g=234g,
所得不饱和溶液的溶质质量分数:×100%=10%.
答:所得溶液中溶质的质量分数为10%.
6.解:(1)据图可以看出,a点时盐酸没有消耗尽,故含有的溶质是硫酸和生成的硫酸钠,此时滴加石蕊试液变红;溶液恰好中和,则含有的溶质是硫酸钠,故填:H2SO4、Na2SO4,石蕊试液,Na2SO4;
(2)据图可以看出,溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×10%=1.6g,故填:1.6g;
(2)8g稀硫酸样品含有H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80
98
1.6g
x
解得:x=1.96g
稀H2SO4的溶质质量分数为:×100%=24.5%
答:稀硫酸中的溶质质量分数为24.5%.
7.解:(1)由图可知,每加入15g盐酸生成1.32g二氧化碳,第四次加入盐酸仍有气体生成,说明第三次中的盐酸全部反应,生成1.32g二氧化碳气体,则m的值为1.32;
故答案为:1.32;
(2)第四次加入的盐酸有剩余,则12g样品完全反应生成二氧化碳的量为:1.32g+1.32g+1.32g+0.44g=4.4g;
设纯碱样品中的Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106
44
x
4.4g
x=10.6g
纯碱样品中的Na2CO3的质量分数是:≈88.3%
答:纯碱样品中的Na2CO3的质量分数是88.3%.
8.解:(1)由产生氢气的质量与消耗盐酸的质量图,可得生成氢气质量为1.2g;
(2)未变质的铝与盐酸发生置换反应,生成氯化铝和氢气,反应的化学方程式为2Al+6HCl═2AlCl3+3H2↑;
设铝片中铝单质的质量为x
2Al+6HCl═2AlCl3+3H2↑
54
6
x
1.2g
解得:x=10.8g
故答为:(1)1.2;(2)2Al+6HCl═2AlCl3+3H2↑;10.8g.
三.计算题(共8小题)
9.解:(1)较第一次和第三次的数据可知第一次中盐酸完全反应,消耗碳酸钙8g﹣5.5g=2.5g,因此第二次中也是消耗2.5g碳酸钙,所以用第一次的剩余固体质量减去第二次消耗的碳酸钙的质量就是第二次剩余固体的质量.m=5.5g﹣(8g﹣5.5g)=3g
(2)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g,样品中碳酸钙的质量分数为×100%=85%
(3)设需要石灰石的质量为x.
CaCO3CaO+CO2↑
100
56
x×80%
280Kg
x=625Kg
答案:
(1)3;
(2)85%,
(3)需要石灰石的质量为625kg.
10.解:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙20g﹣14g=6g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有3g杂质;故填:3;
(2)碳酸钙质量为20g﹣3g=17g,所以碳酸钙质量分数为:×100%=85%;
(3)设17g的碳酸钙生成二氧化碳为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100
44
17g
x
x=7.48g
20g此样品与足量盐酸反应最多生成二氧化碳的质量为7.48g.
11.解:设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106
117
44
50g×10.6%
x
y
x=5.85g,y=2.2g
设与氯化钙反应时,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
100
117
5g
w
w=5.85g
所得溶液中氯化钠的质量分数为:=5%
答:所得溶液中氯化钠的质量分数为5%.
12.解:(1)产生沉淀的质量为9.85g。
故填:9.85。
(2)设53g碳酸钠溶液中碳酸钠质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106
197
x
9.85g
=,
x=5.3g,
由图中数据可知,和稀盐酸反应的碳酸钠溶液质量是53g,设生成二氧化碳质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106
44
5.3g
y
=,
y=2.2g,
x的值为2.2。
(3)所用碳酸钠溶液中溶质的质量分数是:×100%=10%,
答:所用碳酸钠溶液中溶质的质量分数是10%。
13.解:(1)分析表中数据可知第一次9g碳酸氢钠样品与50g盐酸反应生成2.2g二氧化碳,第二次9g碳酸氢钠样品与100g盐酸反应生成4.4g二氧化碳,第三次9g碳酸氢钠样品与150g盐酸反应也生成4.4g二氧化碳,说明9g碳酸氢钠样品与100g盐酸恰好反应生成4.4g二氧化碳,所以第二次实验中NaHCO3和HCl恰好完全反应,故填:二;
(2)设9g小苏打样品中碳酸氢钠的质量为x
NaHCO3+HCl=NaCl+H2O+CO2↑
84
44
x
4.4g
=
x=8.4g
则27g小苏打样品中碳酸氢钠的质量8.4g×3=25.2g
答:27g小苏打样品中碳酸氢钠的质量25.2g。
14.解:根据前两次都是生成0.08g氢气,而第三次只生成0.04g氢气,说明金属已经完全反应,生成氢气的总质量为0.08g+0.08g+0.04g=0.2g
设锌的质量为x
Zn+H2SO4═Zn
SO4+H2↑
65
2
x
0.2g
=
x=6.5g
设
稀硫酸中溶质的质量分数为y
20g稀硫酸对应0.08g氢气生成
Zn+H2SO4═ZnSO4+H2↑
98
2
20gy
0.08g
x=19.6%
故答案为:
(1)0.2;6.5g;
(2)19.6%。
15.解:(1)氢氧化钙易与空气中的二氧化碳反应生成碳酸钙和水而变质。
故填:二氧化碳。
(2)分析表中数据可知,部分变质的氢氧化钙样品,开始加入20g稀盐酸时,产生二氧化碳质量为0,说明与氢氧化钙反应,后面每加入20g稀盐酸产生2.2g二氧化碳,如果加80g稀盐酸完全反应,会产生6.6g二氧化碳,加入100g稀盐酸时产生5.5g二氧化碳,说明加入80g稀盐酸时,碳酸钙已完全反应,故加入80g稀盐酸时产生二氧化碳的质量为5.5g,
故填:5.5。
(3)设样品中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑,
100
44
x
5.5g
,
x=12.5g,
样品中碳酸钙质量分数==77.2%,
答:样品中碳酸钙质量分数为77.2%。
(4)加入20g稀盐酸时产生气体二氧化碳,加入70g稀盐酸时碳酸钙完全反应,不再产生气体,加入稀盐酸的质量与生成CO2的质量之间的变化关系图如下所示:
16.解:(1)根据图象可以看出,当氢氧化钡溶液为50g时,稀硫酸没有全部反应,溶液呈酸性,pH<7;
(2)设该硫酸溶液的溶质的质量分数为x,生成沉淀的质量为y。
H2SO4+Ba(OH)2=BaSO4↓+2H2O
98
171
233
50g×x
100g×3.42%
y
解得:x=3.92%
解得:y=4.66g
(3)滴加Ba(OH)2溶液至150g时,所得溶液的溶质的质量分数为:≈0.88%
故答为:(1)>;(2)该硫酸溶液的溶质质量分数为
3.92%;(3)0.88%。
一.选择题(共3小题)
1.氢气和氧气的混合气体12g,点燃充分反应后,还剩余了3g氢气,则混合气体中含有氢气( )g.
A.4
B.5
C.6
D.7
2.在2A+B=C+D的反应中,用40g的A与足量的B充分反应,生成53g的C和9g的D,已知A物质的相对分子质量为40,则B的相对分子质量是( )
A.22
B.33
C.44
D.66
3.某同学为了测定黄铜屑(由锌和铜形成的合金)样品的组成,取4份黄铜屑分别加稀硫酸反应,其实验数据记录如下表.下列关于第三组样品相关说法正确的是( )
样品
第一组
第二组
第三组
第四组
黄铜屑质量g
25.0
25.0
25.0
25.0
稀硫酸质量g
20.0
40.0
60.0
80.0
产生气体质量g
0.2
0.4
0.5
0.5
A.锌有剩余稀硫酸反应完
B.稀硫酸有剩余锌反应完
C.锌和稀硫酸刚好反应完
D.铜和锌都反应完
二.填空题(共5小题)
4.加热氯酸钾和二氧化锰的混合物10g,使其完全反应.在一定温度下,向反应后固体中加5g水,充分溶解.过滤后得饱和溶液7g,将滤纸上剩余物干燥后称量为5.12g,且剩余物为混合物.(提示:二氧化锰不溶解于水)求:
(1)生成氧气的质量为 g.
(2)原混合物中氯酸钾的质量分数.
5.向盛有22.3
g
Na2CO3和NaCl固体混合物的烧杯中加入216.1g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300
g.
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 s
(2)完全反应后,产生二氧化碳气体质量 g.
(3)反应后,得到室温下的不饱和溶液.所得溶液中溶质的质量分数为多少?
6.实验室欲测定一瓶标签破损的稀硫酸的溶质质量分数.现取8g稀硫酸样品,将10%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液液的pH的变化如图所示.试回答:
(1)a点溶液中含有的溶质有
(填化学式);此时,滴加
,溶液变成红色;
溶液恰好中和,则该溶液中的溶质是
(填化学式)
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为
.
(3)计算稀硫酸中的溶质质量分数.
7.某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,并将60g稀盐酸分四次加入,每次加入情况如表,请回答下列问题:
实验次数
一
二
三
四
所加盐酸的量/g
15
15
15
15
产生气体的质量/g
1.32
1.32
m
0.44
(1)m的值是
;
(2)纯碱样品中的Na2CO3的质量分数是多少?(计算结果保留1位小数).
8.某兴趣小组从废铝锅底部剪一块铝片,将它放入20%的稀盐酸中,产生氢气的质量与消耗盐酸的质量如图(假设酸与氧化膜反应时没有H2产生,其他杂质不与酸反应).请回答:
(1)从图中看出,该反应产生了H2
g.
(2)产生氢气的化学方程式为:
;铝片中铝单质的质量为
.
三.计算题(共8小题)
9.(2011春?潍坊月考)小强同学前往某地的石灰石矿区进行调查,他取回了若干矿石样品,对样品中碳酸钙的质量分数进行监测,采取了以下办法:取用8克这种石灰石样品,把40克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中所含的杂质不溶于水,也不与盐酸反应)
请计算:
(1)如表中
m的数值是
序号
加入稀盐酸的质量/g
剩余固体质量/g
第一次
10
5.5
第二次
10
m
第三次
10
1.2
第四次
10
1.2
(2)石灰石样品中碳酸钙的质量分数是 (写出简单计算过程)
(3)要制得280千克的氧化钙,需要质量分数为80%的石灰石多少千克?
10.为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80mL(密度为1.1g/cm3)的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的体积与反应后剩余固体的质量见下表.
次
数
一
二
三
四
加入盐酸的体积/mL
20
20
20
20
剩余固体的质量/g
14
8
3
3
计算:(1)样品中杂质的质量是
克.
(2)样品中碳酸钙的质量分数?
(3)20g此样品与足量盐酸反应最多生成二氧化碳的质量?
11.实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃
时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.计算当滴入碳酸钠溶液至100g时,所得溶液中溶质质量分数.
12.取氯化钡和盐酸的混合溶液100g于烧杯中,向其中滴加碳酸钠溶液,产生气体或沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答:
(1)产生沉淀的质量为 g。
(2)x的值为 。
(3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。
13.碳酸氢钠是小苏打的主要成分。在医疗上,它是治疗胃酸(主要成分是盐酸)过多的药剂之一,反应的化学方程式:NaHCO3+HCl═NaCl+H2O+CO2↑,化学实验小组取27g小苏打样品(含有少量不与HCl反应的杂质)进行测定实验。现将小苏打样品平均分为3份,分别进行3次实验。实验数据如表。
实验次数
第一次
第二次
第三次
小苏打样品的质量/g
9
9
9
加入稀盐酸的质量/g
50
100
150
生成气体的质量/g
2.2
4.4
4.4
(1)第 次实验中NaHCO3和HCl恰好完全反应。
(2)计算27g小苏打样品中碳酸氢钠的质量。(写出计算过程。结果精确到0.1g)
14.今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数
第一次
第二次
第三次
加入稀硫酸质量/g
20
20
20
生成氢气的质量/g
0.08
0.08
0.04
试计算:
(1)共制得氢气 g和共加入 g锌粒。
(2)实验所用稀硫酸中溶质的质量分数。(写出计算过程)
15.氢氧化钙久置会逐渐变质为碳酸钙。实验室有一瓶部分变质的氢氧化钙样品,为测定其中碳酸钙的质量分数,取16.2g样品于烧杯中,加足量的水,再将100g稀盐酸逐渐缓慢加入烧杯中并不断搅拌,获得相关数据如表(提示:氢氧化钙先与盐酸反应时无气体产生),请回答问题并计算。
加入稀盐酸的质量/g
20.0
40.0
60.0
80.0
100
生成CO2的质量/g
0
2.2
4.4
m
5.5
(1)氢氧化钙变质是它与空气中的 发生了反应。
(2)表中m的数值为 。
(3)试计算样品中碳酸钙的质量分数(请在答题卡上写出计算过程,计算结果精确到0.1%)。
(4)请在坐标中画出加入稀盐酸的质量与生成CO2的质量之间的变化关系图。
16.某化学兴趣小组对失去标签的稀硫酸溶液的浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加溶质的质量分数为3.42%的氢氧化钡溶液并振荡,充分反应后,烧杯内的溶液中溶质质量与滴加氢氧化钡溶液质量关系如图所示
(1)当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH 7(填“>”“<”或“=”)
(2)求该稀硫酸溶液的溶质的质量分数(写出答题过程)。
(3)滴加Ba(OH)2溶液至150g时,所得溶液的溶质的质量分数为 (计算结果精确到0.01%)
2021-2022学年华师大版科学化学方程式的简单计算培优练习
参考答案与试题解析
一.选择题(共3小题)
1.A.
2.C.
3.B.
二.填空题(共5小题)
4.解:(1)处理前的总质量为10g+5g,变化后和溶解后总计7g+5.12g.差值为氧气的质量:(10g+5g)﹣(7g+5.12g)=2.88g
故答案为:2.88
(2)设10g混合物中氯酸钾的质量为x
2KClO32KCl+3O2↑
245
96
x
2.88g
x=7.35g
原混合物中氯酸钾的质量分数为×100%=73.5%
答:原混合物中氯酸钾的质量分数为73.5%
5.解:(1)从反应物之间关系的曲线图可以看出,到20s时,反应曲线变成直线,说明反应物和生成物的质量不再变化,说明此时已是完全反应,故答案为:20.
(2)300g﹣259.6g=4.4g.故答案为:4.4.
(3)解:设参与反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+CO2↑+H2O.
106
117
44
x
y
4.4g
∴,
解得:x=10.6g,y=11.7g,
烧杯里不饱和溶液中溶质总质量为:11.7g+(22.3g﹣10.6g)=23.4g,
烧杯里不饱和溶液的质量为:22.3g+216.1g﹣4.4g=234g,
所得不饱和溶液的溶质质量分数:×100%=10%.
答:所得溶液中溶质的质量分数为10%.
6.解:(1)据图可以看出,a点时盐酸没有消耗尽,故含有的溶质是硫酸和生成的硫酸钠,此时滴加石蕊试液变红;溶液恰好中和,则含有的溶质是硫酸钠,故填:H2SO4、Na2SO4,石蕊试液,Na2SO4;
(2)据图可以看出,溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×10%=1.6g,故填:1.6g;
(2)8g稀硫酸样品含有H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80
98
1.6g
x
解得:x=1.96g
稀H2SO4的溶质质量分数为:×100%=24.5%
答:稀硫酸中的溶质质量分数为24.5%.
7.解:(1)由图可知,每加入15g盐酸生成1.32g二氧化碳,第四次加入盐酸仍有气体生成,说明第三次中的盐酸全部反应,生成1.32g二氧化碳气体,则m的值为1.32;
故答案为:1.32;
(2)第四次加入的盐酸有剩余,则12g样品完全反应生成二氧化碳的量为:1.32g+1.32g+1.32g+0.44g=4.4g;
设纯碱样品中的Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106
44
x
4.4g
x=10.6g
纯碱样品中的Na2CO3的质量分数是:≈88.3%
答:纯碱样品中的Na2CO3的质量分数是88.3%.
8.解:(1)由产生氢气的质量与消耗盐酸的质量图,可得生成氢气质量为1.2g;
(2)未变质的铝与盐酸发生置换反应,生成氯化铝和氢气,反应的化学方程式为2Al+6HCl═2AlCl3+3H2↑;
设铝片中铝单质的质量为x
2Al+6HCl═2AlCl3+3H2↑
54
6
x
1.2g
解得:x=10.8g
故答为:(1)1.2;(2)2Al+6HCl═2AlCl3+3H2↑;10.8g.
三.计算题(共8小题)
9.解:(1)较第一次和第三次的数据可知第一次中盐酸完全反应,消耗碳酸钙8g﹣5.5g=2.5g,因此第二次中也是消耗2.5g碳酸钙,所以用第一次的剩余固体质量减去第二次消耗的碳酸钙的质量就是第二次剩余固体的质量.m=5.5g﹣(8g﹣5.5g)=3g
(2)比较第三次和的四次的数据可知:样品中杂质的质量为1.2g,样品中碳酸钙的质量分数为×100%=85%
(3)设需要石灰石的质量为x.
CaCO3CaO+CO2↑
100
56
x×80%
280Kg
x=625Kg
答案:
(1)3;
(2)85%,
(3)需要石灰石的质量为625kg.
10.解:(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙20g﹣14g=6g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有3g杂质;故填:3;
(2)碳酸钙质量为20g﹣3g=17g,所以碳酸钙质量分数为:×100%=85%;
(3)设17g的碳酸钙生成二氧化碳为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100
44
17g
x
x=7.48g
20g此样品与足量盐酸反应最多生成二氧化碳的质量为7.48g.
11.解:设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106
117
44
50g×10.6%
x
y
x=5.85g,y=2.2g
设与氯化钙反应时,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
100
117
5g
w
w=5.85g
所得溶液中氯化钠的质量分数为:=5%
答:所得溶液中氯化钠的质量分数为5%.
12.解:(1)产生沉淀的质量为9.85g。
故填:9.85。
(2)设53g碳酸钠溶液中碳酸钠质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106
197
x
9.85g
=,
x=5.3g,
由图中数据可知,和稀盐酸反应的碳酸钠溶液质量是53g,设生成二氧化碳质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106
44
5.3g
y
=,
y=2.2g,
x的值为2.2。
(3)所用碳酸钠溶液中溶质的质量分数是:×100%=10%,
答:所用碳酸钠溶液中溶质的质量分数是10%。
13.解:(1)分析表中数据可知第一次9g碳酸氢钠样品与50g盐酸反应生成2.2g二氧化碳,第二次9g碳酸氢钠样品与100g盐酸反应生成4.4g二氧化碳,第三次9g碳酸氢钠样品与150g盐酸反应也生成4.4g二氧化碳,说明9g碳酸氢钠样品与100g盐酸恰好反应生成4.4g二氧化碳,所以第二次实验中NaHCO3和HCl恰好完全反应,故填:二;
(2)设9g小苏打样品中碳酸氢钠的质量为x
NaHCO3+HCl=NaCl+H2O+CO2↑
84
44
x
4.4g
=
x=8.4g
则27g小苏打样品中碳酸氢钠的质量8.4g×3=25.2g
答:27g小苏打样品中碳酸氢钠的质量25.2g。
14.解:根据前两次都是生成0.08g氢气,而第三次只生成0.04g氢气,说明金属已经完全反应,生成氢气的总质量为0.08g+0.08g+0.04g=0.2g
设锌的质量为x
Zn+H2SO4═Zn
SO4+H2↑
65
2
x
0.2g
=
x=6.5g
设
稀硫酸中溶质的质量分数为y
20g稀硫酸对应0.08g氢气生成
Zn+H2SO4═ZnSO4+H2↑
98
2
20gy
0.08g
x=19.6%
故答案为:
(1)0.2;6.5g;
(2)19.6%。
15.解:(1)氢氧化钙易与空气中的二氧化碳反应生成碳酸钙和水而变质。
故填:二氧化碳。
(2)分析表中数据可知,部分变质的氢氧化钙样品,开始加入20g稀盐酸时,产生二氧化碳质量为0,说明与氢氧化钙反应,后面每加入20g稀盐酸产生2.2g二氧化碳,如果加80g稀盐酸完全反应,会产生6.6g二氧化碳,加入100g稀盐酸时产生5.5g二氧化碳,说明加入80g稀盐酸时,碳酸钙已完全反应,故加入80g稀盐酸时产生二氧化碳的质量为5.5g,
故填:5.5。
(3)设样品中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑,
100
44
x
5.5g
,
x=12.5g,
样品中碳酸钙质量分数==77.2%,
答:样品中碳酸钙质量分数为77.2%。
(4)加入20g稀盐酸时产生气体二氧化碳,加入70g稀盐酸时碳酸钙完全反应,不再产生气体,加入稀盐酸的质量与生成CO2的质量之间的变化关系图如下所示:
16.解:(1)根据图象可以看出,当氢氧化钡溶液为50g时,稀硫酸没有全部反应,溶液呈酸性,pH<7;
(2)设该硫酸溶液的溶质的质量分数为x,生成沉淀的质量为y。
H2SO4+Ba(OH)2=BaSO4↓+2H2O
98
171
233
50g×x
100g×3.42%
y
解得:x=3.92%
解得:y=4.66g
(3)滴加Ba(OH)2溶液至150g时,所得溶液的溶质的质量分数为:≈0.88%
故答为:(1)>;(2)该硫酸溶液的溶质质量分数为
3.92%;(3)0.88%。
