高中化学人教版(2019)必修第一册第一章 第一节物质的分类及转化(共24张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册第一章 第一节物质的分类及转化(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-18 20:27:36 | ||
图片预览




文档简介
(共24张PPT)
第一章
物质及其变化
第一节
物质的分类及转化
目
录
分散系及其分类
物质分类
胶体
物质的分类
物质分类
一
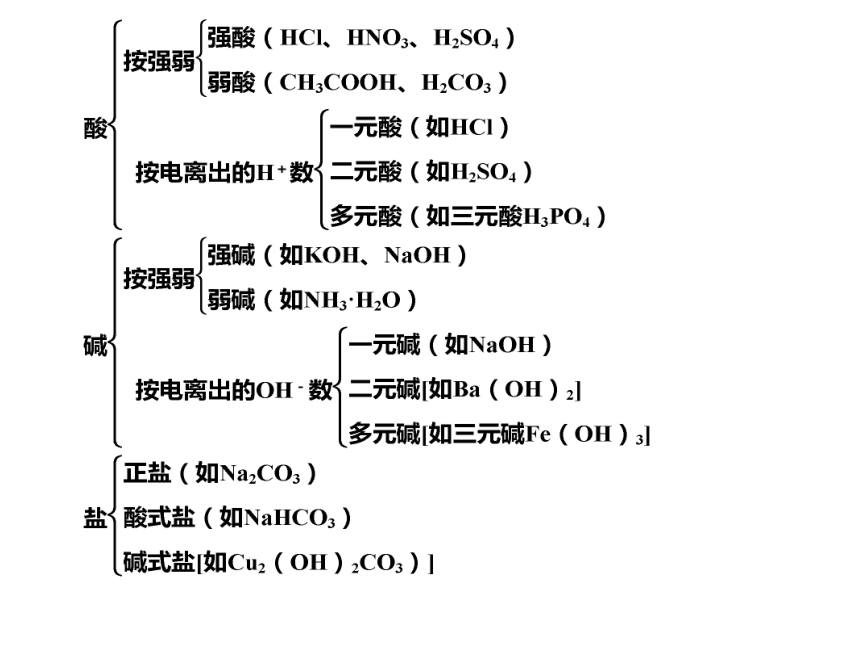
(1)单质:由一种元素组成的纯净物。
(2)同素异形体:由同一种元素形成的几种不同的单质,叫做这种元素的同素异形体。
如:金刚石、石墨、C60
红磷、白磷
O2、O3
1.根据物质的组成分类
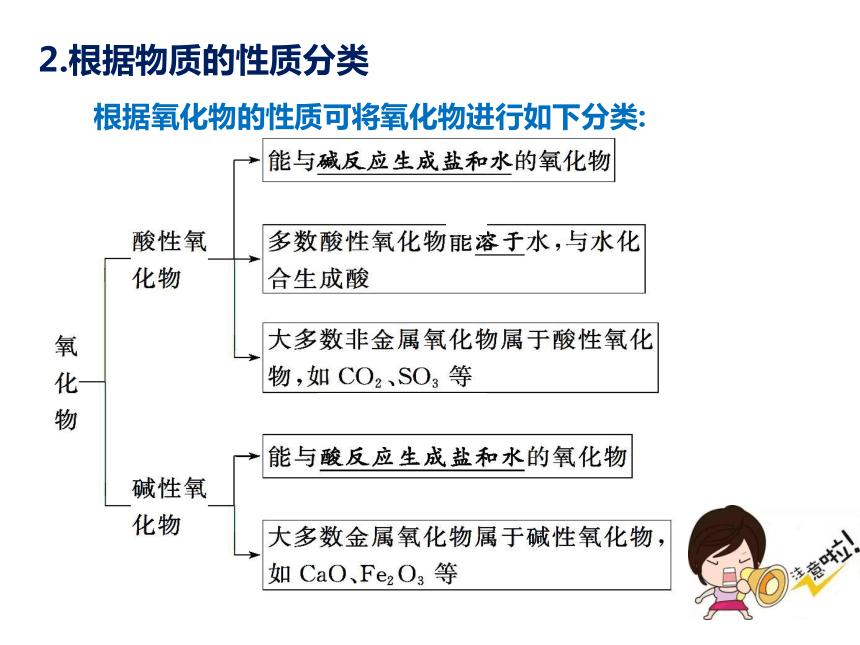
2.根据物质的性质分类
根据氧化物的性质可将氧化物进行如下分类:
酸、碱、盐的性质
一
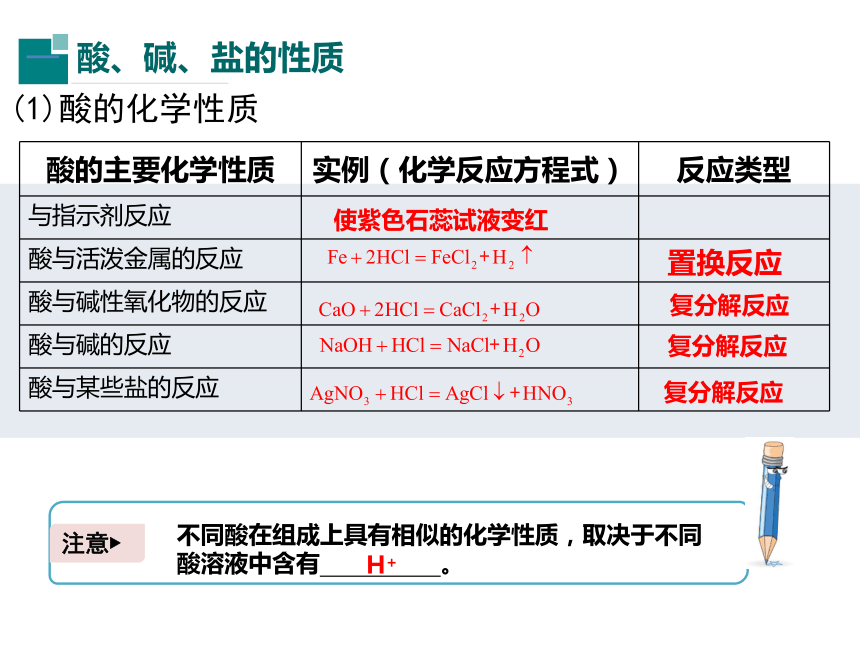
(1)酸的化学性质
酸的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
酸与活泼金属的反应
酸与碱性氧化物的反应
酸与碱的反应
酸与某些盐的反应
使紫色石蕊试液变红
置换反应
复分解反应
复分解反应
复分解反应
注意?
不同酸在组成上具有相似的化学性质,取决于不同酸溶液中含有
。
H+
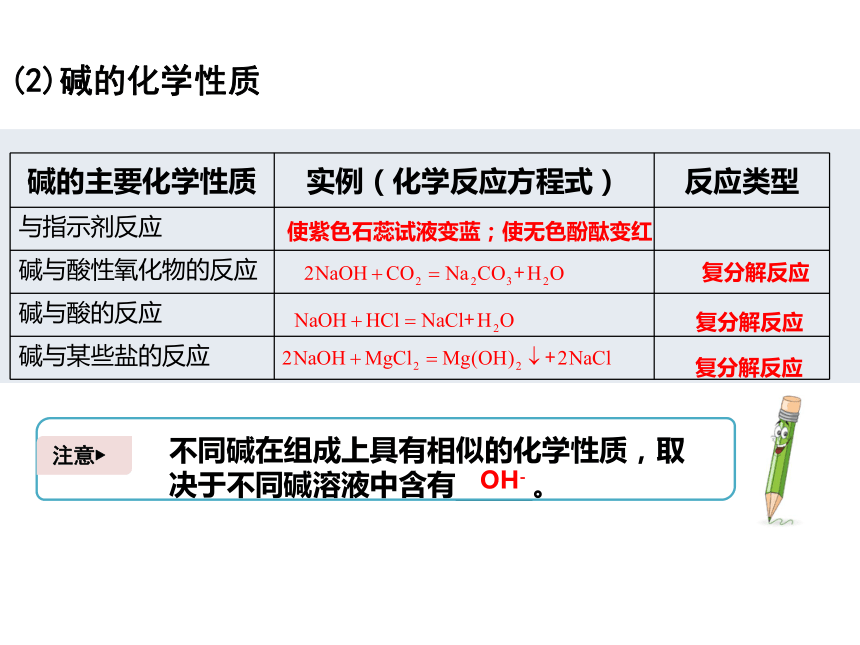
(2)碱的化学性质
碱的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
碱与酸性氧化物的反应
碱与酸的反应
碱与某些盐的反应
使紫色石蕊试液变蓝;使无色酚酞变红
复分解反应
复分解反应
复分解反应
不同碱在组成上具有相似的化学性质,取决于不同碱溶液中含有
。
注意?
OH-
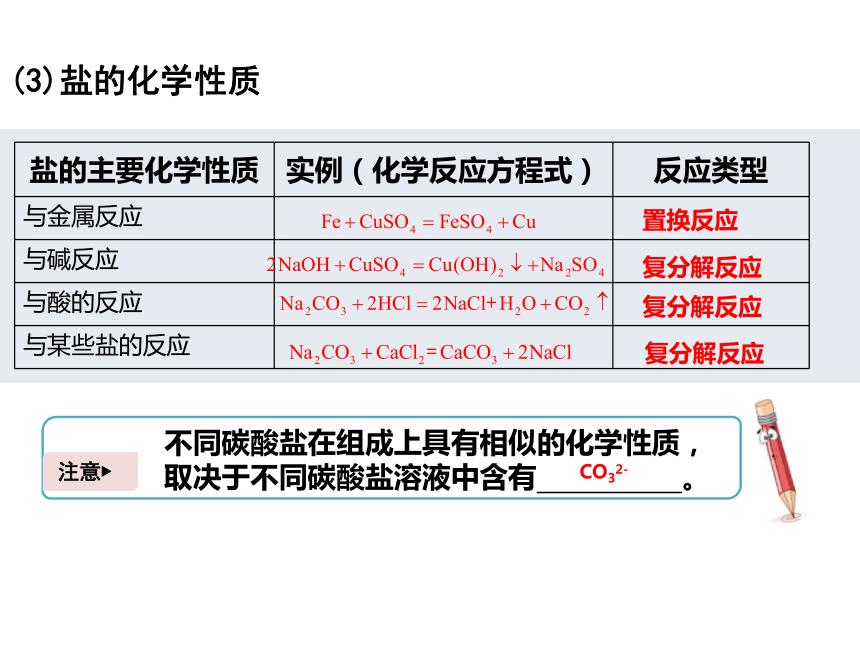
(3)盐的化学性质
盐的主要化学性质
实例(化学反应方程式)
反应类型
与金属反应
与碱反应
与酸的反应
与某些盐的反应
复分解反应
复分解反应
复分解反应
注意?
不同碳酸盐在组成上具有相似的化学性质,取决于不同碳酸盐溶液中含有
。
置换反应
CO32-
思考讨论
讨论2
写出下列物质之间转化的方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
讨论3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
讨论1
单质、氧化物有哪些化学性质?
金属单质到盐、非金属单质到盐的转化关系
1.钙转化为硫酸钙的流程
金属单质
碱性氧化物
碱
盐
O2
H2O
H2SO4
氧气
水
酸
2.碳转化为碳酸钠的流程
O2
H2O
NaOH
非金属单质
酸性氧化物
酸
盐
氧气
水
碱
练一练
根据上面的转化过程,写出非金属单质S到对于盐Na2SO3的转化过程
单质、氧化物的性质
金属单质
酸性氧化物
碱性氧化物
酸
碱
盐
氧化物(H2O)
单质
1.能溶于水的含氧酸,对应的酸性氧化物一般都能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O=H2SO4。
2.能溶于水的碱(NH3?H2O除外),对应的碱性氧化物一般都能与H2O反应生成相应的碱,如NaOH:Na2O+H2O=2NaOH。
物质的转化
二
1.单质、酸、碱、盐、氧化物之间的转化关系
图示解读:
序号
反应
实例
①
金属单质+非金属单质→盐
②
金属单质+盐→新盐+新金属单质
③
金属单质+酸→盐+氢气
④
碱性氧化物+酸性氧化物→盐
⑤
碱性氧化物+酸→盐+水
⑥
酸性氧化物+碱→盐+水
⑦
酸+碱→盐+水
⑧
碱+盐→新盐+新碱
⑨
酸+盐→新盐+新酸
⑩
盐+盐→新盐+新盐
序号
反应
实例
?
金属单质+氧气→碱性氧化物
?
碱性氧化物→金属单质
?
非金属单质+氧气→酸性氧化物
?
碱性氧化物+水→碱
?
酸性氧化物+水→酸
续上
2.物质转化的应用
(1)在实际生产中,通过物质的转化制备具体物质时,除了要考虑反应进行的可能性,还需要考虑
、
、
等因素。
(2)实例——工业制NaOH
原理:电解饱和食盐水
。
不采用Na2O和H2O反应制取的原因:
。
原料来源
成本高低
设备要求
Na2O来源少、成本高
分散系
二
1、分散系的含义与组成
2、分散系的组合方式
按照分散质或分散剂所处的状态
(气态、液态、固态),可将分
散系分为9类:
按照分散质粒子大小分类:
分散系分类
胶体分类、制备、性质
三
1.胶体的分类
胶体
根据分散剂的状态
根据胶体粒子的组成分类
气溶胶
液溶胶
固溶胶
粒子胶体
分子胶体
烟、云、雾
豆浆、牛奶、墨水
有色玻璃、玛瑙
Fe(OH)3胶体
淀粉胶体
2.胶体的制备
操作
现象
实验1
取100mL烧杯,加入40mL蒸馏水,将烧杯中的蒸馏水加热至沸腾。向沸腾的水中滴加5~6滴FeCl3的饱和溶液。
。
实验2
取100mL烧杯,加入40mL硫酸铜溶液
。
溶液由无色变为红褐色
溶液为蓝色
注意事项:①实验中必须使用FeCl3饱和溶液和沸水。
②当液体呈红褐色时立即停止加热,因为过度加热会破坏胶体,生成Fe(OH)3沉淀。
③制备过程中不能用玻璃棒搅拌,否则会使Fe(OH)3胶体粒子碰撞形成大颗粒,最后形成沉淀。
操作
现象
实验3
用激光笔照射实验1、实验2得到的液体
。
出现一条光亮的通路
3.胶体的性质——丁达尔效应
丁达尔效应
当一束可见光通过胶体时,可以看到一条
。这条光亮的“通路”
是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。
光亮的“通路”
【应用】丁达尔效应是区别胶体和溶液的一种常用物理方法。
明矾溶于水形成Al(OH)3胶体具有很好的凝聚作用,
是一种良好的净水剂。
常见的丁达尔效应
【思考讨论】1.溶液和胶体的本质区别是什么呢?为什么胶体有丁达尔效应而溶液没有呢?胶体产生丁达尔效应的原因是什么呢?
2.如何分离氯化钠溶液和淀粉胶体?
提示1:胶体产生丁达尔效应的原因:因为胶体粒子的大小适中,光线照射到胶体的粒子时发生散射,散射光线进入人眼,人以为是胶体在发光,所以看到光亮的通路。而溶液的分散质粒子太小,浊液的分散质粒子太大,无法发生散射。
提示2:根据分散质粒子直径大小不同,利用半透膜设计实验分离胶体及溶液,并检验是否成功分离。
总结
溶液、胶体、浊液的比较
分散系
溶液
胶体
浊液
悬浊液
乳浊液
分散质粒子直径大小
<1
nm
1~100
nm
>100
nm
>100
nm
分散质粒子结构
分子、离子
较多分子的集合体或大分子
大量分子聚集成的固体颗粒
大量分子聚集成的液体液滴
特点
均一、透明
多数均一、透明,较稳定
不均一、不透明,久置沉淀
不均一、不透明,久置分层
稳定性
稳定
介稳性
不稳定
不稳定
能否透
过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别方法
胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别
练习:有下列分散系
①饱和食盐水②食醋③雾④云⑤淀粉溶液⑥血液
⑦泥水⑧烟水晶⑨有色玻璃⑩石灰乳?豆浆?牛奶
(2)分散系②⑤⑥⑦⑩中分散质能透过滤纸的有________。
请思考回答下列问题:
(1)上述分散系中属于溶液的有________(填序号,下同),属于浊液的有________,
属于胶体的有________
。
(3)上述分散系是气溶胶的有________,固溶胶的有____。
(4)证明淀粉溶液是胶体的方法叫做______________。
①②
⑦⑩
③④⑤⑥⑧⑨??
②⑤⑥
③④
⑧⑨
丁达尔效应
第一章
物质及其变化
第一节
物质的分类及转化
目
录
分散系及其分类
物质分类
胶体
物质的分类
物质分类
一
(1)单质:由一种元素组成的纯净物。
(2)同素异形体:由同一种元素形成的几种不同的单质,叫做这种元素的同素异形体。
如:金刚石、石墨、C60
红磷、白磷
O2、O3
1.根据物质的组成分类
2.根据物质的性质分类
根据氧化物的性质可将氧化物进行如下分类:
酸、碱、盐的性质
一
(1)酸的化学性质
酸的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
酸与活泼金属的反应
酸与碱性氧化物的反应
酸与碱的反应
酸与某些盐的反应
使紫色石蕊试液变红
置换反应
复分解反应
复分解反应
复分解反应
注意?
不同酸在组成上具有相似的化学性质,取决于不同酸溶液中含有
。
H+
(2)碱的化学性质
碱的主要化学性质
实例(化学反应方程式)
反应类型
与指示剂反应
碱与酸性氧化物的反应
碱与酸的反应
碱与某些盐的反应
使紫色石蕊试液变蓝;使无色酚酞变红
复分解反应
复分解反应
复分解反应
不同碱在组成上具有相似的化学性质,取决于不同碱溶液中含有
。
注意?
OH-
(3)盐的化学性质
盐的主要化学性质
实例(化学反应方程式)
反应类型
与金属反应
与碱反应
与酸的反应
与某些盐的反应
复分解反应
复分解反应
复分解反应
注意?
不同碳酸盐在组成上具有相似的化学性质,取决于不同碳酸盐溶液中含有
。
置换反应
CO32-
思考讨论
讨论2
写出下列物质之间转化的方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
讨论3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
讨论1
单质、氧化物有哪些化学性质?
金属单质到盐、非金属单质到盐的转化关系
1.钙转化为硫酸钙的流程
金属单质
碱性氧化物
碱
盐
O2
H2O
H2SO4
氧气
水
酸
2.碳转化为碳酸钠的流程
O2
H2O
NaOH
非金属单质
酸性氧化物
酸
盐
氧气
水
碱
练一练
根据上面的转化过程,写出非金属单质S到对于盐Na2SO3的转化过程
单质、氧化物的性质
金属单质
酸性氧化物
碱性氧化物
酸
碱
盐
氧化物(H2O)
单质
1.能溶于水的含氧酸,对应的酸性氧化物一般都能与H2O反应生成相应的含氧酸,如H2SO4:SO3+H2O=H2SO4。
2.能溶于水的碱(NH3?H2O除外),对应的碱性氧化物一般都能与H2O反应生成相应的碱,如NaOH:Na2O+H2O=2NaOH。
物质的转化
二
1.单质、酸、碱、盐、氧化物之间的转化关系
图示解读:
序号
反应
实例
①
金属单质+非金属单质→盐
②
金属单质+盐→新盐+新金属单质
③
金属单质+酸→盐+氢气
④
碱性氧化物+酸性氧化物→盐
⑤
碱性氧化物+酸→盐+水
⑥
酸性氧化物+碱→盐+水
⑦
酸+碱→盐+水
⑧
碱+盐→新盐+新碱
⑨
酸+盐→新盐+新酸
⑩
盐+盐→新盐+新盐
序号
反应
实例
?
金属单质+氧气→碱性氧化物
?
碱性氧化物→金属单质
?
非金属单质+氧气→酸性氧化物
?
碱性氧化物+水→碱
?
酸性氧化物+水→酸
续上
2.物质转化的应用
(1)在实际生产中,通过物质的转化制备具体物质时,除了要考虑反应进行的可能性,还需要考虑
、
、
等因素。
(2)实例——工业制NaOH
原理:电解饱和食盐水
。
不采用Na2O和H2O反应制取的原因:
。
原料来源
成本高低
设备要求
Na2O来源少、成本高
分散系
二
1、分散系的含义与组成
2、分散系的组合方式
按照分散质或分散剂所处的状态
(气态、液态、固态),可将分
散系分为9类:
按照分散质粒子大小分类:
分散系分类
胶体分类、制备、性质
三
1.胶体的分类
胶体
根据分散剂的状态
根据胶体粒子的组成分类
气溶胶
液溶胶
固溶胶
粒子胶体
分子胶体
烟、云、雾
豆浆、牛奶、墨水
有色玻璃、玛瑙
Fe(OH)3胶体
淀粉胶体
2.胶体的制备
操作
现象
实验1
取100mL烧杯,加入40mL蒸馏水,将烧杯中的蒸馏水加热至沸腾。向沸腾的水中滴加5~6滴FeCl3的饱和溶液。
。
实验2
取100mL烧杯,加入40mL硫酸铜溶液
。
溶液由无色变为红褐色
溶液为蓝色
注意事项:①实验中必须使用FeCl3饱和溶液和沸水。
②当液体呈红褐色时立即停止加热,因为过度加热会破坏胶体,生成Fe(OH)3沉淀。
③制备过程中不能用玻璃棒搅拌,否则会使Fe(OH)3胶体粒子碰撞形成大颗粒,最后形成沉淀。
操作
现象
实验3
用激光笔照射实验1、实验2得到的液体
。
出现一条光亮的通路
3.胶体的性质——丁达尔效应
丁达尔效应
当一束可见光通过胶体时,可以看到一条
。这条光亮的“通路”
是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。
光亮的“通路”
【应用】丁达尔效应是区别胶体和溶液的一种常用物理方法。
明矾溶于水形成Al(OH)3胶体具有很好的凝聚作用,
是一种良好的净水剂。
常见的丁达尔效应
【思考讨论】1.溶液和胶体的本质区别是什么呢?为什么胶体有丁达尔效应而溶液没有呢?胶体产生丁达尔效应的原因是什么呢?
2.如何分离氯化钠溶液和淀粉胶体?
提示1:胶体产生丁达尔效应的原因:因为胶体粒子的大小适中,光线照射到胶体的粒子时发生散射,散射光线进入人眼,人以为是胶体在发光,所以看到光亮的通路。而溶液的分散质粒子太小,浊液的分散质粒子太大,无法发生散射。
提示2:根据分散质粒子直径大小不同,利用半透膜设计实验分离胶体及溶液,并检验是否成功分离。
总结
溶液、胶体、浊液的比较
分散系
溶液
胶体
浊液
悬浊液
乳浊液
分散质粒子直径大小
<1
nm
1~100
nm
>100
nm
>100
nm
分散质粒子结构
分子、离子
较多分子的集合体或大分子
大量分子聚集成的固体颗粒
大量分子聚集成的液体液滴
特点
均一、透明
多数均一、透明,较稳定
不均一、不透明,久置沉淀
不均一、不透明,久置分层
稳定性
稳定
介稳性
不稳定
不稳定
能否透
过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别方法
胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别
练习:有下列分散系
①饱和食盐水②食醋③雾④云⑤淀粉溶液⑥血液
⑦泥水⑧烟水晶⑨有色玻璃⑩石灰乳?豆浆?牛奶
(2)分散系②⑤⑥⑦⑩中分散质能透过滤纸的有________。
请思考回答下列问题:
(1)上述分散系中属于溶液的有________(填序号,下同),属于浊液的有________,
属于胶体的有________
。
(3)上述分散系是气溶胶的有________,固溶胶的有____。
(4)证明淀粉溶液是胶体的方法叫做______________。
①②
⑦⑩
③④⑤⑥⑧⑨??
②⑤⑥
③④
⑧⑨
丁达尔效应
