3.1 氧化还原反应(新教材) 同步教学课件(19张ppt)
文档属性
| 名称 | 3.1 氧化还原反应(新教材) 同步教学课件(19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-18 15:09:40 | ||
图片预览






文档简介
(共19张PPT)
第三节
氧化还原反应
课时1
氧化还原反应
新知导入
新知导入
思考与讨论
回忆初中学过的化学反应的四个基本反应类型,并判断下列两个反应属于哪种反应类型,说明判断依据。
2CuO
+
C
=
2Cu
+
CO2↑
Fe2O3
+
3CO
=
2Fe
+
3CO2
高温
高温
判断依据:一种物质得到氧,另一种物质失去氧
新知导入
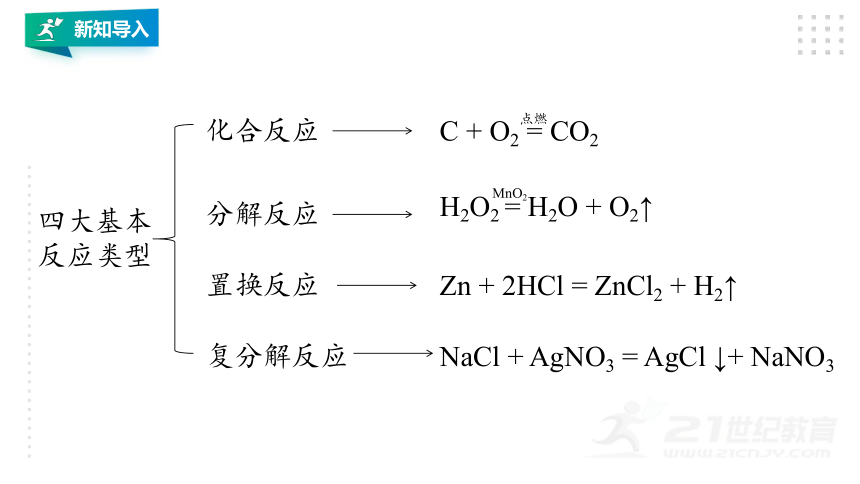
四大基本反应类型
化合反应
分解反应
置换反应
复分解反应
C
+
O2
=
CO2
点燃
H2O2
=
H2O
+
O2↑
MnO2
Zn
+
2HCl
=
ZnCl2
+
H2↑
NaCl
+
AgNO3
=
AgCl
↓+
NaNO3
新知讲解
一、从得失氧的角度分析
定义:一种物质得到氧发生氧化反应,另一种物质失去氧发生还原反应,并且氧化反应和还原反应同时发生的反应,叫做氧化还原反应
得到氧的物质发生氧化反应
失去氧的物质发生还原反应
注意
新知讲解
请从得失氧角度判断下列哪些是氧化还原反应:
1、H2O
+
C
=
H2
+
CO
2、Fe
+
CuSO4
=
FeSO4
+
Cu
3、Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
高温
尝试标出氧化还原反应中各元素化合价,找出他们的共同特征
共同特征:化合价升高的元素被氧化,发生氧化反应;化合价降低的元素被还原,发生还原反应。
新知讲解
二、从化合价升降的角度分析
定义:凡是有化合价升降的反应,叫做氧化还原反应
注意
(1)氧化反应:物质中所含元素化合价升高的反应
(2)还原反应:物质中所含元素化合价降低的反应
(3)氧化还原反应的特征:元素化合价发生变化
请从化合价升降角度判断下列哪些是氧化还原反应:
A、Ca(OH)2+CO2
=
CaCO3
↓+
H2O
B、MnO2+4HCl(浓)
=
MnCl2+Cl2↑+2H2O
△
D、2KMnO4
=
K2MnO4
+MnO2
+O2↑
现学现用:
新知讲解
新知讲解
思考?
氧化还原反应中化合价的升降是什么原因引起的?
Na
+
Cl2═
2NaCl
点燃
化合价升高,被氧(氧化反应)
化合价降低,被还原(还原反应)
新知讲解
(1)离子化合物NaCl的形成过程分析:
2Na
+
Cl2
═
2NaCl
点燃
失去2×e-,化合价
升高,被氧化
得到2×e-,化合价
降低,被还原
0
0
+1
—1
化合价升降的原因:电子的得失
新知讲解
(2)共价化合物
HCl的形成过程分析:
H2
+
Cl2
═
2HCl
点燃
电子对偏离,化合价
升高,被氧化
电子对偏向,化合价
降低,被还原
0
0
+1
—1
化合价升降的原因:电子的偏移
新知讲解
三、从电子转移的角度分析
定义:有电子的转移(得失和偏移)的反应,叫做氧化还原反应
注意
(1)氧化反应:失去电子(电子对偏移)的反应
(2)还原反应:得到电子(电子对偏向)的反应
(3)氧化还原反应的本质:电子的转移
新知讲解
现学现用:
尝试利用元素化合价变化来分析以下反应的反应过程,判断发生氧化反应和还原反应的物质分别是什么。
2CuO+C
=
2Cu+CO2
高温
氧化还原反应
规律
物质的化合价降低,得到电子,被还原,发生还原反应
降
得
还
还
物质的化合价升高,失去电子,被氧化,发生氧化反应
升
失
氧
氧
新知讲解
请归纳总结氧化还原反应与初中所学的四个基本反应类型的关系
思考?
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
课堂总结
氧化还原反应
1.定义:凡是有化合价升降的化学反应
2.特征:化合价升降
3.本质:电子的转移(电子的得失或偏移)
4.规律:升失氧氧,降得还还
课堂练习
1、下列反应属于氧化还原反应的是(
)
A、CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2
B、CaCO3
=
CaO
+
CO2
C、Na2O
+
H2O
=
2NaOH
D、Mg
+
2HCl
=
MgCl2
+
H2
D
课堂练习
2、下列反应中,Cl2既表现氧化性又表现还原性的反应是(????)
A、Cl2?+?2NaOH?=?NaCl?+NaClO?+H2O?
B、2HClO?=?2HCl?+?O2↑
C、Cl2?+?2Na?=?2NaCl?
D、MnO2?+?4HCl?=?MnCl2?+?Cl2↑+?2H2O
A
https://www.21cnjy.com/help/help_extract.php
第三节
氧化还原反应
课时1
氧化还原反应
新知导入
新知导入
思考与讨论
回忆初中学过的化学反应的四个基本反应类型,并判断下列两个反应属于哪种反应类型,说明判断依据。
2CuO
+
C
=
2Cu
+
CO2↑
Fe2O3
+
3CO
=
2Fe
+
3CO2
高温
高温
判断依据:一种物质得到氧,另一种物质失去氧
新知导入
四大基本反应类型
化合反应
分解反应
置换反应
复分解反应
C
+
O2
=
CO2
点燃
H2O2
=
H2O
+
O2↑
MnO2
Zn
+
2HCl
=
ZnCl2
+
H2↑
NaCl
+
AgNO3
=
AgCl
↓+
NaNO3
新知讲解
一、从得失氧的角度分析
定义:一种物质得到氧发生氧化反应,另一种物质失去氧发生还原反应,并且氧化反应和还原反应同时发生的反应,叫做氧化还原反应
得到氧的物质发生氧化反应
失去氧的物质发生还原反应
注意
新知讲解
请从得失氧角度判断下列哪些是氧化还原反应:
1、H2O
+
C
=
H2
+
CO
2、Fe
+
CuSO4
=
FeSO4
+
Cu
3、Fe2O3
+
6HCl
=
2FeCl3
+
3H2O
高温
尝试标出氧化还原反应中各元素化合价,找出他们的共同特征
共同特征:化合价升高的元素被氧化,发生氧化反应;化合价降低的元素被还原,发生还原反应。
新知讲解
二、从化合价升降的角度分析
定义:凡是有化合价升降的反应,叫做氧化还原反应
注意
(1)氧化反应:物质中所含元素化合价升高的反应
(2)还原反应:物质中所含元素化合价降低的反应
(3)氧化还原反应的特征:元素化合价发生变化
请从化合价升降角度判断下列哪些是氧化还原反应:
A、Ca(OH)2+CO2
=
CaCO3
↓+
H2O
B、MnO2+4HCl(浓)
=
MnCl2+Cl2↑+2H2O
△
D、2KMnO4
=
K2MnO4
+MnO2
+O2↑
现学现用:
新知讲解
新知讲解
思考?
氧化还原反应中化合价的升降是什么原因引起的?
Na
+
Cl2═
2NaCl
点燃
化合价升高,被氧(氧化反应)
化合价降低,被还原(还原反应)
新知讲解
(1)离子化合物NaCl的形成过程分析:
2Na
+
Cl2
═
2NaCl
点燃
失去2×e-,化合价
升高,被氧化
得到2×e-,化合价
降低,被还原
0
0
+1
—1
化合价升降的原因:电子的得失
新知讲解
(2)共价化合物
HCl的形成过程分析:
H2
+
Cl2
═
2HCl
点燃
电子对偏离,化合价
升高,被氧化
电子对偏向,化合价
降低,被还原
0
0
+1
—1
化合价升降的原因:电子的偏移
新知讲解
三、从电子转移的角度分析
定义:有电子的转移(得失和偏移)的反应,叫做氧化还原反应
注意
(1)氧化反应:失去电子(电子对偏移)的反应
(2)还原反应:得到电子(电子对偏向)的反应
(3)氧化还原反应的本质:电子的转移
新知讲解
现学现用:
尝试利用元素化合价变化来分析以下反应的反应过程,判断发生氧化反应和还原反应的物质分别是什么。
2CuO+C
=
2Cu+CO2
高温
氧化还原反应
规律
物质的化合价降低,得到电子,被还原,发生还原反应
降
得
还
还
物质的化合价升高,失去电子,被氧化,发生氧化反应
升
失
氧
氧
新知讲解
请归纳总结氧化还原反应与初中所学的四个基本反应类型的关系
思考?
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
课堂总结
氧化还原反应
1.定义:凡是有化合价升降的化学反应
2.特征:化合价升降
3.本质:电子的转移(电子的得失或偏移)
4.规律:升失氧氧,降得还还
课堂练习
1、下列反应属于氧化还原反应的是(
)
A、CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2
B、CaCO3
=
CaO
+
CO2
C、Na2O
+
H2O
=
2NaOH
D、Mg
+
2HCl
=
MgCl2
+
H2
D
课堂练习
2、下列反应中,Cl2既表现氧化性又表现还原性的反应是(????)
A、Cl2?+?2NaOH?=?NaCl?+NaClO?+H2O?
B、2HClO?=?2HCl?+?O2↑
C、Cl2?+?2Na?=?2NaCl?
D、MnO2?+?4HCl?=?MnCl2?+?Cl2↑+?2H2O
A
https://www.21cnjy.com/help/help_extract.php
