第三单元 课题03 元素 同步课件(15张ppt)
文档属性
| 名称 | 第三单元 课题03 元素 同步课件(15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-03 16:41:36 | ||
图片预览




文档简介
(共15张PPT)
第三单元
物质构成的奥秘
课题3
元
素
化
学(初中)(人教版)
同步课堂
钙
硒
碘
铁
想一想,以上的“钙”、“硒”、“碘”、“铁”指的是什么
中子数
质子数
氢原子A
氢原子B
氢原子C
原
子
核外电子
1
0
1
1
1
1
1
2
1
中子数
质子数
碳原子A
碳原子B
碳原子C
原
子
核外电子
6
6
6
6
7
6
6
8
6
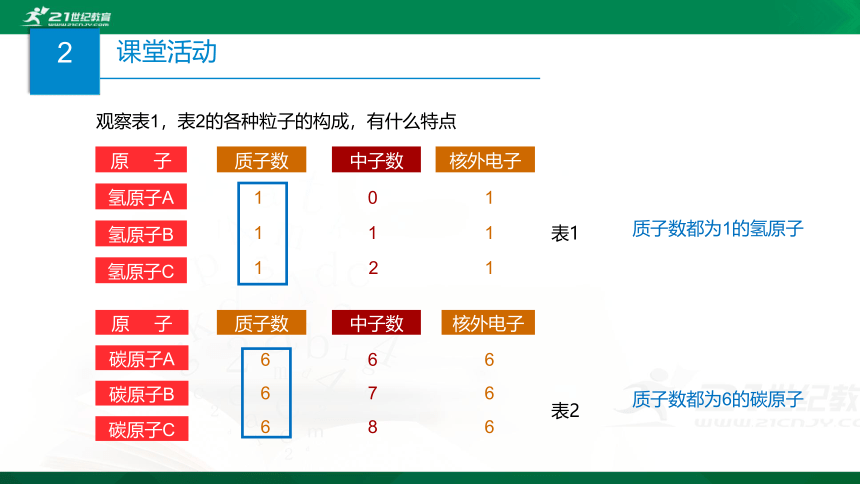
观察表1,表2的各种粒子的构成,有什么特点
质子数都为6的碳原子
质子数都为1的氢原子
表1
表2
元素:是质子数(即核电荷数)相同的一类原子的总称。
①决定元素种类的为质子数(核电荷数),质子数相同,即为同种元素。
②
“一类原子”指的是其核电荷数相同而核内所含中子数并不一定相同的一类原子。
③元素是同一类原子的“总称”,是一个宏观概念,只讲种类,不讲个数。
01
元素的定义
一、元素
①下列微粒属于同种元素的是(
)
A微粒
质子数6
中子数8
电子数6
B微粒
质子数8
中子数8
电子数8
C微粒
质子数12
中子数12
电子数10
D微粒
质子数8
中子数8
电子数10
BDE
学以致用
02
学以致用
②下列对氢气(H2)描述正确的是(
)
A.一个氢分子由氢原子构成
B.氢气由氢分子构成
C.氢分子由氢原子构成
D.一个氢分子由两个氢原子构成
E.氢气由两个氢元素组成
F.氢气由氢元素组成
BCDF
③讨论:在下列化学反应中,反应物与生成物相比较,分子是否发生了变化?原子是否发生了变化?元素是否发生了变化?
过氧化氢
水
+
氧气
二氧化锰
硫+氧气
二氧化硫
点燃
H2O2
H2O
O2
O2
SO2
S
化学变化前后,分子种类改变,原子种类个数不变,元素种类不变
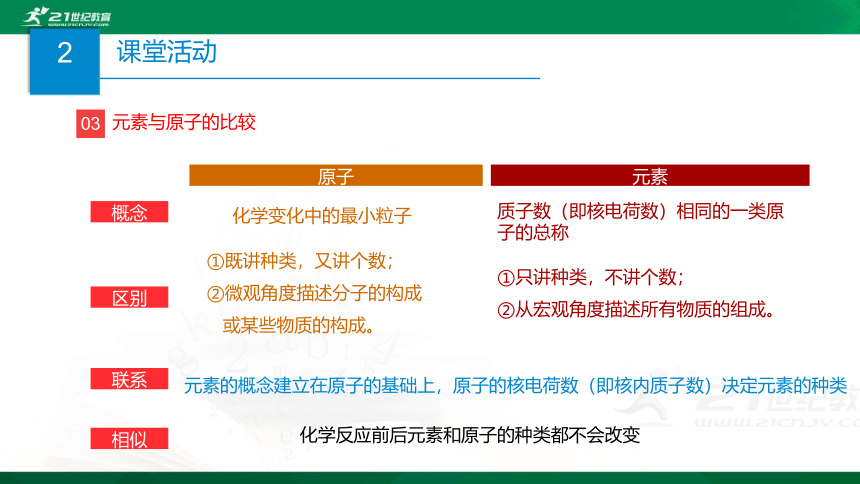
03
元素与原子的比较
元素
原子
概念
区别
联系
质子数(即核电荷数)相同的一类原子的总称
化学变化中的最小粒子
①既讲种类,又讲个数;
②微观角度描述分子的构成
或某些物质的构成。
①只讲种类,不讲个数;
②从宏观角度描述所有物质的组成。
元素的概念建立在原子的基础上,原子的核电荷数(即核内质子数)决定元素的种类
化学反应前后元素和原子的种类都不会改变
相似
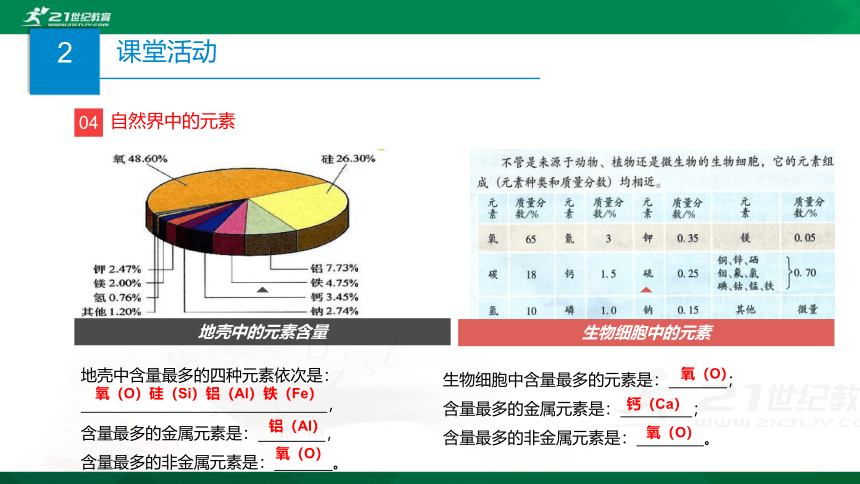
04
自然界中的元素
地壳中的元素含量
生物细胞中的元素
地壳中含量最多的四种元素依次是:
,
含量最多的金属元素是:
,
含量最多的非金属元素是:
。
氧(O)硅(Si)铝(Al)铁(Fe)
氧(O)
铝(Al)
生物细胞中含量最多的元素是:
;
含量最多的金属元素是:
;
含量最多的非金属元素是:
。
氧(O)
钙(Ca)
氧(O)
01
元素符号的书写
二、元素符号
(1)由首字母表示元素符号(大写)。
(2)若首字母相同,则第一个字母(大写),附加第二个字母(小写)
国际上统一采用元素拉丁文名称
O
C
H
N
S
氧 碳
氢
氮
硫
Fe
Cu
Al
Mg
Hg
铁 铜
铝
镁
汞
书写规则“一大二小”
H氢、
He氦、
Li锂、
Be铍、
B硼、
C碳、
N氮、
O氧、
F氟、
Ne氖
Na钠、
Mg镁、Al铝、Si硅、
P磷、
S硫、
Cl氯、
Ar氩、
K钾、Ca钙
Fe铁、
Cu铜、
Zn锌、Hg汞、Ag银、Au金
熟练记忆常见元素的名称和符号
02
元素符号的意义
①表示一种元素
②表示该元素的一个原子
H
表示氢元素
表示一个氢原子
部分元素符号有三个意义(当物质由直接原子构成)
③一个铁原子
①铁元素
Fe
②铁这种物质
Ne
①表示氖元素
③表示一个氖原子
②表示稀有气体氖
宏观
微观
宏观
微观
03
学以致用
5O
2Cu
N
3P
氧元素或一个氧原子
2个氢原子
钠元素或一个钠原子或钠物质
2个镁原子
两个氢原子
一个氢气分子由两个氢原子构成
1、说说下列符号的意义
2、用符号和数字表达含义
5个氧原子:
2个铜原子:
氮元素
:
3个磷原子:
O
:
2H:
Na:
2Mg:
2H
H2
3、指出下列“2”表示的含义义
Mg2+
镁离子带两个单位的正电
图书馆里有成千上万册图书,为了便于读者检索和阅读,必须对图书分门别类、有序地摆放。那已知的上百种元素又是如何排列的呢?
三、元素周期表简介
1
H
1.008
氢
3
Li
6.941
锂
4
Be
9.012
铍
11
Na
22.99
钠
12
Mg
24.31
镁
19
K
39.10
钾
20
Ca
40.08
钙
37
Rb
85.47
铷
38
Sr
87.62
锶
55
Cs
132.9
铯
56
Ba
137.3
钡
21
Sc
44.96
钪
22
Ti
47.87
钛
57~71
镧系
La~Lu
23
V
50.94
钒
24
Cr
52.00
铬
25
Mn
54.94
锰
26
Fe
55.85
铁
27
Co
58.93
钴
28
Ni
58.69
镍
29
Cu
63.55
铜
30
Zn
65.38
锌
5
B
10.81
硼
13
Al
26.98
铝
31
Ga
69.72
稼
49
In
114.8
铟
81
Ti
204.4
铊
6
C
12.01
碳
7
N
14.01
氮
14
Si
28.09
硅
15
P
30.97
磷
32
Ge
72.63
锗
33
As
74.92
砷
50
Sn
118.7
锡
51
Sb
121.8
锑
82
Pb
207.2
铅
83
Bi
209.0
铋
8
O
16.00
氧
16
S
32.06
硫
34
Se
78.96
硒
52
Te
127.6
碲
84
Po
209
钋
9
F
19.00
氟
10
Ne
20.18
氖
17
Cl
35.45
氯
18
Ar
39.95
氩
35
Br
79.90
溴
36
Kr
83.80
氪
53
I
126.9
碘
54
Xe
131.3
氙
85
At
210
砹
86
Rn
222
氡
3
Li
1.008
锂
57
La
138.9
镧
71
Lu
89
Ac
227
锕
2
He
4.003
氦
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
镧
系
錒
系
103
Lr
金属
非金属
1
H
1.008
氢
原子序数
元素符号
87
Fr
223
钫
88
Ra
226
镭
89~103
锕系
Ac~Lr
元素名称
相对原子量
0
1
18
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1、元素周期表共有7个横行,18个纵行。每一个横行叫做一个周期(共7个周期),每一个纵行叫做一个族(8,9,10三个纵行共同组成一个族)(共16个族)。
2、为了便于查找,元素周期表按元素原子核电荷数递增的顺序给元素编了序号,叫做原子序数,原子序数与元素原子核电荷数在数值上相同。
质子数=核外电子数=核电荷数=原子序数
3、排列规律:
(1)元素周期表上开头是金属元素、靠近尾部的是非金属元素结尾的是稀有气体元素用不同的颜色做
了分区。说明元素之间存在着一些规律性。
(2)按照原子序数由大到小地排列;(3)电子层数相同的排在同一个横行(同周期)
(4)最外层电子数相同的排在同一个纵行(同一族)
01.通过阅读课本说出元素符号所表示的意义,学会正确书写元素符号。
02.住一些常见元素的名称和符号,并能对元素进行简单分类。
03.初步认识元素周期表;能根据原子序数在元素周期表中找到指定元素的一些信息。
你
应
该
知
道
第三单元
物质构成的奥秘
课题3
元
素
化
学(初中)(人教版)
同步课堂
钙
硒
碘
铁
想一想,以上的“钙”、“硒”、“碘”、“铁”指的是什么
中子数
质子数
氢原子A
氢原子B
氢原子C
原
子
核外电子
1
0
1
1
1
1
1
2
1
中子数
质子数
碳原子A
碳原子B
碳原子C
原
子
核外电子
6
6
6
6
7
6
6
8
6
观察表1,表2的各种粒子的构成,有什么特点
质子数都为6的碳原子
质子数都为1的氢原子
表1
表2
元素:是质子数(即核电荷数)相同的一类原子的总称。
①决定元素种类的为质子数(核电荷数),质子数相同,即为同种元素。
②
“一类原子”指的是其核电荷数相同而核内所含中子数并不一定相同的一类原子。
③元素是同一类原子的“总称”,是一个宏观概念,只讲种类,不讲个数。
01
元素的定义
一、元素
①下列微粒属于同种元素的是(
)
A微粒
质子数6
中子数8
电子数6
B微粒
质子数8
中子数8
电子数8
C微粒
质子数12
中子数12
电子数10
D微粒
质子数8
中子数8
电子数10
BDE
学以致用
02
学以致用
②下列对氢气(H2)描述正确的是(
)
A.一个氢分子由氢原子构成
B.氢气由氢分子构成
C.氢分子由氢原子构成
D.一个氢分子由两个氢原子构成
E.氢气由两个氢元素组成
F.氢气由氢元素组成
BCDF
③讨论:在下列化学反应中,反应物与生成物相比较,分子是否发生了变化?原子是否发生了变化?元素是否发生了变化?
过氧化氢
水
+
氧气
二氧化锰
硫+氧气
二氧化硫
点燃
H2O2
H2O
O2
O2
SO2
S
化学变化前后,分子种类改变,原子种类个数不变,元素种类不变
03
元素与原子的比较
元素
原子
概念
区别
联系
质子数(即核电荷数)相同的一类原子的总称
化学变化中的最小粒子
①既讲种类,又讲个数;
②微观角度描述分子的构成
或某些物质的构成。
①只讲种类,不讲个数;
②从宏观角度描述所有物质的组成。
元素的概念建立在原子的基础上,原子的核电荷数(即核内质子数)决定元素的种类
化学反应前后元素和原子的种类都不会改变
相似
04
自然界中的元素
地壳中的元素含量
生物细胞中的元素
地壳中含量最多的四种元素依次是:
,
含量最多的金属元素是:
,
含量最多的非金属元素是:
。
氧(O)硅(Si)铝(Al)铁(Fe)
氧(O)
铝(Al)
生物细胞中含量最多的元素是:
;
含量最多的金属元素是:
;
含量最多的非金属元素是:
。
氧(O)
钙(Ca)
氧(O)
01
元素符号的书写
二、元素符号
(1)由首字母表示元素符号(大写)。
(2)若首字母相同,则第一个字母(大写),附加第二个字母(小写)
国际上统一采用元素拉丁文名称
O
C
H
N
S
氧 碳
氢
氮
硫
Fe
Cu
Al
Mg
Hg
铁 铜
铝
镁
汞
书写规则“一大二小”
H氢、
He氦、
Li锂、
Be铍、
B硼、
C碳、
N氮、
O氧、
F氟、
Ne氖
Na钠、
Mg镁、Al铝、Si硅、
P磷、
S硫、
Cl氯、
Ar氩、
K钾、Ca钙
Fe铁、
Cu铜、
Zn锌、Hg汞、Ag银、Au金
熟练记忆常见元素的名称和符号
02
元素符号的意义
①表示一种元素
②表示该元素的一个原子
H
表示氢元素
表示一个氢原子
部分元素符号有三个意义(当物质由直接原子构成)
③一个铁原子
①铁元素
Fe
②铁这种物质
Ne
①表示氖元素
③表示一个氖原子
②表示稀有气体氖
宏观
微观
宏观
微观
03
学以致用
5O
2Cu
N
3P
氧元素或一个氧原子
2个氢原子
钠元素或一个钠原子或钠物质
2个镁原子
两个氢原子
一个氢气分子由两个氢原子构成
1、说说下列符号的意义
2、用符号和数字表达含义
5个氧原子:
2个铜原子:
氮元素
:
3个磷原子:
O
:
2H:
Na:
2Mg:
2H
H2
3、指出下列“2”表示的含义义
Mg2+
镁离子带两个单位的正电
图书馆里有成千上万册图书,为了便于读者检索和阅读,必须对图书分门别类、有序地摆放。那已知的上百种元素又是如何排列的呢?
三、元素周期表简介
1
H
1.008
氢
3
Li
6.941
锂
4
Be
9.012
铍
11
Na
22.99
钠
12
Mg
24.31
镁
19
K
39.10
钾
20
Ca
40.08
钙
37
Rb
85.47
铷
38
Sr
87.62
锶
55
Cs
132.9
铯
56
Ba
137.3
钡
21
Sc
44.96
钪
22
Ti
47.87
钛
57~71
镧系
La~Lu
23
V
50.94
钒
24
Cr
52.00
铬
25
Mn
54.94
锰
26
Fe
55.85
铁
27
Co
58.93
钴
28
Ni
58.69
镍
29
Cu
63.55
铜
30
Zn
65.38
锌
5
B
10.81
硼
13
Al
26.98
铝
31
Ga
69.72
稼
49
In
114.8
铟
81
Ti
204.4
铊
6
C
12.01
碳
7
N
14.01
氮
14
Si
28.09
硅
15
P
30.97
磷
32
Ge
72.63
锗
33
As
74.92
砷
50
Sn
118.7
锡
51
Sb
121.8
锑
82
Pb
207.2
铅
83
Bi
209.0
铋
8
O
16.00
氧
16
S
32.06
硫
34
Se
78.96
硒
52
Te
127.6
碲
84
Po
209
钋
9
F
19.00
氟
10
Ne
20.18
氖
17
Cl
35.45
氯
18
Ar
39.95
氩
35
Br
79.90
溴
36
Kr
83.80
氪
53
I
126.9
碘
54
Xe
131.3
氙
85
At
210
砹
86
Rn
222
氡
3
Li
1.008
锂
57
La
138.9
镧
71
Lu
89
Ac
227
锕
2
He
4.003
氦
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
镧
系
錒
系
103
Lr
金属
非金属
1
H
1.008
氢
原子序数
元素符号
87
Fr
223
钫
88
Ra
226
镭
89~103
锕系
Ac~Lr
元素名称
相对原子量
0
1
18
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1、元素周期表共有7个横行,18个纵行。每一个横行叫做一个周期(共7个周期),每一个纵行叫做一个族(8,9,10三个纵行共同组成一个族)(共16个族)。
2、为了便于查找,元素周期表按元素原子核电荷数递增的顺序给元素编了序号,叫做原子序数,原子序数与元素原子核电荷数在数值上相同。
质子数=核外电子数=核电荷数=原子序数
3、排列规律:
(1)元素周期表上开头是金属元素、靠近尾部的是非金属元素结尾的是稀有气体元素用不同的颜色做
了分区。说明元素之间存在着一些规律性。
(2)按照原子序数由大到小地排列;(3)电子层数相同的排在同一个横行(同周期)
(4)最外层电子数相同的排在同一个纵行(同一族)
01.通过阅读课本说出元素符号所表示的意义,学会正确书写元素符号。
02.住一些常见元素的名称和符号,并能对元素进行简单分类。
03.初步认识元素周期表;能根据原子序数在元素周期表中找到指定元素的一些信息。
你
应
该
知
道
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
