上海市交大附高2021-2022学年高一上学期9月摸底测试化学试题 (Word版含答案)
文档属性
| 名称 | 上海市交大附高2021-2022学年高一上学期9月摸底测试化学试题 (Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 980.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-22 21:21:35 | ||
图片预览



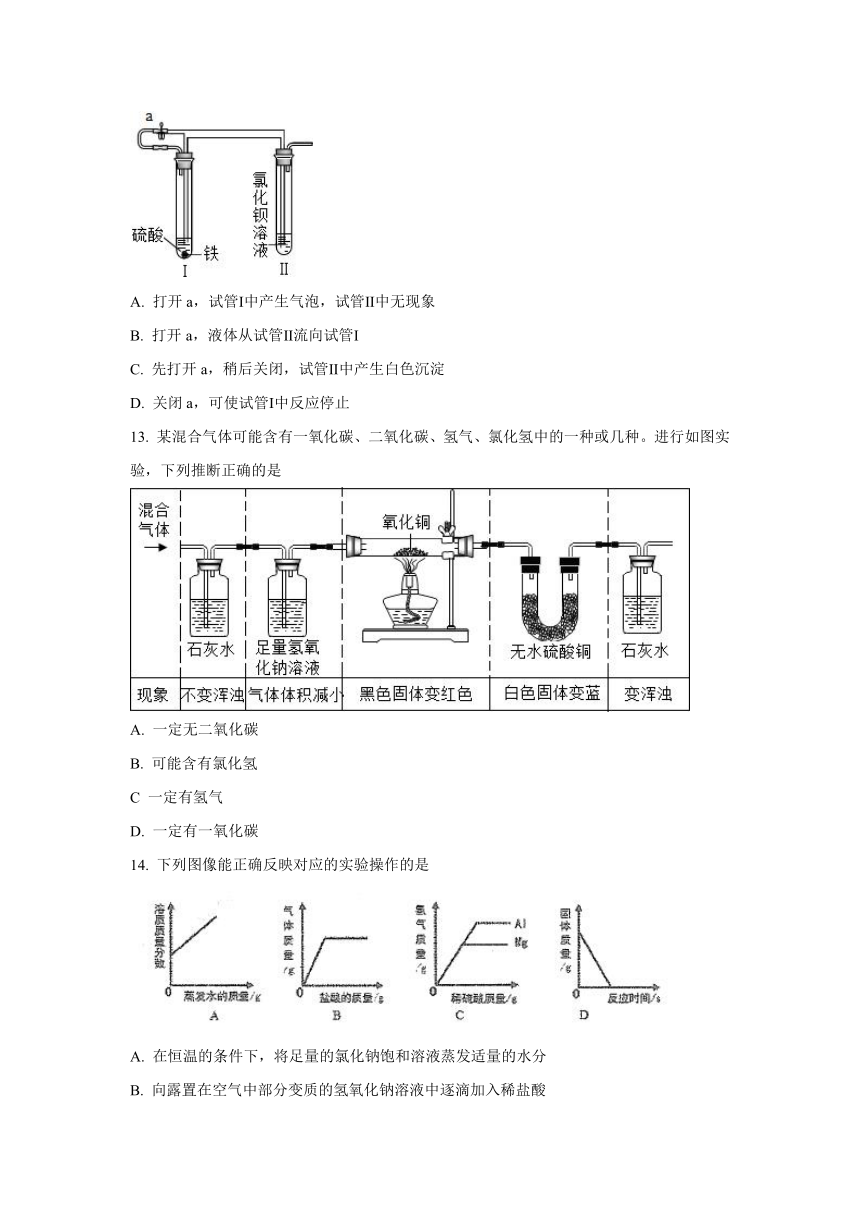

文档简介
上海交通大学附属中学2021-2022学年第一学期
高一化学摸底考试卷
相对原子质量:H-1
C-12
O-16
Mg-24
Al-27
S-32
Cl-35.5
Fe-56
Cu-64
一、选择题(每小题只有一个正确答案)
1.
“酸雨”成为当今主要的环境问题之一,雨水在未被污染的大气中原本应该呈
A.
弱酸性
B.
中性
C.
弱碱性
D.
强酸性
2.
中药的煎制直接关系到其疗效。下列制备中草药汤剂的步骤中,与过滤操作类似的是
甲
乙
丙
丁
A.
图甲冷水浸泡
B.
图乙加热煎制
C.
图丙箅渣取液
D.
图丁灌装保存
3.
在命名化学物质时,如果某元素的化合价不止一种,一般我们把其中比较稳定而且常见的化合价作为标准,化合价比它高的加上前缀“高”,化合价比它低的加上前缀“亚”,以此进行区分。据此,下列物质命名正确的是
A.
BaMnO4:锰酸钡
B.
Na2FeO4:铁酸钠
C.
Hg2Cl2:氯化汞
D.
CaHPO4:亚磷酸氢钙
4.
已知碘和氯有相似的化学性质。有一种的化合物可以称为碘酸碘。碘酸碘的化学式为:I(IO3)3,这种化合物中碘的化合价分别是
A.
+1和+5
B.
+3和+5
C.
-1和+5
D.
-1和+7
5.
如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是
A.
30℃时M的溶解度小于的溶解度
B.
M、N都是难溶物质
C.
P点表示t℃时M、N的溶解度相等
D.
阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
6.
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23%=35.453中
A.
75.77%表示35Cl的质量分数
B.
24.23%表示35Cl的丰度
C.
35.453表示氯元素的相对原子质量
D.
36.966表示37Cl的质量数
7.
“类推”是学习化学过程中常用的思维方法。现有以下类推结果,其中错误的是
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
④单质中只含一种元素,所以只含一种元素的物质一定是单质
A.
①
B.
①③
C.
①②④
D.
全部
8.
美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.
该微粒为电中性
B.
它是氢元素的一种新的核素
C.
它的化学式为H3
D.
它比一个普通H2分子多一个氢原子核
9.
实验方案能达到实验目的的是
A.
图1比较Zn和Fe的金属活动性强弱
B.
图2探究二氧化锰的催化作用
C.
图3比较红磷和白磷的着火点
D.
图4测定空气中O2的含量
10.
下列除去杂质的方法中,正确的是
选项
物质(括号内为杂质)
去除杂质的方法
A
N2(O2)
将气体缓慢通过灼热的碳粉
B
CaO(CaCO3)
加水、过滤
C
Fe(Zn)
加过量FeSO4溶液、过滤
D
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A
A
B.
B
C.
C
D.
D
11.
据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反……假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图
A
B.
C.
D.
12.
对于如图实验现象分析正确的是
A.
打开a,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.
打开a,液体从试管Ⅱ流向试管Ⅰ
C.
先打开a,稍后关闭,试管Ⅱ中产生白色沉淀
D.
关闭a,可使试管Ⅰ中反应停止
13.
某混合气体可能含有一氧化碳、二氧化碳、氢气、氯化氢中的一种或几种。进行如图实验,下列推断正确的是
A.
一定无二氧化碳
B.
可能含有氯化氢
C
一定有氢气
D.
一定有一氧化碳
14.
下列图像能正确反映对应的实验操作的是
A.
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.
向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸
C.
等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应
D.
向一定量的氧化铜中通入一氧化碳气体并加热
15.
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。根据实验事实绘制如图所示曲线,其中说法正确的是
A.
a至b段有蓝色沉淀生成
B.
a至d段硫酸钠质量不断增加
C
c至d段溶液pH不断减小
D.
c点比a点所含的溶质种类少
16.
密闭容器内有M、N、Q、Z四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表。下列说法中正确的是
物质
M
N
Q
Z
反应前质量(g)
19.7
8.7
31.6
0.4
反应后质量(g)
待测
17.4
0
3.6
A.
物质Q可能是化合物,物质Z可能是单质
B.
反应后密闭容器中M的质量为29.7g
C.
反应过程中,物质N与物质Z变化的质量比为87:36
D.
若M与Q的相对式量之比为197:158,则反应中M与Q的物质的量之比为1:2
17.
Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a
g,12C核素的质量为b
g,NA是阿伏加德罗常数,下列说法中错误的是(
)
A.
NA=
B.
WgHf的物质的量为mol
C.
Hf的摩尔质量为g/mol
D.
等物质的量的Hf、12C质量比为b∶a
18.
意大利化学家阿伏伽德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是
A.
气体体积:甲>乙
B.
原子数目:甲<乙
C.
分子数目:甲>乙
D.
摩尔质量:甲>乙
19.
已知t℃时,CuSO4的溶解度为sg/100gH2O,将sg无水CuSO4粉末加到CuSO4饱和溶液中,析出一定量的蓝色晶体,若要将该蓝色晶体溶解,则至少还应加入水的质量为
A.
(100+s)g
B.
(100-)g
C.
100g
D.
(100+)g
20.
元素M、R形成的简单离子M2-与R+的核外电子数之和为20,下列说法正确的是
A.
M原子的质子数一定大于R原子的质子数
B.
M可能存在16M、18M两种核素
C.
M2-与R+的电子层结构不可能相同
D.
两种离子结合可形成MR型化合物
二、综合分析题
21.
纳米级超细碳酸钙是一种新型超细固体材料,是橡胶、塑料制品、造纸、涂料、油墨等工业重要填料。工业上用石灰石来制备纳米级超细碳酸钙的流程如图,请回答下列问题:
(1)煅烧炉中发生反应的化学方程式是___。
(2)沉淀池中反应的基本类型属于___。操作1、2与实验室___操作类似,需要用到的玻璃仪器有___。
(3)上述流程中可循环使用的物质的化学式为___。
22.
某同学制取氧气,并回收提纯氯化钾和二氧化锰的流程如图。
(1)写出上述流程中制取氧气的化学方程式___。
(2)步骤Ⅱ中加适量水的目的___(填编号)。
a提高实验效率
b.保证固体1全部溶解
c.加快固体溶解速度
d.减少固体2的损失
(3)步骤Ⅱ中的操作m应选择图中____装置(选填“甲”或“乙”,下同),步骤Ⅳ中的操作n应选择图中___装置,操作n中玻璃棒的作用是___。
(4)实验结束后,称得回收到的二氧化锰的质量比原来氯酸钾中的大,可能的原因有___(写一点)。
(5)
该同学制取氧气时可选用的发生装置是___,收集装置是___(均填字母)。
23.
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(a)取少量粉末,加水溶解得无色溶液;(b)另取少量粉末,滴加稀盐酸,无明显现象。
(1)由实验(a)可确定原粉末中一定没有___;由实验(b)可确定原粉末中一定没有___。
(2)为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同)
原粉末的成分是___,写出无色溶液与X反应生成白色沉淀的化学方程式___。
24.
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)C原子的结构示意图为___、D离子的电子式为____、E离子的电子式为___。
(2)写出A分别与B、C、D所形成化合物的化学式:___、___、___。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于哪类物质?___、___。写出它们相互反应的化学方程式___。
25.
如图是甲、乙、丙三种物质的溶解度曲线。
(1)三种物质溶解度关系为甲<乙<丙时的温度为T℃,则T的取值范围为___。
(2)T4℃时,取相同质量的甲、乙、丙三种饱和溶液,恒温蒸发一定质量的水(析出晶体均不含结晶水),剩余溶液质量大小关系为:甲=乙<丙。则析出晶体质量大小关系为___。
(3)已知丙溶液在T2℃以下析出晶体含有结晶水,在T2℃以上析出的晶体不含结晶水,现将一定质量T1℃时丙的饱和溶液冷却至Ta℃或升高至Tb℃时,析出晶体质量相等,则三种温度下丙(指无水物)的溶解度S1、Sa、Sb的大小关系为___(填编号)。
a.S1>Sa>Sb
b.S1>Sa=Sb
c.S1>Sb>Sa
d.Sb>S1>Sa
上海交通大学附属中学2021-2022学年第一学期
高一化学摸底考试卷
答案
相对原子质量:H-1
C-12
O-16
Mg-24
Al-27
S-32
Cl-35.5
Fe-56
Cu-64
一、选择题(每小题只有一个正确答案)
1.
“酸雨”成为当今主要的环境问题之一,雨水在未被污染的大气中原本应该呈
A.
弱酸性
B.
中性
C.
弱碱性
D.
强酸性
答案:A
2.
中药的煎制直接关系到其疗效。下列制备中草药汤剂的步骤中,与过滤操作类似的是
甲
乙
丙
丁
A.
图甲冷水浸泡
B.
图乙加热煎制
C.
图丙箅渣取液
D.
图丁灌装保存
答案:C
3.
在命名化学物质时,如果某元素的化合价不止一种,一般我们把其中比较稳定而且常见的化合价作为标准,化合价比它高的加上前缀“高”,化合价比它低的加上前缀“亚”,以此进行区分。据此,下列物质命名正确的是
A.
BaMnO4:锰酸钡
B.
Na2FeO4:铁酸钠
C.
Hg2Cl2:氯化汞
D.
CaHPO4:亚磷酸氢钙
答案:A
4.
已知碘和氯有相似的化学性质。有一种的化合物可以称为碘酸碘。碘酸碘的化学式为:I(IO3)3,这种化合物中碘的化合价分别是
A.
+1和+5
B.
+3和+5
C.
-1和+5
D.
-1和+7
答案:B
5.
如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是
A.
30℃时M的溶解度小于的溶解度
B.
M、N都是难溶物质
C.
P点表示t℃时M、N的溶解度相等
D.
阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
答案:C
6.
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23%=35.453中
A.
75.77%表示35Cl的质量分数
B.
24.23%表示35Cl的丰度
C.
35.453表示氯元素的相对原子质量
D.
36.966表示37Cl的质量数
答案:C
7.
“类推”是学习化学过程中常用的思维方法。现有以下类推结果,其中错误的是
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
④单质中只含一种元素,所以只含一种元素的物质一定是单质
A.
①
B.
①③
C.
①②④
D.
全部
答案:D
8.
美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.
该微粒为电中性
B.
它是氢元素的一种新的核素
C.
它的化学式为H3
D.
它比一个普通H2分子多一个氢原子核
答案:D
9.
实验方案能达到实验目的的是
A.
图1比较Zn和Fe的金属活动性强弱
B.
图2探究二氧化锰的催化作用
C.
图3比较红磷和白磷的着火点
D.
图4测定空气中O2的含量
答案:B
10.
下列除去杂质的方法中,正确的是
选项
物质(括号内为杂质)
去除杂质的方法
A
N2(O2)
将气体缓慢通过灼热的碳粉
B
CaO(CaCO3)
加水、过滤
C
Fe(Zn)
加过量FeSO4溶液、过滤
D
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A
A
B.
B
C.
C
D.
D
答案:C
11.
据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反……假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图
A
B.
C.
D.
答案:D
12.
对于如图实验现象分析正确的是
A.
打开a,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.
打开a,液体从试管Ⅱ流向试管Ⅰ
C.
先打开a,稍后关闭,试管Ⅱ中产生白色沉淀
D.
关闭a,可使试管Ⅰ中反应停止
答案:C
13.
某混合气体可能含有一氧化碳、二氧化碳、氢气、氯化氢中的一种或几种。进行如图实验,下列推断正确的是
A.
一定无二氧化碳
B.
可能含有氯化氢
C
一定有氢气
D.
一定有一氧化碳
答案:D
14.
下列图像能正确反映对应的实验操作的是
A.
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.
向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸
C.
等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应
D.
向一定量的氧化铜中通入一氧化碳气体并加热
答案:C
15.
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。根据实验事实绘制如图所示曲线,其中说法正确的是
A.
a至b段有蓝色沉淀生成
B.
a至d段硫酸钠质量不断增加
C
c至d段溶液pH不断减小
D.
c点比a点所含的溶质种类少
答案:D
16.
密闭容器内有M、N、Q、Z四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表。下列说法中正确的是
物质
M
N
Q
Z
反应前质量(g)
19.7
8.7
31.6
0.4
反应后质量(g)
待测
17.4
0
3.6
A.
物质Q可能是化合物,物质Z可能是单质
B.
反应后密闭容器中M的质量为29.7g
C.
反应过程中,物质N与物质Z变化的质量比为87:36
D.
若M与Q的相对式量之比为197:158,则反应中M与Q的物质的量之比为1:2
答案:D
17.
Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a
g,12C核素的质量为b
g,NA是阿伏加德罗常数,下列说法中错误的是(
)
A.
NA=
B.
WgHf的物质的量为mol
C.
Hf的摩尔质量为g/mol
D.
等物质的量的Hf、12C质量比为b∶a
答案:D
18.
意大利化学家阿伏伽德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是
A.
气体体积:甲>乙
B.
原子数目:甲<乙
C.
分子数目:甲>乙
D.
摩尔质量:甲>乙
答案:D
19.
已知t℃时,CuSO4的溶解度为sg/100gH2O,将sg无水CuSO4粉末加到CuSO4饱和溶液中,析出一定量的蓝色晶体,若要将该蓝色晶体溶解,则至少还应加入水的质量为
A.
(100+s)g
B.
(100-)g
C.
100g
D.
(100+)g
答案:C
20.
元素M、R形成的简单离子M2-与R+的核外电子数之和为20,下列说法正确的是
A.
M原子的质子数一定大于R原子的质子数
B.
M可能存在16M、18M两种核素
C.
M2-与R+的电子层结构不可能相同
D.
两种离子结合可形成MR型化合物
答案:B
二、综合分析题
21.
纳米级超细碳酸钙是一种新型超细固体材料,是橡胶、塑料制品、造纸、涂料、油墨等工业重要填料。工业上用石灰石来制备纳米级超细碳酸钙的流程如图,请回答下列问题:
(1)煅烧炉中发生反应的化学方程式是___。
(2)沉淀池中反应的基本类型属于___。操作1、2与实验室___操作类似,需要用到的玻璃仪器有___。
(3)上述流程中可循环使用的物质的化学式为___。
答案:(1)CaCO3CaO+CO2↑
(2)
①.
化合反应
②.
过滤
③.
烧杯、漏斗和玻璃棒
(3)CO2、H2O
22.
某同学制取氧气,并回收提纯氯化钾和二氧化锰的流程如图。
(1)写出上述流程中制取氧气的化学方程式___。
(2)步骤Ⅱ中加适量水的目的___(填编号)。
a提高实验效率
b.保证固体1全部溶解
c.加快固体溶解速度
d.减少固体2的损失
(3)步骤Ⅱ中的操作m应选择图中____装置(选填“甲”或“乙”,下同),步骤Ⅳ中的操作n应选择图中___装置,操作n中玻璃棒的作用是___。
(4)实验结束后,称得回收到的二氧化锰的质量比原来氯酸钾中的大,可能的原因有___(写一点)。
(5)
该同学制取氧气时可选用的发生装置是___,收集装置是___(均填字母)。
答案:(1)2KClO32KCl+3O2↑
(2)ab
(3)
①.
甲
②.
乙
③.
搅拌溶液,防止飞溅
(4)没有进行洗涤操作或者洗涤不干净
(5)
①.
A
②.
D或者F
23.
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(a)取少量粉末,加水溶解得无色溶液;(b)另取少量粉末,滴加稀盐酸,无明显现象。
(1)由实验(a)可确定原粉末中一定没有___;由实验(b)可确定原粉末中一定没有___。
(2)为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同)
原粉末的成分是___,写出无色溶液与X反应生成白色沉淀的化学方程式___。
答案:(1)
①.
CuSO4
②.
Na2CO3
(2)
①.
Na2SO4
②.
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
24.
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)C原子的结构示意图为___、D离子的电子式为____、E离子的电子式为___。
(2)写出A分别与B、C、D所形成化合物的化学式:___、___、___。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于哪类物质?___、___。写出它们相互反应的化学方程式___。
答案:(1)
①.
②.
③.
Na+
(2)
①.
CH4
②.
NH3
③.
H2O
(3)
①.
盐
②.
碱
③.
NH4NO3+NaOH=NH3+H2O+NaNO3
25.
如图是甲、乙、丙三种物质的溶解度曲线。
(1)三种物质溶解度关系为甲<乙<丙时的温度为T℃,则T的取值范围为___。
(2)T4℃时,取相同质量的甲、乙、丙三种饱和溶液,恒温蒸发一定质量的水(析出晶体均不含结晶水),剩余溶液质量大小关系为:甲=乙<丙。则析出晶体质量大小关系为___。
(3)已知丙溶液在T2℃以下析出晶体含有结晶水,在T2℃以上析出的晶体不含结晶水,现将一定质量T1℃时丙的饱和溶液冷却至Ta℃或升高至Tb℃时,析出晶体质量相等,则三种温度下丙(指无水物)的溶解度S1、Sa、Sb的大小关系为___(填编号)。
a.S1>Sa>Sb
b.S1>Sa=Sb
c.S1>Sb>Sa
d.Sb>S1>Sa
答案:(1)T1~T3
(2)甲>乙>丙
(3)c
高一化学摸底考试卷
相对原子质量:H-1
C-12
O-16
Mg-24
Al-27
S-32
Cl-35.5
Fe-56
Cu-64
一、选择题(每小题只有一个正确答案)
1.
“酸雨”成为当今主要的环境问题之一,雨水在未被污染的大气中原本应该呈
A.
弱酸性
B.
中性
C.
弱碱性
D.
强酸性
2.
中药的煎制直接关系到其疗效。下列制备中草药汤剂的步骤中,与过滤操作类似的是
甲
乙
丙
丁
A.
图甲冷水浸泡
B.
图乙加热煎制
C.
图丙箅渣取液
D.
图丁灌装保存
3.
在命名化学物质时,如果某元素的化合价不止一种,一般我们把其中比较稳定而且常见的化合价作为标准,化合价比它高的加上前缀“高”,化合价比它低的加上前缀“亚”,以此进行区分。据此,下列物质命名正确的是
A.
BaMnO4:锰酸钡
B.
Na2FeO4:铁酸钠
C.
Hg2Cl2:氯化汞
D.
CaHPO4:亚磷酸氢钙
4.
已知碘和氯有相似的化学性质。有一种的化合物可以称为碘酸碘。碘酸碘的化学式为:I(IO3)3,这种化合物中碘的化合价分别是
A.
+1和+5
B.
+3和+5
C.
-1和+5
D.
-1和+7
5.
如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是
A.
30℃时M的溶解度小于的溶解度
B.
M、N都是难溶物质
C.
P点表示t℃时M、N的溶解度相等
D.
阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
6.
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23%=35.453中
A.
75.77%表示35Cl的质量分数
B.
24.23%表示35Cl的丰度
C.
35.453表示氯元素的相对原子质量
D.
36.966表示37Cl的质量数
7.
“类推”是学习化学过程中常用的思维方法。现有以下类推结果,其中错误的是
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
④单质中只含一种元素,所以只含一种元素的物质一定是单质
A.
①
B.
①③
C.
①②④
D.
全部
8.
美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.
该微粒为电中性
B.
它是氢元素的一种新的核素
C.
它的化学式为H3
D.
它比一个普通H2分子多一个氢原子核
9.
实验方案能达到实验目的的是
A.
图1比较Zn和Fe的金属活动性强弱
B.
图2探究二氧化锰的催化作用
C.
图3比较红磷和白磷的着火点
D.
图4测定空气中O2的含量
10.
下列除去杂质的方法中,正确的是
选项
物质(括号内为杂质)
去除杂质的方法
A
N2(O2)
将气体缓慢通过灼热的碳粉
B
CaO(CaCO3)
加水、过滤
C
Fe(Zn)
加过量FeSO4溶液、过滤
D
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A
A
B.
B
C.
C
D.
D
11.
据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反……假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图
A
B.
C.
D.
12.
对于如图实验现象分析正确的是
A.
打开a,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.
打开a,液体从试管Ⅱ流向试管Ⅰ
C.
先打开a,稍后关闭,试管Ⅱ中产生白色沉淀
D.
关闭a,可使试管Ⅰ中反应停止
13.
某混合气体可能含有一氧化碳、二氧化碳、氢气、氯化氢中的一种或几种。进行如图实验,下列推断正确的是
A.
一定无二氧化碳
B.
可能含有氯化氢
C
一定有氢气
D.
一定有一氧化碳
14.
下列图像能正确反映对应的实验操作的是
A.
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.
向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸
C.
等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应
D.
向一定量的氧化铜中通入一氧化碳气体并加热
15.
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。根据实验事实绘制如图所示曲线,其中说法正确的是
A.
a至b段有蓝色沉淀生成
B.
a至d段硫酸钠质量不断增加
C
c至d段溶液pH不断减小
D.
c点比a点所含的溶质种类少
16.
密闭容器内有M、N、Q、Z四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表。下列说法中正确的是
物质
M
N
Q
Z
反应前质量(g)
19.7
8.7
31.6
0.4
反应后质量(g)
待测
17.4
0
3.6
A.
物质Q可能是化合物,物质Z可能是单质
B.
反应后密闭容器中M的质量为29.7g
C.
反应过程中,物质N与物质Z变化的质量比为87:36
D.
若M与Q的相对式量之比为197:158,则反应中M与Q的物质的量之比为1:2
17.
Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a
g,12C核素的质量为b
g,NA是阿伏加德罗常数,下列说法中错误的是(
)
A.
NA=
B.
WgHf的物质的量为mol
C.
Hf的摩尔质量为g/mol
D.
等物质的量的Hf、12C质量比为b∶a
18.
意大利化学家阿伏伽德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是
A.
气体体积:甲>乙
B.
原子数目:甲<乙
C.
分子数目:甲>乙
D.
摩尔质量:甲>乙
19.
已知t℃时,CuSO4的溶解度为sg/100gH2O,将sg无水CuSO4粉末加到CuSO4饱和溶液中,析出一定量的蓝色晶体,若要将该蓝色晶体溶解,则至少还应加入水的质量为
A.
(100+s)g
B.
(100-)g
C.
100g
D.
(100+)g
20.
元素M、R形成的简单离子M2-与R+的核外电子数之和为20,下列说法正确的是
A.
M原子的质子数一定大于R原子的质子数
B.
M可能存在16M、18M两种核素
C.
M2-与R+的电子层结构不可能相同
D.
两种离子结合可形成MR型化合物
二、综合分析题
21.
纳米级超细碳酸钙是一种新型超细固体材料,是橡胶、塑料制品、造纸、涂料、油墨等工业重要填料。工业上用石灰石来制备纳米级超细碳酸钙的流程如图,请回答下列问题:
(1)煅烧炉中发生反应的化学方程式是___。
(2)沉淀池中反应的基本类型属于___。操作1、2与实验室___操作类似,需要用到的玻璃仪器有___。
(3)上述流程中可循环使用的物质的化学式为___。
22.
某同学制取氧气,并回收提纯氯化钾和二氧化锰的流程如图。
(1)写出上述流程中制取氧气的化学方程式___。
(2)步骤Ⅱ中加适量水的目的___(填编号)。
a提高实验效率
b.保证固体1全部溶解
c.加快固体溶解速度
d.减少固体2的损失
(3)步骤Ⅱ中的操作m应选择图中____装置(选填“甲”或“乙”,下同),步骤Ⅳ中的操作n应选择图中___装置,操作n中玻璃棒的作用是___。
(4)实验结束后,称得回收到的二氧化锰的质量比原来氯酸钾中的大,可能的原因有___(写一点)。
(5)
该同学制取氧气时可选用的发生装置是___,收集装置是___(均填字母)。
23.
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(a)取少量粉末,加水溶解得无色溶液;(b)另取少量粉末,滴加稀盐酸,无明显现象。
(1)由实验(a)可确定原粉末中一定没有___;由实验(b)可确定原粉末中一定没有___。
(2)为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同)
原粉末的成分是___,写出无色溶液与X反应生成白色沉淀的化学方程式___。
24.
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)C原子的结构示意图为___、D离子的电子式为____、E离子的电子式为___。
(2)写出A分别与B、C、D所形成化合物的化学式:___、___、___。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于哪类物质?___、___。写出它们相互反应的化学方程式___。
25.
如图是甲、乙、丙三种物质的溶解度曲线。
(1)三种物质溶解度关系为甲<乙<丙时的温度为T℃,则T的取值范围为___。
(2)T4℃时,取相同质量的甲、乙、丙三种饱和溶液,恒温蒸发一定质量的水(析出晶体均不含结晶水),剩余溶液质量大小关系为:甲=乙<丙。则析出晶体质量大小关系为___。
(3)已知丙溶液在T2℃以下析出晶体含有结晶水,在T2℃以上析出的晶体不含结晶水,现将一定质量T1℃时丙的饱和溶液冷却至Ta℃或升高至Tb℃时,析出晶体质量相等,则三种温度下丙(指无水物)的溶解度S1、Sa、Sb的大小关系为___(填编号)。
a.S1>Sa>Sb
b.S1>Sa=Sb
c.S1>Sb>Sa
d.Sb>S1>Sa
上海交通大学附属中学2021-2022学年第一学期
高一化学摸底考试卷
答案
相对原子质量:H-1
C-12
O-16
Mg-24
Al-27
S-32
Cl-35.5
Fe-56
Cu-64
一、选择题(每小题只有一个正确答案)
1.
“酸雨”成为当今主要的环境问题之一,雨水在未被污染的大气中原本应该呈
A.
弱酸性
B.
中性
C.
弱碱性
D.
强酸性
答案:A
2.
中药的煎制直接关系到其疗效。下列制备中草药汤剂的步骤中,与过滤操作类似的是
甲
乙
丙
丁
A.
图甲冷水浸泡
B.
图乙加热煎制
C.
图丙箅渣取液
D.
图丁灌装保存
答案:C
3.
在命名化学物质时,如果某元素的化合价不止一种,一般我们把其中比较稳定而且常见的化合价作为标准,化合价比它高的加上前缀“高”,化合价比它低的加上前缀“亚”,以此进行区分。据此,下列物质命名正确的是
A.
BaMnO4:锰酸钡
B.
Na2FeO4:铁酸钠
C.
Hg2Cl2:氯化汞
D.
CaHPO4:亚磷酸氢钙
答案:A
4.
已知碘和氯有相似的化学性质。有一种的化合物可以称为碘酸碘。碘酸碘的化学式为:I(IO3)3,这种化合物中碘的化合价分别是
A.
+1和+5
B.
+3和+5
C.
-1和+5
D.
-1和+7
答案:B
5.
如图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是
A.
30℃时M的溶解度小于的溶解度
B.
M、N都是难溶物质
C.
P点表示t℃时M、N的溶解度相等
D.
阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
答案:C
6.
氯元素在自然界有35Cl和37Cl两种同位素,在计算式:34.969×75.77%+36.966×24.23%=35.453中
A.
75.77%表示35Cl的质量分数
B.
24.23%表示35Cl的丰度
C.
35.453表示氯元素的相对原子质量
D.
36.966表示37Cl的质量数
答案:C
7.
“类推”是学习化学过程中常用的思维方法。现有以下类推结果,其中错误的是
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
④单质中只含一种元素,所以只含一种元素的物质一定是单质
A.
①
B.
①③
C.
①②④
D.
全部
答案:D
8.
美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新粒子是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法正确的是
A.
该微粒为电中性
B.
它是氢元素的一种新的核素
C.
它的化学式为H3
D.
它比一个普通H2分子多一个氢原子核
答案:D
9.
实验方案能达到实验目的的是
A.
图1比较Zn和Fe的金属活动性强弱
B.
图2探究二氧化锰的催化作用
C.
图3比较红磷和白磷的着火点
D.
图4测定空气中O2的含量
答案:B
10.
下列除去杂质的方法中,正确的是
选项
物质(括号内为杂质)
去除杂质的方法
A
N2(O2)
将气体缓慢通过灼热的碳粉
B
CaO(CaCO3)
加水、过滤
C
Fe(Zn)
加过量FeSO4溶液、过滤
D
H2SO4(HNO3)
加Ba(NO3)2溶液、过滤
A
A
B.
B
C.
C
D.
D
答案:C
11.
据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反……假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图
A
B.
C.
D.
答案:D
12.
对于如图实验现象分析正确的是
A.
打开a,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.
打开a,液体从试管Ⅱ流向试管Ⅰ
C.
先打开a,稍后关闭,试管Ⅱ中产生白色沉淀
D.
关闭a,可使试管Ⅰ中反应停止
答案:C
13.
某混合气体可能含有一氧化碳、二氧化碳、氢气、氯化氢中的一种或几种。进行如图实验,下列推断正确的是
A.
一定无二氧化碳
B.
可能含有氯化氢
C
一定有氢气
D.
一定有一氧化碳
答案:D
14.
下列图像能正确反映对应的实验操作的是
A.
在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.
向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸
C.
等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应
D.
向一定量的氧化铜中通入一氧化碳气体并加热
答案:C
15.
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。根据实验事实绘制如图所示曲线,其中说法正确的是
A.
a至b段有蓝色沉淀生成
B.
a至d段硫酸钠质量不断增加
C
c至d段溶液pH不断减小
D.
c点比a点所含的溶质种类少
答案:D
16.
密闭容器内有M、N、Q、Z四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表。下列说法中正确的是
物质
M
N
Q
Z
反应前质量(g)
19.7
8.7
31.6
0.4
反应后质量(g)
待测
17.4
0
3.6
A.
物质Q可能是化合物,物质Z可能是单质
B.
反应后密闭容器中M的质量为29.7g
C.
反应过程中,物质N与物质Z变化的质量比为87:36
D.
若M与Q的相对式量之比为197:158,则反应中M与Q的物质的量之比为1:2
答案:D
17.
Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a
g,12C核素的质量为b
g,NA是阿伏加德罗常数,下列说法中错误的是(
)
A.
NA=
B.
WgHf的物质的量为mol
C.
Hf的摩尔质量为g/mol
D.
等物质的量的Hf、12C质量比为b∶a
答案:D
18.
意大利化学家阿伏伽德罗在化学上的重大贡献是建立分子学说,他提出:同温同压下,相同体积的任何气体含有相同数目的分子。现有两个密闭容器,分别装有等质量的甲、乙两种气体,若两容器内气体的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是
A.
气体体积:甲>乙
B.
原子数目:甲<乙
C.
分子数目:甲>乙
D.
摩尔质量:甲>乙
答案:D
19.
已知t℃时,CuSO4的溶解度为sg/100gH2O,将sg无水CuSO4粉末加到CuSO4饱和溶液中,析出一定量的蓝色晶体,若要将该蓝色晶体溶解,则至少还应加入水的质量为
A.
(100+s)g
B.
(100-)g
C.
100g
D.
(100+)g
答案:C
20.
元素M、R形成的简单离子M2-与R+的核外电子数之和为20,下列说法正确的是
A.
M原子的质子数一定大于R原子的质子数
B.
M可能存在16M、18M两种核素
C.
M2-与R+的电子层结构不可能相同
D.
两种离子结合可形成MR型化合物
答案:B
二、综合分析题
21.
纳米级超细碳酸钙是一种新型超细固体材料,是橡胶、塑料制品、造纸、涂料、油墨等工业重要填料。工业上用石灰石来制备纳米级超细碳酸钙的流程如图,请回答下列问题:
(1)煅烧炉中发生反应的化学方程式是___。
(2)沉淀池中反应的基本类型属于___。操作1、2与实验室___操作类似,需要用到的玻璃仪器有___。
(3)上述流程中可循环使用的物质的化学式为___。
答案:(1)CaCO3CaO+CO2↑
(2)
①.
化合反应
②.
过滤
③.
烧杯、漏斗和玻璃棒
(3)CO2、H2O
22.
某同学制取氧气,并回收提纯氯化钾和二氧化锰的流程如图。
(1)写出上述流程中制取氧气的化学方程式___。
(2)步骤Ⅱ中加适量水的目的___(填编号)。
a提高实验效率
b.保证固体1全部溶解
c.加快固体溶解速度
d.减少固体2的损失
(3)步骤Ⅱ中的操作m应选择图中____装置(选填“甲”或“乙”,下同),步骤Ⅳ中的操作n应选择图中___装置,操作n中玻璃棒的作用是___。
(4)实验结束后,称得回收到的二氧化锰的质量比原来氯酸钾中的大,可能的原因有___(写一点)。
(5)
该同学制取氧气时可选用的发生装置是___,收集装置是___(均填字母)。
答案:(1)2KClO32KCl+3O2↑
(2)ab
(3)
①.
甲
②.
乙
③.
搅拌溶液,防止飞溅
(4)没有进行洗涤操作或者洗涤不干净
(5)
①.
A
②.
D或者F
23.
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。现做如下实验:(a)取少量粉末,加水溶解得无色溶液;(b)另取少量粉末,滴加稀盐酸,无明显现象。
(1)由实验(a)可确定原粉末中一定没有___;由实验(b)可确定原粉末中一定没有___。
(2)为进一步确定原粉末的组成,另取少量粉末按如图所示进行实验:(每步所加试剂均不同)
原粉末的成分是___,写出无色溶液与X反应生成白色沉淀的化学方程式___。
答案:(1)
①.
CuSO4
②.
Na2CO3
(2)
①.
Na2SO4
②.
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3
24.
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)C原子的结构示意图为___、D离子的电子式为____、E离子的电子式为___。
(2)写出A分别与B、C、D所形成化合物的化学式:___、___、___。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于哪类物质?___、___。写出它们相互反应的化学方程式___。
答案:(1)
①.
②.
③.
Na+
(2)
①.
CH4
②.
NH3
③.
H2O
(3)
①.
盐
②.
碱
③.
NH4NO3+NaOH=NH3+H2O+NaNO3
25.
如图是甲、乙、丙三种物质的溶解度曲线。
(1)三种物质溶解度关系为甲<乙<丙时的温度为T℃,则T的取值范围为___。
(2)T4℃时,取相同质量的甲、乙、丙三种饱和溶液,恒温蒸发一定质量的水(析出晶体均不含结晶水),剩余溶液质量大小关系为:甲=乙<丙。则析出晶体质量大小关系为___。
(3)已知丙溶液在T2℃以下析出晶体含有结晶水,在T2℃以上析出的晶体不含结晶水,现将一定质量T1℃时丙的饱和溶液冷却至Ta℃或升高至Tb℃时,析出晶体质量相等,则三种温度下丙(指无水物)的溶解度S1、Sa、Sb的大小关系为___(填编号)。
a.S1>Sa>Sb
b.S1>Sa=Sb
c.S1>Sb>Sa
d.Sb>S1>Sa
答案:(1)T1~T3
(2)甲>乙>丙
(3)c
同课章节目录
