2.2重要的酸(酸的通性)(含答案)
文档属性
| 名称 | 2.2重要的酸(酸的通性)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 141.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-23 11:51:12 | ||
图片预览


文档简介
2021-2022学年华师大版科学酸的通性
一.选择题(共9小题)
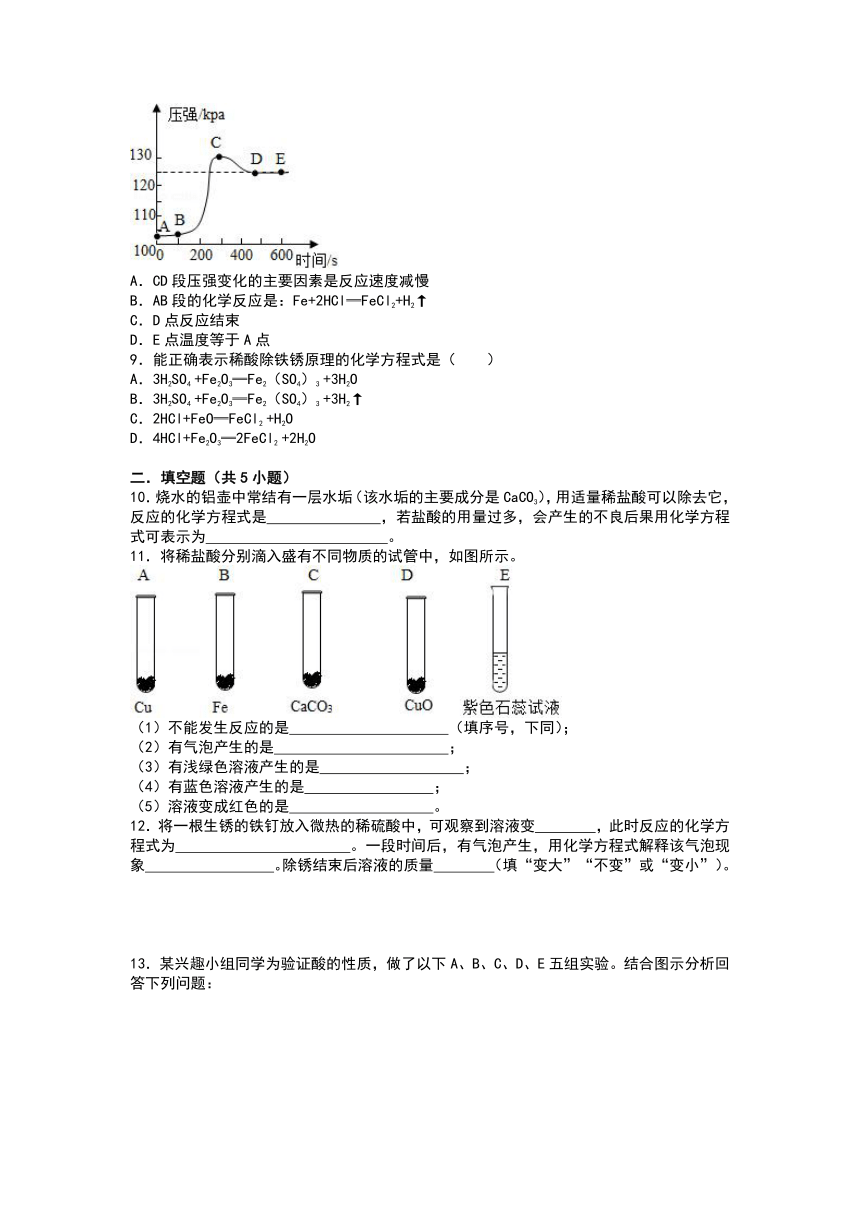
1.向下列物质中加入稀盐酸,无明显现象的是( )
A.Fe2O3粉末
B.滴有酚酞的NaOH溶液
C.Ag
D.NaHCO3溶液
2.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
3.物质X可发生下列所示的两个反应,则X可能是( )
①X+碱→盐+水
②X+金属氧化物→盐+水.
A.CaO
B.CO2
C.NaOH
D.H2SO4
4.下列变化不能通过加稀盐酸反应实现的是( )
A.Al→AlCl3
B.Fe→FeCl2
C.CaCO3→CaCl2
D.Fe→FeCl3
5.将下列各组内的物质混合,所得溶液的质量比反应前溶液质量减少的是( )
A.氢氧化钠溶液和稀硫酸
B.氯化钡溶液和稀硫酸
C.氧化铜和稀盐酸
D.碳酸钠粉末和稀盐酸
6.要使如图装置中的小球扁下来,使用的固体和液体可以是( )
A.小苏打和稀盐酸
B.硝酸铵和水
C.生石灰和水
D.镁和稀硫酸
7.按图所示装置,将液体x注入装有固体y的试管中,会导致U形管中右端液面降低。则可能的组合是( )
选项
x
y
A
水
硝酸铵
B
稀硫酸
氢氧化钠
C
水
氧化钙
D
稀盐酸
镁
A.A
B.B
C.C
D.D
8.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.CD段压强变化的主要因素是反应速度减慢
B.AB段的化学反应是:Fe+2HCl═FeCl2+H2↑
C.D点反应结束
D.E点温度等于A点
9.能正确表示稀酸除铁锈原理的化学方程式是( )
A.3H2SO4
+Fe2O3═Fe2(SO4)3
+3H2O
B.3H2SO4
+Fe2O3═Fe2(SO4)3
+3H2↑
C.2HCl+FeO═FeCl2
+H2O
D.4HCl+Fe2O3═2FeCl2
+2H2O
二.填空题(共5小题)
10.烧水的铝壶中常结有一层水垢(该水垢的主要成分是CaCO3),用适量稀盐酸可以除去它,反应的化学方程式是
,若盐酸的用量过多,会产生的不良后果用化学方程式可表示为
。
11.将稀盐酸分别滴入盛有不同物质的试管中,如图所示。
(1)不能发生反应的是
(填序号,下同);
(2)有气泡产生的是
;
(3)有浅绿色溶液产生的是
;
(4)有蓝色溶液产生的是
;
(5)溶液变成红色的是
。
12.将一根生锈的铁钉放入微热的稀硫酸中,可观察到溶液变
,此时反应的化学方程式为
。一段时间后,有气泡产生,用化学方程式解释该气泡现象
。除锈结束后溶液的质量
(填“变大”“不变”或“变小”)。
13.某兴趣小组同学为验证酸的性质,做了以下A、B、C、D、E五组实验。结合图示分析回答下列问题:
(1)A组试管中都有氢气产生,结合图2分析,该微粒转化过程是Mg原子失去电子变成Mg2+,H+ (填“失去”或“得到”)电子变成H2;
(2)B组试管中实验现象相同。写出其中任一试管中发生反应的化学方程式
;
(3)能证明C组试管中发生反应的现象是
;
(4)E组试管中都能产生使澄清石灰水变浑浊的气体,其原因是
;
(5)上述五组实验中没有体现酸的通性的一组是
(填字母序号)。
14.小芳结合所学有关酸、碱的知识,用图1总结了盐酸的四条化学性质(即盐酸与这四类物质能够发生化学反应)。
(1)为了验证性质①,小芳将紫色石蕊试液滴入盐酸溶液中,溶液变成
色。
(2)依据性质②,盐酸常用于金属的除锈,用盐酸除去生锈铁钉表面铁锈的反应的化学方程式为
。
(3)小明用微观示意图(图2)来说明性质③反应的发生过程,用化学反应方程式表示为
。从该图可以看出,该反应的微观实质是:
。
4)为了验证性质④反应能够发生,你选择的物质是
。
A.Na2CO3
B.HCl
C.CuSO4
D.NaCl
三.解答题(共4小题)
15.进行如图微型实验,研究物质的性质。
(1)能产生气泡的烧杯是
(填序号)。
(2)有一只烧杯中发生中和反应,写出反应的化学方程式
,恰好完全反应的现象是
。
16.构建知识网络可以帮助我们理解知识间的内在联系,如图是稀硫酸与不同类别物质之间反应的知识网络图,请回答下列有关问题。
(1)氧化铜与硫酸反应,现象为氧化铜逐渐溶解,溶液出无色逐渐变为
;
(2)反应③的实质是稀硫酸中的H+与M中的
(写离子符号)反应生成水;
(3)写出符合反应④,且有沉淀生成的一个化学反应的方程式
。
17.如图1以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题:
(1)通过反应③的原理,Ca(OH)2在农业上可
。
(2)反应⑤的化学方程式为:
。
(3)图中只生成盐和水的反应有
(填序号)。
(4)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是BaCl2、CuSO4、Na2CO3中的
。
(5)在如图2五组实验中没有体现酸的通性的是
(填序号)。
18.硫酸、盐酸是重要的化工原料。
(1)浓硫酸滴在蔗糖上,蔗糖发黑,因为浓硫酸有
性。
(2)写出稀硫酸与下列物质反应的化学方程式:
①与铁粉反应:
。
②与碳酸钾溶液反应:
。
③与硝酸钡溶液反应:
;上述反应中,属于酸的共同性质的是 (填编号)。
(3)硫酸的下列用途中,不能用盐酸代替硫酸的是
(填编号)。
①金属表面除锈
②制造泻药硫酸锌
③除去水垢
④除去Na2SO4中的少量NaOH
2021-2022学年华师大版科学酸的通性
参考答案与试题解析
一.选择题(共9小题)
1.C。
2.B。
3.D。
4.D。
5.B。
6.B。
7.A。
8.D。
9.A。
二.填空题(共5小题)
10.CaCO3+2HCl=CaCl2+H2O+CO2↑;2Al+6HCl═2AlCl3+3H2↑。
11.(1)A;
(2)BC;
(3)B;
(4)D;
(5)E。
12.铁锈消失,溶液由无色变为黄色;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4═FeSO4+H2↑;变大。
13.解:(1)氢离子得到电子形成氢原子,每两个氢原子再构成一个氢分子;故填:得到;
(2)氧化铁能与稀盐酸反应生成氯化铁和水、稀硫酸反应生成硫酸铁和水,它们反应的化学方程式分别为:Fe2O3+6HCl═2FeCl3+3H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;故填:Fe2O3+6HCl═2FeCl3+3H2O或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)氢氧化钠与硫酸反应生成硫酸钠和水,与盐酸反应生成氯化钠和水,氢氧化钠被完全中和后,溶液呈中性,所以可以观察到试管中的红色逐渐消失;故填:红色逐渐消失;
(4)碳酸钠和碳酸钾都是碳酸盐,都含有碳酸根离子,能与酸反应生成二氧化碳气体;故填:碳酸钾和碳酸钠中都含有碳酸根离子;
(5)酸能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,盐酸与硝酸盐反应,硫酸与盐酸盐反应,故五组实验中没有体现酸的通性的是D.故填:D。
14.(1)红;(2)6HCl+Fe2O3═2FeCl3+3H2O;
(3)HCl+NaOH=NaCl+H2O;氢离子和氢氧根离子结合生成水分子;(4)A。
三.解答题(共4小题)
15.(1)BD;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;
溶液由红色变为无色。
16.(1)蓝色;
(2)OH﹣;
(3)H2SO4+BaCl2=BaSO4↓+2HCl(合理即可)。
17.解:(1)氢氧化钙是一种碱,能与酸反应生成盐和水,所以在农业上可以用氢氧化钙来改良酸性土壤;故填:改良酸性土壤;
(2)⑤中盐酸与氧化铝反应生成氯化铝和水,反应的化学方程式为Al2O3+6HCl═2AlCl3+3H2O;故填:Al2O3+6HCl═2AlCl3+3H2O;
(3)酸碱中和反应生成盐和水,酸和金属氧化物反应生成盐和水,图示中能生成盐和水的反应有③⑤;故填:③⑤;
(4)X与稀盐酸、氢氧化钙的反应属于复分解反应,要求生成物中有沉淀、气体或水生成。氯化钡与不能与盐酸、氢氧化钙反应;硫酸铜与盐酸不反应,与氢氧化钙反应生成氢氧化铜蓝色沉淀和硫酸钙;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;故填:Na2CO3;
(5)酸能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,但是盐酸与氯化钡溶液不反应,故五组实验中没有体现酸的通性的是D.故填:D。
18.解:(1)浓硫酸滴在蔗糖上,蔗糖发黑,因为浓硫酸有脱水性。
故填:脱水。
(2)①稀硫酸与铁粉反应生成硫酸亚铁和氢气,反应的化学方程式:Fe+H2SO4═FeSO4+H2↑。
故填:Fe+H2SO4═FeSO4+H2↑。
②稀硫酸与碳酸钾反应生成硫酸钾、水和二氧化碳,反应的化学方程式:K2CO3+H2SO4═K2SO4+H2O+CO2↑。
故填:K2CO3+H2SO4═K2SO4+H2O+CO2↑。
③稀硫酸与硝酸钡反应生成硫酸钡沉淀和硝酸,反应的化学方程式:Ba(NO3)2+H2SO4═BaSO4↓+2HNO3;
上述反应中,属于酸的共同性质的是①②,即酸能和比较活泼的金属单质反应,能和碳酸盐反应。
故填:Ba(NO3)2+H2SO4═BaSO4↓+2HNO3;①②。
(3)硫酸的下列用途中,不能用盐酸代替硫酸的是制造泻药硫酸锌(利用盐酸时得到氯化锌),除去Na2SO4中的少量NaOH(盐酸和氢氧化钠反应生成氯化钠等物质)。
故填:②④。
一.选择题(共9小题)
1.向下列物质中加入稀盐酸,无明显现象的是( )
A.Fe2O3粉末
B.滴有酚酞的NaOH溶液
C.Ag
D.NaHCO3溶液
2.下列物质间不能发生反应的是( )
A.稀盐酸和镁条
B.稀盐酸和铜丝
C.稀盐酸和氢氧化镁
D.稀盐酸和氢氧化铜
3.物质X可发生下列所示的两个反应,则X可能是( )
①X+碱→盐+水
②X+金属氧化物→盐+水.
A.CaO
B.CO2
C.NaOH
D.H2SO4
4.下列变化不能通过加稀盐酸反应实现的是( )
A.Al→AlCl3
B.Fe→FeCl2
C.CaCO3→CaCl2
D.Fe→FeCl3
5.将下列各组内的物质混合,所得溶液的质量比反应前溶液质量减少的是( )
A.氢氧化钠溶液和稀硫酸
B.氯化钡溶液和稀硫酸
C.氧化铜和稀盐酸
D.碳酸钠粉末和稀盐酸
6.要使如图装置中的小球扁下来,使用的固体和液体可以是( )
A.小苏打和稀盐酸
B.硝酸铵和水
C.生石灰和水
D.镁和稀硫酸
7.按图所示装置,将液体x注入装有固体y的试管中,会导致U形管中右端液面降低。则可能的组合是( )
选项
x
y
A
水
硝酸铵
B
稀硫酸
氢氧化钠
C
水
氧化钙
D
稀盐酸
镁
A.A
B.B
C.C
D.D
8.生锈的铁钉放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图,说法正确的是( )
A.CD段压强变化的主要因素是反应速度减慢
B.AB段的化学反应是:Fe+2HCl═FeCl2+H2↑
C.D点反应结束
D.E点温度等于A点
9.能正确表示稀酸除铁锈原理的化学方程式是( )
A.3H2SO4
+Fe2O3═Fe2(SO4)3
+3H2O
B.3H2SO4
+Fe2O3═Fe2(SO4)3
+3H2↑
C.2HCl+FeO═FeCl2
+H2O
D.4HCl+Fe2O3═2FeCl2
+2H2O
二.填空题(共5小题)
10.烧水的铝壶中常结有一层水垢(该水垢的主要成分是CaCO3),用适量稀盐酸可以除去它,反应的化学方程式是
,若盐酸的用量过多,会产生的不良后果用化学方程式可表示为
。
11.将稀盐酸分别滴入盛有不同物质的试管中,如图所示。
(1)不能发生反应的是
(填序号,下同);
(2)有气泡产生的是
;
(3)有浅绿色溶液产生的是
;
(4)有蓝色溶液产生的是
;
(5)溶液变成红色的是
。
12.将一根生锈的铁钉放入微热的稀硫酸中,可观察到溶液变
,此时反应的化学方程式为
。一段时间后,有气泡产生,用化学方程式解释该气泡现象
。除锈结束后溶液的质量
(填“变大”“不变”或“变小”)。
13.某兴趣小组同学为验证酸的性质,做了以下A、B、C、D、E五组实验。结合图示分析回答下列问题:
(1)A组试管中都有氢气产生,结合图2分析,该微粒转化过程是Mg原子失去电子变成Mg2+,H+ (填“失去”或“得到”)电子变成H2;
(2)B组试管中实验现象相同。写出其中任一试管中发生反应的化学方程式
;
(3)能证明C组试管中发生反应的现象是
;
(4)E组试管中都能产生使澄清石灰水变浑浊的气体,其原因是
;
(5)上述五组实验中没有体现酸的通性的一组是
(填字母序号)。
14.小芳结合所学有关酸、碱的知识,用图1总结了盐酸的四条化学性质(即盐酸与这四类物质能够发生化学反应)。
(1)为了验证性质①,小芳将紫色石蕊试液滴入盐酸溶液中,溶液变成
色。
(2)依据性质②,盐酸常用于金属的除锈,用盐酸除去生锈铁钉表面铁锈的反应的化学方程式为
。
(3)小明用微观示意图(图2)来说明性质③反应的发生过程,用化学反应方程式表示为
。从该图可以看出,该反应的微观实质是:
。
4)为了验证性质④反应能够发生,你选择的物质是
。
A.Na2CO3
B.HCl
C.CuSO4
D.NaCl
三.解答题(共4小题)
15.进行如图微型实验,研究物质的性质。
(1)能产生气泡的烧杯是
(填序号)。
(2)有一只烧杯中发生中和反应,写出反应的化学方程式
,恰好完全反应的现象是
。
16.构建知识网络可以帮助我们理解知识间的内在联系,如图是稀硫酸与不同类别物质之间反应的知识网络图,请回答下列有关问题。
(1)氧化铜与硫酸反应,现象为氧化铜逐渐溶解,溶液出无色逐渐变为
;
(2)反应③的实质是稀硫酸中的H+与M中的
(写离子符号)反应生成水;
(3)写出符合反应④,且有沉淀生成的一个化学反应的方程式
。
17.如图1以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题:
(1)通过反应③的原理,Ca(OH)2在农业上可
。
(2)反应⑤的化学方程式为:
。
(3)图中只生成盐和水的反应有
(填序号)。
(4)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是BaCl2、CuSO4、Na2CO3中的
。
(5)在如图2五组实验中没有体现酸的通性的是
(填序号)。
18.硫酸、盐酸是重要的化工原料。
(1)浓硫酸滴在蔗糖上,蔗糖发黑,因为浓硫酸有
性。
(2)写出稀硫酸与下列物质反应的化学方程式:
①与铁粉反应:
。
②与碳酸钾溶液反应:
。
③与硝酸钡溶液反应:
;上述反应中,属于酸的共同性质的是 (填编号)。
(3)硫酸的下列用途中,不能用盐酸代替硫酸的是
(填编号)。
①金属表面除锈
②制造泻药硫酸锌
③除去水垢
④除去Na2SO4中的少量NaOH
2021-2022学年华师大版科学酸的通性
参考答案与试题解析
一.选择题(共9小题)
1.C。
2.B。
3.D。
4.D。
5.B。
6.B。
7.A。
8.D。
9.A。
二.填空题(共5小题)
10.CaCO3+2HCl=CaCl2+H2O+CO2↑;2Al+6HCl═2AlCl3+3H2↑。
11.(1)A;
(2)BC;
(3)B;
(4)D;
(5)E。
12.铁锈消失,溶液由无色变为黄色;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+H2SO4═FeSO4+H2↑;变大。
13.解:(1)氢离子得到电子形成氢原子,每两个氢原子再构成一个氢分子;故填:得到;
(2)氧化铁能与稀盐酸反应生成氯化铁和水、稀硫酸反应生成硫酸铁和水,它们反应的化学方程式分别为:Fe2O3+6HCl═2FeCl3+3H2O、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;故填:Fe2O3+6HCl═2FeCl3+3H2O或Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)氢氧化钠与硫酸反应生成硫酸钠和水,与盐酸反应生成氯化钠和水,氢氧化钠被完全中和后,溶液呈中性,所以可以观察到试管中的红色逐渐消失;故填:红色逐渐消失;
(4)碳酸钠和碳酸钾都是碳酸盐,都含有碳酸根离子,能与酸反应生成二氧化碳气体;故填:碳酸钾和碳酸钠中都含有碳酸根离子;
(5)酸能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,盐酸与硝酸盐反应,硫酸与盐酸盐反应,故五组实验中没有体现酸的通性的是D.故填:D。
14.(1)红;(2)6HCl+Fe2O3═2FeCl3+3H2O;
(3)HCl+NaOH=NaCl+H2O;氢离子和氢氧根离子结合生成水分子;(4)A。
三.解答题(共4小题)
15.(1)BD;
(2)Ca(OH)2+2HCl=CaCl2+2H2O;
溶液由红色变为无色。
16.(1)蓝色;
(2)OH﹣;
(3)H2SO4+BaCl2=BaSO4↓+2HCl(合理即可)。
17.解:(1)氢氧化钙是一种碱,能与酸反应生成盐和水,所以在农业上可以用氢氧化钙来改良酸性土壤;故填:改良酸性土壤;
(2)⑤中盐酸与氧化铝反应生成氯化铝和水,反应的化学方程式为Al2O3+6HCl═2AlCl3+3H2O;故填:Al2O3+6HCl═2AlCl3+3H2O;
(3)酸碱中和反应生成盐和水,酸和金属氧化物反应生成盐和水,图示中能生成盐和水的反应有③⑤;故填:③⑤;
(4)X与稀盐酸、氢氧化钙的反应属于复分解反应,要求生成物中有沉淀、气体或水生成。氯化钡与不能与盐酸、氢氧化钙反应;硫酸铜与盐酸不反应,与氢氧化钙反应生成氢氧化铜蓝色沉淀和硫酸钙;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;故填:Na2CO3;
(5)酸能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应,ABCE分别能体现酸能与活泼金属、金属氧化物、碱、碳酸盐等反应;D中盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,但是盐酸与氯化钡溶液不反应,故五组实验中没有体现酸的通性的是D.故填:D。
18.解:(1)浓硫酸滴在蔗糖上,蔗糖发黑,因为浓硫酸有脱水性。
故填:脱水。
(2)①稀硫酸与铁粉反应生成硫酸亚铁和氢气,反应的化学方程式:Fe+H2SO4═FeSO4+H2↑。
故填:Fe+H2SO4═FeSO4+H2↑。
②稀硫酸与碳酸钾反应生成硫酸钾、水和二氧化碳,反应的化学方程式:K2CO3+H2SO4═K2SO4+H2O+CO2↑。
故填:K2CO3+H2SO4═K2SO4+H2O+CO2↑。
③稀硫酸与硝酸钡反应生成硫酸钡沉淀和硝酸,反应的化学方程式:Ba(NO3)2+H2SO4═BaSO4↓+2HNO3;
上述反应中,属于酸的共同性质的是①②,即酸能和比较活泼的金属单质反应,能和碳酸盐反应。
故填:Ba(NO3)2+H2SO4═BaSO4↓+2HNO3;①②。
(3)硫酸的下列用途中,不能用盐酸代替硫酸的是制造泻药硫酸锌(利用盐酸时得到氯化锌),除去Na2SO4中的少量NaOH(盐酸和氢氧化钠反应生成氯化钠等物质)。
故填:②④。
