第3章 第一节 原子同步训练—2021-2022学年九年级化学京改版(2013)上册(有答案)
文档属性
| 名称 | 第3章 第一节 原子同步训练—2021-2022学年九年级化学京改版(2013)上册(有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 167.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-24 23:22:01 | ||
图片预览




文档简介
第一节
原子
一、单选题
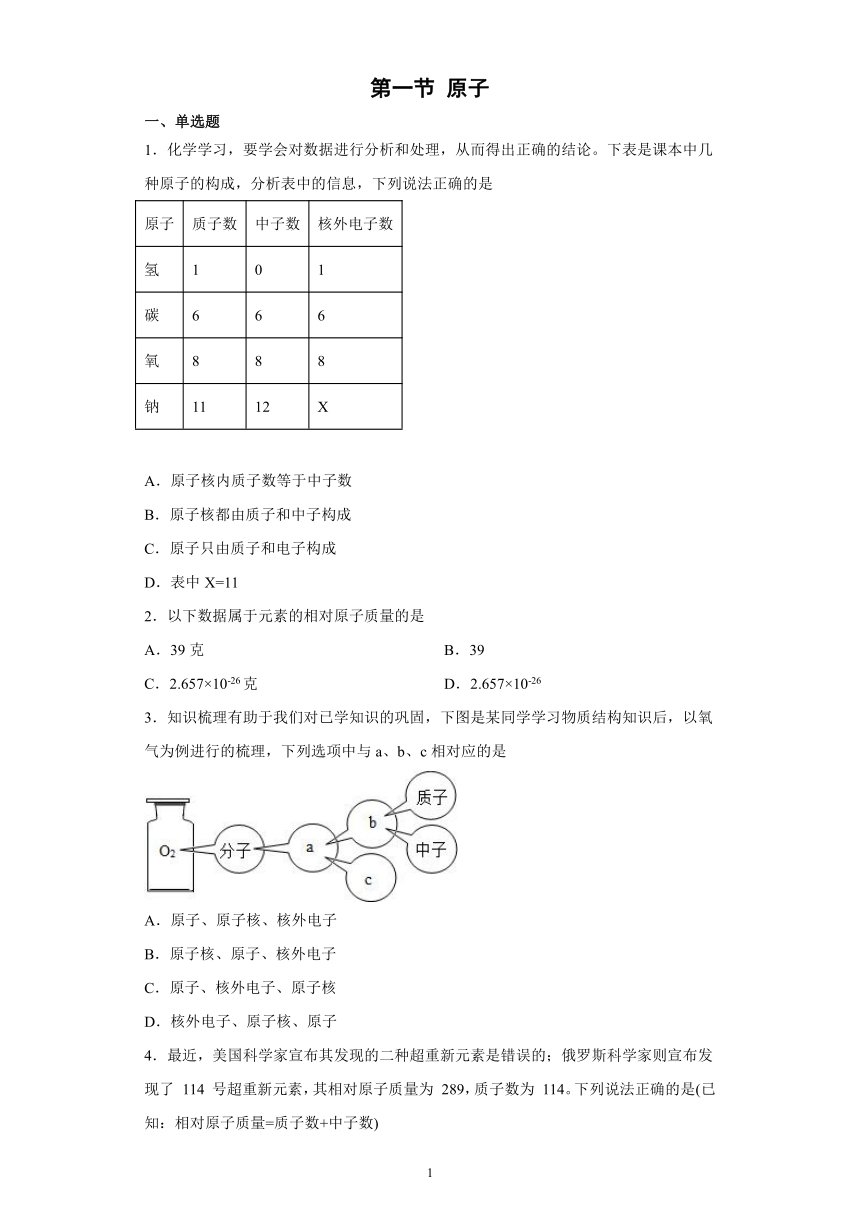
1.化学学习,要学会对数据进行分析和处理,从而得出正确的结论。下表是课本中几种原子的构成,分析表中的信息,下列说法正确的是
原子
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
X
A.原子核内质子数等于中子数
B.原子核都由质子和中子构成
C.原子只由质子和电子构成
D.表中X=11
2.以下数据属于元素的相对原子质量的是
A.39克
B.39
C.2.657×10-26克
D.2.657×10-26
3.知识梳理有助于我们对已学知识的巩固,下图是某同学学习物质结构知识后,以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
4.最近,美国科学家宣布其发现的二种超重新元素是错误的;俄罗斯科学家则宣布发现了
114
号超重新元素,其相对原子质量为
289,质子数为
114。下列说法正确的是(已知:相对原子质量=质子数+中子数)
A.114
号元素原子的中子数为
175
B.114
号元素原子的中子数为
408
C.科学家宣布自己的研究成果错误是可耻的
D.科学研究成果是不可能有误的
5.不同元素最本质的区别是
A.质子数不同
B.相对原子质量不同
C.中子数不同
D.中子数与核外电子数之和不同
6.硒的原子核内有34个质子,45个中子,则硒原子的核电荷数为
A.11
B.34
C.45
D.79
7.1911年,英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
8.疫情期间,同学们用眼增多,容易引发近视。科学家研究发现青少年近视还可能与体内缺乏微量元素铬有关。铬原子的核电荷数是24,相对原子质量52,则铬原子的质子数为
A.24
B.52
C.76
D.28
9.在学习相对原子质量的时候,课本上引用了如图所示的模型图。根据相对原子质量的定义,右盘中的每一小块表示的是
A.一个碳原子的质量
B.一个碳原子质量的
C.一个氢原子的质量
D.一个氧原子质量的
10.科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论,关于原子结构的观点有:
①在球体内正电荷均匀分布,电子镶嵌其中;
②原子是可分的;
③原子中有带负电的电子;
④原子中有带正电的原子核;
⑤原子核很小,但集中了原子的大部分质量。
其中经过卢瑟福传承和发展后的观点是
A.④⑤
B.③④⑤
C.①②③④
D.②③④⑤
11.下列说法正确的是
A.在原子里质子数等于中子数
B.原子核位于原子中央,体积较大
C.原子的质量主要集中在原子核上
D.电子在原子核外静止不动
12.关于相对原子质量,下列叙述正确的是
A.相对原子质量可以用来计算原子的质量
B.碳原子的相对原子质量为12g
C.采用相对原子质量后,增大了原子的质量
D.碳原子的相对原子质量为1.993×1026kg
13.下列对原子结构的认识错误的是
A.原子核体积很小
B.原子核带正电
C.原子内部有很大的空间
D.原子是实心的球体
14.下列叙述错误的是( )
A.拉瓦锡用实验的方法研究空气的成分
B.我国科学院院士张青莲为相对原子质量的测定作出了卓越的贡献
C.门捷列夫发明的元素周期表有7个周期16个族
D.道尔顿用图形加字母的方式作为元素符号被广泛采用
15.原子核中,一定含有的粒子是
A.中子
B.中子和电子
C.质子
D.质子和中子
二、填空题
16.如图是某化学反应前后微观模拟图,请根据图示回答:
(1)该化学反应中,参加反应的“”的个数为______。
(2)该反应的基本反应类型为______。
(3)该反应中的生成物______(填“可能”或“不可能”)属于氧化物。
(4)该化学反应中不变的微粒是______(画微粒符号)。
17.用分子、原子、质子、中子、电子填空:化学变化中最小的微粒是________;原子核中一定含有的微粒是__________;质量最小的是___________。
18.一个碳原子(原子核内有6个质子和6个中子)的质量是mkg,一个R原子的原子质量是n/3kg,
(1)一个碳原子的相对原子质量是______
(2)一个R原子的相对原子质量是______。(用字母表示,写出计算过程)
19.化学的学科特征让在原子、分子的水平上研究物成和创造物质。请从微观的角度回答下列问题。
(1)物质的结构决定性质。
①根据Na、Al的原子结构示意图可推知,金属Na、Al的化学性质不同的原因是_______
②CO和CO2化学性质不同的原因是______。
(2)如图是某密闭容器中物质变化过程的微观示意:
①A、B、C中表示混合物的是_______。
②上述变化Ⅰ、Ⅱ和Ⅲ中,属于化学变化的是___,该化学变化中一定不变的粒子是___(填粒子名称)。
③A图中“”表示构成氧气的粒子,氧气的化学性质比较活泼,铁可以在纯净的氧气中燃烧,该反应的化学方程式为_______。
20.原子核由______和_______构成,在原子核里,带正电的是______,不带电的是______
21.原子的核电荷数_______质子数______核外电子数(填“>”或“<”或“=”符号)
22.认识原子
微观粒子看不见、摸不着,化学家通过模型来说明他们心目中粒子的“模样”,揭示物质的微观结构特点,解释微观结构与宏观现象之间的因果关系。模型化的方法是化学科学重要的思想工具。试回答下列问题:
(1)一百多年来,化学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
①如图A模型是汤姆森于1897年提出的,B模型是卢瑟福于1911年提出的。
②下面是两位科学家关于原子结构理论的学说
A.原子是不可分的
B.原子是可分的
C.原子呈球形
D.在球体内充斥着正电荷,电子镶嵌其中
E.带正电荷的原子核居于原子的中心
F.带正电荷的原子核很小,但集中了原子的大部分质量
G.电子带负电
H.电子在原子核外很大的空间内高速运动
卢瑟福继承的观点有_______,卢瑟福修正的观点有_______。
(2)人类一直没有停止探索微观世界的脚步:从公元前440年古希腊哲学家德谟克利特提出原子论,到1976年华裔科学家丁肇中发现比质子更小的粒子夸克,历经2000多年的时光。
对此你的感想是________。
三、计算题
23.已知一个X原子的质量为9.296×10-26kg,一个碳12原子的质量为1.993×10-26kg,又如X原子中质子数比中子数少4,则X原子的中子数是:______。
24.已知X原子的质量为2.325×10-26kg,碳原子质量的1/12为1.661×10-27kg。求:X原子相对原子质量=______=______
25.已知X原子的质量为2.325×10-26kg,一个C-12原子的质量为1.993×10-26kg。则X原子的相对原子质量为______。
26.已知作为相对原子质量标准的一种碳原子的质量是1.993×10-26kg。
(第(1)和(2)要求写出计算过程)
(1)若一个铝原子的质量是4.482×10-26kg,则铝原子的相对原子质量是多少?已知在铝原子核中有13个质子,则铝原子中的中子数是多少?
(2)若氧原子的相对原子质量是16,则一个氧原子的质量是多少?
(3)相同质量的锂和铝,___________含有的原子个数更多。
27.有关原子的计算。
(1)等质量的镁与铁中,所含原子的个数之比为_____。
(2)某R原子的实际质量为a克,一个碳-12原子的实际质量为b克,则R原子的相对原子质量为_____。
参考答案
1.D
2.B
3.A
4.A
5.A
6.B
7.C
8.A
9.B
10.D
11.C
12.A
13.D
14.D
15.C
16.
(1)2
(2)化合反应
(3)可能
(4),
17.原子
质子
电子
18.
(1)12
(2)一个碳原子(原子核内有6个质子和6个中子)的质量是mkg,一个R原子的原子质量是n/3kg,则R原子的相对原子质量为。
19.
(1)
最外层电子数不同
由不同分子构成
(2)
A
Ⅰ
碳原子和氧原子
20.质子
中子
质子
中子
21.=
=
22.
(1)
BCG
EFH
(2)科学是不断发展的
23.30
24.
14
25.14
26.(1)铝原子的相对原子质量为:,中子数=相对原子质量-质子数=27-13=14。
(2)一个氧原子的质量为:16×1.993×10-26kg×≈2.657×10-26kg。
(3)锂
27.7:3;
原子
一、单选题
1.化学学习,要学会对数据进行分析和处理,从而得出正确的结论。下表是课本中几种原子的构成,分析表中的信息,下列说法正确的是
原子
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
X
A.原子核内质子数等于中子数
B.原子核都由质子和中子构成
C.原子只由质子和电子构成
D.表中X=11
2.以下数据属于元素的相对原子质量的是
A.39克
B.39
C.2.657×10-26克
D.2.657×10-26
3.知识梳理有助于我们对已学知识的巩固,下图是某同学学习物质结构知识后,以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
4.最近,美国科学家宣布其发现的二种超重新元素是错误的;俄罗斯科学家则宣布发现了
114
号超重新元素,其相对原子质量为
289,质子数为
114。下列说法正确的是(已知:相对原子质量=质子数+中子数)
A.114
号元素原子的中子数为
175
B.114
号元素原子的中子数为
408
C.科学家宣布自己的研究成果错误是可耻的
D.科学研究成果是不可能有误的
5.不同元素最本质的区别是
A.质子数不同
B.相对原子质量不同
C.中子数不同
D.中子数与核外电子数之和不同
6.硒的原子核内有34个质子,45个中子,则硒原子的核电荷数为
A.11
B.34
C.45
D.79
7.1911年,英国科学家卢瑟福用带正电的α粒子轰击金属箔,这就是著名的α粒子散射实验。该实验不能证明的是
A.原子核体积很小
B.原子不是实心球体,大部分空间是空的
C.原子核是由质子和中子组成
D.原子核质量比较大
8.疫情期间,同学们用眼增多,容易引发近视。科学家研究发现青少年近视还可能与体内缺乏微量元素铬有关。铬原子的核电荷数是24,相对原子质量52,则铬原子的质子数为
A.24
B.52
C.76
D.28
9.在学习相对原子质量的时候,课本上引用了如图所示的模型图。根据相对原子质量的定义,右盘中的每一小块表示的是
A.一个碳原子的质量
B.一个碳原子质量的
C.一个氢原子的质量
D.一个氧原子质量的
10.科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论,关于原子结构的观点有:
①在球体内正电荷均匀分布,电子镶嵌其中;
②原子是可分的;
③原子中有带负电的电子;
④原子中有带正电的原子核;
⑤原子核很小,但集中了原子的大部分质量。
其中经过卢瑟福传承和发展后的观点是
A.④⑤
B.③④⑤
C.①②③④
D.②③④⑤
11.下列说法正确的是
A.在原子里质子数等于中子数
B.原子核位于原子中央,体积较大
C.原子的质量主要集中在原子核上
D.电子在原子核外静止不动
12.关于相对原子质量,下列叙述正确的是
A.相对原子质量可以用来计算原子的质量
B.碳原子的相对原子质量为12g
C.采用相对原子质量后,增大了原子的质量
D.碳原子的相对原子质量为1.993×1026kg
13.下列对原子结构的认识错误的是
A.原子核体积很小
B.原子核带正电
C.原子内部有很大的空间
D.原子是实心的球体
14.下列叙述错误的是( )
A.拉瓦锡用实验的方法研究空气的成分
B.我国科学院院士张青莲为相对原子质量的测定作出了卓越的贡献
C.门捷列夫发明的元素周期表有7个周期16个族
D.道尔顿用图形加字母的方式作为元素符号被广泛采用
15.原子核中,一定含有的粒子是
A.中子
B.中子和电子
C.质子
D.质子和中子
二、填空题
16.如图是某化学反应前后微观模拟图,请根据图示回答:
(1)该化学反应中,参加反应的“”的个数为______。
(2)该反应的基本反应类型为______。
(3)该反应中的生成物______(填“可能”或“不可能”)属于氧化物。
(4)该化学反应中不变的微粒是______(画微粒符号)。
17.用分子、原子、质子、中子、电子填空:化学变化中最小的微粒是________;原子核中一定含有的微粒是__________;质量最小的是___________。
18.一个碳原子(原子核内有6个质子和6个中子)的质量是mkg,一个R原子的原子质量是n/3kg,
(1)一个碳原子的相对原子质量是______
(2)一个R原子的相对原子质量是______。(用字母表示,写出计算过程)
19.化学的学科特征让在原子、分子的水平上研究物成和创造物质。请从微观的角度回答下列问题。
(1)物质的结构决定性质。
①根据Na、Al的原子结构示意图可推知,金属Na、Al的化学性质不同的原因是_______
②CO和CO2化学性质不同的原因是______。
(2)如图是某密闭容器中物质变化过程的微观示意:
①A、B、C中表示混合物的是_______。
②上述变化Ⅰ、Ⅱ和Ⅲ中,属于化学变化的是___,该化学变化中一定不变的粒子是___(填粒子名称)。
③A图中“”表示构成氧气的粒子,氧气的化学性质比较活泼,铁可以在纯净的氧气中燃烧,该反应的化学方程式为_______。
20.原子核由______和_______构成,在原子核里,带正电的是______,不带电的是______
21.原子的核电荷数_______质子数______核外电子数(填“>”或“<”或“=”符号)
22.认识原子
微观粒子看不见、摸不着,化学家通过模型来说明他们心目中粒子的“模样”,揭示物质的微观结构特点,解释微观结构与宏观现象之间的因果关系。模型化的方法是化学科学重要的思想工具。试回答下列问题:
(1)一百多年来,化学家借助构建原子结构模型,逐渐揭开了原子构成的神秘面纱,通过不断提出新的原子结构模型,逐步形成了今天的原子结构理论。
①如图A模型是汤姆森于1897年提出的,B模型是卢瑟福于1911年提出的。
②下面是两位科学家关于原子结构理论的学说
A.原子是不可分的
B.原子是可分的
C.原子呈球形
D.在球体内充斥着正电荷,电子镶嵌其中
E.带正电荷的原子核居于原子的中心
F.带正电荷的原子核很小,但集中了原子的大部分质量
G.电子带负电
H.电子在原子核外很大的空间内高速运动
卢瑟福继承的观点有_______,卢瑟福修正的观点有_______。
(2)人类一直没有停止探索微观世界的脚步:从公元前440年古希腊哲学家德谟克利特提出原子论,到1976年华裔科学家丁肇中发现比质子更小的粒子夸克,历经2000多年的时光。
对此你的感想是________。
三、计算题
23.已知一个X原子的质量为9.296×10-26kg,一个碳12原子的质量为1.993×10-26kg,又如X原子中质子数比中子数少4,则X原子的中子数是:______。
24.已知X原子的质量为2.325×10-26kg,碳原子质量的1/12为1.661×10-27kg。求:X原子相对原子质量=______=______
25.已知X原子的质量为2.325×10-26kg,一个C-12原子的质量为1.993×10-26kg。则X原子的相对原子质量为______。
26.已知作为相对原子质量标准的一种碳原子的质量是1.993×10-26kg。
(第(1)和(2)要求写出计算过程)
(1)若一个铝原子的质量是4.482×10-26kg,则铝原子的相对原子质量是多少?已知在铝原子核中有13个质子,则铝原子中的中子数是多少?
(2)若氧原子的相对原子质量是16,则一个氧原子的质量是多少?
(3)相同质量的锂和铝,___________含有的原子个数更多。
27.有关原子的计算。
(1)等质量的镁与铁中,所含原子的个数之比为_____。
(2)某R原子的实际质量为a克,一个碳-12原子的实际质量为b克,则R原子的相对原子质量为_____。
参考答案
1.D
2.B
3.A
4.A
5.A
6.B
7.C
8.A
9.B
10.D
11.C
12.A
13.D
14.D
15.C
16.
(1)2
(2)化合反应
(3)可能
(4),
17.原子
质子
电子
18.
(1)12
(2)一个碳原子(原子核内有6个质子和6个中子)的质量是mkg,一个R原子的原子质量是n/3kg,则R原子的相对原子质量为。
19.
(1)
最外层电子数不同
由不同分子构成
(2)
A
Ⅰ
碳原子和氧原子
20.质子
中子
质子
中子
21.=
=
22.
(1)
BCG
EFH
(2)科学是不断发展的
23.30
24.
14
25.14
26.(1)铝原子的相对原子质量为:,中子数=相对原子质量-质子数=27-13=14。
(2)一个氧原子的质量为:16×1.993×10-26kg×≈2.657×10-26kg。
(3)锂
27.7:3;
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
