高中化学苏教版(2019)必修第二册 专题6 第二单元 第1课时 放热反应和吸热反应 热化学方程式(57张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题6 第二单元 第1课时 放热反应和吸热反应 热化学方程式(57张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-24 23:29:05 | ||
图片预览








文档简介
(共57张PPT)
第1课时 放热反应和吸热反应
热化学方程式
1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。2.知道热化学方程式与普通化学方程式的不同,能正确书写热化学方
程式。
核心素养发展目标
一、放热反应与吸热反应
随堂演练 知识落实
课时对点练
二、热化学方程式
内
容
索
引
1.化学反应中的热量变化
(1)化学反应过程中能量转化形式
化学反应中不仅有物质的转变,同时还伴随着
的变化。化学反应中比较常见的是化学能与热能、电能、光能等的互相转化。
一、放热反应与吸热反应
能量
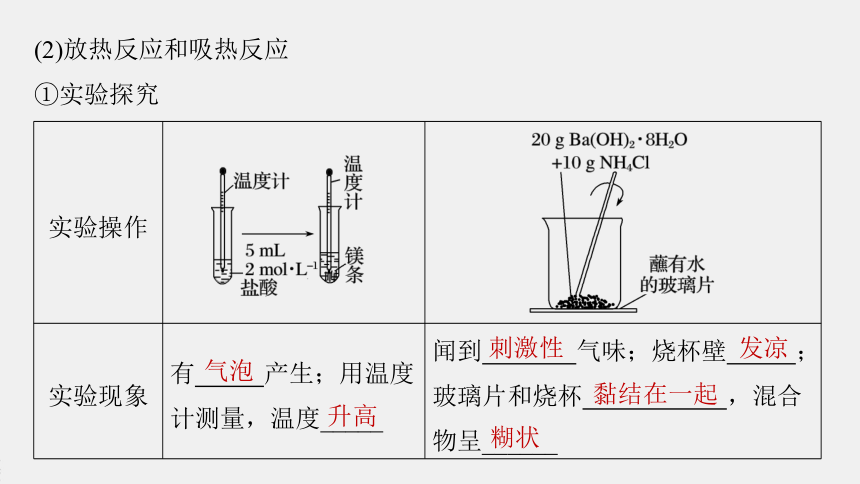
实验操作
?
?
实验现象
有
产生;用温度计测量,温度_____
闻到
气味;烧杯壁
;玻璃片和烧杯
,混合物呈______
(2)放热反应和吸热反应
①实验探究
气泡
升高
刺激性
发凉
黏结在一起
糊状
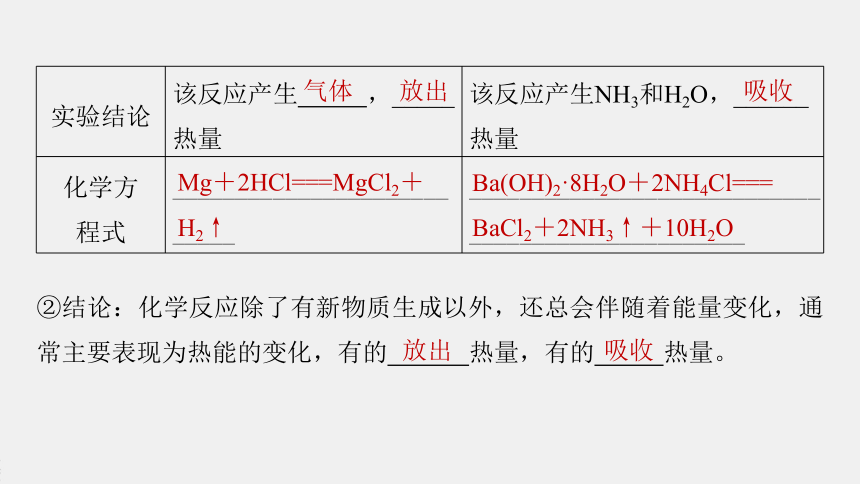
实验结论
该反应产生
,_____
热量
该反应产生NH3和H2O,______
热量
化学方
程式
___________________________
__________________________________________________
气体
放出
吸收
Mg+2HCl===MgCl2+H2↑
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
②结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的
热量,有的
热量。
放出
吸收
2.放热反应与吸热反应
(1)概念
①放热反应:
热的化学反应。
②吸热反应:
热的化学反应。
放出
吸收
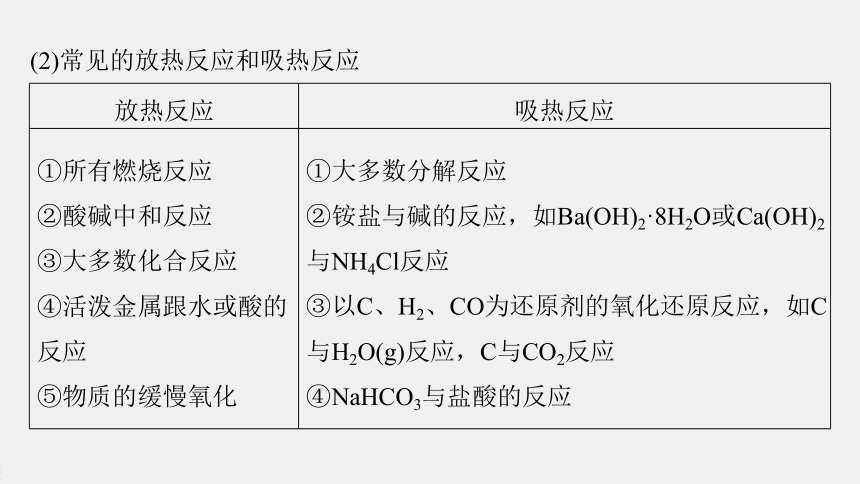
(2)常见的放热反应和吸热反应
放热反应
吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2
与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)化学反应既有物质变化,又有能量变化( )
(4)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(5)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
(6)火药爆炸时所释放的能量包括热、光、声、机械能等多种能量形式
( )
判断正误
×
×
√
×
×
×
化学兴趣小组的同学在开展研究性学习时,做了一个有关物质溶解和物质发生化学反应过程中能量变化的探究实验,装置如图所示。
已知:小试管A、B中分别盛有两种不
同的无色液体,U形管内均为滴有红墨
水的水。
(1)若试管A中的无色液体是稀硫酸,向A试管中加入铁粉,可以观察到的实验现象是什么?
深度思考
提示 看到试管A中产生大量无色气泡,且U形管a、b两端液面的变化是a端液面下降,b端液面上升。
(2)产生图1中的现象的原因是什么?
提示 铁粉与稀硫酸反应放热,致使瓶
内气体膨胀,瓶内气压大于外界气压,
从而将U形管中的红色墨水压往U形管的右侧。
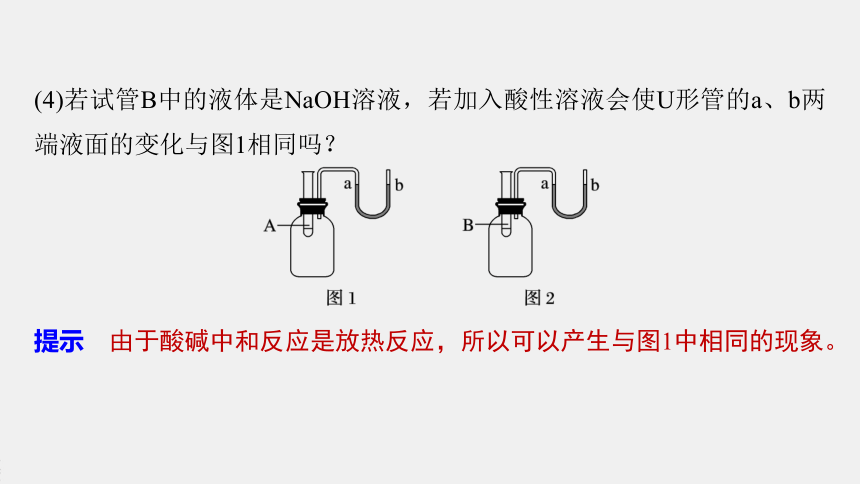
(3)若试管B中的无色液体是水,向试管B中加入一种固体,且U形管的a、b两端液面的变化与图1相同,则所加固体可能是什么(从冰、氧化钙、氢氧化钠、硝酸铵、干冰五种物质中选择)?
提示 由于U形管的a、b两端液面的变化与图1相同,则加入水的物质应该是溶于水或与水反应放热的物质,所以应该是氧化钙或氢氧化钠。
(4)若试管B中的液体是NaOH溶液,若加入酸性溶液会使U形管的a、b两端液面的变化与图1相同吗?
提示 由于酸碱中和反应是放热反应,所以可以产生与图1中相同的现象。
有关放热反应和吸热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
归纳总结
返回
二、热化学方程式
1.概念
能表示化学反应中
的热量的化学方程式。
2.书写——“三字诀”
放出或吸收
放
吸
例如,已知1
mol
C与1
mol
O2完全反应生成1
mol
CO2放出393.6
kJ热量,则该反应的热化学方程式为
。
C(s)+O2(g)===CO2(g) ΔH=-393.6
kJ·mol-1
(1)CaCO3(g)===CaO+CO2(g) ΔH=177.7
kJ( )
(2)C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.3
kJ·mol-1( )
(3)C(s)+
O2(g)===CO(g) ΔH=-110.5
kJ·mol-1( )
(4)CO(g)+
O2(g)===CO2(g) ΔH=-283
kJ·mol-1( )
判断正误
×
×
√
√
写出298
K时,下列反应的热化学方程式:
(1)1
mol
HgO(s)分解为液态汞和氧气,吸热90.7
kJ。
______________________________________________________________
_________________________
理解应用
2HgO(s)===2Hg(l)+O2(g) ΔH=181.4
kJ·mol-1[或HgO(s)===Hg(l)+
(2)16
g固体硫完全燃烧时放出148.4
kJ的热量。
________________________________________________________________
______________________
ΔH=-296.8
kJ·mol-1]
(3)2.00
g
C2H2气体完全燃烧生成液态水和CO2,放出99.6
kJ的热量。
________________________________________________________
热化学方程式的书写方法
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)要注明反应物和生成物的状态。
(3)在右端注明ΔH的符号(正号常省略)、大小及单位。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。化学计量数改变,ΔH的数值要相应改变。
归纳总结
返回
1.下列反应一定属于放热反应的是
①H2SO4与Ba(OH)2溶液的反应 ②Mg与CH3COOH溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
A.仅①②③
B.仅①②④
C.仅①②③④
D.仅③④⑤
1
2
3
5
随堂演练 知识落实
4
√
6
解析 金属与酸的置换反应、中和反应、所有燃烧反应都是放热反应;复分解反应不一定是放热反应。
2.下列反应属于吸热反应的是
A.铝与CuCl2溶液反应
B.NaOH和HCl反应
C.NaOH与NH4Cl的反应
D.甲烷燃烧
1
2
3
5
4
√
解析 金属与盐溶液的置换反应、中和反应、燃烧反应均为放热反应。
6
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484
kJ·mol-1
3.已知在1×105
Pa、298
K条件下,2
mol氢气燃烧生成水蒸气放出484
kJ热量,下列热化学方程式正确的是
√
1
2
3
5
4
6
D.2H2(g)+O2(g)===2H2O(g) ΔH=484
kJ·mol-1
解析 2
mol氢气燃烧生成水蒸气放出484
kJ热量,则1
mol氢气燃烧生成水蒸气应放出
×484
kJ=242
kJ热量,放出热量ΔH为“-”,各物质的状态分别是H2(g)、O2(g)、H2O(g)。B项中H2O的状态应为气态;
C、D两项中ΔH的符号应为“-”;
A项是逆向进行的反应,ΔH为正值,数值为2
mol
H2燃烧放热数值的一半,书写正确,故应选A项。
1
2
3
5
4
6
4.下列说法中正确的是
A.化合反应均是放热反应,分解反应均是吸热反应
B.燃料的燃烧反应是放热反应
C.干冰的升华是吸热反应
D.需要点燃或加热的化学反应一定是吸热反应
1
2
3
5
4
解析 C+CO2
2CO是化合反应,但需要吸热,2H2O2===2H2O+O2↑是分解反应,但放出热量。物质的燃烧均是放热反应。判断吸热、放热反应与外部条件无关,如可燃物的燃烧需要点燃,但是放热反应。
√
6
5.依据事实,写出下列反应的热化学方程式。
(1)在25
℃、101
kPa下,1
g甲醇燃烧生成CO2和液态水时放热22.68
kJ。
则表示甲醇燃烧的热化学方程式为_________________________________
______________________。
(2)若适量的N2和O2完全反应,每生成23
g
NO2需要吸收16.95
kJ热量,__________________________________________。
1
2
3
5
4
6
ΔH=-725.76
kJ·mol-1
N2(g)+2O2(g)===2NO2(g) ΔH=67.8
kJ·mol-1
6.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究化学反应过程中有热量变化时,某兴趣小组设计了如下三套装置:
1
2
3
5
4
6
(1)该小组选择装置Ⅰ探究Na2O2和H2O反应为放热反应,将水滴入盛有过氧化钠的试管中,现象为_________________________________,化学方程式:_____________________________。
U形管右侧液面下降,左侧液面上升
2Na2O2+2H2O===4NaOH+O2↑
(2)该小组选择装置Ⅱ探究硝酸铵溶于水的能量变化,当向盛有硝酸铵固体的试管中滴入少量水,发现导管中上升一段水柱,则该变化_____
(填“是”或“不是”)吸热反应,原因为__________________________
________________。
1
2
3
5
4
6
不是
硝酸铵溶于水没有新物质生
成,为物理变化
(3)该小组在探究镁和盐酸反应热量变化时,选择了装置Ⅲ,发现反应过程中,导管口有气泡冒出,该装置______(填“能”或“不能”)证明镁和盐酸反应为放热反应,原因为_______________________________
_____________________________________________。
1
2
3
5
4
6
不能
镁和盐酸反应生成氢气,无论是吸
热反应还是放热反应,烧杯中导管口都有气泡冒出
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学反应与能量变化的关系
1.(2020·吉林松原一中高一期中)下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
√
A组 基础对点练
解析 化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
1
2
3
4
5
6
7
8
9
2.下列关于化学反应中能量变化的说法正确的是
A.形成化学键的过程是放热过程
B.可逆反应进行的过程中没有能量变化
C.在常温下可以发生的反应一定是放热反应
D.化学反应中能量变化的大小与反应物的质量多少无关
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
题组二 吸热反应与放热反应
3.(2019·陕西省商洛市高一期末)下列属于吸热反应的是
A.气态水液化为液态水
B.高温分解石灰石
C.氢氧化钠和盐酸反应
D.氢气在氯气中燃烧
√
解析 气态水液化为液态水是一个放热过程,属于物理变化,故A错误;
高温分解石灰石是一个吸热反应,故B正确;
氢氧化钠和盐酸反应为中和反应,属于放热反应,故C错误;
氢气在氯气中燃烧生成氯化氢的反应为放热反应,故D错误。
4.(2019·河北张家口第一中学月考)下列变化一定是吸热反应的是
A.凡需加热才能发生的反应
B.所有的分解反应
C.将化学能转变为热能的反应
D.Ba(OH)2晶体与NH4Cl晶体的反应
1
2
3
4
5
6
7
8
9
√
1
2
3
4
5
6
7
8
9
解析 需要加热才能发生的反应不一定是吸热反应,如燃烧,一般需加热到一定温度才能反应,但是燃烧是放热反应,A项错误;
不是所有的分解反应都是吸热反应,如过氧化氢的分解是放热反应,B项错误;
将化学能转变为热能的反应是放热反应,C项错误。
5.(2020·广东江门一中高一检测)为了探究化学反应的能量变化情况,某同学设计了如图装置,向盛有A试剂的试管中滴加B试剂时,看到U形管中,甲处液面上升,乙处液面下降,则A试剂和B试剂为
A.金属钠和水
B.碳酸氢钠和盐酸
C.生石灰和水
D.氢氧化钠和硝酸
√
1
2
3
4
5
6
7
8
9
解析 金属钠和水反应,生石灰和水反应,氢氧化钠和硝酸中和反应,都为放热反应,现象应为甲处液面下降,乙处液面上升,与题意不符,故A、C、D错误;
NaHCO3和盐酸反应为吸热反应,温度降低,试剂瓶中气体压强降低,U形管中甲处液面上升,乙处液面下降,故B正确。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
6.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有_____________(填序号,下同)。
(2)属于吸热反应的有_______。
①③④⑤⑥⑧
②⑦
7.在两支试管中分别加入3
mL稀盐酸(均足量),将两个各装有0.3
g
NaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如下图)。将气球内的NaHCO3或Na2CO3同时倒入试管中。
(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子
方程式:
_________________________;
_________________________。
②两支试管中的现象为__________________________________________
____________________________。
1
2
3
4
5
6
7
8
9
两支试管中都产生大量气泡,但加入NaHCO3的
试管中产生气泡的速度要快得多
甲得出结论的方法是否正确?________(填“正确”或“不正确”)。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。
1
2
3
4
5
6
7
8
9
不正确
解析 与同浓度盐酸反应时,NaHCO3比Na2CO3剧烈,产生气泡的速度快,甲得出结论的方法不正确,因为两粉末与盐酸的反应包括两个过程:一是粉末的溶解过程,二是在溶液中与盐酸的反应过程。
(2)为研究两反应是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
1
2
3
4
5
6
7
8
9
序号
试剂1
试剂2
混合前温度
混合后最高或最低温度
①
50
mL水
2.5
g
NaHCO3固体
20
℃
18.5
℃
②
35
mL水
3.2
g
Na2CO3固体
20
℃
23.3
℃
③
35
mL稀盐酸
含2.5
g
NaHCO3的饱和溶液15
mL
20
℃
18.8
℃
④
50
mL稀盐酸
含3.2
g
Na2CO3的饱和溶液15
mL
20
℃
21.2
℃
通过上述实验可得出三条结论:
a.NaHCO3的溶解是_______(填“吸热”或“放热”)过程。
b.Na2CO3的饱和溶液和盐酸的反应是_____(填“吸热”或“放热”)反应。
c.NaHCO3的饱和溶液和盐酸的反应是_______(填“吸热”或“放热”)反应。
1
2
3
4
5
6
7
8
9
吸热
放热
吸热
解析 由表中数据①②可知,NaHCO3固体的溶解是吸热的,Na2CO3固体的溶解是放热的。分析③④两组数据可知NaHCO3饱和溶液与盐酸反应是吸热的,Na2CO3饱和溶液与盐酸反应是放热的。
题组三 热化学方程式的意义与书写
8.下列说法中正确的是
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数
值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(g) ΔH=
-483.6
kJ
1
2
3
4
5
6
7
8
9
√
解析 A项中要标明物质的状态;
B项中C在O2中燃烧是放热反应;
D项中ΔH的单位是kJ·mol-1。
1
2
3
4
5
6
7
8
9
A.1
mol氢气和1
mol碘蒸气完全反应需要吸收9
kJ热量
B.1个氢分子和1个碘分子完全反应需要放出9
kJ的热量
C.1
mol
H2(g)与1
mol
I2(g)完全反应生成2
mol的HI气体放出18
kJ的热量
D.1
mol
H2(g)与1
mol
I2(g)完全反应吸收18
kJ的热量
1
2
3
4
5
6
7
8
9
解析 热化学方程式的具体形式是表示一定物质的量、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热或吸热情况。只要依据书写热化学方程式的注意事项,对于本题就不难作出判断。
√
B组 综合强化练
1.下列反应中,属于吸热反应的是
A.酸碱中和反应
B.CH4在O2中燃烧
C.NH4Cl晶体与Ba(OH)2·8H2O晶体混合搅拌
D.CaO溶于水生成Ca(OH)2
1
2
3
4
5
6
7
√
解析 酸碱中和反应为放热反应,生成物总能量应该低于反应物总能量,故A错误;
燃烧反应为放热反应,生成物总能量应该低于反应物总能量,故B错误;
NH4Cl晶体与Ba(OH)2·8H2O晶体反应为吸热反应,故C正确;
CaO溶于水生成Ca(OH)2为放热反应,生成物总能量应该低于反应物总能量,故D错误。
1
2
3
4
5
6
7
2.“即食即热型”快餐适合外出时携带和食用,其内层中有用铝箔包裹的已加工好的真空包装食品,外层有分别包装的两包化学物质,拉动预留在外的拉线使这两种化学物质相互作用,放出的热量便可对食物进行加热。这两包化学物质最合理的组合是
A.浓硫酸和水
B.生石灰和水
C.熟石灰和水
D.氯化钠和水
√
1
2
3
4
5
6
7
解析 选项中只有浓硫酸与水、生石灰和水相互作用是明显放热的,但浓硫酸为腐蚀品,不适用于食物加热,且浓硫酸与水混合所得的稀硫酸能与铝箔反应,故不适用。
3.下列说法正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就可以发生
C.反应条件是加热的反应是吸热反应
D.化学反应放热还是吸热,取决于反应条件
1
2
3
4
5
6
7
√
解析 判断吸热反应、放热反应与反应条件无关。
选项
A
B
C
D
实验装置
?
?
?
?
实验现象
温度计的示数增大
反应开始后,气球慢慢胀大
反应开始后,甲侧液面低于乙侧液面
反应开始后,针筒活塞向右移动
4.(2019·株洲高一检测)下列实验现象中,不能说明相应的化学反应是放热反应的是
1
2
3
4
5
6
7
√
5.在25
℃、101
kPa下,1
g乙醇燃烧生成CO2和液态水时放热29.71
kJ,下列热化学方程式正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=1
366.66
kJ·mol-1
B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1
366.66
kJ·mol-1
D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-29.71
kJ·mol-1
√
1
2
3
4
5
6
7
解析 乙醇燃烧是放热反应,ΔH的符号应为“-”,A不正确;1
g
C2H5OH燃烧放出29.71
kJ热量,则1
mol(46
g)C2H5OH燃烧放出的热量为1
366.66
kJ。
解析 根据题意可知,1
mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ×
=2
165
kJ热量,其热化学方程式为B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2
165
kJ·mol-1。
6.化学在能源开发与利用中起着十分关键的作用。
(1)0.3
mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ热量,其热化学方程式为_______________
_________________________________________。
1
2
3
4
5
6
7
B2H6(g)+3O2(g)
===B2O3(s)+3H2O(l) ΔH=-2
165
kJ·mol-1
(2)家用液化气中主要成分之一是丁烷。当1
g丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50
kJ。试写出丁烷燃烧的热化学方程式:
_________________________________________________________。
1
2
3
4
5
6
7
7.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
1
2
3
4
5
6
7
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是______(填装置序号)。
Ⅲ
解析 装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在试管中加入适量Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是__________
__________________________,说明该反应属于_______(填“吸热”或“放热”)反应。
U形管内左
端液面降低,右端液面升高
放热
解析 Ba(OH)2溶液与稀硫酸的反应属于中和反应,中和反应都是放热反应。
解析 NaOH固体、硝酸铵等溶于水时有热量的变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是
________________________________________________________________________。
导气管口处产生气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱
②若观察到烧杯中产生气泡,则说明M溶于水________________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是________________________________________________。
可能是放热反应
某些物质(如NaOH固体)溶于水放热,但不是放热反应
1
2
3
4
5
6
7
返回
本课结束
第1课时 放热反应和吸热反应
热化学方程式
1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。2.知道热化学方程式与普通化学方程式的不同,能正确书写热化学方
程式。
核心素养发展目标
一、放热反应与吸热反应
随堂演练 知识落实
课时对点练
二、热化学方程式
内
容
索
引
1.化学反应中的热量变化
(1)化学反应过程中能量转化形式
化学反应中不仅有物质的转变,同时还伴随着
的变化。化学反应中比较常见的是化学能与热能、电能、光能等的互相转化。
一、放热反应与吸热反应
能量
实验操作
?
?
实验现象
有
产生;用温度计测量,温度_____
闻到
气味;烧杯壁
;玻璃片和烧杯
,混合物呈______
(2)放热反应和吸热反应
①实验探究
气泡
升高
刺激性
发凉
黏结在一起
糊状
实验结论
该反应产生
,_____
热量
该反应产生NH3和H2O,______
热量
化学方
程式
___________________________
__________________________________________________
气体
放出
吸收
Mg+2HCl===MgCl2+H2↑
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
②结论:化学反应除了有新物质生成以外,还总会伴随着能量变化,通常主要表现为热能的变化,有的
热量,有的
热量。
放出
吸收
2.放热反应与吸热反应
(1)概念
①放热反应:
热的化学反应。
②吸热反应:
热的化学反应。
放出
吸收
(2)常见的放热反应和吸热反应
放热反应
吸热反应
①所有燃烧反应
②酸碱中和反应
③大多数化合反应
④活泼金属跟水或酸的反应
⑤物质的缓慢氧化
①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2
与NH4Cl反应
③以C、H2、CO为还原剂的氧化还原反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
(1)硝酸铵固体溶于水,溶液的温度降低,该变化为吸热反应( )
(2)氢气燃烧,浓硫酸溶于水,都放出热量,这些变化都为放热反应( )
(3)化学反应既有物质变化,又有能量变化( )
(4)镁条在空气中燃烧是放热反应,反应过程中所释放的能量全部转化为热能( )
(5)吸热反应需要加热才能进行,放热反应都不需要加热就可以进行( )
(6)火药爆炸时所释放的能量包括热、光、声、机械能等多种能量形式
( )
判断正误
×
×
√
×
×
×
化学兴趣小组的同学在开展研究性学习时,做了一个有关物质溶解和物质发生化学反应过程中能量变化的探究实验,装置如图所示。
已知:小试管A、B中分别盛有两种不
同的无色液体,U形管内均为滴有红墨
水的水。
(1)若试管A中的无色液体是稀硫酸,向A试管中加入铁粉,可以观察到的实验现象是什么?
深度思考
提示 看到试管A中产生大量无色气泡,且U形管a、b两端液面的变化是a端液面下降,b端液面上升。
(2)产生图1中的现象的原因是什么?
提示 铁粉与稀硫酸反应放热,致使瓶
内气体膨胀,瓶内气压大于外界气压,
从而将U形管中的红色墨水压往U形管的右侧。
(3)若试管B中的无色液体是水,向试管B中加入一种固体,且U形管的a、b两端液面的变化与图1相同,则所加固体可能是什么(从冰、氧化钙、氢氧化钠、硝酸铵、干冰五种物质中选择)?
提示 由于U形管的a、b两端液面的变化与图1相同,则加入水的物质应该是溶于水或与水反应放热的物质,所以应该是氧化钙或氢氧化钠。
(4)若试管B中的液体是NaOH溶液,若加入酸性溶液会使U形管的a、b两端液面的变化与图1相同吗?
提示 由于酸碱中和反应是放热反应,所以可以产生与图1中相同的现象。
有关放热反应和吸热反应理解的三个“不一定”
(1)放热反应不一定容易发生,如合成氨反应需要在高温、高压和催化剂作用下才能发生;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应在常温下就能发生。
(2)需要加热才能发生的反应不一定是吸热反应,如硫与铁的反应;吸热反应不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(3)放热过程不一定是放热反应,如NaOH固体的溶解和浓硫酸的稀释是放热过程,但不是放热反应;吸热过程不一定是吸热反应,如升华、蒸发等过程是吸热过程,但不是吸热反应。
归纳总结
返回
二、热化学方程式
1.概念
能表示化学反应中
的热量的化学方程式。
2.书写——“三字诀”
放出或吸收
放
吸
例如,已知1
mol
C与1
mol
O2完全反应生成1
mol
CO2放出393.6
kJ热量,则该反应的热化学方程式为
。
C(s)+O2(g)===CO2(g) ΔH=-393.6
kJ·mol-1
(1)CaCO3(g)===CaO+CO2(g) ΔH=177.7
kJ( )
(2)C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.3
kJ·mol-1( )
(3)C(s)+
O2(g)===CO(g) ΔH=-110.5
kJ·mol-1( )
(4)CO(g)+
O2(g)===CO2(g) ΔH=-283
kJ·mol-1( )
判断正误
×
×
√
√
写出298
K时,下列反应的热化学方程式:
(1)1
mol
HgO(s)分解为液态汞和氧气,吸热90.7
kJ。
______________________________________________________________
_________________________
理解应用
2HgO(s)===2Hg(l)+O2(g) ΔH=181.4
kJ·mol-1[或HgO(s)===Hg(l)+
(2)16
g固体硫完全燃烧时放出148.4
kJ的热量。
________________________________________________________________
______________________
ΔH=-296.8
kJ·mol-1]
(3)2.00
g
C2H2气体完全燃烧生成液态水和CO2,放出99.6
kJ的热量。
________________________________________________________
热化学方程式的书写方法
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)要注明反应物和生成物的状态。
(3)在右端注明ΔH的符号(正号常省略)、大小及单位。
(4)化学计量数只表示物质的量,因此可以是整数,也可以是分数。化学计量数改变,ΔH的数值要相应改变。
归纳总结
返回
1.下列反应一定属于放热反应的是
①H2SO4与Ba(OH)2溶液的反应 ②Mg与CH3COOH溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
A.仅①②③
B.仅①②④
C.仅①②③④
D.仅③④⑤
1
2
3
5
随堂演练 知识落实
4
√
6
解析 金属与酸的置换反应、中和反应、所有燃烧反应都是放热反应;复分解反应不一定是放热反应。
2.下列反应属于吸热反应的是
A.铝与CuCl2溶液反应
B.NaOH和HCl反应
C.NaOH与NH4Cl的反应
D.甲烷燃烧
1
2
3
5
4
√
解析 金属与盐溶液的置换反应、中和反应、燃烧反应均为放热反应。
6
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484
kJ·mol-1
3.已知在1×105
Pa、298
K条件下,2
mol氢气燃烧生成水蒸气放出484
kJ热量,下列热化学方程式正确的是
√
1
2
3
5
4
6
D.2H2(g)+O2(g)===2H2O(g) ΔH=484
kJ·mol-1
解析 2
mol氢气燃烧生成水蒸气放出484
kJ热量,则1
mol氢气燃烧生成水蒸气应放出
×484
kJ=242
kJ热量,放出热量ΔH为“-”,各物质的状态分别是H2(g)、O2(g)、H2O(g)。B项中H2O的状态应为气态;
C、D两项中ΔH的符号应为“-”;
A项是逆向进行的反应,ΔH为正值,数值为2
mol
H2燃烧放热数值的一半,书写正确,故应选A项。
1
2
3
5
4
6
4.下列说法中正确的是
A.化合反应均是放热反应,分解反应均是吸热反应
B.燃料的燃烧反应是放热反应
C.干冰的升华是吸热反应
D.需要点燃或加热的化学反应一定是吸热反应
1
2
3
5
4
解析 C+CO2
2CO是化合反应,但需要吸热,2H2O2===2H2O+O2↑是分解反应,但放出热量。物质的燃烧均是放热反应。判断吸热、放热反应与外部条件无关,如可燃物的燃烧需要点燃,但是放热反应。
√
6
5.依据事实,写出下列反应的热化学方程式。
(1)在25
℃、101
kPa下,1
g甲醇燃烧生成CO2和液态水时放热22.68
kJ。
则表示甲醇燃烧的热化学方程式为_________________________________
______________________。
(2)若适量的N2和O2完全反应,每生成23
g
NO2需要吸收16.95
kJ热量,__________________________________________。
1
2
3
5
4
6
ΔH=-725.76
kJ·mol-1
N2(g)+2O2(g)===2NO2(g) ΔH=67.8
kJ·mol-1
6.除了用手触摸和温度计测量外还可以借助其他方法感知温度的变化,如在探究化学反应过程中有热量变化时,某兴趣小组设计了如下三套装置:
1
2
3
5
4
6
(1)该小组选择装置Ⅰ探究Na2O2和H2O反应为放热反应,将水滴入盛有过氧化钠的试管中,现象为_________________________________,化学方程式:_____________________________。
U形管右侧液面下降,左侧液面上升
2Na2O2+2H2O===4NaOH+O2↑
(2)该小组选择装置Ⅱ探究硝酸铵溶于水的能量变化,当向盛有硝酸铵固体的试管中滴入少量水,发现导管中上升一段水柱,则该变化_____
(填“是”或“不是”)吸热反应,原因为__________________________
________________。
1
2
3
5
4
6
不是
硝酸铵溶于水没有新物质生
成,为物理变化
(3)该小组在探究镁和盐酸反应热量变化时,选择了装置Ⅲ,发现反应过程中,导管口有气泡冒出,该装置______(填“能”或“不能”)证明镁和盐酸反应为放热反应,原因为_______________________________
_____________________________________________。
1
2
3
5
4
6
不能
镁和盐酸反应生成氢气,无论是吸
热反应还是放热反应,烧杯中导管口都有气泡冒出
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学反应与能量变化的关系
1.(2020·吉林松原一中高一期中)下列对于化学反应过程的理解,错误的是
A.化学反应过程中同时存在物质和能量的变化
B.凡是能量变化一定发生在化学变化中
C.化学反应中同时存在质量守恒和能量守恒
D.能量的释放和吸收以发生变化的物质为基础
√
A组 基础对点练
解析 化学反应过程中都会伴随着物质变化和能量变化,A正确;
化学变化过程中往往伴随着能量的变化,而有能量变化时不一定发生化学变化,如灯泡通电发光放热,B错误;
化学反应的实质是原子的重新组合,符合质量守恒定律;反应过程中往往伴随着能量的变化,符合能量守恒定律,C正确;
化学反应过程中同时存在物质和能量的变化,且能量的释放和吸收是以发生变化的物质为基础的,二者密不可分,D正确。
1
2
3
4
5
6
7
8
9
2.下列关于化学反应中能量变化的说法正确的是
A.形成化学键的过程是放热过程
B.可逆反应进行的过程中没有能量变化
C.在常温下可以发生的反应一定是放热反应
D.化学反应中能量变化的大小与反应物的质量多少无关
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
题组二 吸热反应与放热反应
3.(2019·陕西省商洛市高一期末)下列属于吸热反应的是
A.气态水液化为液态水
B.高温分解石灰石
C.氢氧化钠和盐酸反应
D.氢气在氯气中燃烧
√
解析 气态水液化为液态水是一个放热过程,属于物理变化,故A错误;
高温分解石灰石是一个吸热反应,故B正确;
氢氧化钠和盐酸反应为中和反应,属于放热反应,故C错误;
氢气在氯气中燃烧生成氯化氢的反应为放热反应,故D错误。
4.(2019·河北张家口第一中学月考)下列变化一定是吸热反应的是
A.凡需加热才能发生的反应
B.所有的分解反应
C.将化学能转变为热能的反应
D.Ba(OH)2晶体与NH4Cl晶体的反应
1
2
3
4
5
6
7
8
9
√
1
2
3
4
5
6
7
8
9
解析 需要加热才能发生的反应不一定是吸热反应,如燃烧,一般需加热到一定温度才能反应,但是燃烧是放热反应,A项错误;
不是所有的分解反应都是吸热反应,如过氧化氢的分解是放热反应,B项错误;
将化学能转变为热能的反应是放热反应,C项错误。
5.(2020·广东江门一中高一检测)为了探究化学反应的能量变化情况,某同学设计了如图装置,向盛有A试剂的试管中滴加B试剂时,看到U形管中,甲处液面上升,乙处液面下降,则A试剂和B试剂为
A.金属钠和水
B.碳酸氢钠和盐酸
C.生石灰和水
D.氢氧化钠和硝酸
√
1
2
3
4
5
6
7
8
9
解析 金属钠和水反应,生石灰和水反应,氢氧化钠和硝酸中和反应,都为放热反应,现象应为甲处液面下降,乙处液面上升,与题意不符,故A、C、D错误;
NaHCO3和盐酸反应为吸热反应,温度降低,试剂瓶中气体压强降低,U形管中甲处液面上升,乙处液面下降,故B正确。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
6.根据日常生活和回忆已学化学反应,对下列变化按吸热或放热的标准分类:
①钠投入水中 ②煅烧石灰石制生石灰 ③食物腐烂 ④炸药爆炸 ⑤氢气在氯气中燃烧 ⑥生石灰与水作用制熟石灰 ⑦碳与水蒸气制取水煤气(CO和H2) ⑧硫酸与氢氧化钠的中和反应 ⑨氦气球受热爆炸
(1)属于放热反应的有_____________(填序号,下同)。
(2)属于吸热反应的有_______。
①③④⑤⑥⑧
②⑦
7.在两支试管中分别加入3
mL稀盐酸(均足量),将两个各装有0.3
g
NaHCO3或Na2CO3粉末的小气球分别套在两支试管口(如下图)。将气球内的NaHCO3或Na2CO3同时倒入试管中。
(1)①Ⅰ试管和Ⅱ试管中分别发生反应的离子
方程式:
_________________________;
_________________________。
②两支试管中的现象为__________________________________________
____________________________。
1
2
3
4
5
6
7
8
9
两支试管中都产生大量气泡,但加入NaHCO3的
试管中产生气泡的速度要快得多
甲得出结论的方法是否正确?________(填“正确”或“不正确”)。
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。
1
2
3
4
5
6
7
8
9
不正确
解析 与同浓度盐酸反应时,NaHCO3比Na2CO3剧烈,产生气泡的速度快,甲得出结论的方法不正确,因为两粉末与盐酸的反应包括两个过程:一是粉末的溶解过程,二是在溶液中与盐酸的反应过程。
(2)为研究两反应是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
1
2
3
4
5
6
7
8
9
序号
试剂1
试剂2
混合前温度
混合后最高或最低温度
①
50
mL水
2.5
g
NaHCO3固体
20
℃
18.5
℃
②
35
mL水
3.2
g
Na2CO3固体
20
℃
23.3
℃
③
35
mL稀盐酸
含2.5
g
NaHCO3的饱和溶液15
mL
20
℃
18.8
℃
④
50
mL稀盐酸
含3.2
g
Na2CO3的饱和溶液15
mL
20
℃
21.2
℃
通过上述实验可得出三条结论:
a.NaHCO3的溶解是_______(填“吸热”或“放热”)过程。
b.Na2CO3的饱和溶液和盐酸的反应是_____(填“吸热”或“放热”)反应。
c.NaHCO3的饱和溶液和盐酸的反应是_______(填“吸热”或“放热”)反应。
1
2
3
4
5
6
7
8
9
吸热
放热
吸热
解析 由表中数据①②可知,NaHCO3固体的溶解是吸热的,Na2CO3固体的溶解是放热的。分析③④两组数据可知NaHCO3饱和溶液与盐酸反应是吸热的,Na2CO3饱和溶液与盐酸反应是放热的。
题组三 热化学方程式的意义与书写
8.下列说法中正确的是
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数
值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)===2H2O(g) ΔH=
-483.6
kJ
1
2
3
4
5
6
7
8
9
√
解析 A项中要标明物质的状态;
B项中C在O2中燃烧是放热反应;
D项中ΔH的单位是kJ·mol-1。
1
2
3
4
5
6
7
8
9
A.1
mol氢气和1
mol碘蒸气完全反应需要吸收9
kJ热量
B.1个氢分子和1个碘分子完全反应需要放出9
kJ的热量
C.1
mol
H2(g)与1
mol
I2(g)完全反应生成2
mol的HI气体放出18
kJ的热量
D.1
mol
H2(g)与1
mol
I2(g)完全反应吸收18
kJ的热量
1
2
3
4
5
6
7
8
9
解析 热化学方程式的具体形式是表示一定物质的量、一定聚集状态的反应物完全反应生成一定聚集状态的生成物时的放热或吸热情况。只要依据书写热化学方程式的注意事项,对于本题就不难作出判断。
√
B组 综合强化练
1.下列反应中,属于吸热反应的是
A.酸碱中和反应
B.CH4在O2中燃烧
C.NH4Cl晶体与Ba(OH)2·8H2O晶体混合搅拌
D.CaO溶于水生成Ca(OH)2
1
2
3
4
5
6
7
√
解析 酸碱中和反应为放热反应,生成物总能量应该低于反应物总能量,故A错误;
燃烧反应为放热反应,生成物总能量应该低于反应物总能量,故B错误;
NH4Cl晶体与Ba(OH)2·8H2O晶体反应为吸热反应,故C正确;
CaO溶于水生成Ca(OH)2为放热反应,生成物总能量应该低于反应物总能量,故D错误。
1
2
3
4
5
6
7
2.“即食即热型”快餐适合外出时携带和食用,其内层中有用铝箔包裹的已加工好的真空包装食品,外层有分别包装的两包化学物质,拉动预留在外的拉线使这两种化学物质相互作用,放出的热量便可对食物进行加热。这两包化学物质最合理的组合是
A.浓硫酸和水
B.生石灰和水
C.熟石灰和水
D.氯化钠和水
√
1
2
3
4
5
6
7
解析 选项中只有浓硫酸与水、生石灰和水相互作用是明显放热的,但浓硫酸为腐蚀品,不适用于食物加热,且浓硫酸与水混合所得的稀硫酸能与铝箔反应,故不适用。
3.下列说法正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就可以发生
C.反应条件是加热的反应是吸热反应
D.化学反应放热还是吸热,取决于反应条件
1
2
3
4
5
6
7
√
解析 判断吸热反应、放热反应与反应条件无关。
选项
A
B
C
D
实验装置
?
?
?
?
实验现象
温度计的示数增大
反应开始后,气球慢慢胀大
反应开始后,甲侧液面低于乙侧液面
反应开始后,针筒活塞向右移动
4.(2019·株洲高一检测)下列实验现象中,不能说明相应的化学反应是放热反应的是
1
2
3
4
5
6
7
√
5.在25
℃、101
kPa下,1
g乙醇燃烧生成CO2和液态水时放热29.71
kJ,下列热化学方程式正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=1
366.66
kJ·mol-1
B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1
366.66
kJ·mol-1
D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-29.71
kJ·mol-1
√
1
2
3
4
5
6
7
解析 乙醇燃烧是放热反应,ΔH的符号应为“-”,A不正确;1
g
C2H5OH燃烧放出29.71
kJ热量,则1
mol(46
g)C2H5OH燃烧放出的热量为1
366.66
kJ。
解析 根据题意可知,1
mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ×
=2
165
kJ热量,其热化学方程式为B2H6(g)+3O2(g)===B2O3(s)+3H2O(l) ΔH=-2
165
kJ·mol-1。
6.化学在能源开发与利用中起着十分关键的作用。
(1)0.3
mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ热量,其热化学方程式为_______________
_________________________________________。
1
2
3
4
5
6
7
B2H6(g)+3O2(g)
===B2O3(s)+3H2O(l) ΔH=-2
165
kJ·mol-1
(2)家用液化气中主要成分之一是丁烷。当1
g丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50
kJ。试写出丁烷燃烧的热化学方程式:
_________________________________________________________。
1
2
3
4
5
6
7
7.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
1
2
3
4
5
6
7
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是______(填装置序号)。
Ⅲ
解析 装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在试管中加入适量Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是__________
__________________________,说明该反应属于_______(填“吸热”或“放热”)反应。
U形管内左
端液面降低,右端液面升高
放热
解析 Ba(OH)2溶液与稀硫酸的反应属于中和反应,中和反应都是放热反应。
解析 NaOH固体、硝酸铵等溶于水时有热量的变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是
________________________________________________________________________。
导气管口处产生气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱
②若观察到烧杯中产生气泡,则说明M溶于水________________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是________________________________________________。
可能是放热反应
某些物质(如NaOH固体)溶于水放热,但不是放热反应
1
2
3
4
5
6
7
返回
本课结束
