高中化学苏教版(2019)必修第二册 专题6 第二单元 第2课时 化学反应中能量变化原因 燃料的选择和氢能的利用(74张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题6 第二单元 第2课时 化学反应中能量变化原因 燃料的选择和氢能的利用(74张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-24 23:31:01 | ||
图片预览











文档简介
(共74张PPT)
第2课时 化学反应中能量变化原因
燃料的选择和氢能的利用
1.能用化学键解释某些吸热反应和放热反应,能进行一些简单的能量
变化计算。
2.理解化学反应中能量的变化取决于反应物与生成物的总能量相对大小。
3.认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
核心素养发展目标
一、化学反应中能量变化的原因
随堂演练 知识落实
课时对点练
二、燃料燃烧释放的能量和氢燃料的应用前景
内
容
索
引
1.化学反应中能量变化与化学键的关系
(1)化学反应过程
一、化学反应中能量变化的原因
(2)化学反应中能量变化的原因
吸收
放出
吸热
放热
图示
?
?
能量相对大小
反应物的总能量
生成物的总能量
反应物的总能量
生成物的总能量
2.化学反应中能量的决定因素(宏观辨识)
大于
小于
(1)化学反应的两大基本特征:物质种类发生变化和能量发生变化。
(2)化学键的断裂和形成是物质在化学反应中发生能量变化的本质原因。
(1)对于一个化学反应来说,当化学键断裂时吸收的能量大于化学键形成时放出的能量,则反应放热( )
(2)相同条件下形成1
mol
H—Cl键放出的能量与断开1
mol
H—Cl键吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程
( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
判断正误
×
√
√
×
×
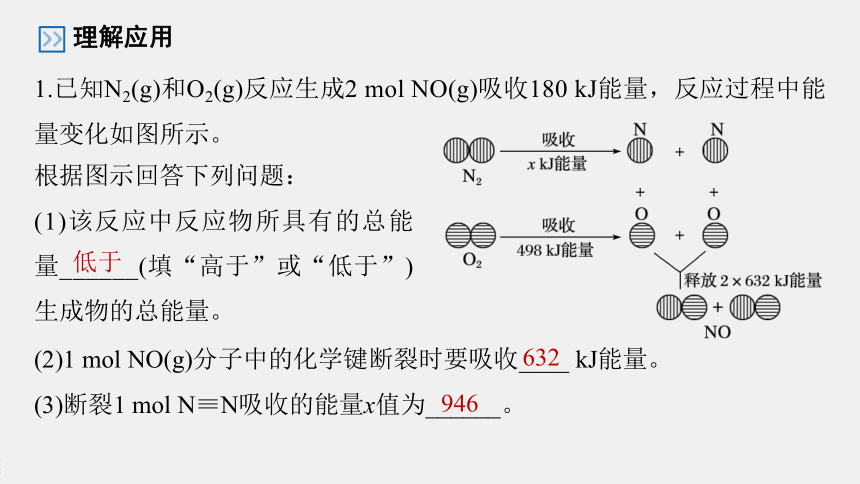
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量______(填“高于”或“低于”)生成物的总能量。
1.已知N2(g)和O2(g)反应生成2
mol
NO(g)吸收180
kJ能量,反应过程中能量变化如图所示。
理解应用
(2)1
mol
NO(g)分子中的化学键断裂时要吸收____
kJ能量。
(3)断裂1
mol
N≡N吸收的能量x值为______。
低于
632
946
解析 根据图示,断裂旧化学键所吸收能量为(x+498)kJ,形成新化学键所释放能量为2×632
kJ=1
264
kJ,每生成2
mol
NO(g)所吸收能量为180
kJ,因此有180
kJ=(x+498)kJ-1
264
kJ,故x为946。
2.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25
℃、101
kPa下,31
g白磷完全转化为红磷,放出11
kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于______反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是______(填“白磷”或“红磷”,下同)。
(3)31
g白磷与31
g红磷的能量较高的是______,二者更稳定的是______。
吸热
白磷
白磷
红磷
物质稳定性的因素
物质的化学键越牢固,断裂时需要吸收的能量越多,形成时释放的能量越多,物质具有的能量越低,物质越稳定。
归纳总结
返回
二、燃料燃烧释放的能量和氢燃料的应用前景
1.热值
已知下列几种燃料的热值:
其热化学方程式分别为
①C(s)+O2(g)===CO2(g) ΔH=-396
kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·mol-1
物质
煤炭
天然气
氢气
乙醇
热值/kJ·g-1
约33
约56
143
30
④C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1
380
kJ·mol-1
(1)完全燃烧相等物质的量的上述物质,放出热量的大小顺序是________
。
(2)完全燃烧等质量的上述物质,放出热量的大小顺序是
。
(3)燃料燃烧放出热量的大小常用热值来衡量。燃料的热值是指在一定条件下
的物质完全燃烧所放出的
,单位是
。
④>②>
①>③
③>②>①>④
单位质量
热量
kJ·g-1
2.常规能源
(1)现阶段人类获取热能的主要途径是
;使用最多的常规能源是
。
(2)化石燃料获取能量面临的问题
①储量有限,短期内不可再生。
②影响环境:煤、石油产品燃烧排放的____________________________
等是大气污染物的主要来源。
物质的燃烧
化石燃料(煤、石油和天然气)
粉尘、SO2、氮氧化物(NOx)、
CO
(3)节能减排的措施
①节约现有的能源,尤其是减少作为燃料的煤和石油的开采。
②提高燃料的使用效率。
③积极开发优质的新能源,目前人们比较关注的新能源有_________
等。
太阳能、
风能、水能和氢能
3.氢燃料的应用前景
(1)能源特点
(2)氢能开发利用的困难与解决方法
①困难:能耗高、储存和运输困难等。
②方法:
a.在光分解催化剂存在条件下,在特定的装置中,利用
分解水制氢气。
b.利用蓝绿藻等低等植物和微生物在阳光作用下分解水释放出
。
c.发现和应用贮氢材料,解决氢气的储存和运输问题。
太阳能
氢气
(3)氢燃料的应用实例
①
的燃料。
②
的燃料。
③
。
作人造卫星和运载火箭
作混合动力有轨电车
氢燃料电池
(1)太阳能转化为化学能
①物质转化:
在太阳光作用下,植物体内的叶绿素把水、二氧化碳转化为葡萄糖,进而生成淀粉、纤维素。
②化学反应:
。
③能量转化:光能―→
能。
6CO2(g)+6H2O(g)
C6H12O6(s)+6O2(g)
4.太阳能及其利用
化学
化学
(2)化学能转化为热能
①物质转化:
动物摄入体内的淀粉能水解转化为葡萄糖,葡萄糖氧化生成二氧化碳和水,释放出
,供给生命活动的需要。
C6H12O6+6O2―→6H2O+6CO2。
③能量转化:化学能―→热能。
热
?
实例
能量转化方式
直接利用
光合作用
光能转化为________
太阳能热水器
光能转化为______
太阳能电池
光能转化为_____
光解水制氢气
光能转化为______
间接利用
化石燃料
太阳能间接转化为_______
(3)太阳能的利用
化学能
热能
电能
化学能
化学能
(1)氢气的热值较高,是目前主要的能源( )
(2)煤经气化转化为煤气是物理变化( )
(3)我国目前使用燃料效率不高,而且引起的污染大( )
(4)利用太阳光催化分解水制氢是一种理想的制氢手段( )
(5)将太阳能转化为热能是目前太阳能应用最广泛的形式( )
判断正误
×
×
√
√
√
小明的爸爸是一名出租车司机,为倡导“绿水青山就是金山银山”这一理念,小明回到家和爸爸进行了一番争论。
小明认为:现在空气污染比较严重,应将汽车燃料改用新能源,或者污染较小的燃料。
小明的爸爸认为:现在城市污染不是很严重,新能源汽车价格高,续航能力差,不经济,汽油作燃料性价比高,适合长时间运行。
为了说服爸爸,小明又给爸爸展示了三张图片。
理解应用
燃料
液化石油气
天然气(CNG)
95号乙醇汽油
价格(元/升)
4.8
2.3
6.9
热值(kJ·kg-1)
4.5×104
4.0×104
4.6×104
图2 常用车用燃料热值及价格
最后小明的爸爸赞同了小明的观点,决定将汽油改为天然气。
(1)小明鼓励爸爸,将汽油改为天然气的目的是_______________________
________________________________________。
节约石油资源,减少对空气的污染,天然气作燃料性价比相对较高
(2)结合图3,对于能源的选择,请你再提一条符合小明的目的的建议:____________________________________________________________________________________。
为减少化石能源对环境的影响,可以大力开发利用新能源,如太阳能、风能、水能、氢能等
(3)“开源节流”是应对能源危机的重要举措,下列做法有助于能源“开源节流”的是________(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化
石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
acd
归纳总结
返回
1.(2020·山东泰安高一期末)已知2H→H2的能量变化如图所示。下列说法不正确的是
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1
mol新化学键放出437.6
kJ
的能量
D.1
mol
H2离解成2
mol
H要放出437.6
kJ热量
1
2
3
5
随堂演练 知识落实
4
√
解析 A对,H2分子中含有共价键,故2H→H2过程中形成共价键;
B对,由图可知,H原子变成H2放出能量,则相同质量的氢气分子的能量比氢原子的能量低;
C对,由图可知,2H→H2过程中,形成1
mol
H—H键要放出437.6
kJ能量;
1
2
3
5
4
D错,1
mol
H2离解成2
mol
H原子,要断裂H—H键,故要吸收437.6
kJ能量。
2.(2020·四川遂宁高一期末)如图是某化学反应
过程中能量变化的曲线图。下列叙述正确的是
A.该反应为吸热反应
B.该图可以表示Zn与HCl溶液反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形成生成物中化学键放出的能量
1
2
3
5
4
√
解析 A错,由图可知,反应物的总能量高于生成物的总能量,则该反应是放热反应;
B对,Zn和HCl溶液反应生成ZnCl2和H2,是放热反应,符合图示能量变化;
C错,化学反应过程中,物质变化和能量变化同时发生;
1
2
3
5
4
D错,该反应是放热反应,断开反应物中化学键吸收的能量小于形成生成物中化学键放出的能量。
3.(2020·怀化市高一期末)100
kPa时,1
mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化为金刚石的反应为放热反应
D.破坏1
mol石墨化学键所吸收的能量小于形成1
mol金刚石化学键所放
出的能量
√
1
2
3
5
4
解析 由图可知,石墨转化为金刚石要吸收能量,说明石墨的能量低,更稳定,选项A正确,选项B错误;
由图可知,石墨转化为金刚石要吸收能量,反应为吸热反应,选项C错误;
1
2
3
5
4
由图可知,该反应为吸热反应,故破坏1
mol石墨化学键所吸收的能量大于形成1
mol金刚石化学键所放出的能量,选项D错误。
4.(2019·淮南月考)液态储氢技术就是在常温常压下将氢气融入一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
1
2
3
5
4
√
解析 “氢油”便于储存和运输,说明它比较稳定,故A错误;
氢气燃烧生成水,水分解又生成氢气,故属于可再生能源,故B正确;
常温常压下可以将氢气融入一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;
液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
1
2
3
5
4
解析 若E1>E2,反应体系的总能量降低,故反应物的部分内能通过化学反应转化为热能释放给环境,则生成物的总能量小于反应物的总能量,依据反应前后能量守恒可知反应是放热反应。
5.在一定条件下A与B反应可生成C和D,其能量变化如下:
(1)若E1>E2,反应体系的总能量________(填“升高”或“降低”),为______(填“吸热”或“放热”)反应,其原因是______________________
_____________________________。
降低
放热
反应物的部分内能通过
化学反应转化为热能释放给环境
1
2
3
5
4
(2)若E1<E2,反应体系的总能量_______(填“升高”或“降低”),为______(填“吸热”或“放热”)反应,其原因是______________________。
1
2
3
5
4
返回
升高
吸热
解析 若E1<E2,反应体系的总能量升高,故反应物从环境中吸收能量,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应。
反应物从环境中吸收能量
课时对点练
1
2
3
4
5
6
7
8
9
题组一 能量变化的决定因素
1.下列反应一定属于放热反应的是
A.八水合氢氧化钡晶体和氯化铵晶体的反应
B.反应物能量比生成物能量低的反应
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.不需要加热就能发生的反应
√
A组 基础对点练
10
11
1
2
3
4
5
6
7
8
9
解析 氢氧化钡晶体和氯化铵晶体的反应属于吸热反应,故A错误;
生成物的总能量比反应物的总能量大的反应为吸热反应,故B错误;
化学键断裂吸收的能量比化学键形成放出的能量少的反应为放热反应,故C正确;
不需要加热就能发生的反应可能为吸热反应,也可能为放热反应,故D错误。
10
11
D.Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
2.(2019·福建省南平市高一下学期期末)下列化学反应过程中的能量变化符合如图所示的是
A.HCl+NaOH===NaCl+H2O
B.Fe+H2SO4===FeSO4+H2↑
√
1
2
3
4
5
6
7
8
9
10
11
解析 酸碱中和反应是放热反应,故A错误;
金属与酸的反应为放热反应,故B错误;
物质的燃烧反应是放热反应,故C错误;
Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
为铵盐与碱的反应,属于吸热反应,故D正确。
1
2
3
4
5
6
7
8
9
10
11
A.12
g
C所具有的能量一定高于28
g
CO所具有的能量
B.56
g
CO和32
g
O2所具有的总能量大于88
g
CO2所具有的总能量
C.12
g
C和32
g
O2所具有的总能量大于44
g
CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
1
2
3
4
5
6
7
8
9
√
10
11
12
g
C并不代表反应物的全部,O2也是反应物,A项不正确;
1
2
3
4
5
6
7
8
9
10
11
A.500
mL
2.0
mol·L-1
HCl溶液和
500
mL
2.0
mol·L-1
NaOH溶液的反应符合图(a),且放出热量为ΔE1
B.500
mL
2.0
mol·L-1
H2SO4溶液和500
mL
2.0
mol·L-1
Ba(OH)2溶液的
反应符合图(b),且吸收热量为ΔE2
C.发生图(a)能量变化的任何反应,一定不需要加热即可发生
D.CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
4.如图表示化学反应过程中的能
量变化,据图判断下列说法中合
理的是
1
2
3
4
5
6
7
8
9
√
10
11
1
2
3
4
5
6
7
8
9
解析 图(a)表示放热反应,选
项A是放热反应,A项正确;
图(b)表示吸热反应,选项B是
放热反应,B项错误;
一些放热反应需加热才能发生,C项错误;
浓硫酸溶于水虽然会放出热量,但不属于化学反应,D项错误。
10
11
5.下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
√
1
2
3
4
5
6
7
8
9
10
11
解析 E生成物>E反应物为吸热反应,E生成物燃料燃烧放热,故B正确;
硝酸铵溶于水是物理变化,故C错误;
ΔH与反应条件无关,故D错误。
下列关于合成氨反应的叙述中不正确的是
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
题组二 化学反应中能量变化的实质
6.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
√
1
2
3
4
5
6
7
8
9
10
11
解析 由图可知,每3个氢气分子和1个氮气分子断键得到原子,然后氢原子和氮原子生成2个氨分子,A项正确;
催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物化学键的断裂和生成物化学键的形成变得更容易,B项正确;
化学键的断裂需要吸收能量,而化学键的形成则放出能量,从图中可看出②为化学键断裂过程,③为新的化学键形成过程,C项正确;
化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
1
2
3
4
5
6
7
8
9
10
11
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
A.1
mol
N2(g)和1
mol
O2(g)反应放出的能量为180
kJ
B.1
mol
N2(g)和1
mol
O2(g)具有的总能量小于2
mol
NO(g)具有的总能量
C.通常情况下,N2(g)和
O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
√
1
2
3
4
5
6
7
8
9
10
11
解析 反应热就是断裂旧化学键吸收的能量和形成新化学键所放出的能量的差值,所以该反应的反应热是946
kJ·mol-1+498
kJ·mol-1-2×632
kJ·mol-1=180
kJ·mol-1,所以该反应是吸热反应,所以选项A不正确,选项B正确;
氮气和氧气反应需要在高温或放电条件下才能发生,选项C不正确;
NO不是酸性氧化物,和氢氧化钠溶液不反应,选项D不正确。
1
2
3
4
5
6
7
8
9
10
11
解析 H2在O2中燃烧放热,则拆开化学键吸收的总能量比形成化学键放出的总能量小,由于反应的方程式为2H2+O2
2H2O,则断键吸收的能量为2Q1+Q2,形成化学键放出的能量为4Q3,则能量关系为2Q1+Q2<4Q3。
8.氢气可以在氧气中燃烧。在该反应中:断裂1
molH—H键消耗的能量为Q1
kJ,断裂1
molO==O键消耗的能量为Q2
kJ,形成1
molH—O键释放的能量为Q3
kJ。下列关系式中,正确的是
A.2Q1+Q2B.Q1+Q2>2Q3
C.2Q1+Q2<4Q3
D.2Q1+Q2<2Q3
1
2
3
4
5
6
7
8
9
√
10
11
9.(2019·黄州一中高一期末)已知反应H2(g)+
O2(g)===H2O(g),反应过程中能量变化如图所示,则
1
2
3
4
5
6
7
8
9
10
11
(1)a、b、c分别代表什么意义?
a____________________________;
b____________________________;
c___________________。
旧的化学键断裂所吸收的能量
新的化学键形成所放出的能量
总反应所放出的能量
解析 由图像分析可知,a表示旧的化学键断裂所吸收的能量,b表示新的化学键形成所放出的能量,c表示总反应所放出的能量。
(2)该反应是________(填“吸热”或“放热”)反应,放出的热量为__________kJ(用字母表示)。
1
2
3
4
5
6
7
8
9
10
11
解析 反应物的总能量高于生成物的,所以该反应是放热反应,放出的热量为c(或b-a)kJ。
放热
c(或b-a)
题组三 能源与热值
10.氢能是一种理想的“绿色能源”,以下有关氢能开发的方式中最理想的是
A.大量建设水电站,用电力分解水制取氢气
B.利用化石燃料燃烧放热,使水高温分解产生氢气
C.在催化剂作用下,利用太阳能分解水制取氢气
D.利用铁等金属与酸反应产生氢气
1
2
3
4
5
6
7
8
9
√
10
11
解析 消耗大量的电能,A错误;
产生大量污染物,且造成能源的浪费,B错误;
太阳能无污染,且取之不尽用之不竭,C正确;
消耗大量的金属,D错误。
1
2
3
4
5
6
7
8
9
10
11
11.25
℃、101
kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33
kJ·
g-1、143
kJ·g-1、56
kJ·g-1、23
kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)===CO(g) ΔH=-396
kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-286
kJ·mol-1
D.CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=736
kJ·mol-1
1
2
3
4
5
6
7
8
9
√
10
11
解析 A项,煤炭的热值是33
kJ·g-1,则12
g煤炭放出的热量为396
kJ,所以热化学方程式为:C(s)+O2(g)===CO2(g) ΔH=-396
kJ·mol-1,错误;
B项,天然气的热值是56
kJ·g-1,则16
g
CH4放出的热量为896
kJ,所以热化学方程式:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·
mol-1,正确;
C项,氢气的热值是143
kJ·g-1,则4
g
H2放出的热量为572
kJ,所以热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH=-572
kJ·mol-1,错误;
1
2
3
4
5
6
7
8
9
10
11
D项,甲醇(CH3OH)的热值是23
kJ·g-1,则32
g
CH3OH放出的热量为736
kJ,所以热化学方程式:CH3OH(l)+
O2(g)===CO2(g)+2H2O(l) ΔH=-736
kJ·mol-1,错误。
1
2
3
4
5
6
7
8
9
10
11
B组 综合强化练
1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.该反应中,反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
1
2
3
4
5
6
7
√
解析 醋酸逐渐凝固,说明NH4HCO3与盐酸反应使醋酸的温度降低,因此该反应为吸热反应,A错误;
吸热反应中反应物吸收能量,吸收的能量转化为生成物内部的能量储存在生成物中,B正确;
由于NH4HCO3和盐酸的反应是吸热反应,故反应物的总能量低于生成物的总能量,C错误;
NH4HCO3粉末与盐酸的反应是吸热反应,各反应物的总能量低于各生成物的总能量,而NH4HCO3仅是两种反应物之一、NH4Cl仅是三种生成物之一,故无法得出NH4HCO3的能量一定低于NH4Cl的能量的结论,D错误。
1
2
3
4
5
6
7
2.(2019·诸暨市校级期中)下列有关新能源的说法不正确的是
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的
矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
√
1
2
3
4
5
6
7
3.在催化剂、400
℃时可实现氯的循环利用,下图是其能量关系图,下列分析正确的是
A.曲线a是使用了催化剂的能量变化曲线
B.反应物的总键能高于生成物的总键能
C.反应的热化学方程式为
4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-115.6
kJ
D.若反应生成2
mol液态水,放出的热量高于115.6
kJ
1
2
3
4
5
6
7
√
4.(2020·湖南衡阳一中高一月考)反应A+B―→C(放热)分两步进行:①A+B―→X(吸热),②X―→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是
1
2
3
4
5
6
7
√
解析 由反应A+B―→C(放热)分两步进行:①A+B―→X(吸热)、②X―→C(放热)可以看出,A+B―→C是放热反应,A和B的能量之和大于C的能量,A+B―→X是吸热反应,X―→C是放热反应,故X的能量大于A和B的能量之和,且X的能量大于C的能量,选项A中图像符合。
1
2
3
4
5
6
7
5.已知断开1
mol
H—H键吸收的能量为436
kJ,形成1
mol
H—N键放出的
能量为391
kJ,根据化学方程式N2+3H2
2NH3,反应完1
mol
N2放出的能量为92.4
kJ,则断开1
mol
N≡N键需吸收的能量是
A.431
kJ
B.945.6
kJ
C.649
kJ
D.869
kJ
√
1
2
3
4
5
6
7
解析 设断开1
mol
N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4
kJ=6×391
kJ-3×436
kJ-x,x=945.6
kJ。
6.(2019·天津月考)工业生产水煤气的反应为:C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.4
kJ·mol-1,下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)===C(s)+H2O(g)
ΔH=131.4
kJ·mol-1
C.水煤气反应中,生成1
mol
H2(g)吸收131.4
kJ热量
D.水煤气反应中,生成1体积CO(g)吸收131.4
kJ热量
1
2
3
4
5
6
7
√
解析 A项,该反应是吸热反应,故反应物的总能量小于生成物的总能量,错误;
B项,正反应吸热,逆反应放热,错误;
C项,由题干反应可知生成1
mol氢气吸收的热量为131.4
kJ,正确;
D项,由题干反应可知生成1
mol
CO吸收的热量为131.4
kJ,而1
L
CO物质的量不是1
mol,D错误。
1
2
3
4
5
6
7
7.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
1
2
3
4
5
6
7
(1)图中所示反应是________(填“吸热”或“放热”)反应。
放热
解析 由题图可知反应物的总能量高于生成物的总能量,故该反应为放热反应。
(2)已知断开1
mol
H—H键、1
mol
I—I键、1
mol
H—I键分别需要吸收的能量为436
kJ、151
kJ、299
kJ。则由1
mol氢气和1
mol碘反应生成HI会______(填“放出”或“吸收”)______kJ的热量。在化学反应过程中,是将________转化为______。
1
2
3
4
5
6
7
放出
11
化学能
热能
解析 H2(g)+I2(g)===2HI(g),断裂1
mol
H—H键和1
mol
I—I键需要吸收436
kJ+151
kJ=587
kJ热量,生成2
mol
HI放出2×299
kJ=598
kJ热量,所以1
mol氢气和1
mol碘反应生成HI放出11
kJ的热量;在化学反应过程中,将化学能转化为热能。
1
2
3
4
5
6
7
(3)下列反应中,属于放热反应的是______________(填序号,下同),属于吸热反应的是______。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
1
2
3
4
5
6
7
①②③⑤⑦
④⑥
解析 应熟悉常见的吸热反应和放热反应:中和反应、燃料的燃烧、有氧参与的氧化还原反应、多数化合反应等属于放热反应;多数分解反应(H2O2分解除外)、二氧化碳通过炽热的碳、Ba(OH)2·8H2O与NH4Cl反应等属于吸热反应。
1
2
3
4
5
6
7
返回
本课结束
第2课时 化学反应中能量变化原因
燃料的选择和氢能的利用
1.能用化学键解释某些吸热反应和放热反应,能进行一些简单的能量
变化计算。
2.理解化学反应中能量的变化取决于反应物与生成物的总能量相对大小。
3.认识燃料的燃烧效率、保护环境、开发清洁燃料的必要性和重要性。
核心素养发展目标
一、化学反应中能量变化的原因
随堂演练 知识落实
课时对点练
二、燃料燃烧释放的能量和氢燃料的应用前景
内
容
索
引
1.化学反应中能量变化与化学键的关系
(1)化学反应过程
一、化学反应中能量变化的原因
(2)化学反应中能量变化的原因
吸收
放出
吸热
放热
图示
?
?
能量相对大小
反应物的总能量
生成物的总能量
反应物的总能量
生成物的总能量
2.化学反应中能量的决定因素(宏观辨识)
大于
小于
(1)化学反应的两大基本特征:物质种类发生变化和能量发生变化。
(2)化学键的断裂和形成是物质在化学反应中发生能量变化的本质原因。
(1)对于一个化学反应来说,当化学键断裂时吸收的能量大于化学键形成时放出的能量,则反应放热( )
(2)相同条件下形成1
mol
H—Cl键放出的能量与断开1
mol
H—Cl键吸收的能量相等( )
(3)任何化学反应,都有物质变化,同时伴随着能量变化( )
(4)放热反应为“贮存”能量的过程,吸热反应为“释放”能量的过程
( )
(5)已知Fe与稀盐酸的反应为放热反应,即Fe的能量大于H2的能量( )
判断正误
×
√
√
×
×
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量______(填“高于”或“低于”)生成物的总能量。
1.已知N2(g)和O2(g)反应生成2
mol
NO(g)吸收180
kJ能量,反应过程中能量变化如图所示。
理解应用
(2)1
mol
NO(g)分子中的化学键断裂时要吸收____
kJ能量。
(3)断裂1
mol
N≡N吸收的能量x值为______。
低于
632
946
解析 根据图示,断裂旧化学键所吸收能量为(x+498)kJ,形成新化学键所释放能量为2×632
kJ=1
264
kJ,每生成2
mol
NO(g)所吸收能量为180
kJ,因此有180
kJ=(x+498)kJ-1
264
kJ,故x为946。
2.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在25
℃、101
kPa下,31
g白磷完全转化为红磷,放出11
kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于______反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是______(填“白磷”或“红磷”,下同)。
(3)31
g白磷与31
g红磷的能量较高的是______,二者更稳定的是______。
吸热
白磷
白磷
红磷
物质稳定性的因素
物质的化学键越牢固,断裂时需要吸收的能量越多,形成时释放的能量越多,物质具有的能量越低,物质越稳定。
归纳总结
返回
二、燃料燃烧释放的能量和氢燃料的应用前景
1.热值
已知下列几种燃料的热值:
其热化学方程式分别为
①C(s)+O2(g)===CO2(g) ΔH=-396
kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·mol-1
物质
煤炭
天然气
氢气
乙醇
热值/kJ·g-1
约33
约56
143
30
④C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1
380
kJ·mol-1
(1)完全燃烧相等物质的量的上述物质,放出热量的大小顺序是________
。
(2)完全燃烧等质量的上述物质,放出热量的大小顺序是
。
(3)燃料燃烧放出热量的大小常用热值来衡量。燃料的热值是指在一定条件下
的物质完全燃烧所放出的
,单位是
。
④>②>
①>③
③>②>①>④
单位质量
热量
kJ·g-1
2.常规能源
(1)现阶段人类获取热能的主要途径是
;使用最多的常规能源是
。
(2)化石燃料获取能量面临的问题
①储量有限,短期内不可再生。
②影响环境:煤、石油产品燃烧排放的____________________________
等是大气污染物的主要来源。
物质的燃烧
化石燃料(煤、石油和天然气)
粉尘、SO2、氮氧化物(NOx)、
CO
(3)节能减排的措施
①节约现有的能源,尤其是减少作为燃料的煤和石油的开采。
②提高燃料的使用效率。
③积极开发优质的新能源,目前人们比较关注的新能源有_________
等。
太阳能、
风能、水能和氢能
3.氢燃料的应用前景
(1)能源特点
(2)氢能开发利用的困难与解决方法
①困难:能耗高、储存和运输困难等。
②方法:
a.在光分解催化剂存在条件下,在特定的装置中,利用
分解水制氢气。
b.利用蓝绿藻等低等植物和微生物在阳光作用下分解水释放出
。
c.发现和应用贮氢材料,解决氢气的储存和运输问题。
太阳能
氢气
(3)氢燃料的应用实例
①
的燃料。
②
的燃料。
③
。
作人造卫星和运载火箭
作混合动力有轨电车
氢燃料电池
(1)太阳能转化为化学能
①物质转化:
在太阳光作用下,植物体内的叶绿素把水、二氧化碳转化为葡萄糖,进而生成淀粉、纤维素。
②化学反应:
。
③能量转化:光能―→
能。
6CO2(g)+6H2O(g)
C6H12O6(s)+6O2(g)
4.太阳能及其利用
化学
化学
(2)化学能转化为热能
①物质转化:
动物摄入体内的淀粉能水解转化为葡萄糖,葡萄糖氧化生成二氧化碳和水,释放出
,供给生命活动的需要。
C6H12O6+6O2―→6H2O+6CO2。
③能量转化:化学能―→热能。
热
?
实例
能量转化方式
直接利用
光合作用
光能转化为________
太阳能热水器
光能转化为______
太阳能电池
光能转化为_____
光解水制氢气
光能转化为______
间接利用
化石燃料
太阳能间接转化为_______
(3)太阳能的利用
化学能
热能
电能
化学能
化学能
(1)氢气的热值较高,是目前主要的能源( )
(2)煤经气化转化为煤气是物理变化( )
(3)我国目前使用燃料效率不高,而且引起的污染大( )
(4)利用太阳光催化分解水制氢是一种理想的制氢手段( )
(5)将太阳能转化为热能是目前太阳能应用最广泛的形式( )
判断正误
×
×
√
√
√
小明的爸爸是一名出租车司机,为倡导“绿水青山就是金山银山”这一理念,小明回到家和爸爸进行了一番争论。
小明认为:现在空气污染比较严重,应将汽车燃料改用新能源,或者污染较小的燃料。
小明的爸爸认为:现在城市污染不是很严重,新能源汽车价格高,续航能力差,不经济,汽油作燃料性价比高,适合长时间运行。
为了说服爸爸,小明又给爸爸展示了三张图片。
理解应用
燃料
液化石油气
天然气(CNG)
95号乙醇汽油
价格(元/升)
4.8
2.3
6.9
热值(kJ·kg-1)
4.5×104
4.0×104
4.6×104
图2 常用车用燃料热值及价格
最后小明的爸爸赞同了小明的观点,决定将汽油改为天然气。
(1)小明鼓励爸爸,将汽油改为天然气的目的是_______________________
________________________________________。
节约石油资源,减少对空气的污染,天然气作燃料性价比相对较高
(2)结合图3,对于能源的选择,请你再提一条符合小明的目的的建议:____________________________________________________________________________________。
为减少化石能源对环境的影响,可以大力开发利用新能源,如太阳能、风能、水能、氢能等
(3)“开源节流”是应对能源危机的重要举措,下列做法有助于能源“开源节流”的是________(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化
石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
acd
归纳总结
返回
1.(2020·山东泰安高一期末)已知2H→H2的能量变化如图所示。下列说法不正确的是
A.2H→H2过程中形成的化学键是共价键
B.相同质量的氢气分子的能量比氢原子的能量低
C.2H→H2过程中形成1
mol新化学键放出437.6
kJ
的能量
D.1
mol
H2离解成2
mol
H要放出437.6
kJ热量
1
2
3
5
随堂演练 知识落实
4
√
解析 A对,H2分子中含有共价键,故2H→H2过程中形成共价键;
B对,由图可知,H原子变成H2放出能量,则相同质量的氢气分子的能量比氢原子的能量低;
C对,由图可知,2H→H2过程中,形成1
mol
H—H键要放出437.6
kJ能量;
1
2
3
5
4
D错,1
mol
H2离解成2
mol
H原子,要断裂H—H键,故要吸收437.6
kJ能量。
2.(2020·四川遂宁高一期末)如图是某化学反应
过程中能量变化的曲线图。下列叙述正确的是
A.该反应为吸热反应
B.该图可以表示Zn与HCl溶液反应的能量变化
C.该反应先发生物质变化后发生能量变化
D.断开反应物中化学键吸收的能量大于形成生成物中化学键放出的能量
1
2
3
5
4
√
解析 A错,由图可知,反应物的总能量高于生成物的总能量,则该反应是放热反应;
B对,Zn和HCl溶液反应生成ZnCl2和H2,是放热反应,符合图示能量变化;
C错,化学反应过程中,物质变化和能量变化同时发生;
1
2
3
5
4
D错,该反应是放热反应,断开反应物中化学键吸收的能量小于形成生成物中化学键放出的能量。
3.(2020·怀化市高一期末)100
kPa时,1
mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化为金刚石的反应为放热反应
D.破坏1
mol石墨化学键所吸收的能量小于形成1
mol金刚石化学键所放
出的能量
√
1
2
3
5
4
解析 由图可知,石墨转化为金刚石要吸收能量,说明石墨的能量低,更稳定,选项A正确,选项B错误;
由图可知,石墨转化为金刚石要吸收能量,反应为吸热反应,选项C错误;
1
2
3
5
4
由图可知,该反应为吸热反应,故破坏1
mol石墨化学键所吸收的能量大于形成1
mol金刚石化学键所放出的能量,选项D错误。
4.(2019·淮南月考)液态储氢技术就是在常温常压下将氢气融入一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
1
2
3
5
4
√
解析 “氢油”便于储存和运输,说明它比较稳定,故A错误;
氢气燃烧生成水,水分解又生成氢气,故属于可再生能源,故B正确;
常温常压下可以将氢气融入一种化合物“储油”中,故该技术实现了常温常压下储氢技术的新突破,故C正确;
液态储氢解决了氢能储存难、运输难的问题,能实现氢能的广泛应用,故有利于发展氢能源电动机,从而带来新能源汽车的升级,故D正确。
1
2
3
5
4
解析 若E1>E2,反应体系的总能量降低,故反应物的部分内能通过化学反应转化为热能释放给环境,则生成物的总能量小于反应物的总能量,依据反应前后能量守恒可知反应是放热反应。
5.在一定条件下A与B反应可生成C和D,其能量变化如下:
(1)若E1>E2,反应体系的总能量________(填“升高”或“降低”),为______(填“吸热”或“放热”)反应,其原因是______________________
_____________________________。
降低
放热
反应物的部分内能通过
化学反应转化为热能释放给环境
1
2
3
5
4
(2)若E1<E2,反应体系的总能量_______(填“升高”或“降低”),为______(填“吸热”或“放热”)反应,其原因是______________________。
1
2
3
5
4
返回
升高
吸热
解析 若E1<E2,反应体系的总能量升高,故反应物从环境中吸收能量,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应。
反应物从环境中吸收能量
课时对点练
1
2
3
4
5
6
7
8
9
题组一 能量变化的决定因素
1.下列反应一定属于放热反应的是
A.八水合氢氧化钡晶体和氯化铵晶体的反应
B.反应物能量比生成物能量低的反应
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.不需要加热就能发生的反应
√
A组 基础对点练
10
11
1
2
3
4
5
6
7
8
9
解析 氢氧化钡晶体和氯化铵晶体的反应属于吸热反应,故A错误;
生成物的总能量比反应物的总能量大的反应为吸热反应,故B错误;
化学键断裂吸收的能量比化学键形成放出的能量少的反应为放热反应,故C正确;
不需要加热就能发生的反应可能为吸热反应,也可能为放热反应,故D错误。
10
11
D.Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
2.(2019·福建省南平市高一下学期期末)下列化学反应过程中的能量变化符合如图所示的是
A.HCl+NaOH===NaCl+H2O
B.Fe+H2SO4===FeSO4+H2↑
√
1
2
3
4
5
6
7
8
9
10
11
解析 酸碱中和反应是放热反应,故A错误;
金属与酸的反应为放热反应,故B错误;
物质的燃烧反应是放热反应,故C错误;
Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O
为铵盐与碱的反应,属于吸热反应,故D正确。
1
2
3
4
5
6
7
8
9
10
11
A.12
g
C所具有的能量一定高于28
g
CO所具有的能量
B.56
g
CO和32
g
O2所具有的总能量大于88
g
CO2所具有的总能量
C.12
g
C和32
g
O2所具有的总能量大于44
g
CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
1
2
3
4
5
6
7
8
9
√
10
11
12
g
C并不代表反应物的全部,O2也是反应物,A项不正确;
1
2
3
4
5
6
7
8
9
10
11
A.500
mL
2.0
mol·L-1
HCl溶液和
500
mL
2.0
mol·L-1
NaOH溶液的反应符合图(a),且放出热量为ΔE1
B.500
mL
2.0
mol·L-1
H2SO4溶液和500
mL
2.0
mol·L-1
Ba(OH)2溶液的
反应符合图(b),且吸收热量为ΔE2
C.发生图(a)能量变化的任何反应,一定不需要加热即可发生
D.CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
4.如图表示化学反应过程中的能
量变化,据图判断下列说法中合
理的是
1
2
3
4
5
6
7
8
9
√
10
11
1
2
3
4
5
6
7
8
9
解析 图(a)表示放热反应,选
项A是放热反应,A项正确;
图(b)表示吸热反应,选项B是
放热反应,B项错误;
一些放热反应需加热才能发生,C项错误;
浓硫酸溶于水虽然会放出热量,但不属于化学反应,D项错误。
10
11
5.下列叙述正确的是
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是放热反应
C.硝酸铵溶于水温度降低,这个变化是吸热反应
D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同
√
1
2
3
4
5
6
7
8
9
10
11
解析 E生成物>E反应物为吸热反应,E生成物
硝酸铵溶于水是物理变化,故C错误;
ΔH与反应条件无关,故D错误。
下列关于合成氨反应的叙述中不正确的是
A.该过程表明,在化学反应中存在化学键的断裂与形成
B.在催化剂的作用下,反应物的化学键变得容易断裂
C.过程②需吸收能量,过程③则放出能量
D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
题组二 化学反应中能量变化的实质
6.化学家证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
√
1
2
3
4
5
6
7
8
9
10
11
解析 由图可知,每3个氢气分子和1个氮气分子断键得到原子,然后氢原子和氮原子生成2个氨分子,A项正确;
催化剂能改变化学反应的速率,合成氨的反应在催化剂作用下,反应速率加快,意味着反应物化学键的断裂和生成物化学键的形成变得更容易,B项正确;
化学键的断裂需要吸收能量,而化学键的形成则放出能量,从图中可看出②为化学键断裂过程,③为新的化学键形成过程,C项正确;
化学键的断裂需要吸收能量,所以该反应在常温下难以进行,D项错误。
1
2
3
4
5
6
7
8
9
10
11
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
A.1
mol
N2(g)和1
mol
O2(g)反应放出的能量为180
kJ
B.1
mol
N2(g)和1
mol
O2(g)具有的总能量小于2
mol
NO(g)具有的总能量
C.通常情况下,N2(g)和
O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
√
1
2
3
4
5
6
7
8
9
10
11
解析 反应热就是断裂旧化学键吸收的能量和形成新化学键所放出的能量的差值,所以该反应的反应热是946
kJ·mol-1+498
kJ·mol-1-2×632
kJ·mol-1=180
kJ·mol-1,所以该反应是吸热反应,所以选项A不正确,选项B正确;
氮气和氧气反应需要在高温或放电条件下才能发生,选项C不正确;
NO不是酸性氧化物,和氢氧化钠溶液不反应,选项D不正确。
1
2
3
4
5
6
7
8
9
10
11
解析 H2在O2中燃烧放热,则拆开化学键吸收的总能量比形成化学键放出的总能量小,由于反应的方程式为2H2+O2
2H2O,则断键吸收的能量为2Q1+Q2,形成化学键放出的能量为4Q3,则能量关系为2Q1+Q2<4Q3。
8.氢气可以在氧气中燃烧。在该反应中:断裂1
molH—H键消耗的能量为Q1
kJ,断裂1
molO==O键消耗的能量为Q2
kJ,形成1
molH—O键释放的能量为Q3
kJ。下列关系式中,正确的是
A.2Q1+Q2
C.2Q1+Q2<4Q3
D.2Q1+Q2<2Q3
1
2
3
4
5
6
7
8
9
√
10
11
9.(2019·黄州一中高一期末)已知反应H2(g)+
O2(g)===H2O(g),反应过程中能量变化如图所示,则
1
2
3
4
5
6
7
8
9
10
11
(1)a、b、c分别代表什么意义?
a____________________________;
b____________________________;
c___________________。
旧的化学键断裂所吸收的能量
新的化学键形成所放出的能量
总反应所放出的能量
解析 由图像分析可知,a表示旧的化学键断裂所吸收的能量,b表示新的化学键形成所放出的能量,c表示总反应所放出的能量。
(2)该反应是________(填“吸热”或“放热”)反应,放出的热量为__________kJ(用字母表示)。
1
2
3
4
5
6
7
8
9
10
11
解析 反应物的总能量高于生成物的,所以该反应是放热反应,放出的热量为c(或b-a)kJ。
放热
c(或b-a)
题组三 能源与热值
10.氢能是一种理想的“绿色能源”,以下有关氢能开发的方式中最理想的是
A.大量建设水电站,用电力分解水制取氢气
B.利用化石燃料燃烧放热,使水高温分解产生氢气
C.在催化剂作用下,利用太阳能分解水制取氢气
D.利用铁等金属与酸反应产生氢气
1
2
3
4
5
6
7
8
9
√
10
11
解析 消耗大量的电能,A错误;
产生大量污染物,且造成能源的浪费,B错误;
太阳能无污染,且取之不尽用之不竭,C正确;
消耗大量的金属,D错误。
1
2
3
4
5
6
7
8
9
10
11
11.25
℃、101
kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33
kJ·
g-1、143
kJ·g-1、56
kJ·g-1、23
kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)===CO(g) ΔH=-396
kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-286
kJ·mol-1
D.CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=736
kJ·mol-1
1
2
3
4
5
6
7
8
9
√
10
11
解析 A项,煤炭的热值是33
kJ·g-1,则12
g煤炭放出的热量为396
kJ,所以热化学方程式为:C(s)+O2(g)===CO2(g) ΔH=-396
kJ·mol-1,错误;
B项,天然气的热值是56
kJ·g-1,则16
g
CH4放出的热量为896
kJ,所以热化学方程式:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-896
kJ·
mol-1,正确;
C项,氢气的热值是143
kJ·g-1,则4
g
H2放出的热量为572
kJ,所以热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH=-572
kJ·mol-1,错误;
1
2
3
4
5
6
7
8
9
10
11
D项,甲醇(CH3OH)的热值是23
kJ·g-1,则32
g
CH3OH放出的热量为736
kJ,所以热化学方程式:CH3OH(l)+
O2(g)===CO2(g)+2H2O(l) ΔH=-736
kJ·mol-1,错误。
1
2
3
4
5
6
7
8
9
10
11
B组 综合强化练
1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.该反应中,反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
1
2
3
4
5
6
7
√
解析 醋酸逐渐凝固,说明NH4HCO3与盐酸反应使醋酸的温度降低,因此该反应为吸热反应,A错误;
吸热反应中反应物吸收能量,吸收的能量转化为生成物内部的能量储存在生成物中,B正确;
由于NH4HCO3和盐酸的反应是吸热反应,故反应物的总能量低于生成物的总能量,C错误;
NH4HCO3粉末与盐酸的反应是吸热反应,各反应物的总能量低于各生成物的总能量,而NH4HCO3仅是两种反应物之一、NH4Cl仅是三种生成物之一,故无法得出NH4HCO3的能量一定低于NH4Cl的能量的结论,D错误。
1
2
3
4
5
6
7
2.(2019·诸暨市校级期中)下列有关新能源的说法不正确的是
A.绿色植物通过光合作用,将光能转化为化学能
B.风能、太阳能是清洁能源
C.氢能还未进入实用阶段的主要原因是其燃烧所放热量低于相同质量的
矿物燃料
D.共享单车利用太阳能发电完成卫星定位,有利于节能环保
√
1
2
3
4
5
6
7
3.在催化剂、400
℃时可实现氯的循环利用,下图是其能量关系图,下列分析正确的是
A.曲线a是使用了催化剂的能量变化曲线
B.反应物的总键能高于生成物的总键能
C.反应的热化学方程式为
4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-115.6
kJ
D.若反应生成2
mol液态水,放出的热量高于115.6
kJ
1
2
3
4
5
6
7
√
4.(2020·湖南衡阳一中高一月考)反应A+B―→C(放热)分两步进行:①A+B―→X(吸热),②X―→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是
1
2
3
4
5
6
7
√
解析 由反应A+B―→C(放热)分两步进行:①A+B―→X(吸热)、②X―→C(放热)可以看出,A+B―→C是放热反应,A和B的能量之和大于C的能量,A+B―→X是吸热反应,X―→C是放热反应,故X的能量大于A和B的能量之和,且X的能量大于C的能量,选项A中图像符合。
1
2
3
4
5
6
7
5.已知断开1
mol
H—H键吸收的能量为436
kJ,形成1
mol
H—N键放出的
能量为391
kJ,根据化学方程式N2+3H2
2NH3,反应完1
mol
N2放出的能量为92.4
kJ,则断开1
mol
N≡N键需吸收的能量是
A.431
kJ
B.945.6
kJ
C.649
kJ
D.869
kJ
√
1
2
3
4
5
6
7
解析 设断开1
mol
N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开旧键吸收的能量,代入数据:92.4
kJ=6×391
kJ-3×436
kJ-x,x=945.6
kJ。
6.(2019·天津月考)工业生产水煤气的反应为:C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.4
kJ·mol-1,下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)===C(s)+H2O(g)
ΔH=131.4
kJ·mol-1
C.水煤气反应中,生成1
mol
H2(g)吸收131.4
kJ热量
D.水煤气反应中,生成1体积CO(g)吸收131.4
kJ热量
1
2
3
4
5
6
7
√
解析 A项,该反应是吸热反应,故反应物的总能量小于生成物的总能量,错误;
B项,正反应吸热,逆反应放热,错误;
C项,由题干反应可知生成1
mol氢气吸收的热量为131.4
kJ,正确;
D项,由题干反应可知生成1
mol
CO吸收的热量为131.4
kJ,而1
L
CO物质的量不是1
mol,D错误。
1
2
3
4
5
6
7
7.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
1
2
3
4
5
6
7
(1)图中所示反应是________(填“吸热”或“放热”)反应。
放热
解析 由题图可知反应物的总能量高于生成物的总能量,故该反应为放热反应。
(2)已知断开1
mol
H—H键、1
mol
I—I键、1
mol
H—I键分别需要吸收的能量为436
kJ、151
kJ、299
kJ。则由1
mol氢气和1
mol碘反应生成HI会______(填“放出”或“吸收”)______kJ的热量。在化学反应过程中,是将________转化为______。
1
2
3
4
5
6
7
放出
11
化学能
热能
解析 H2(g)+I2(g)===2HI(g),断裂1
mol
H—H键和1
mol
I—I键需要吸收436
kJ+151
kJ=587
kJ热量,生成2
mol
HI放出2×299
kJ=598
kJ热量,所以1
mol氢气和1
mol碘反应生成HI放出11
kJ的热量;在化学反应过程中,将化学能转化为热能。
1
2
3
4
5
6
7
(3)下列反应中,属于放热反应的是______________(填序号,下同),属于吸热反应的是______。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
1
2
3
4
5
6
7
①②③⑤⑦
④⑥
解析 应熟悉常见的吸热反应和放热反应:中和反应、燃料的燃烧、有氧参与的氧化还原反应、多数化合反应等属于放热反应;多数分解反应(H2O2分解除外)、二氧化碳通过炽热的碳、Ba(OH)2·8H2O与NH4Cl反应等属于吸热反应。
1
2
3
4
5
6
7
返回
本课结束
