高中化学苏教版(2019)必修第二册 专题6 第三单元 第1课时 化学能转化为电能(62张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题6 第三单元 第1课时 化学能转化为电能(62张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-24 23:32:23 | ||
图片预览









文档简介
(共62张PPT)
第1课时 化学能转化为电能
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正负极。
3.认识化学能转化为电能的原理及其在生产、生活中的应用。
核心素养发展目标
一、原电池工作原理
随堂演练 知识落实
课时对点练
二、原电池工作原理的应用
内
容
索
引
实验装置
实验现象
实验结论
?
锌片:
,_____
________
铜片:_________
锌与稀硫酸__________
,铜与稀硫酸
_______
?
锌片:
,_____
_______
铜片:__________
锌与稀硫酸_________
,铜与稀硫酸
_______
1.实验探究
一、原电池工作原理
逐渐溶解
有气
泡产生
没有变化
反应生成
氢气
不反应
逐渐溶解
有气
泡产生
没有变化
反应生成
氢气
不反应
?
锌片:__________
铜片:___________
锌
电子,变为_______
进入溶液,氢离子在铜片上
电子生成_____
?
锌片:_________
铜片:___________
电流计:____________
锌
电子,变为
,电子经过导线流向
,产生电流,
在铜片上
电子生成
,反应过程中产生了______
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
指针发生偏转
失去
锌离子
得到
氢气
失去
锌离子
铜片
氢离子
得到
氢气
电能
2.原电池的概念
原电池是把
能转化为
能的装置;原电池的反应本质是_____
反应。
化学
电
氧化
还原
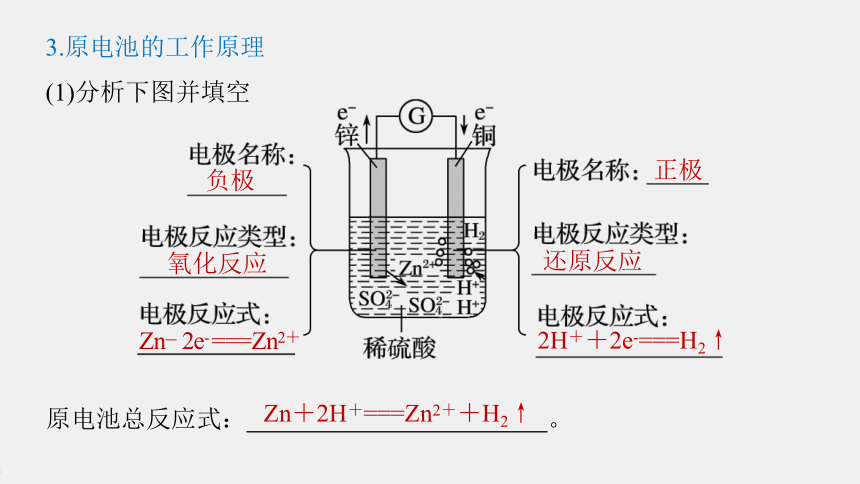
3.原电池的工作原理
(1)分析下图并填空
原电池总反应式:
。
负极
氧化反应
Zn-
2e-
===Zn2+
正极
还原反应
2H++2e-===H2↑
Zn+2H+===Zn2++H2↑
(2)能量转化:
能转变为
能。
(3)电子的移动方向:从负极流出,经导线流向正极。
(4)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
4.原电池的构成条件
化学
电
活泼性不同
电解质
闭合回路
氧化还原
(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池( )
(2)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转( )
(3)在铜—锌—稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌( )
(4)原电池中阳离子向正极移动( )
(5)原电池中的负极反应一定是电极材料失电子( )
判断正误
×
×
×
√
×
1.下列装置中能够组成原电池的是______(填序号),其他不能构成原电池的试分别说明理由:_____________________________________________
____________________________________________________________________。
理解应用
③⑤
①中只有一个电极,②中两个电极的活泼性相同,④中为非电解质溶液,不能导电,⑥中电解质溶液(内电路)未形成闭合回路
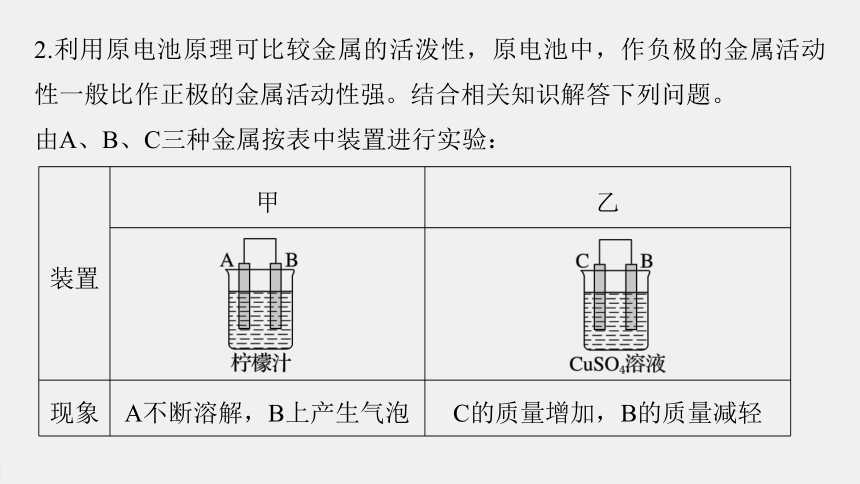
装置
甲
乙
?
?
现象
A不断溶解,B上产生气泡
C的质量增加,B的质量减轻
2.利用原电池原理可比较金属的活泼性,原电池中,作负极的金属活动性一般比作正极的金属活动性强。结合相关知识解答下列问题。
由A、B、C三种金属按表中装置进行实验:
(1)在甲中,金属片_____(填“A”或“B”)发生氧化反应。
(2)在乙中,金属片_____(填“B”或“C”)作负极。
(3)如果把B、C用导线连接后同时浸入稀硫酸溶液中,有一电极产生气泡。则金属片______(填“B”或“C”)上有气泡产生。
(4)上述三种金属的活动性顺序是____________。
A
B
C
A>B>C
归纳总结
返回
二、原电池工作原理的应用
1.比较金属活动性
原电池中,作负极的金属活动性一般比作正极的金属活动性强。
2.改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
3.解释生活中的现象
如潮湿的空气里钢铁容易生锈,生活中的暖贴等。
(1)为保护船体不被腐蚀,可以在船体外壳焊一些铜块( )
(2)一般作原电池正极的金属较活泼( )
(3)钢铁在潮湿的空气里发生的腐蚀是电化学腐蚀( )
(4)生活中用到的暖贴,就是以钢铁电化学腐蚀的原理制成的( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+
( )
判断正误
×
×
√
√
×
选项
正极
负极
电解质溶液
A
Fe
Zn
HCl
B
Zn
Cu
H2SO4
C
Ag
Zn
CuSO4
D
C
Zn
ZnCl2
1.某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是
理解应用
√
解析 将Zn+Cu2+===Zn2++Cu拆开两个半反应:
氧化反应(负极反应):Zn-2e-===Zn2+;
还原反应(正极反应):Cu2++2e-===Cu。
则电池的负极是Zn,正极是比锌不活泼的金属或能导电的非金属,电解质溶液中含Cu2+。
装置
?
?
?
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
2.由A、B、C、D四种金属按下表中装置进行实验
(1)装置甲中负极的电极反应式是_______________。
(2)装置乙中正极的电极反应式是________________。
(3)四种金属活动性由强到弱的顺序是__________。
A-2e-===A2+
Cu2++2e-===Cu
D>A>B>C
归纳总结
返回
1.如图为某兴趣小组制作的番茄电池,下列说法正确的是
A.电子由铜通过导线流向锌
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌通过导线流向铜
1
2
3
5
随堂演练 知识落实
4
√
解析 A项,铜作正极,锌作负极,因此电子由锌流向铜,故错误;
B项,该装置将化学能转化为电能,故错误;
C项,锌作负极失去电子,发生氧化反应,故正确;
D项,电子与电流的方向相反,因此电流由铜极流向锌极,故错误。
1
2
3
5
4
?
M
N
R
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
铁
铜
硝酸银
D
铜
铁
蔗糖溶液
2.如图装置中,M棒变细,N棒变粗。由此判断下表所列M、N、R物质,其中合理的是
1
2
3
5
4
√
解析 由于D中蔗糖溶液不是电解质溶液,故D不正确;
M棒变细,N棒变粗,则M为负极,N为正极,M的金属活动性比N强,故B错误;
N棒变粗则电解质溶液中有能得电子的金属阳离子,故A不正确。
1
2
3
5
4
3.在钢铁腐蚀过程中,下列五种变化可能发生的是
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质碳被氧化
A.①②
B.②③④
C.①②③④
D.①②③④⑤
√
1
2
3
5
4
解析 本题考查钢铁的电化学腐蚀。在腐蚀过程中,负极Fe-2e-===Fe2+,正极O2或H+得电子,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2被氧化生成Fe(OH)3,Fe(OH)3失水形成铁锈。
4.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
?
A.①②③④
B.④②①③
C.③①②④
D.②①③④
1
2
3
5
4
√
解析 ③中的锌作负极,腐蚀速率最快;
④中的锌与外界不接触,腐蚀速率最慢;
②中的锌作正极,腐蚀速率比①中的锌要慢;
因此腐蚀速率由慢到快的顺序为④②①③,故B正确。
1
2
3
5
4
5.在铜锌原电池中(如图),以硫酸铜为电解质溶液,锌为_____极,电极上发生的是______(填“氧化”或“还原”)反应,电极反应式为________
_________。锌片上观察到的现象为__________;铜为____极,电极上发生的是_____(填“氧化”或“还原”)反应,电极反应式_______________;
铜片上观察到的现象为___________,原电池总反应的离子方程式为______________________。
1
2
3
5
4
负
氧化
Zn-2e-
===Zn2+
锌片溶解
正
还原
Cu2++2e-===Cu
铜片变粗
Zn+Cu2+===Zn2++Cu
解析 CuSO4为电解质溶液时,铜锌原电池的负极为锌,电极反应式为Zn-2e-===Zn2+,所以锌片不断溶解,正极为铜,电极反应式为Cu2++2e-===Cu,所以铜片不断变粗,原电池总反应的离子方程式为Zn+Cu2+===Zn2++Cu。
1
2
3
5
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学能转化为电能
1.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)
√
A组 基础对点练
10
1
2
3
4
5
6
7
8
9
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行的氧化还原反应。对图示各个装置进行观察,发现只有D不能形成闭合回路,因此不能形成原电池。
10
2.(2020·仲元中学高一检测)下列关于原电池的叙述中,不正确的是
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应是还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
√
1
2
3
4
5
6
7
8
9
10
解析 原电池的负极失去电子被氧化,发生氧化反应,A正确;
原电池正极上物质得电子,发生还原反应,B正确;
在原电池电解质溶液中,阳离子向正极移动,阴离子向负极移动,C错误;
原电池放电时,电子转移的方向是从负极沿导线流向正极,所以正极为电子流入的电极,D正确。
1
2
3
4
5
6
7
8
9
10
3.(2020·哈尔滨三中高一月考)下列关于实验现象的描述不正确的是
A.铜、锌组成的原电池中,电子从锌极经过导线流向铜极
B.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.将铜片和铁片用导线相连浸入硫酸铜溶液中,一段时间后,铁片质
量减轻,铜片质量增加
1
2
3
4
5
6
7
8
9
√
10
解析 铜、锌组成的原电池中,金属锌作负极,金属铜作正极,电子从锌极流向铜极,故A项正确;
把铜片和锌片紧靠在一起浸入稀硫酸中,形成铜—锌—稀硫酸原电池,金属铜作正极,该极上产生气体,故B项正确;
把铜片插入FeCl3溶液中,Cu和FeCl3反应生成CuCl2和FeCl2,故C项错误;
将铜片和铁片用导线相连浸入硫酸铜溶液中,形成原电池,铜片作正极,铁片作负极,铁片失电子,形成Fe2+进入溶液,质量减轻,溶液中的Cu2+在铜电极上得电子,生成单质铜,质量增加,故D项正确。
1
2
3
4
5
6
7
8
9
10
4.如图是某同学学习原电池后整理的学习笔记,错误的是
A.①电子流动方向
B.②电流方向
C.③电极反应
D.④溶液中离子移动方向
1
2
3
4
5
6
7
8
9
√
10
解析 锌为负极,铜为正极,电子由锌片流向铜片,A正确;
电流与电子运动方向相反,则电流由铜片经导线流向锌片,B错误;
锌失电子生成锌离子,H+在铜片上得电子被还原生成H2,C正确;
1
2
3
4
5
6
7
8
9
10
原电池工作时,阴离子移向负极,阳离子移向正极,D正确。
题组二 原电池工作原理的应用
5.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:
则四种金属的活动性由强到弱的顺序为
A.Z>Y>X>W
B.Z>X>Y>W
C.Z>Y>W>X
D.Y>Z>X>W
√
1
2
3
4
5
6
7
8
9
10
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
6.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
√
1
2
3
4
5
6
7
8
9
10
解析 只有属于氧化还原反应,才能用于设计原电池;A、B、D属于氧化还原反应,均可以设计为原电池。
C不属于氧化还原反应,不能设计成原电池,故选C。
解析 A项为原电池,铝为负极,但总反应为2Al+2OH-+2H2O===
+3H2↑,不符合;
C项为原电池,但硝酸是氧化性酸,与Al反应不产生H2,不符合;
D项装置中有外接电源,不属于原电池,不符合。
7.(2019·太原月考)为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)
√
1
2
3
4
5
6
7
8
9
10
题组三 钢铁的电化学腐蚀
8.(2019·贵阳期末)下图实验为研究金属腐蚀的实验。下列相关说法正确的是
A.铁表面的反应为Fe-3e-===Fe3+
B.红色首先在食盐水滴的中心出现
C.食盐水中有气泡逸出
D.红色物质为Fe2O3·xH2O
1
2
3
4
5
6
7
8
9
√
10
解析 A项,负极上发生的电极反应式为Fe-2e-===Fe2+,错误;
B项,食盐水滴周围液体少,氧气量多,所以红色首先在食盐水滴的周围出现,错误;
C项,正极上发生的电极反应式为O2+2H2O+4e-===4OH-,所以食盐水中没有气泡逸出,错误。
1
2
3
4
5
6
7
8
9
10
9.下列关于金属材料的锈蚀说法不一,其中没有科学道理的是
A.金属接触水和空气锈蚀加快
B.改变金属的内部结构形成合金能抵御金属锈蚀
C.金属表面刷油漆可以抵御金属锈蚀
D.不断擦去铝表面的锈能抵御铝的继续锈蚀
1
2
3
4
5
6
7
8
9
10
√
解析 A项,金属接触水和空气锈蚀加快,正确;
B项,铁中掺入铬和镍等金属改变内部结构,制成不锈钢可以防腐蚀,所以改变金属的内部结构能抵御金属锈蚀,正确;
C项,金属防锈的措施之一是在金属表面刷油漆,正确;
D项,不断擦去铝表面的锈,使得内部金属暴露出来,加快了铝的腐蚀而不是抵御铝的继续锈蚀,错误。
1
2
3
4
5
6
7
8
9
10
10.(2020·南阳一中高一期中)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
1
2
3
4
5
6
7
8
9
10
(1)A中反应的离子方程式为______________________。
(2)B中锡极为____极,电极反应式为__________________,锡极附近溶液的酸性______(填“增强”“减弱”或“不变”)。B中Fe极为____极,电极反应式为________________。
Fe+2H+===Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
(3)C中被腐蚀的金属是_____,总反应的化学方程式为________________
_____________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
1
2
3
4
5
6
7
8
9
10
Zn
Zn+H2SO4===
ZnSO4+H2↑
BAC
解析 A中不能形成原电池,铁与稀硫酸发生置换反应。B中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被腐蚀的速率加快。C能形成原电池,锌比铁活泼,锌为负极,不断被腐蚀,铁为正极,被保护。
B组 综合强化练
1.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2
mol电子通过时,负极质量的变化是
A.增加5.6
g
B.减小0.1
g
C.减少6.5
g
D.增加6.4
g
1
2
3
4
5
6
7
√
8
解析 方法一 依据电极反应式计算,
负极:Zn - 2e- === Zn2+
65
g
2
mol
m(Zn)
0.2
mol
1
2
3
4
5
6
7
8
方法二 依据原电池总反应式计算,
2.铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(
)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,
保持溶液中电荷平衡
√
1
2
3
4
5
6
7
8
解析 题中所述铜锌原电池中,Zn为负极,电极反应式为Zn-2e-===Zn2+;Cu为正极,电极反应式为Cu2++2e-===Cu,发生还原反应。Zn2+通过阳离子交换膜向正极移动;乙池溶液中消耗的Cu2+与由甲池迁移过来的Zn2+的物质的量相同,则乙池溶液质量增加,溶液中的阴离子无法通过阳离子交换膜。
1
2
3
4
5
6
7
8
3.(2019·长沙高一下学期期中)如图所示,两电极一极为碳棒,一极为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
1
2
3
4
5
6
7
√
8
解析 Fe、C形成的原电池中,负极铁失去电子,变成Fe2+,由于a极上有大量气泡生成,所以正极(C棒)的电极反应为2H++2e-===H2↑,故a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸。
1
2
3
4
5
6
7
8
4.我国在太阳能光电催化-化学耦合分
解硫化氢研究中获得新进展,相关装置
如图所示。下列说法正确的是(已知质子
交换膜只允许H+通过)
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
1
2
3
4
5
6
7
√
8
解析 该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;
该装置工作时,H+由a极区流向b极区,B项错误;
a极上有电子流出,发生氧化反应,所
1
2
3
4
5
6
7
8
以a极上发生的电极反应为Fe2+-e-===Fe3+,C项错误;
由图可知,a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,D项错误。
5.按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示
①c(Ag+) ②c(
) ③a棒的质量
④b棒的质量 ⑤溶液的质量
A.①③
B.②④
C.①③⑤
D.②④⑤
√
1
2
3
4
5
6
7
8
解析
不参加反应,因此c(
)不变,②不符合图像变化;负极反应式为Fe-2e-===Fe2+,正极反应式为Ag++e-===Ag,则a棒的质量逐渐减少,b棒的质量逐渐增加,c(Ag+)逐渐减小,①③符合图像变化,④不符合图像变化;由电极反应式可知,每溶解56
g铁转移2
mol电子,有216
g银从溶液中析出,故随着反应的进行,溶液的质量减少,⑤符合图像变化;综上可知,C项正确。
1
2
3
4
5
6
7
8
6.(2020·武汉高一检测)在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:
2H2O+O2+4e-===4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
1
2
3
4
5
6
7
√
8
解析 铁作负极,发生失电子的氧化反应,选项A错误;
铁片负极腐蚀最严重,由于离子的移动,在正极区域生成铁锈最多,选项B错误;
1
2
3
4
5
6
7
8
铁作负极,发生失电子的氧化反应,即Fe-2e-===Fe2+,选项C错误;
D项,铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,铁作负极,碳作正极,选项D正确。
7.(2019·桂林高一检测)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是______,发生______反应(填“氧化”或“还原”),电解质溶液是______________。
1
2
3
4
5
6
7
Cu
8
解析 根据电池的总反应,可知负极一般是失电子的物质,所以负极材料应该是铜,发生氧化反应,电解质溶液是一种可溶性的银盐溶液,所以是AgNO3溶液。
氧化
AgNO3溶液
(2)正极上出现的现象是_____________________。
1
2
3
4
5
6
7
碳棒上出现银白色物质
8
解析 正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。
(3)若导线上转移电子1
mol,则生成银______
g。
108
解析 当导线上转移1
mol电子的时候,正极上会析出1
mol银单质,所以正极上生成的银的质量是108
g。
8.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)_____(填字母)。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是________________________________________
_____________________________________________________________。
1
2
3
4
5
6
7
8
D
加入CuSO4溶液后,构成Fe—Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在其上,质量增加
(3)写出该池反应的总化学方程式:_________________________。
1
2
3
4
5
6
7
返回
8
Fe+CuSO4===FeSO4+Cu
解析 加入CuSO4溶液后,构成Fe—Ag原电池,Fe失电子作负极,质量减轻,Cu2+在正极银圈上得电子,生成金属铜沉积在其上使其质量增加。
本课结束
第1课时 化学能转化为电能
1.设计实验认识构成原电池的条件。
2.理解原电池的概念及工作原理,能正确判断原电池的正负极。
3.认识化学能转化为电能的原理及其在生产、生活中的应用。
核心素养发展目标
一、原电池工作原理
随堂演练 知识落实
课时对点练
二、原电池工作原理的应用
内
容
索
引
实验装置
实验现象
实验结论
?
锌片:
,_____
________
铜片:_________
锌与稀硫酸__________
,铜与稀硫酸
_______
?
锌片:
,_____
_______
铜片:__________
锌与稀硫酸_________
,铜与稀硫酸
_______
1.实验探究
一、原电池工作原理
逐渐溶解
有气
泡产生
没有变化
反应生成
氢气
不反应
逐渐溶解
有气
泡产生
没有变化
反应生成
氢气
不反应
?
锌片:__________
铜片:___________
锌
电子,变为_______
进入溶液,氢离子在铜片上
电子生成_____
?
锌片:_________
铜片:___________
电流计:____________
锌
电子,变为
,电子经过导线流向
,产生电流,
在铜片上
电子生成
,反应过程中产生了______
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
指针发生偏转
失去
锌离子
得到
氢气
失去
锌离子
铜片
氢离子
得到
氢气
电能
2.原电池的概念
原电池是把
能转化为
能的装置;原电池的反应本质是_____
反应。
化学
电
氧化
还原
3.原电池的工作原理
(1)分析下图并填空
原电池总反应式:
。
负极
氧化反应
Zn-
2e-
===Zn2+
正极
还原反应
2H++2e-===H2↑
Zn+2H+===Zn2++H2↑
(2)能量转化:
能转变为
能。
(3)电子的移动方向:从负极流出,经导线流向正极。
(4)离子的移动方向:阳离子向正极移动,阴离子向负极移动。
4.原电池的构成条件
化学
电
活泼性不同
电解质
闭合回路
氧化还原
(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池( )
(2)将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转( )
(3)在铜—锌—稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌( )
(4)原电池中阳离子向正极移动( )
(5)原电池中的负极反应一定是电极材料失电子( )
判断正误
×
×
×
√
×
1.下列装置中能够组成原电池的是______(填序号),其他不能构成原电池的试分别说明理由:_____________________________________________
____________________________________________________________________。
理解应用
③⑤
①中只有一个电极,②中两个电极的活泼性相同,④中为非电解质溶液,不能导电,⑥中电解质溶液(内电路)未形成闭合回路
装置
甲
乙
?
?
现象
A不断溶解,B上产生气泡
C的质量增加,B的质量减轻
2.利用原电池原理可比较金属的活泼性,原电池中,作负极的金属活动性一般比作正极的金属活动性强。结合相关知识解答下列问题。
由A、B、C三种金属按表中装置进行实验:
(1)在甲中,金属片_____(填“A”或“B”)发生氧化反应。
(2)在乙中,金属片_____(填“B”或“C”)作负极。
(3)如果把B、C用导线连接后同时浸入稀硫酸溶液中,有一电极产生气泡。则金属片______(填“B”或“C”)上有气泡产生。
(4)上述三种金属的活动性顺序是____________。
A
B
C
A>B>C
归纳总结
返回
二、原电池工作原理的应用
1.比较金属活动性
原电池中,作负极的金属活动性一般比作正极的金属活动性强。
2.改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
3.解释生活中的现象
如潮湿的空气里钢铁容易生锈,生活中的暖贴等。
(1)为保护船体不被腐蚀,可以在船体外壳焊一些铜块( )
(2)一般作原电池正极的金属较活泼( )
(3)钢铁在潮湿的空气里发生的腐蚀是电化学腐蚀( )
(4)生活中用到的暖贴,就是以钢铁电化学腐蚀的原理制成的( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+
( )
判断正误
×
×
√
√
×
选项
正极
负极
电解质溶液
A
Fe
Zn
HCl
B
Zn
Cu
H2SO4
C
Ag
Zn
CuSO4
D
C
Zn
ZnCl2
1.某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是
理解应用
√
解析 将Zn+Cu2+===Zn2++Cu拆开两个半反应:
氧化反应(负极反应):Zn-2e-===Zn2+;
还原反应(正极反应):Cu2++2e-===Cu。
则电池的负极是Zn,正极是比锌不活泼的金属或能导电的非金属,电解质溶液中含Cu2+。
装置
?
?
?
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
2.由A、B、C、D四种金属按下表中装置进行实验
(1)装置甲中负极的电极反应式是_______________。
(2)装置乙中正极的电极反应式是________________。
(3)四种金属活动性由强到弱的顺序是__________。
A-2e-===A2+
Cu2++2e-===Cu
D>A>B>C
归纳总结
返回
1.如图为某兴趣小组制作的番茄电池,下列说法正确的是
A.电子由铜通过导线流向锌
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌通过导线流向铜
1
2
3
5
随堂演练 知识落实
4
√
解析 A项,铜作正极,锌作负极,因此电子由锌流向铜,故错误;
B项,该装置将化学能转化为电能,故错误;
C项,锌作负极失去电子,发生氧化反应,故正确;
D项,电子与电流的方向相反,因此电流由铜极流向锌极,故错误。
1
2
3
5
4
?
M
N
R
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
铁
铜
硝酸银
D
铜
铁
蔗糖溶液
2.如图装置中,M棒变细,N棒变粗。由此判断下表所列M、N、R物质,其中合理的是
1
2
3
5
4
√
解析 由于D中蔗糖溶液不是电解质溶液,故D不正确;
M棒变细,N棒变粗,则M为负极,N为正极,M的金属活动性比N强,故B错误;
N棒变粗则电解质溶液中有能得电子的金属阳离子,故A不正确。
1
2
3
5
4
3.在钢铁腐蚀过程中,下列五种变化可能发生的是
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质碳被氧化
A.①②
B.②③④
C.①②③④
D.①②③④⑤
√
1
2
3
5
4
解析 本题考查钢铁的电化学腐蚀。在腐蚀过程中,负极Fe-2e-===Fe2+,正极O2或H+得电子,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2被氧化生成Fe(OH)3,Fe(OH)3失水形成铁锈。
4.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
?
A.①②③④
B.④②①③
C.③①②④
D.②①③④
1
2
3
5
4
√
解析 ③中的锌作负极,腐蚀速率最快;
④中的锌与外界不接触,腐蚀速率最慢;
②中的锌作正极,腐蚀速率比①中的锌要慢;
因此腐蚀速率由慢到快的顺序为④②①③,故B正确。
1
2
3
5
4
5.在铜锌原电池中(如图),以硫酸铜为电解质溶液,锌为_____极,电极上发生的是______(填“氧化”或“还原”)反应,电极反应式为________
_________。锌片上观察到的现象为__________;铜为____极,电极上发生的是_____(填“氧化”或“还原”)反应,电极反应式_______________;
铜片上观察到的现象为___________,原电池总反应的离子方程式为______________________。
1
2
3
5
4
负
氧化
Zn-2e-
===Zn2+
锌片溶解
正
还原
Cu2++2e-===Cu
铜片变粗
Zn+Cu2+===Zn2++Cu
解析 CuSO4为电解质溶液时,铜锌原电池的负极为锌,电极反应式为Zn-2e-===Zn2+,所以锌片不断溶解,正极为铜,电极反应式为Cu2++2e-===Cu,所以铜片不断变粗,原电池总反应的离子方程式为Zn+Cu2+===Zn2++Cu。
1
2
3
5
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 化学能转化为电能
1.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)
√
A组 基础对点练
10
1
2
3
4
5
6
7
8
9
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行的氧化还原反应。对图示各个装置进行观察,发现只有D不能形成闭合回路,因此不能形成原电池。
10
2.(2020·仲元中学高一检测)下列关于原电池的叙述中,不正确的是
A.原电池的负极发生的反应是氧化反应
B.原电池的正极上发生的反应是还原反应
C.原电池电解质溶液中阳离子移向负极,阴离子移向正极
D.原电池中电子流入的极一定是正极
√
1
2
3
4
5
6
7
8
9
10
解析 原电池的负极失去电子被氧化,发生氧化反应,A正确;
原电池正极上物质得电子,发生还原反应,B正确;
在原电池电解质溶液中,阳离子向正极移动,阴离子向负极移动,C错误;
原电池放电时,电子转移的方向是从负极沿导线流向正极,所以正极为电子流入的电极,D正确。
1
2
3
4
5
6
7
8
9
10
3.(2020·哈尔滨三中高一月考)下列关于实验现象的描述不正确的是
A.铜、锌组成的原电池中,电子从锌极经过导线流向铜极
B.把铜片和锌片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.把铜片插入FeCl3溶液中,在铜片表面出现一层铁
D.将铜片和铁片用导线相连浸入硫酸铜溶液中,一段时间后,铁片质
量减轻,铜片质量增加
1
2
3
4
5
6
7
8
9
√
10
解析 铜、锌组成的原电池中,金属锌作负极,金属铜作正极,电子从锌极流向铜极,故A项正确;
把铜片和锌片紧靠在一起浸入稀硫酸中,形成铜—锌—稀硫酸原电池,金属铜作正极,该极上产生气体,故B项正确;
把铜片插入FeCl3溶液中,Cu和FeCl3反应生成CuCl2和FeCl2,故C项错误;
将铜片和铁片用导线相连浸入硫酸铜溶液中,形成原电池,铜片作正极,铁片作负极,铁片失电子,形成Fe2+进入溶液,质量减轻,溶液中的Cu2+在铜电极上得电子,生成单质铜,质量增加,故D项正确。
1
2
3
4
5
6
7
8
9
10
4.如图是某同学学习原电池后整理的学习笔记,错误的是
A.①电子流动方向
B.②电流方向
C.③电极反应
D.④溶液中离子移动方向
1
2
3
4
5
6
7
8
9
√
10
解析 锌为负极,铜为正极,电子由锌片流向铜片,A正确;
电流与电子运动方向相反,则电流由铜片经导线流向锌片,B错误;
锌失电子生成锌离子,H+在铜片上得电子被还原生成H2,C正确;
1
2
3
4
5
6
7
8
9
10
原电池工作时,阴离子移向负极,阳离子移向正极,D正确。
题组二 原电池工作原理的应用
5.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:
则四种金属的活动性由强到弱的顺序为
A.Z>Y>X>W
B.Z>X>Y>W
C.Z>Y>W>X
D.Y>Z>X>W
√
1
2
3
4
5
6
7
8
9
10
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
6.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
√
1
2
3
4
5
6
7
8
9
10
解析 只有属于氧化还原反应,才能用于设计原电池;A、B、D属于氧化还原反应,均可以设计为原电池。
C不属于氧化还原反应,不能设计成原电池,故选C。
解析 A项为原电池,铝为负极,但总反应为2Al+2OH-+2H2O===
+3H2↑,不符合;
C项为原电池,但硝酸是氧化性酸,与Al反应不产生H2,不符合;
D项装置中有外接电源,不属于原电池,不符合。
7.(2019·太原月考)为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)
√
1
2
3
4
5
6
7
8
9
10
题组三 钢铁的电化学腐蚀
8.(2019·贵阳期末)下图实验为研究金属腐蚀的实验。下列相关说法正确的是
A.铁表面的反应为Fe-3e-===Fe3+
B.红色首先在食盐水滴的中心出现
C.食盐水中有气泡逸出
D.红色物质为Fe2O3·xH2O
1
2
3
4
5
6
7
8
9
√
10
解析 A项,负极上发生的电极反应式为Fe-2e-===Fe2+,错误;
B项,食盐水滴周围液体少,氧气量多,所以红色首先在食盐水滴的周围出现,错误;
C项,正极上发生的电极反应式为O2+2H2O+4e-===4OH-,所以食盐水中没有气泡逸出,错误。
1
2
3
4
5
6
7
8
9
10
9.下列关于金属材料的锈蚀说法不一,其中没有科学道理的是
A.金属接触水和空气锈蚀加快
B.改变金属的内部结构形成合金能抵御金属锈蚀
C.金属表面刷油漆可以抵御金属锈蚀
D.不断擦去铝表面的锈能抵御铝的继续锈蚀
1
2
3
4
5
6
7
8
9
10
√
解析 A项,金属接触水和空气锈蚀加快,正确;
B项,铁中掺入铬和镍等金属改变内部结构,制成不锈钢可以防腐蚀,所以改变金属的内部结构能抵御金属锈蚀,正确;
C项,金属防锈的措施之一是在金属表面刷油漆,正确;
D项,不断擦去铝表面的锈,使得内部金属暴露出来,加快了铝的腐蚀而不是抵御铝的继续锈蚀,错误。
1
2
3
4
5
6
7
8
9
10
10.(2020·南阳一中高一期中)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
1
2
3
4
5
6
7
8
9
10
(1)A中反应的离子方程式为______________________。
(2)B中锡极为____极,电极反应式为__________________,锡极附近溶液的酸性______(填“增强”“减弱”或“不变”)。B中Fe极为____极,电极反应式为________________。
Fe+2H+===Fe2++H2↑
正
2H++2e-===H2↑
减弱
负
Fe-2e-===Fe2+
(3)C中被腐蚀的金属是_____,总反应的化学方程式为________________
_____________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是________。
1
2
3
4
5
6
7
8
9
10
Zn
Zn+H2SO4===
ZnSO4+H2↑
BAC
解析 A中不能形成原电池,铁与稀硫酸发生置换反应。B中能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁被腐蚀的速率加快。C能形成原电池,锌比铁活泼,锌为负极,不断被腐蚀,铁为正极,被保护。
B组 综合强化练
1.将铁棒和锌棒用导线连接插入CuSO4溶液里,当电池中有0.2
mol电子通过时,负极质量的变化是
A.增加5.6
g
B.减小0.1
g
C.减少6.5
g
D.增加6.4
g
1
2
3
4
5
6
7
√
8
解析 方法一 依据电极反应式计算,
负极:Zn - 2e- === Zn2+
65
g
2
mol
m(Zn)
0.2
mol
1
2
3
4
5
6
7
8
方法二 依据原电池总反应式计算,
2.铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(
)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,
保持溶液中电荷平衡
√
1
2
3
4
5
6
7
8
解析 题中所述铜锌原电池中,Zn为负极,电极反应式为Zn-2e-===Zn2+;Cu为正极,电极反应式为Cu2++2e-===Cu,发生还原反应。Zn2+通过阳离子交换膜向正极移动;乙池溶液中消耗的Cu2+与由甲池迁移过来的Zn2+的物质的量相同,则乙池溶液质量增加,溶液中的阴离子无法通过阳离子交换膜。
1
2
3
4
5
6
7
8
3.(2019·长沙高一下学期期中)如图所示,两电极一极为碳棒,一极为铁片,若电流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
1
2
3
4
5
6
7
√
8
解析 Fe、C形成的原电池中,负极铁失去电子,变成Fe2+,由于a极上有大量气泡生成,所以正极(C棒)的电极反应为2H++2e-===H2↑,故a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸。
1
2
3
4
5
6
7
8
4.我国在太阳能光电催化-化学耦合分
解硫化氢研究中获得新进展,相关装置
如图所示。下列说法正确的是(已知质子
交换膜只允许H+通过)
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
1
2
3
4
5
6
7
√
8
解析 该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;
该装置工作时,H+由a极区流向b极区,B项错误;
a极上有电子流出,发生氧化反应,所
1
2
3
4
5
6
7
8
以a极上发生的电极反应为Fe2+-e-===Fe3+,C项错误;
由图可知,a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,D项错误。
5.按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,则y轴可以表示
①c(Ag+) ②c(
) ③a棒的质量
④b棒的质量 ⑤溶液的质量
A.①③
B.②④
C.①③⑤
D.②④⑤
√
1
2
3
4
5
6
7
8
解析
不参加反应,因此c(
)不变,②不符合图像变化;负极反应式为Fe-2e-===Fe2+,正极反应式为Ag++e-===Ag,则a棒的质量逐渐减少,b棒的质量逐渐增加,c(Ag+)逐渐减小,①③符合图像变化,④不符合图像变化;由电极反应式可知,每溶解56
g铁转移2
mol电子,有216
g银从溶液中析出,故随着反应的进行,溶液的质量减少,⑤符合图像变化;综上可知,C项正确。
1
2
3
4
5
6
7
8
6.(2020·武汉高一检测)在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:
2H2O+O2+4e-===4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
1
2
3
4
5
6
7
√
8
解析 铁作负极,发生失电子的氧化反应,选项A错误;
铁片负极腐蚀最严重,由于离子的移动,在正极区域生成铁锈最多,选项B错误;
1
2
3
4
5
6
7
8
铁作负极,发生失电子的氧化反应,即Fe-2e-===Fe2+,选项C错误;
D项,铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,铁作负极,碳作正极,选项D正确。
7.(2019·桂林高一检测)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是______,发生______反应(填“氧化”或“还原”),电解质溶液是______________。
1
2
3
4
5
6
7
Cu
8
解析 根据电池的总反应,可知负极一般是失电子的物质,所以负极材料应该是铜,发生氧化反应,电解质溶液是一种可溶性的银盐溶液,所以是AgNO3溶液。
氧化
AgNO3溶液
(2)正极上出现的现象是_____________________。
1
2
3
4
5
6
7
碳棒上出现银白色物质
8
解析 正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。
(3)若导线上转移电子1
mol,则生成银______
g。
108
解析 当导线上转移1
mol电子的时候,正极上会析出1
mol银单质,所以正极上生成的银的质量是108
g。
8.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)_____(填字母)。
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是________________________________________
_____________________________________________________________。
1
2
3
4
5
6
7
8
D
加入CuSO4溶液后,构成Fe—Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在其上,质量增加
(3)写出该池反应的总化学方程式:_________________________。
1
2
3
4
5
6
7
返回
8
Fe+CuSO4===FeSO4+Cu
解析 加入CuSO4溶液后,构成Fe—Ag原电池,Fe失电子作负极,质量减轻,Cu2+在正极银圈上得电子,生成金属铜沉积在其上使其质量增加。
本课结束
