高中化学苏教版(2019)必修第二册 专题6 第一单元 第2课时 化学反应的限度(77张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题6 第一单元 第2课时 化学反应的限度(77张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-24 23:37:35 | ||
图片预览










文档简介
(共77张PPT)
第2课时 化学反应的限度
1.了解可逆反应及特点。
2.理解化学平衡状态的特征及标志,会判断可逆反应的平衡状态。
3.了解控制反应条件在生产、生活和科学研究中的作用。
核心素养发展目标
一、化学反应限度
随堂演练 知识落实
课时对点练
二、化学平衡状态
内
容
索
引
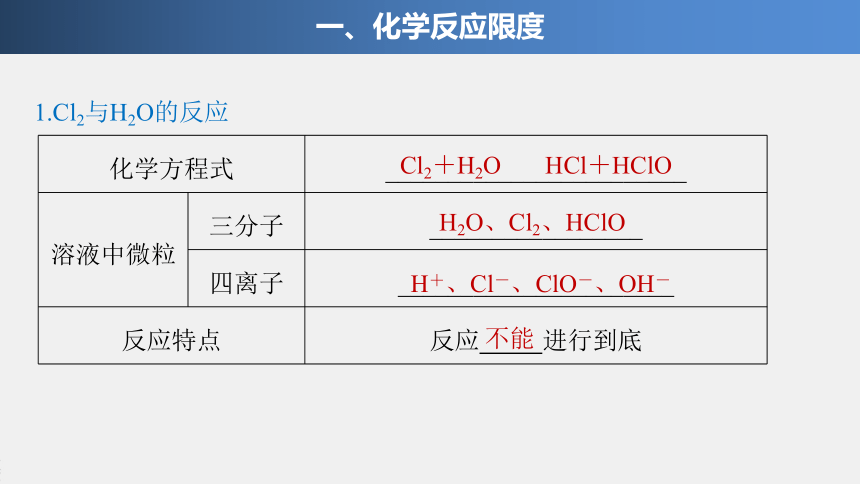
化学方程式
________________________
溶液中微粒
三分子
_________________
四离子
______________________
反应特点
反应
进行到底
1.Cl2与H2O的反应
一、化学反应限度
Cl2+H2O
HCl+HClO
H2O、Cl2、HClO
H+、Cl-、ClO-、OH-
不能
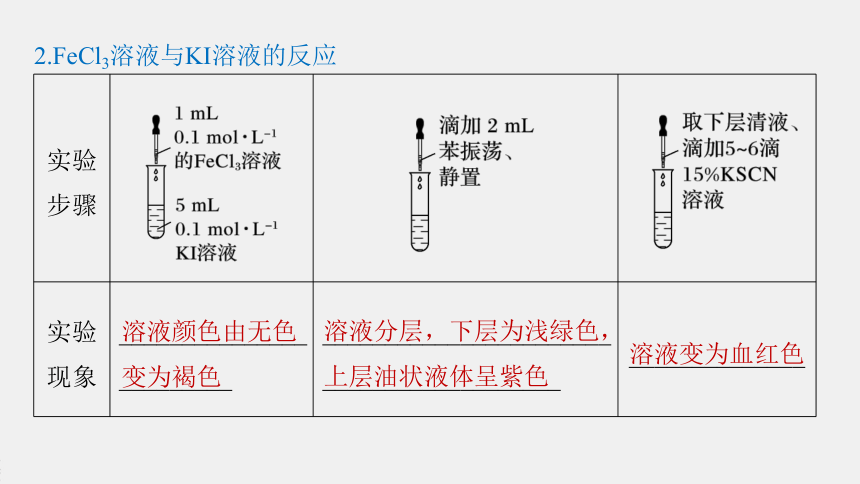
实验步骤
?
?
?
实验现象
________________________
__________________________________________
______________
2.FeCl3溶液与KI溶液的反应
溶液颜色由无色变为褐色
溶液分层,下层为浅绿色,上层油状液体呈紫色
溶液变为血红色
实验结论
有
生成
有
生成
下层清液中含有____________
离子方程式
_________________________
反应特点
I-过量条件下,反应物Fe3+
转化为生成物,即可逆反应具有一定的_____
I2
Fe2+和I2
未反应的Fe3+
2Fe3++2I-
2Fe2++I2
不能完全
限度
3.可逆反应
(1)定义:在同一条件下,既能向
进行,还能向
进行的化学反应。书写可逆反应的化学方程式时,不用“===”,用“
”。
(2)特征
正反应方向
逆反应方向
②双同性:正、逆反应是在
下同时进行的。
③共存性:反应物和生成物
存在。
同一条件
同时
(1)Pb+PbO2+2H2SO4
2PbSO4+2H2O为可逆反应( )
(2)1
mol
N2和3
mol
H2在一定条件下可完全生成2
mol
NH3( )
(3)既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应
( )
(4)在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应( )
(5)H2+Cl2
2HCl与2HCl
H2+Cl2互为可逆反应( )
判断正误
×
×
×
√
×
1.对于化学反应的限度的叙述,错误的是
A.任何可逆反应都有一定的限度
B.有一定限度的化学反应,都是可逆反应
C.化学反应的限度与时间的长短无关
D.化学反应的限度是不可改变的
理解应用
解析 任何可逆反应都有一定的限度,反之,有一定限度的化学反应都是可逆反应,对同一可逆反应,当外界条件不变时,反应的限度不变,与时间长短无关,但当外界条件发生改变时,化学反应的限度也会发生改变。
√
2.(2018·诸暨市牌头中学期中)在一定量的密闭容器中进行反应:N2(g)+3H2(g)
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1
mol·L-1、0.3
mol·L-1、0.2
mol·L-1。当反应达到最大限度时,可能存在的数据是
A.N2为0.2
mol·L-1,H2为0.6
mol·L-1
B.N2为0.15
mol·L-1
C.N2、H2均为0.18
mol·L-1
D.NH3为0.4
mol·L-1
√
解析 A项,可逆反应不能进行到底,N2的浓度范围是0~0.2
mol·L-1,H2的浓度范围是0~0.6
mol·L-1,NH3的浓度范围是0~0.4
mol·L-1,不能取最大值和最小值,错误;
B项,氮气的物质的量浓度在范围内,正确;
C项,虽然氮气和氢气的物质的量浓度在范围内,N2和H2都是反应物,浓度要么都增加,要么都减小,错误;
D项,此反应是可逆反应,不能进行到底,错误。
(1)化学反应的限度是在给定的条件下,可逆反应所能达到或完成的最大程度。化学反应的限度的意义在于决定了反应物在该条件下的最大转化率。
(2)不同的可逆反应在给定条件下的化学反应的限度不同;同一可逆反应在不同条件(如温度、浓度、压强等)下,其反应的限度不同。
归纳总结
返回
二、化学平衡状态
1.化学平衡状态的建立过程
在一定条件下向反应容器中加入N2和H2发生反应N2+3H2
2NH3。
?
浓度
速率变化
v正、v逆关系
开始
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
最大
最大
为0
为0
>
变化
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
平衡
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
减小
增大
不变
不变
减小
增大
不变
不变
>
=
2.用速率变化图像表示化学平衡状态的建立
3.化学平衡状态
(1)化学平衡状态的概念
如果外界条件(温度、浓度、压强等)不发生改变,当
反应进行到一定程度时,
与
相等,反应物的浓度与生成物的浓度都
,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
可逆
正反应速率
逆反应速率
不再改变
(2)化学平衡状态的特征
可逆反应
相等
不再改变
(1)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率
( )
(2)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等
( )
(3)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(4)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
判断正误
×
√
×
×
(1)一段时间后,再向容器中充入含氧同位素
的氧气,则
最终存在的物质为___(填字母)。
A.只有氧气
B.只有三氧化硫
C.只有氧气、三氧化硫
D.氧气、二氧化硫、三氧化硫
在一定温度下,在恒容的容器中充入2
mol
SO2和1
mol
O2发生反应:2SO2
+O2
2SO3。
理解应用
D
(2)一段时间后,该反应达到化学平衡,下列能说明反应达到化学平衡状态的是_________(填序号)。
①v正(SO2)=2v逆(O2)
②v(SO2)=v(SO3)
③单位时间内消耗a
mol
SO2,同时生成a
mol
SO3
④SO2、O2和SO3的浓度之比为2∶1∶2
⑤混合气体的总的物质的量不再改变
⑥混合气体的压强不再改变
⑦混合气体的密度不再改变
⑧混合气体的平均相对分子质量不再改变
①⑤⑥⑧
解析 ①因为v正(SO2)=2v正(O2),现有v正(SO2)=2v逆(O2),故v正(O2)=v逆(O2),为化学平衡状态;
②v(SO2)和v(SO3)一直保持相等,不能说明达到化学平衡状态;
③单位时间内消耗a
mol
SO2,必然生成a
mol
SO3,不能说明达到化学平衡状态;
④非平衡状态下,SO2、O2和SO3的浓度之比也可能为2∶1∶2;
⑤因为反应前后气体分子数不相等,若气体的总物质的量不再改变,说明正、逆反应速率相等,可以说明达到化学平衡状态;
⑥因为反应前后气体分子数不相等,如未达到平衡,则压强随时间改变而改变,现压强不变,说明反应达到化学平衡状态;
⑦该反应体系的容积不变,反应物及产物都是气体,故气体的密度一直不变,密度不变,不能说明反应达到化学平衡状态;
⑧根据M=
,该反应前后气体分子数不相等,故n是个变化的量,故M也是一个变化的量,如混合气体的平均相对分子质量不变,则n不变,反应一定达到化学平衡状态。
化学平衡状态的判断依据
(1)直接依据——根据速率关系
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)。
②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率,
如aA+bB
归纳总结
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
返回
1.反应CO(g)+H2O(g)
CO2(g)+H2(g),达到平衡后,再向反应容器中充入含18O的一氧化碳,经过一段时间后,18O存在于
A.CO
B.H2O
C.CO2、CO
D.CO、H2O、CO2
1
2
3
5
随堂演练 知识落实
4
√
解析 含18O的一氧化碳和H2O正向反应生成含18O的二氧化碳,同时含18O的二氧化碳和H2又逆向反应生成了一氧化碳和水,故最终CO、H2O和CO2中都含有了18O。
2.(2020·南京高一期中)可逆反应2NO2(g)
2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n
mol
O2的同时,生成2n
mol
NO2
②单位时间内生成n
mol
O2的同时,生成2n
mol
NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是
A.①④⑥⑦
B.②③④⑥
C.①④⑤⑦
D.①②⑥⑦
1
2
3
5
4
√
解析 单位时间内生成n
mol
O2必同时消耗2n
mol
NO2,而生成2n
mol
NO2必同时消耗n
mol
O2,①能说明反应已达到化学平衡状态,②不能说明。③中无论反应是否达到化学平衡状态,各物质表示的化学反应速率之比都等于相应物质的化学计量数之比。④有色气体的颜色不再改变,则表示体系中各物质的物质的量浓度不再变化,说明反应已达到化学平衡状态。⑤体积固定,气体的质量反应前后不变,无论是否达到化学平衡状态,气体的密度始终不变。⑥反应前后气体的体积不相等,压强不变,意味着各物质的含量不再变化,说明反应已达到化学平衡状态。⑦由于反应前后气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的物质的量不变,反应达到化学平衡状态。故选A。
1
2
3
5
4
3.工业上合成氨反应为N2(g)+3H2(g)
2NH3(g),在实际生产
中为提高合成氨的反应速率,下列说法正确的是
A.温度越高,反应速率越快,因此采取的温度越高越好
B.压强越高,反应速率越快,因此采取的压强越高越好
C.催化剂能加快反应速率,因此可选用适当的催化剂
D.可向容器中加入一定量的水蒸气,使氨气溶解以提高反应速率
√
1
2
3
5
4
解析 A项,温度高反应速率快,但温度过高会消耗更多的燃料,因此实际生产中的温度不是越高越好,故错误;
B项,压强大反应速率快,但压强过高会增加设备的成本,因此实际生产中的压强不是越高越好,故错误;
C项,可选用适当的催化剂提高反应速率,故正确;
D项,加入水蒸气会降低反应体系的温度,且氨气溶于水并不能提高反应速率,故错误。
1
2
3
5
4
4.在密闭容器中发生反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为0.1
mol·L-1、0.3
mol·L-1和0.2
mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是
A.X为0.2
mol·L-1
B.Y为0.1
mol·L-1
C.Z为0.4
mol·L-1
D.Z为0.1
mol·L-1时,Y为0.4
mol·L-1
1
2
3
5
4
√
1
2
3
5
4
解析 化学反应的限度决定了可逆反应中的各成分是不能完全转化的,反应可能正向进行,也可能逆向进行,所以当反应达到一定限度时各物质的浓度范围为0mol·L-1,0mol·L-1,00.4
mol·L-1。而当c(Z)=0.1
mol·L-1时,c(Y)=0.45
mol·L-1。
5.(2020·兖州区期中)某化学反应2A(g)
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
1
2
3
5
4
时间
实验序号
1
10
20
30
40
50
60
1
800
℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
℃
c2
0.60
0.50
0.50
0.50
0.50
0.50
3
800
℃
c3
0.92
0.75
0.63
0.60
0.60
0.60
4
820
℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
根据上述数据,完成下列填空:
(1)实验1中,在10~20
min时间内,以A表示的平均反应速率为______mol·
L-1·min-1。
1
2
3
5
4
0.013
(2)实验2中,A的初始浓度c2=____mol·L-1,反应经20
min就达到平衡,可推测实验2中还隐含的条件是___________。
1
2
3
5
4
1.0
加入催化剂
解析 根据实验1、2的数据分析,温度相同,达到平衡后A的物质的量浓度相同,且B、D起始浓度均为0,所以两组实验中A的起始浓度相同,为1.0
mol·L-1
;温度相同,达到平衡后A的物质的量浓度相同,但达到平衡时实验2的时间较短,所以只能是加入催化剂。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3____v1
(填“>”“=”或“<”),且c3_______1.0
mol·L-1(填“>”“=”或
“<”)。
1
2
3
5
4
>
>
解析 实验1、3比较,温度相同,10~20
min时,实验3的浓度减少量大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;根据相同条件下,浓度对化学反应速率的影响判断,实验3的起始浓度大于实验1的,即c3>1.0
mol·L-1。
(4)已知,温度升高,化学平衡向吸热方向移动,比较实验4和实验1,可推测该反应的正反应是______反应(填“吸热”或“放热”)。
1
2
3
5
4
吸热
解析 根据已知信息,温度升高,化学平衡向吸热方向移动,实验4与实验1比较,温度升高,达到平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应。
返回
题组一 可逆反应
1.(2020·临川区校级期中)下列反应不属于可逆反应的是
A.二氧化硫的催化氧化
B.氯气溶于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中的燃烧反应
课时对点练
1
2
3
4
5
6
7
8
√
A组 基础对点练
9
10
解析 二氧化硫催化氧化生成SO3是可逆反应,故A正确;
氯气溶于水,氯气与水反应生成HCl和HClO,是可逆反应,故B正确;
工业合成氨是可逆反应,故C正确;
水电解生成H2和O2与H2在O2中的燃烧反应,反应条件不同,不是可逆反应,故D错误。
1
2
3
4
5
6
7
8
9
10
2.(2020·历城区校级月考)500
℃时,将2
mol
N2和2.25
mol
H2充入体积为10
L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是
A.0.1
mol·L-1
B.0.12
mol·L-1
C.0.05
mol·L-1
D.0.16
mol·L-1
√
1
2
3
4
5
6
7
8
解析 由题干信息可知,N2和H2发生反应生成NH3,反应的方程式为N2+3H2
2NH3,该反应中N2过量,假设2.25
mol
H2完全反应,则生成NH3的物质的量为1.5
mol,浓度为0.15
mol·L-1,但该反应是可逆反应,H2不可能完全转化为NH3,因此达到平衡时,NH3的浓度小于0.15
mol·L-1,D选项符合题意。
9
10
1
2
3
4
5
6
7
8
题组二 化学反应的限度
3.(2020·杜集区校级期中)已知反应:NO2(g)+SO2(g)
SO3(g)+NO(g),起始时向某密闭容器中通入1
mol
NO2、2
mol
S18O2,反应达到平衡后,下列有关说法正确的是
A.NO2中不可能含18O
B.有1
mol
N18O生成
C.S18O2的物质的量不可能为0.8
mol
D.SO2、SO3、NO、NO2均含18O时,说明该反应达到平衡
√
9
10
1
2
3
4
5
6
7
8
解析 该反应为可逆反应,则通入1
mol
NO2、2
mol
S18O2,反应达到平衡后,SO2、SO3、NO、NO2均含18O,故A错误;
该反应为可逆反应,反应物不可能完全反应,所以通入1
mol
NO2、2
mol
S18O2,不可能有1
mol
N18O生成,故B错误;
该反应为可逆反应,反应物不可能完全反应,所以通入1
mol
NO2、2
mol
S18O2,则NO2、S18O2消耗都小于1
mol,所以S18O2的物质的量不可能为0.8
mol,故C正确;
该反应为可逆反应,SO2、SO3、NO、NO2均含18O时,不能说明该反应达到平衡,故D错误。
9
10
解析 t1时,v正>v逆>0,正、逆反应都在发生,A项错误;
t2~t3时,v正=v逆>0,反应并未停止,B项错误;
该反应为可逆反应,1
mol
X不能完全反应,所以当反应达到平衡时,容器内Y的物质的量小于1.5
mol,C项错误;
t2~t3时为化学平衡状态,X、Y的物质的量均不发生变化,D项正确。
4.向一密闭容器中放入1
mol
X,进行可逆反应2X(g)
3Y(g),反应过程中的反应速率(v)与时间(t)的关系曲线如图所示,下列叙述正确的是
A.t1时,只有正反应
B.t2~t3时,反应不再发生
C.t2时,容器内有1.5
mol
Y
D.t2~t3时,X、Y的物质的量均没有发生变化
1
2
3
4
5
6
7
8
√
9
10
5.(2020·襄阳五中期中)化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,若设法提高化学反应的限度,下面的说法错误的是
A.能够节约原料和能源
B.能够提高产品的产量
C.能够提高经济效益
D.能够提高化学反应速率
√
1
2
3
4
5
6
7
8
解析 提高化学反应的限度能够节约原料和能源、提高产品的产量、提高经济效益,但是和化学反应速率的快慢无关,故选D。
9
10
1
2
3
4
5
6
7
8
6.(2019·北京师大附中高一期末)一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g)。当SO2、O2、
SO3的浓度不再变化时,下列说法正确的是
A.SO2和O2全部转化为SO3
B.正、逆反应速率相等且等于零
C.该反应已达化学平衡状态
D.SO2、O2、SO3的浓度一定相等
√
9
10
1
2
3
4
5
6
7
8
解析 A项该反应是可逆反应,无论二者以何种比例混合,
反应达到平衡时,SO2、O2不能完全转化为生成物SO3,错误;
B项,可逆反应达到平衡状态时,反应仍然在进行,正、逆反应速率相等且不等于零,错误;
C项,当SO2、O2、SO3的浓度不再改变时,任何物质的消耗速率等于生成速率,说明反应已达到化学平衡状态,正确;
D项,当SO2、O2、SO3的浓度不再改变时,SO2、O2、SO3的浓度可能相等,也可能不相等,与加入物质的多少、反应条件有关,错误。
9
10
题组三 化学平衡状态的判断
7.(2019·杭州市学军中学检测)一定条件下的可逆反应2NO2(红棕色)
2NO(无色)+O2(无色),在恒压密闭容器中充入NO2,达到化学平衡状态的标志是
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO)∶c(O2)=2∶1
D.气体的颜色不再变化
1
2
3
4
5
6
7
8
√
9
10
1
2
3
4
5
6
7
8
解析 A项,反应达到平衡时,正、逆反应速率相等,但反应并没有停止,故错误;
B项,NO的正反应速率与O2的逆反应速率之比为2∶1时才能确定反应达到平衡状态,故错误;
C项,c(NO)∶c(O2)始终是2∶1,不能作为判断是否达到平衡状态的依据,故错误;
D项,混合气体的颜色不再改变,说明NO2气体的浓度不变,则反应达到平衡状态,故正确。
9
10
8.(2020·海淀区校级检测)煤焦与水蒸气的反应C(s)+H2O(g)
CO(g)+H2(g)(是吸热反应)是煤气化过程中的主要反应之一。若该反应在恒温、恒容的密闭体系中进行,仅通过以下数据可以判断t时刻反应是否达到平衡状态的是
①t时刻及其前后H2O(g)、CO(g)、H2(g)的浓度
②t时刻,H2O(g)、CO(g)、H2(g)的浓度
③t时刻,消耗H2O(g)的速率与生成CO(g)的速率
④t时刻,生成CO(g)的速率与消耗H2(g)的速率
A.①③
B.①④
C.②③
D.②④
1
2
3
4
5
6
7
8
√
9
10
解析 t时刻及其前后各种气体的浓度不变时,该反应正、逆反应速率相等,反应达到平衡状态,故①可以判断t时刻反应是否达到平衡状态;
t时刻,各种气体的浓度只是一个数值,无法判断平衡状态,故②无法判断;
无论反应是否达到平衡状态都存在消耗H2O(g)的速率与生成CO(g)的速率相等,所以不能据此判断平衡状态,故③无法判断;
t时刻生成CO(g)的速率是正反应,消耗H2(g)的速率是逆反应,v(正)=v(逆)可以判断平衡状态,故④可以判断t时刻反应是否达到平衡状态。
1
2
3
4
5
6
7
8
9
10
9.(2020·北京161中学期中)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应),673
K、30
MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
1
2
3
4
5
6
7
8
9
√
10
解析 c点反应物和生成物的物质的量仍在变化,没有达到平衡状态,所以正、逆反应速率不相等,A错误;
从a点到b点,氢气的物质的量在逐渐减小,即其物质的量浓度在逐渐减小,所以正反应的反应速率在逐渐减小,即a点的正反应速率比b点的大,B正确;
d点和e点都处于平衡状态,n(N2)不变,即
d点和e点处n(N2)相等,C错误;
在t2时刻,该反应处于化学平衡状态,所以
正、逆反应速率相等,D错误。
1
2
3
4
5
6
7
8
9
10
10.某温度下,在2
L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
1
2
3
4
5
6
7
8
9
10
(1)该反应的化学方程式可表示为____________。
解析 由图像可以看出X为反应物,Y和Z为生成物,当反应达到t
min时,Δn(X)=0.8
mol,Δn(Y)=1.2
mol,Δn(Z)=0.4
mol,化学反应中,各物质的物质的量变化值与化学计量数呈正比,故Δn(X)∶Δn(Y)∶Δn(Z)=2∶3∶1,所以反应的化学方程式为2X
3Y+Z。
(2)反应起始至t
min(设t=5),X的平均反应速率是__________________。
1
2
3
4
5
6
7
8
9
10
0.08
mol·L-1·min-1
(3)在t
min时,该反应达到了________状态,下列可判断反应已达到该状态的是___(填字母,下同)。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2∶3
C.混合气体的密度不变
D.生成1
mol
Z的同时生成2
mol
X
1
2
3
4
5
6
7
8
9
10
化学平衡
D
解析 在t
min时,反应中各物质的物质的量不再变化,反应达到化学平衡状态。A项,X、Y、Z的化学计量数不相等,则X、Y、Z的反应速率也不会相等,错误;
B项,用不同物质表示的化学反应速率之比等于化学计量数之比,无论平衡与否,X、Y的反应速率之比都为2∶3,错误;
C项,据ρ=
,由于反应体系的体积不变,气体的总质量不变,则混合气体的密度不变,错误;
D项,当生成1
mol
Z的同时生成2
mol
X,说明
正、逆反应速率相等,达到平衡状态,正确。
1
2
3
4
5
6
7
8
9
10
(4)一定能使该反应的反应速率增大的措施有____。
A.其他条件不变,及时分离出产物
B.适当降低温度
C.其他条件不变,增大X的浓度
D.保持温度不变,将容器体积压缩为1
L
1
2
3
4
5
6
7
8
9
10
CD
解析 减小产物浓度,降低温度,压缩容器体积,会使反应速率减小,故A、B项错误;
增大反应物浓度,会使反应速率增大,故C、D项正确。
B组 综合强化练
1.(2019·兰州一中高一期末)在密闭容器中加入2.0
mol
SO2和1.0
mol
O2,一定条件下发生如下反应2SO2+O2
2SO3。反应达到平衡后,各物质的物质的量可能为
1
2
3
4
5
选项
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
A
2.0
1.0
0
B
1.0
0.8
1.0
C
0.2
0.1
1.8
D
0
0
2.0
√
6
7
8
解析 反应2SO2+O2
2SO3是可逆反应,加入2.0
mol
SO2和1.0
mol
O2,最终各种物质都应该存在,不能全为反应物,也不能都为生成物,所以A、D错误;
反应正向进行,所以向生成SO3的方向进行,SO2与O2反应的物质的量关系为2∶1,所以SO2减小1
mol,消耗氧气0.5
mol,所以应该剩余氧气物质的量为0.5
mol,不能是0.8
mol,B错误,故合理选项是C。
1
2
3
4
5
6
7
8
2.已知SO2和O2反应生成4
mol
SO3时放出的热量为Q
kJ,那么2
mol
SO2和1
mol
O2在一有催化剂的密闭容器中发生反应时,放出的热量为
A.大于Q
kJ
B.等于Q
kJ
C.小于0.5Q
kJ
D.无法确定
√
1
2
3
4
5
6
7
8
3.(2020·西安市未央区校级期中)在一定条件下发生反应:2A(g)+2B(g)
xC(g)+2D(g),在2
L密闭容器中,把4
mol
A和2
mol
B混合,2
min后达到平衡时生成1.2
mol
C,又测得反应速率v(D)=0.2
mol·L-1·min-1,下列说法正确的是
A.A和B的转化率均是20%
B.x=3
C.平衡时A的物质的量为2.8
mol
D.平衡时气体压强比原来减小
1
2
3
4
5
√
6
7
8
1
2
3
4
5
相同时间内v(C)=
mol·L-1·min-1=0.3
mol·L-1·min-1,v(C)∶v(D)=x∶2=0.3
mol·L-1·min-1∶0.2
mol·L-1·min-1=3∶2,则x=3,故B正确;
6
7
8
1
2
3
4
5
平衡时n(A)=(4-0.8)mol=3.2
mol,故C错误;
恒温恒容条件下,气体压强与气体物质的量成正比,反应前后气体的化学计量数之和增大,则反应前后气体总物质的量增大,所以平衡时气体压强比原来增大,故D错误。
6
7
8
4.一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n
mol
CO的同时生成n
mol
H2
D.1
mol
H—H键断裂的同时断裂2
mol
H—O键
1
2
3
4
5
√
6
7
8
解析 A项,由于该反应前后气体体积改变,当体系的压强不再发生变化时,说明反应已达到化学平衡状态;
B项,CO的正反应速率等于其逆反应速率,说明反应已达到化学平衡状态;
C项,生成CO、H2均表示反应向正反应方向进行,没有表示出正、逆反应速率的关系,不能说明反应已达化学平衡状态;
D项,H—H键断裂和H—O键断裂是两个相反的反应方向,1
mol
H—H键断裂的同时断裂2
mol
H—O键,即消耗1
mol
H2的同时消耗了1
mol
H2O,可知H2的消耗量等于其生成量,说明反应已达到化学平衡状态。
1
2
3
4
5
6
7
8
5.(2020·武汉高一期中)在容积可变的密闭容器中,2
mol
N2和8
mol
H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于
A.5%
B.10%
C.15%
D.20%
1
2
3
4
5
√
6
7
8
解析 达到平衡时,H2转化的物质的量为8
mol×25%=2
mol。在一定条件下,N2与H2发生反应:
1
2
3
4
5
同温同压下,气体的体积比等于其物质的量之比,故平衡时氮气的体积
分数为
×100%≈15%。
6
7
8
6.(2019·贵阳高一期末)在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为X
2Y
C.t2时,反应的正、逆反应速率相等,达到
平衡状态
D.t3时,X、Y的量不再变化,化学反应停止
了,正、逆反应速率为零
1
2
3
4
5
6
√
7
8
解析 A项,由图像知,反应中Y的物质的量减少,X的物质的量增多,则Y为反应物,X为生成物,Y、X的物质的量变化量之比为(8-2)∶(5-2)=6∶3=2∶1,则化学方程式为2Y
X,t1时X的物质的量为3
mol,Y的物质的量为6
mol,因此Y的浓度是X的2倍,故A项正确,B项错误;
在t2时,X和Y的物质的量相等,但反应未达到平衡,故正、逆反应速率不相等,故C项错误;
在t3时,X和Y的物质的量不再随时间的变化而
变化,反应达到平衡,此时正、逆反应速率相
等,但不为零,故D项错误。
1
2
3
4
5
6
7
8
7.(2020·合肥八中高一期中)据报道,在300
℃、70
MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
A.使用Cu—Zn—Fe催化剂可大大提高生产效率
B.升高温度,则CH3CH2OH的产率一定增大
C.充入大量CO2气体可提高H2的转化率
D.反应达到平衡时,反应速率不为零
1
2
3
4
5
6
√
7
8
解析 因催化剂能提高化学反应速率,加快反应的进行,则在一定时间内提高了生产效率,故A正确;
升高温度是为了获得较快的反应速率,不能说明反应是向哪个方向移动,故CH3CH2OH的产率不一定增大,故B错误;
充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C正确。
1
2
3
4
5
6
7
8
8.在2
L密闭容器中,800
℃时,反应2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如下表所示。
1
2
3
4
5
6
7
8
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(1)如图中,A点处v正_____v逆(填“大于”“小于”或“等于”)。
大于
解析 图中表明A点的反应时间小于1
s,表格中数据表明在0~1
s内n(NO)呈减小状态,则反应2NO(g)+O2(g)
2NO2(g)在正向进行,v正>v逆。
(2)图中表示NO2变化的曲线是____。用O2表示从0~2
s内该反应的平均速率v=____________________。
1
2
3
4
5
6
7
8
b
1.5×10-3
mol·L-1·s-1
解析 上述反应正向进行,则c(NO)由逐渐减小
到保持不变。表格中数据表明上述反应从开始到
平衡,n(NO)的减小量为0.020
mol-0.007
mol=
0.013
mol,则n(NO2)的增加量为0.013
mol。上述
反应容器的容积为2
L,则平衡时c(NO2)=0.006
5
mol·L-1,则表示NO2变化的曲线是b。表格中数据表明,在0~2
s内n(NO)减小量为0.020
mol-0.008
mol=0.012
mol,则n(O2)的减小量为0.006
mol,容器容积为2
L,则Δc(O2)=0.003
mol·L-1,反应时间为2
s,根据v=
计算得v(O2)=1.5
×10-3
mol·L-1·s-1。
1
2
3
4
5
6
7
8
(3)下列能说明该反应已经达到平衡状态的是_____(填字母,下同)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
1
2
3
4
5
6
7
8
bc
解析 化学平衡状态中正、逆反应速率相等,
v正(NO2)=2v逆(O2)体现了上述反应中正、逆
反应速率相等,v(NO2)=2v(O2)则不可以。上
述反应,在达到平衡之前气体总物质的量不
守恒,则在恒温、恒容下气体总压强不守恒;在达到平衡之后气体总物质的量守恒,则在恒温、恒容下气体总压强守恒。总之,上述反应的容器内压强保持不变,说明反应已经到达平衡。上述反应,在达到平衡前后气体质量守恒,由于容器容积不变,则容器内的密度不变不能说明反应达到平衡。
1
2
3
4
5
6
7
8
(4)下列能使该反应的反应速率增大的是____。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
1
2
3
4
5
6
7
8
bcd
解析 其他条件一定,升高温度或增大反应物的浓度或使用催化剂,都能使化学反应速率增大;反之,可使化学反应速率减小。
返回
本课结束
第2课时 化学反应的限度
1.了解可逆反应及特点。
2.理解化学平衡状态的特征及标志,会判断可逆反应的平衡状态。
3.了解控制反应条件在生产、生活和科学研究中的作用。
核心素养发展目标
一、化学反应限度
随堂演练 知识落实
课时对点练
二、化学平衡状态
内
容
索
引
化学方程式
________________________
溶液中微粒
三分子
_________________
四离子
______________________
反应特点
反应
进行到底
1.Cl2与H2O的反应
一、化学反应限度
Cl2+H2O
HCl+HClO
H2O、Cl2、HClO
H+、Cl-、ClO-、OH-
不能
实验步骤
?
?
?
实验现象
________________________
__________________________________________
______________
2.FeCl3溶液与KI溶液的反应
溶液颜色由无色变为褐色
溶液分层,下层为浅绿色,上层油状液体呈紫色
溶液变为血红色
实验结论
有
生成
有
生成
下层清液中含有____________
离子方程式
_________________________
反应特点
I-过量条件下,反应物Fe3+
转化为生成物,即可逆反应具有一定的_____
I2
Fe2+和I2
未反应的Fe3+
2Fe3++2I-
2Fe2++I2
不能完全
限度
3.可逆反应
(1)定义:在同一条件下,既能向
进行,还能向
进行的化学反应。书写可逆反应的化学方程式时,不用“===”,用“
”。
(2)特征
正反应方向
逆反应方向
②双同性:正、逆反应是在
下同时进行的。
③共存性:反应物和生成物
存在。
同一条件
同时
(1)Pb+PbO2+2H2SO4
2PbSO4+2H2O为可逆反应( )
(2)1
mol
N2和3
mol
H2在一定条件下可完全生成2
mol
NH3( )
(3)既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应
( )
(4)在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应( )
(5)H2+Cl2
2HCl与2HCl
H2+Cl2互为可逆反应( )
判断正误
×
×
×
√
×
1.对于化学反应的限度的叙述,错误的是
A.任何可逆反应都有一定的限度
B.有一定限度的化学反应,都是可逆反应
C.化学反应的限度与时间的长短无关
D.化学反应的限度是不可改变的
理解应用
解析 任何可逆反应都有一定的限度,反之,有一定限度的化学反应都是可逆反应,对同一可逆反应,当外界条件不变时,反应的限度不变,与时间长短无关,但当外界条件发生改变时,化学反应的限度也会发生改变。
√
2.(2018·诸暨市牌头中学期中)在一定量的密闭容器中进行反应:N2(g)+3H2(g)
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1
mol·L-1、0.3
mol·L-1、0.2
mol·L-1。当反应达到最大限度时,可能存在的数据是
A.N2为0.2
mol·L-1,H2为0.6
mol·L-1
B.N2为0.15
mol·L-1
C.N2、H2均为0.18
mol·L-1
D.NH3为0.4
mol·L-1
√
解析 A项,可逆反应不能进行到底,N2的浓度范围是0~0.2
mol·L-1,H2的浓度范围是0~0.6
mol·L-1,NH3的浓度范围是0~0.4
mol·L-1,不能取最大值和最小值,错误;
B项,氮气的物质的量浓度在范围内,正确;
C项,虽然氮气和氢气的物质的量浓度在范围内,N2和H2都是反应物,浓度要么都增加,要么都减小,错误;
D项,此反应是可逆反应,不能进行到底,错误。
(1)化学反应的限度是在给定的条件下,可逆反应所能达到或完成的最大程度。化学反应的限度的意义在于决定了反应物在该条件下的最大转化率。
(2)不同的可逆反应在给定条件下的化学反应的限度不同;同一可逆反应在不同条件(如温度、浓度、压强等)下,其反应的限度不同。
归纳总结
返回
二、化学平衡状态
1.化学平衡状态的建立过程
在一定条件下向反应容器中加入N2和H2发生反应N2+3H2
2NH3。
?
浓度
速率变化
v正、v逆关系
开始
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
最大
最大
为0
为0
>
变化
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
平衡
反应物浓度_____
v正_____
v正
v逆
生成物浓度_____
v逆_____
减小
增大
不变
不变
减小
增大
不变
不变
>
=
2.用速率变化图像表示化学平衡状态的建立
3.化学平衡状态
(1)化学平衡状态的概念
如果外界条件(温度、浓度、压强等)不发生改变,当
反应进行到一定程度时,
与
相等,反应物的浓度与生成物的浓度都
,达到一种表面静止的状态,称为化学平衡状态,简称化学平衡。
可逆
正反应速率
逆反应速率
不再改变
(2)化学平衡状态的特征
可逆反应
相等
不再改变
(1)一定条件,可以通过延长化学反应的时间来改变反应物的最大转化率
( )
(2)化学反应达到化学平衡状态时正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等
( )
(3)可逆反应达到平衡状态时,各反应物、生成物的浓度相等( )
(4)化学反应在一定条件下建立平衡状态时,化学反应将会停止( )
判断正误
×
√
×
×
(1)一段时间后,再向容器中充入含氧同位素
的氧气,则
最终存在的物质为___(填字母)。
A.只有氧气
B.只有三氧化硫
C.只有氧气、三氧化硫
D.氧气、二氧化硫、三氧化硫
在一定温度下,在恒容的容器中充入2
mol
SO2和1
mol
O2发生反应:2SO2
+O2
2SO3。
理解应用
D
(2)一段时间后,该反应达到化学平衡,下列能说明反应达到化学平衡状态的是_________(填序号)。
①v正(SO2)=2v逆(O2)
②v(SO2)=v(SO3)
③单位时间内消耗a
mol
SO2,同时生成a
mol
SO3
④SO2、O2和SO3的浓度之比为2∶1∶2
⑤混合气体的总的物质的量不再改变
⑥混合气体的压强不再改变
⑦混合气体的密度不再改变
⑧混合气体的平均相对分子质量不再改变
①⑤⑥⑧
解析 ①因为v正(SO2)=2v正(O2),现有v正(SO2)=2v逆(O2),故v正(O2)=v逆(O2),为化学平衡状态;
②v(SO2)和v(SO3)一直保持相等,不能说明达到化学平衡状态;
③单位时间内消耗a
mol
SO2,必然生成a
mol
SO3,不能说明达到化学平衡状态;
④非平衡状态下,SO2、O2和SO3的浓度之比也可能为2∶1∶2;
⑤因为反应前后气体分子数不相等,若气体的总物质的量不再改变,说明正、逆反应速率相等,可以说明达到化学平衡状态;
⑥因为反应前后气体分子数不相等,如未达到平衡,则压强随时间改变而改变,现压强不变,说明反应达到化学平衡状态;
⑦该反应体系的容积不变,反应物及产物都是气体,故气体的密度一直不变,密度不变,不能说明反应达到化学平衡状态;
⑧根据M=
,该反应前后气体分子数不相等,故n是个变化的量,故M也是一个变化的量,如混合气体的平均相对分子质量不变,则n不变,反应一定达到化学平衡状态。
化学平衡状态的判断依据
(1)直接依据——根据速率关系
①同一物质:生成速率=消耗速率,即v正(A)=v逆(A)。
②不同物质:速率之比=化学计量数之比,但必须是不同方向的速率,
如aA+bB
归纳总结
(2)间接依据——根据各组分的量
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
返回
1.反应CO(g)+H2O(g)
CO2(g)+H2(g),达到平衡后,再向反应容器中充入含18O的一氧化碳,经过一段时间后,18O存在于
A.CO
B.H2O
C.CO2、CO
D.CO、H2O、CO2
1
2
3
5
随堂演练 知识落实
4
√
解析 含18O的一氧化碳和H2O正向反应生成含18O的二氧化碳,同时含18O的二氧化碳和H2又逆向反应生成了一氧化碳和水,故最终CO、H2O和CO2中都含有了18O。
2.(2020·南京高一期中)可逆反应2NO2(g)
2NO(g)+O2(g)在恒容密闭容器中进行:
①单位时间内生成n
mol
O2的同时,生成2n
mol
NO2
②单位时间内生成n
mol
O2的同时,生成2n
mol
NO
③用NO2、NO和O2的物质的量浓度变化表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是
A.①④⑥⑦
B.②③④⑥
C.①④⑤⑦
D.①②⑥⑦
1
2
3
5
4
√
解析 单位时间内生成n
mol
O2必同时消耗2n
mol
NO2,而生成2n
mol
NO2必同时消耗n
mol
O2,①能说明反应已达到化学平衡状态,②不能说明。③中无论反应是否达到化学平衡状态,各物质表示的化学反应速率之比都等于相应物质的化学计量数之比。④有色气体的颜色不再改变,则表示体系中各物质的物质的量浓度不再变化,说明反应已达到化学平衡状态。⑤体积固定,气体的质量反应前后不变,无论是否达到化学平衡状态,气体的密度始终不变。⑥反应前后气体的体积不相等,压强不变,意味着各物质的含量不再变化,说明反应已达到化学平衡状态。⑦由于反应前后气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的物质的量不变,反应达到化学平衡状态。故选A。
1
2
3
5
4
3.工业上合成氨反应为N2(g)+3H2(g)
2NH3(g),在实际生产
中为提高合成氨的反应速率,下列说法正确的是
A.温度越高,反应速率越快,因此采取的温度越高越好
B.压强越高,反应速率越快,因此采取的压强越高越好
C.催化剂能加快反应速率,因此可选用适当的催化剂
D.可向容器中加入一定量的水蒸气,使氨气溶解以提高反应速率
√
1
2
3
5
4
解析 A项,温度高反应速率快,但温度过高会消耗更多的燃料,因此实际生产中的温度不是越高越好,故错误;
B项,压强大反应速率快,但压强过高会增加设备的成本,因此实际生产中的压强不是越高越好,故错误;
C项,可选用适当的催化剂提高反应速率,故正确;
D项,加入水蒸气会降低反应体系的温度,且氨气溶于水并不能提高反应速率,故错误。
1
2
3
5
4
4.在密闭容器中发生反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为0.1
mol·L-1、0.3
mol·L-1和0.2
mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是
A.X为0.2
mol·L-1
B.Y为0.1
mol·L-1
C.Z为0.4
mol·L-1
D.Z为0.1
mol·L-1时,Y为0.4
mol·L-1
1
2
3
5
4
√
1
2
3
5
4
解析 化学反应的限度决定了可逆反应中的各成分是不能完全转化的,反应可能正向进行,也可能逆向进行,所以当反应达到一定限度时各物质的浓度范围为0
mol·L-1。而当c(Z)=0.1
mol·L-1时,c(Y)=0.45
mol·L-1。
5.(2020·兖州区期中)某化学反应2A(g)
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
1
2
3
5
4
时间
实验序号
1
10
20
30
40
50
60
1
800
℃
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2
800
℃
c2
0.60
0.50
0.50
0.50
0.50
0.50
3
800
℃
c3
0.92
0.75
0.63
0.60
0.60
0.60
4
820
℃
1.0
0.40
0.25
0.20
0.20
0.20
0.20
根据上述数据,完成下列填空:
(1)实验1中,在10~20
min时间内,以A表示的平均反应速率为______mol·
L-1·min-1。
1
2
3
5
4
0.013
(2)实验2中,A的初始浓度c2=____mol·L-1,反应经20
min就达到平衡,可推测实验2中还隐含的条件是___________。
1
2
3
5
4
1.0
加入催化剂
解析 根据实验1、2的数据分析,温度相同,达到平衡后A的物质的量浓度相同,且B、D起始浓度均为0,所以两组实验中A的起始浓度相同,为1.0
mol·L-1
;温度相同,达到平衡后A的物质的量浓度相同,但达到平衡时实验2的时间较短,所以只能是加入催化剂。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3____v1
(填“>”“=”或“<”),且c3_______1.0
mol·L-1(填“>”“=”或
“<”)。
1
2
3
5
4
>
>
解析 实验1、3比较,温度相同,10~20
min时,实验3的浓度减少量大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;根据相同条件下,浓度对化学反应速率的影响判断,实验3的起始浓度大于实验1的,即c3>1.0
mol·L-1。
(4)已知,温度升高,化学平衡向吸热方向移动,比较实验4和实验1,可推测该反应的正反应是______反应(填“吸热”或“放热”)。
1
2
3
5
4
吸热
解析 根据已知信息,温度升高,化学平衡向吸热方向移动,实验4与实验1比较,温度升高,达到平衡时A的平衡浓度减小;温度升高,化学平衡向吸热方向移动,所以正反应是吸热反应。
返回
题组一 可逆反应
1.(2020·临川区校级期中)下列反应不属于可逆反应的是
A.二氧化硫的催化氧化
B.氯气溶于水
C.工业合成氨
D.水电解生成H2和O2与H2在O2中的燃烧反应
课时对点练
1
2
3
4
5
6
7
8
√
A组 基础对点练
9
10
解析 二氧化硫催化氧化生成SO3是可逆反应,故A正确;
氯气溶于水,氯气与水反应生成HCl和HClO,是可逆反应,故B正确;
工业合成氨是可逆反应,故C正确;
水电解生成H2和O2与H2在O2中的燃烧反应,反应条件不同,不是可逆反应,故D错误。
1
2
3
4
5
6
7
8
9
10
2.(2020·历城区校级月考)500
℃时,将2
mol
N2和2.25
mol
H2充入体积为10
L的恒容密闭容器中,反应达到平衡时,NH3的浓度不可能是
A.0.1
mol·L-1
B.0.12
mol·L-1
C.0.05
mol·L-1
D.0.16
mol·L-1
√
1
2
3
4
5
6
7
8
解析 由题干信息可知,N2和H2发生反应生成NH3,反应的方程式为N2+3H2
2NH3,该反应中N2过量,假设2.25
mol
H2完全反应,则生成NH3的物质的量为1.5
mol,浓度为0.15
mol·L-1,但该反应是可逆反应,H2不可能完全转化为NH3,因此达到平衡时,NH3的浓度小于0.15
mol·L-1,D选项符合题意。
9
10
1
2
3
4
5
6
7
8
题组二 化学反应的限度
3.(2020·杜集区校级期中)已知反应:NO2(g)+SO2(g)
SO3(g)+NO(g),起始时向某密闭容器中通入1
mol
NO2、2
mol
S18O2,反应达到平衡后,下列有关说法正确的是
A.NO2中不可能含18O
B.有1
mol
N18O生成
C.S18O2的物质的量不可能为0.8
mol
D.SO2、SO3、NO、NO2均含18O时,说明该反应达到平衡
√
9
10
1
2
3
4
5
6
7
8
解析 该反应为可逆反应,则通入1
mol
NO2、2
mol
S18O2,反应达到平衡后,SO2、SO3、NO、NO2均含18O,故A错误;
该反应为可逆反应,反应物不可能完全反应,所以通入1
mol
NO2、2
mol
S18O2,不可能有1
mol
N18O生成,故B错误;
该反应为可逆反应,反应物不可能完全反应,所以通入1
mol
NO2、2
mol
S18O2,则NO2、S18O2消耗都小于1
mol,所以S18O2的物质的量不可能为0.8
mol,故C正确;
该反应为可逆反应,SO2、SO3、NO、NO2均含18O时,不能说明该反应达到平衡,故D错误。
9
10
解析 t1时,v正>v逆>0,正、逆反应都在发生,A项错误;
t2~t3时,v正=v逆>0,反应并未停止,B项错误;
该反应为可逆反应,1
mol
X不能完全反应,所以当反应达到平衡时,容器内Y的物质的量小于1.5
mol,C项错误;
t2~t3时为化学平衡状态,X、Y的物质的量均不发生变化,D项正确。
4.向一密闭容器中放入1
mol
X,进行可逆反应2X(g)
3Y(g),反应过程中的反应速率(v)与时间(t)的关系曲线如图所示,下列叙述正确的是
A.t1时,只有正反应
B.t2~t3时,反应不再发生
C.t2时,容器内有1.5
mol
Y
D.t2~t3时,X、Y的物质的量均没有发生变化
1
2
3
4
5
6
7
8
√
9
10
5.(2020·襄阳五中期中)化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,若设法提高化学反应的限度,下面的说法错误的是
A.能够节约原料和能源
B.能够提高产品的产量
C.能够提高经济效益
D.能够提高化学反应速率
√
1
2
3
4
5
6
7
8
解析 提高化学反应的限度能够节约原料和能源、提高产品的产量、提高经济效益,但是和化学反应速率的快慢无关,故选D。
9
10
1
2
3
4
5
6
7
8
6.(2019·北京师大附中高一期末)一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g)。当SO2、O2、
SO3的浓度不再变化时,下列说法正确的是
A.SO2和O2全部转化为SO3
B.正、逆反应速率相等且等于零
C.该反应已达化学平衡状态
D.SO2、O2、SO3的浓度一定相等
√
9
10
1
2
3
4
5
6
7
8
解析 A项该反应是可逆反应,无论二者以何种比例混合,
反应达到平衡时,SO2、O2不能完全转化为生成物SO3,错误;
B项,可逆反应达到平衡状态时,反应仍然在进行,正、逆反应速率相等且不等于零,错误;
C项,当SO2、O2、SO3的浓度不再改变时,任何物质的消耗速率等于生成速率,说明反应已达到化学平衡状态,正确;
D项,当SO2、O2、SO3的浓度不再改变时,SO2、O2、SO3的浓度可能相等,也可能不相等,与加入物质的多少、反应条件有关,错误。
9
10
题组三 化学平衡状态的判断
7.(2019·杭州市学军中学检测)一定条件下的可逆反应2NO2(红棕色)
2NO(无色)+O2(无色),在恒压密闭容器中充入NO2,达到化学平衡状态的标志是
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO)∶c(O2)=2∶1
D.气体的颜色不再变化
1
2
3
4
5
6
7
8
√
9
10
1
2
3
4
5
6
7
8
解析 A项,反应达到平衡时,正、逆反应速率相等,但反应并没有停止,故错误;
B项,NO的正反应速率与O2的逆反应速率之比为2∶1时才能确定反应达到平衡状态,故错误;
C项,c(NO)∶c(O2)始终是2∶1,不能作为判断是否达到平衡状态的依据,故错误;
D项,混合气体的颜色不再改变,说明NO2气体的浓度不变,则反应达到平衡状态,故正确。
9
10
8.(2020·海淀区校级检测)煤焦与水蒸气的反应C(s)+H2O(g)
CO(g)+H2(g)(是吸热反应)是煤气化过程中的主要反应之一。若该反应在恒温、恒容的密闭体系中进行,仅通过以下数据可以判断t时刻反应是否达到平衡状态的是
①t时刻及其前后H2O(g)、CO(g)、H2(g)的浓度
②t时刻,H2O(g)、CO(g)、H2(g)的浓度
③t时刻,消耗H2O(g)的速率与生成CO(g)的速率
④t时刻,生成CO(g)的速率与消耗H2(g)的速率
A.①③
B.①④
C.②③
D.②④
1
2
3
4
5
6
7
8
√
9
10
解析 t时刻及其前后各种气体的浓度不变时,该反应正、逆反应速率相等,反应达到平衡状态,故①可以判断t时刻反应是否达到平衡状态;
t时刻,各种气体的浓度只是一个数值,无法判断平衡状态,故②无法判断;
无论反应是否达到平衡状态都存在消耗H2O(g)的速率与生成CO(g)的速率相等,所以不能据此判断平衡状态,故③无法判断;
t时刻生成CO(g)的速率是正反应,消耗H2(g)的速率是逆反应,v(正)=v(逆)可以判断平衡状态,故④可以判断t时刻反应是否达到平衡状态。
1
2
3
4
5
6
7
8
9
10
9.(2020·北京161中学期中)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应),673
K、30
MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。
下列叙述中正确的是
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
1
2
3
4
5
6
7
8
9
√
10
解析 c点反应物和生成物的物质的量仍在变化,没有达到平衡状态,所以正、逆反应速率不相等,A错误;
从a点到b点,氢气的物质的量在逐渐减小,即其物质的量浓度在逐渐减小,所以正反应的反应速率在逐渐减小,即a点的正反应速率比b点的大,B正确;
d点和e点都处于平衡状态,n(N2)不变,即
d点和e点处n(N2)相等,C错误;
在t2时刻,该反应处于化学平衡状态,所以
正、逆反应速率相等,D错误。
1
2
3
4
5
6
7
8
9
10
10.某温度下,在2
L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
1
2
3
4
5
6
7
8
9
10
(1)该反应的化学方程式可表示为____________。
解析 由图像可以看出X为反应物,Y和Z为生成物,当反应达到t
min时,Δn(X)=0.8
mol,Δn(Y)=1.2
mol,Δn(Z)=0.4
mol,化学反应中,各物质的物质的量变化值与化学计量数呈正比,故Δn(X)∶Δn(Y)∶Δn(Z)=2∶3∶1,所以反应的化学方程式为2X
3Y+Z。
(2)反应起始至t
min(设t=5),X的平均反应速率是__________________。
1
2
3
4
5
6
7
8
9
10
0.08
mol·L-1·min-1
(3)在t
min时,该反应达到了________状态,下列可判断反应已达到该状态的是___(填字母,下同)。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2∶3
C.混合气体的密度不变
D.生成1
mol
Z的同时生成2
mol
X
1
2
3
4
5
6
7
8
9
10
化学平衡
D
解析 在t
min时,反应中各物质的物质的量不再变化,反应达到化学平衡状态。A项,X、Y、Z的化学计量数不相等,则X、Y、Z的反应速率也不会相等,错误;
B项,用不同物质表示的化学反应速率之比等于化学计量数之比,无论平衡与否,X、Y的反应速率之比都为2∶3,错误;
C项,据ρ=
,由于反应体系的体积不变,气体的总质量不变,则混合气体的密度不变,错误;
D项,当生成1
mol
Z的同时生成2
mol
X,说明
正、逆反应速率相等,达到平衡状态,正确。
1
2
3
4
5
6
7
8
9
10
(4)一定能使该反应的反应速率增大的措施有____。
A.其他条件不变,及时分离出产物
B.适当降低温度
C.其他条件不变,增大X的浓度
D.保持温度不变,将容器体积压缩为1
L
1
2
3
4
5
6
7
8
9
10
CD
解析 减小产物浓度,降低温度,压缩容器体积,会使反应速率减小,故A、B项错误;
增大反应物浓度,会使反应速率增大,故C、D项正确。
B组 综合强化练
1.(2019·兰州一中高一期末)在密闭容器中加入2.0
mol
SO2和1.0
mol
O2,一定条件下发生如下反应2SO2+O2
2SO3。反应达到平衡后,各物质的物质的量可能为
1
2
3
4
5
选项
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
A
2.0
1.0
0
B
1.0
0.8
1.0
C
0.2
0.1
1.8
D
0
0
2.0
√
6
7
8
解析 反应2SO2+O2
2SO3是可逆反应,加入2.0
mol
SO2和1.0
mol
O2,最终各种物质都应该存在,不能全为反应物,也不能都为生成物,所以A、D错误;
反应正向进行,所以向生成SO3的方向进行,SO2与O2反应的物质的量关系为2∶1,所以SO2减小1
mol,消耗氧气0.5
mol,所以应该剩余氧气物质的量为0.5
mol,不能是0.8
mol,B错误,故合理选项是C。
1
2
3
4
5
6
7
8
2.已知SO2和O2反应生成4
mol
SO3时放出的热量为Q
kJ,那么2
mol
SO2和1
mol
O2在一有催化剂的密闭容器中发生反应时,放出的热量为
A.大于Q
kJ
B.等于Q
kJ
C.小于0.5Q
kJ
D.无法确定
√
1
2
3
4
5
6
7
8
3.(2020·西安市未央区校级期中)在一定条件下发生反应:2A(g)+2B(g)
xC(g)+2D(g),在2
L密闭容器中,把4
mol
A和2
mol
B混合,2
min后达到平衡时生成1.2
mol
C,又测得反应速率v(D)=0.2
mol·L-1·min-1,下列说法正确的是
A.A和B的转化率均是20%
B.x=3
C.平衡时A的物质的量为2.8
mol
D.平衡时气体压强比原来减小
1
2
3
4
5
√
6
7
8
1
2
3
4
5
相同时间内v(C)=
mol·L-1·min-1=0.3
mol·L-1·min-1,v(C)∶v(D)=x∶2=0.3
mol·L-1·min-1∶0.2
mol·L-1·min-1=3∶2,则x=3,故B正确;
6
7
8
1
2
3
4
5
平衡时n(A)=(4-0.8)mol=3.2
mol,故C错误;
恒温恒容条件下,气体压强与气体物质的量成正比,反应前后气体的化学计量数之和增大,则反应前后气体总物质的量增大,所以平衡时气体压强比原来增大,故D错误。
6
7
8
4.一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n
mol
CO的同时生成n
mol
H2
D.1
mol
H—H键断裂的同时断裂2
mol
H—O键
1
2
3
4
5
√
6
7
8
解析 A项,由于该反应前后气体体积改变,当体系的压强不再发生变化时,说明反应已达到化学平衡状态;
B项,CO的正反应速率等于其逆反应速率,说明反应已达到化学平衡状态;
C项,生成CO、H2均表示反应向正反应方向进行,没有表示出正、逆反应速率的关系,不能说明反应已达化学平衡状态;
D项,H—H键断裂和H—O键断裂是两个相反的反应方向,1
mol
H—H键断裂的同时断裂2
mol
H—O键,即消耗1
mol
H2的同时消耗了1
mol
H2O,可知H2的消耗量等于其生成量,说明反应已达到化学平衡状态。
1
2
3
4
5
6
7
8
5.(2020·武汉高一期中)在容积可变的密闭容器中,2
mol
N2和8
mol
H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于
A.5%
B.10%
C.15%
D.20%
1
2
3
4
5
√
6
7
8
解析 达到平衡时,H2转化的物质的量为8
mol×25%=2
mol。在一定条件下,N2与H2发生反应:
1
2
3
4
5
同温同压下,气体的体积比等于其物质的量之比,故平衡时氮气的体积
分数为
×100%≈15%。
6
7
8
6.(2019·贵阳高一期末)在一定温度下,某容器内的某一反应中,X、Y的物质的量随反应时间的变化曲线如图所示,下列表述正确的是
A.t1时,Y的浓度是X的浓度的2倍
B.反应的化学方程式为X
2Y
C.t2时,反应的正、逆反应速率相等,达到
平衡状态
D.t3时,X、Y的量不再变化,化学反应停止
了,正、逆反应速率为零
1
2
3
4
5
6
√
7
8
解析 A项,由图像知,反应中Y的物质的量减少,X的物质的量增多,则Y为反应物,X为生成物,Y、X的物质的量变化量之比为(8-2)∶(5-2)=6∶3=2∶1,则化学方程式为2Y
X,t1时X的物质的量为3
mol,Y的物质的量为6
mol,因此Y的浓度是X的2倍,故A项正确,B项错误;
在t2时,X和Y的物质的量相等,但反应未达到平衡,故正、逆反应速率不相等,故C项错误;
在t3时,X和Y的物质的量不再随时间的变化而
变化,反应达到平衡,此时正、逆反应速率相
等,但不为零,故D项错误。
1
2
3
4
5
6
7
8
7.(2020·合肥八中高一期中)据报道,在300
℃、70
MPa下由二氧化碳和氢气合成乙醇(CH3CH2OH)已成为现实:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g)。下列叙述错误的是
A.使用Cu—Zn—Fe催化剂可大大提高生产效率
B.升高温度,则CH3CH2OH的产率一定增大
C.充入大量CO2气体可提高H2的转化率
D.反应达到平衡时,反应速率不为零
1
2
3
4
5
6
√
7
8
解析 因催化剂能提高化学反应速率,加快反应的进行,则在一定时间内提高了生产效率,故A正确;
升高温度是为了获得较快的反应速率,不能说明反应是向哪个方向移动,故CH3CH2OH的产率不一定增大,故B错误;
充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C正确。
1
2
3
4
5
6
7
8
8.在2
L密闭容器中,800
℃时,反应2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如下表所示。
1
2
3
4
5
6
7
8
时间/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.010
0.008
0.007
0.007
0.007
(1)如图中,A点处v正_____v逆(填“大于”“小于”或“等于”)。
大于
解析 图中表明A点的反应时间小于1
s,表格中数据表明在0~1
s内n(NO)呈减小状态,则反应2NO(g)+O2(g)
2NO2(g)在正向进行,v正>v逆。
(2)图中表示NO2变化的曲线是____。用O2表示从0~2
s内该反应的平均速率v=____________________。
1
2
3
4
5
6
7
8
b
1.5×10-3
mol·L-1·s-1
解析 上述反应正向进行,则c(NO)由逐渐减小
到保持不变。表格中数据表明上述反应从开始到
平衡,n(NO)的减小量为0.020
mol-0.007
mol=
0.013
mol,则n(NO2)的增加量为0.013
mol。上述
反应容器的容积为2
L,则平衡时c(NO2)=0.006
5
mol·L-1,则表示NO2变化的曲线是b。表格中数据表明,在0~2
s内n(NO)减小量为0.020
mol-0.008
mol=0.012
mol,则n(O2)的减小量为0.006
mol,容器容积为2
L,则Δc(O2)=0.003
mol·L-1,反应时间为2
s,根据v=
计算得v(O2)=1.5
×10-3
mol·L-1·s-1。
1
2
3
4
5
6
7
8
(3)下列能说明该反应已经达到平衡状态的是_____(填字母,下同)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
1
2
3
4
5
6
7
8
bc
解析 化学平衡状态中正、逆反应速率相等,
v正(NO2)=2v逆(O2)体现了上述反应中正、逆
反应速率相等,v(NO2)=2v(O2)则不可以。上
述反应,在达到平衡之前气体总物质的量不
守恒,则在恒温、恒容下气体总压强不守恒;在达到平衡之后气体总物质的量守恒,则在恒温、恒容下气体总压强守恒。总之,上述反应的容器内压强保持不变,说明反应已经到达平衡。上述反应,在达到平衡前后气体质量守恒,由于容器容积不变,则容器内的密度不变不能说明反应达到平衡。
1
2
3
4
5
6
7
8
(4)下列能使该反应的反应速率增大的是____。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
1
2
3
4
5
6
7
8
bcd
解析 其他条件一定,升高温度或增大反应物的浓度或使用催化剂,都能使化学反应速率增大;反之,可使化学反应速率减小。
返回
本课结束
