高中化学苏教版(2019)必修第二册 专题7 第三单元 第2课时 氮氧化物的无害化处理(64张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题7 第三单元 第2课时 氮氧化物的无害化处理(64张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-25 09:27:43 | ||
图片预览










文档简介
(共64张PPT)
第2课时 氮氧化物的无害化处理
1.理解氮氧化物(NO、NO2)的来源和性质。
2.了解氮氧化物对环境的影响。
3.认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响,
科学合理地选择和应用物质及其变化。
核心素养发展目标
一、空气中氮氧化物的来源及危害
随堂演练 知识落实
课时对点练
二、氮氧化物处理的原理及方法
内
容
索
引
1.氮氧化物(NOx)是大气污染物,主要包括
、_________
。
一、空气中氮氧化物的来源及危害
2.氮氧化物的来源
(1)化石燃料的燃烧
(2)硝酸生产等排放的废气
(3)机动车辆排放的尾气
一氧化氮(NO)
二氧化氮
(NO2)
3.氮氧化物的危害主要是形成
、
和雾霾。
(1)酸雨的危害
①使土壤酸化,危害土壤和植物;②使人类得呼吸道疾病,危害人体的健康;③腐蚀建筑物、机械和市政设施。
(2)光化学烟雾及危害
①氮氧化物(NOx)在日光照射下能使氧气经过复杂的反应生成
。
和一些碳氢化合物在
下发生作用后,产生了一种
的烟雾,人们称它为光化学烟雾。
②性质与危害:光化学烟雾具有
,
眼睛,对人体健康、植物生长等都有很大的危害。
酸雨
光化学烟雾
臭氧(O3)
臭氧与空气中的氮氧化物
紫外线的照射
有毒
特殊气味
刺激
(1)氮氧化物也可以形成酸雨(
)
(2)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶(
)
(3)“温室效应”加剧所带来的环境问题是形成光化学烟雾(
)
判断正误
√
√
×
1.简述硝酸型酸雨的形成过程。
深度思考
提示 2NO+O2===2NO2,NO2溶于降水,与水反应生成HNO3:3NO2+H2O===2HNO3+NO。
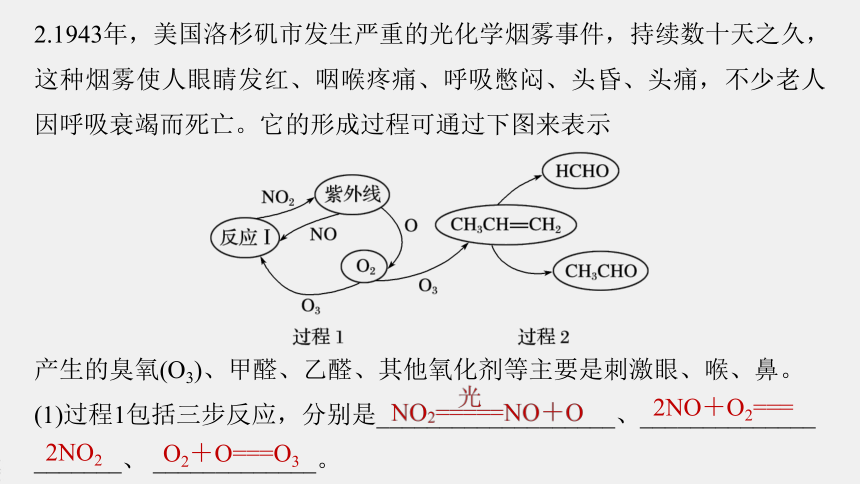
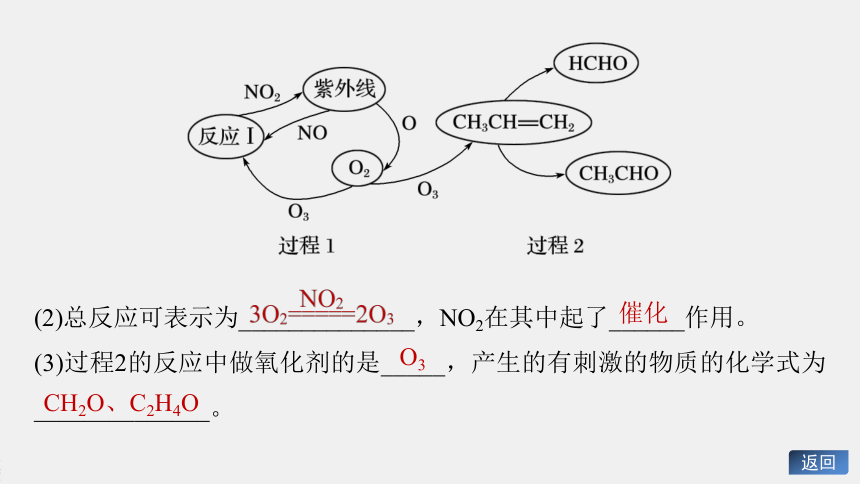
2.1943年,美国洛杉矶市发生严重的光化学烟雾事件,持续数十天之久,这种烟雾使人眼睛发红、咽喉疼痛、呼吸憋闷、头昏、头痛,不少老人因呼吸衰竭而死亡。它的形成过程可通过下图来表示
产生的臭氧(O3)、甲醛、乙醛、其他氧化剂等主要是刺激眼、喉、鼻。
(1)过程1包括三步反应,分别是___________________、______________
_______、
_____________。
2NO+O2===
2NO2
O2+O===O3
(2)总反应可表示为______________,NO2在其中起了______作用。
(3)过程2的反应中做氧化剂的是_____,产生的有刺激的物质的化学式为______________。
催化
O3
CH2O、C2H4O
返回
二、氮氧化物处理的原理及方法
1.应用化学反应将汽车尾气中的氮氧化物(NOx)转化为无污染的氮气
如,汽车排气管上安装催化转化装置,反应的化学方程式为___________
_________________。
2.根据氮氧化物可与碱反应的性质,用碱液吸收工厂排放废气中的NOx,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
2NO+2CO
3.使用洁净能源减少尾气的排放,如为减少汽车有害气体的排放,可采用以下三种措施:
(1)以
、
代替汽油。
(2)安装汽车尾气净化装置,将NOx转化为中性的,无污染的氮气。
(3)使用以液化天然气(LNG)或高效燃料
作为动力的新型环保汽车。
甲醇
液化气
电池
(1)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染(
)
(2)植物秸秆的焚烧产生的氮氧化物也参与了氮的循环(
)
(3)CO、NO等都是汽油和柴油的不完全燃烧产物(
)
判断正误
√
√
×
1.用氢氧化钠溶液可吸收废气中的氮氧化物,相同条件下,
(1)若废气中只含有NO2气体,被氢氧化钠溶液吸收时,生成两种盐,则该反应的离子方程式为_________________________________。
(2)若V(NO)∶V(NO2)=1的混合气体被烧碱溶液恰好吸收,只生成一种盐,写出该反应的离子方程式为_______________________________。
(3)废气中的氮氧化物(NOx)能被烧碱溶液完全吸收的条件是___________
_____________________。
(4)将336
mL
NO、112
mL
NO2和112
mL
N2O4的混合气体(体积均折算成标准状况的气体体积)缓缓通入盛有0.3
mol·L-1
NaOH溶液的烧杯中,气体恰好被完全吸收,则至少需要NaOH溶液的体积为_______。
理解应用
V(NO2)≥
V(NO)或n(NO2)≥n(NO)
100
mL
解析 根据反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O可知,生成物中氮元素和钠元素的物质的量之比为1∶1,所以氢氧化钠的物质的量等于氮氧化物中氮原子的物质的量。
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨
气和二氧化氮在一定条件下反应的化学方程式:______________________
_____________。
(2)若某工厂排出废气中NO2含量为0.5%(体积分数),则处理1.0×103
m3(标准状况)这种废气,需要______千克氨气(计算结果保留2位小数)。
7N2+12H2O
5.06
解析 尾气中二氧化氮含量为1.0×106
L×0.5%=0.5×104
L,设需要氨气x
mol,
6NO2 + 8NH3 === 7N2+12H2O
6×22.4
L
8
mol
0.5×104
L
x
解得:x≈297.62
mol,则氨气的质量为297.62×17×10-3
kg≈5.06
kg。
返回
1.(2019·宁夏育才中学高一月考)下列现象的产生与人为排放大气污染物氮氧化物无关的是
A.温室效应
B.光化学烟雾
C.酸雨
D.水体的富营养化
1
2
3
5
随堂演练 知识落实
4
√
解析 温室效应主要来自于CO2的大量排放,和氮氧化物无关。氮氧化物是形成光化学烟雾和酸雨的一个重要原因。水体中过量的氮对水体会造成污染,使水体富营养化,导致藻类“疯长”。
2.下列说法符合绿色化学思想的是
A.对工业生产硝酸产生的废气、废水进行严格处理
B.开发利用仿生固氮技术以减少氮肥使用
C.验证硝酸的强氧化性时在通风橱内进行实验
D.建设“花园式工厂”
1
2
3
5
4
√
解析 A项,对废气、废水严格处理是补救措施,没有从源头上减少污染;
B项,利用仿生固氮技术能减少氮肥使用,从源头上减少了污染物的排放;
C项,在通风橱内进行实验并不能减轻对大气的污染;
D项,“花园式工厂”也只是对环境的美化,没有从源头上减少污染。
3.下列有关环境污染的说法不正确的是
A.燃煤时加入适量生石灰,可减少废气中SO2的量
B.pH在5.6~7之间的降水通常称为酸雨
C.光化学烟雾的形成主要与NOx和碳氢化合物有关
D.含磷洗涤剂会导致水体污染
√
1
2
3
5
4
4.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——CO2
B.臭氧层破坏——CO
C.酸雨——SO2
D.光化学污染——NOx
1
2
3
5
4
解析 A项,二氧化碳可以造成温室效应,不合题意;
B项,臭氧层破坏不是因为一氧化碳,选B;
C项,硫的氧化物和氮的氧化物形成酸雨,不合题意;
D项,氮的氧化物可以形成光化学污染,不合题意。
√
5.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
1
2
3
5
4
√
1
2
3
5
4
汽车尾气的主要污染成分为有毒的CO和NO,B项正确;
NO和O2在常温下就能反应生成NO2,C项错误;
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 常见的环境污染
1.(2020·太原高一调研)下列污染现象主要与NO2有关的是
A.臭氧空洞
B.水体富营养化
C.光化学烟雾
D.温室效应
√
A组 基础对点练
10
2.(2018·全国卷Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
1
2
3
4
5
6
7
8
9
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
√
10
解析 雾和霾的分散剂都是空气,A项正确;
雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;
NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;
过度施用氮肥会增加大气中氨的含量,D项正确。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
3.下列现象与污染源对应不正确的是
A.酸雨—硫的氧化物、氮的氧化物
B.光化学烟雾—碳氢化合物、氮的氧化物
C.臭氧空洞—氟氯烃(如氟利昂)
D.温室效应—SO2
√
解析 酸雨与人们排放的SO2、NOx等有关;光化学烟雾与碳氢化合物和氮的氧化物有关;臭氧空洞与氟氯烃(如氟利昂)有关;温室效应与大气中CO2浓度不断上升有关。
10
4.在碳、氮、硫的氧化物中,许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物的说法,不正确的是
A.开发太阳能、水能、风能、氢能等新能源将有利于减少这些氧化物的产生
B.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
C.氮与硫的氧化物还能直接危害人的身体健康,引发呼吸道疾病
D.“温室效应”与二氧化碳的排放有着直接的关系
√
解析 正常雨水为二氧化碳的饱和溶液,其pH为5.6,pH小于5.6的雨水才为酸雨。
1
2
3
4
5
6
7
8
9
10
5.(2019·怀化高一检测)化学与环境密切相关,下列有关说法正确的是
A.CO2和NO2都会导致酸雨的形成
B.大气中的PM2.5会导致雾霾的形成
C.NO2和SO2都会导致光化学烟雾的形成
D.大气中SO2含量的增加会导致温室效应加剧
√
1
2
3
4
5
6
7
8
9
解析 CO2不会导致酸雨形成,会导致温室效应,A错误;
大气中的PM2.5会导致雾霾形成,B正确;
SO2不能导致光化学烟雾,C错误;
SO2会导致酸雨,不会导致温室效应,D错误。
10
1
2
3
4
5
6
7
8
9
6.(2020·福建师大附中高一期末)研究氮及其化合物的性质具有极为重要的意义。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:___________
________________。
3NO2+H2O
===2HNO3+NO
解析 NO2和水反应转化为HNO3的化学方程式:3NO2+H2O===2HNO3+NO。
10
1
2
3
4
5
6
7
8
9
(2)在含Cu+的酶的活化中,亚硝酸根离子(
)可转化为NO,写出Cu+和亚硝酸根离子在酸性溶液中反应的离子方程式:_________________
______________________。
===Cu2++NO↑+H2O
10
(3)将38.4
g铜与150
mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2
L,请回答:
①NO2的体积为______
L。
3.36
解析 将38.4
g铜与150
mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2
L。
1
2
3
4
5
6
7
8
9
10
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度约为______
mol·L-1。
11.3
1
2
3
4
5
6
7
8
9
10
题组二 汽车尾气的危害与防治
7.(2019·安徽蚌埠二中检测)汽车排放的尾气中含有NO2,NO2是城市大气的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。下列对该反应过程及产物的叙述正确的是
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2性质相同
1
2
3
4
5
6
7
8
9
√
10
解析 由①式和②③式叠加,反应的总方程式为2O2===O3+O,因此NO2为催化剂,由反应知NO为中间产物不起催化作用,NO2在反应①中化合价既升高,又降低,故NO2在①的反应过程中既起氧化作用,又起还原作用,故A项正确,B、C项错误;
O2和O3的性质是不同的,D项错误。
1
2
3
4
5
6
7
8
9
10
8.下列对NO、NO2的描述,不正确的是
A.NO2是红棕色气体,易溶于水,不是酸性氧化物
B.NO可以用排水法收集,但不能由N2和O2直接化合而得到
C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大
气污染物
D.NO、NO2都有毒,且NO是汽车尾气的有害成分之一
1
2
3
4
5
6
7
8
9
√
10
解析 A项,NO2是红棕色气体,易溶于水,并与水发生反应:3NO2+H2O===2HNO3+NO,由于反应前后N元素的化合价发生了变化,因此NO2不是酸性氧化物,正确;
B项,NO难溶于水,可以用排水法收集,在放电时可由N2和O2直接化合而得到,错误;
C项,NO与氧气发生反应会产生NO2,NO2与水反应产生硝酸和NO,因此二者在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物,正确;
D项,NO、NO2都有毒,且在汽车发动时,在电火花作用下N2和O2化合产生NO,NO是汽车尾气的有害成分之一,正确。
1
2
3
4
5
6
7
8
9
10
9.诺贝尔化学奖曾授予德国化学家Gerhard
Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中的NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
1
2
3
4
5
6
7
8
9
解析 CO、NOx在铂表面发生的反应为CO+NOx―→CO2+N2(未配平),也可能是CO与O2反应,此过程中铂作催化剂;CO2不能与人体中的血红蛋白结合。
√
10
10.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5
(直径小于等于2.5
μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
1
2
3
4
5
6
7
8
9
解析 PM2.5的直径小于等于2.5×10-6
m,所以分散在空气中形成的分散系不属于胶体。
不属于
10
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为_____(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=______
mol·L-1。
酸
10-4
1
2
3
4
5
6
7
8
9
10
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
3
4
4OH-
3
4
2H2O
1
2
3
4
5
6
7
8
9
10
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:
________________________。
1
2
3
4
5
6
7
8
9
10
②洗涤含SO2的烟气。以下物质可作洗涤剂的是_____(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
1
2
3
4
5
6
7
8
9
ab
解析 二氧化硫是酸性氧化物,能够与碱反应:SO2+Ca(OH)2===CaSO3↓+H2O;也能够与碳酸钠反应:SO2+Na2CO3===Na2SO3+CO2,与氯化钙、亚硫酸氢钠均不反应,答案选ab。
10
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中
生成NO的化学方程式:__________________。
1
2
3
4
5
6
7
8
9
10
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转
化器可减少CO和NO的污染,其化学反应方程式为___________________
___________。
1
2
3
4
5
6
7
8
9
2CO2+N2
10
B组 综合强化练
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
1
2
3
4
5
6
下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的
氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度
增大引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①②
B.只有②③
C.全部
D.只有②
√
解析 “酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
1
2
3
4
5
6
2.如图表示汽车尾气净化器处理汽车尾气的过程。有关叙述不正确的是
1
2
3
4
5
6
A.CO氧化为CO2所需氧来源于NOx
B.汽车安装这种净化器后,能避免铅污染
C.Pt-?Rh催化剂化学反应前后质量不变
D.使用该净化器能减少酸雨的发生
√
解析 CO氧化为CO2所需氧来源于氮的氧化物(NOx),故A正确;
汽车安装这种净化器后,能避免CO、NOx造成的空气污染,不是铅污染,故B错误;
Pt-?Rh催化剂在反应前后质量和化学性质都不变,故C正确;
氮的氧化物会造成酸雨,因此使用该净化器能减少酸雨的发生,故D正确。
1
2
3
4
5
6
3.化学与生活、社会密切相关,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.春节是我国传统的节日,应把“爆竹声声辞旧岁,总把新桃换旧符”
发扬光大
C.工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放
D.“雾霾天气”“温室效应”“光化学烟雾”“PM2.5”等都与汽车尾气
排放有关
1
2
3
4
5
6
√
解析 绿色化学的核心是从源头上减少对环境的污染,而不是先污染再治理,故A错误;
爆竹爆炸会产生大量的有害气体,粉尘和纸屑,污染环境,故B错误;
燃煤时加入少量石灰石,可以减少SO2的排放,不能减少CO2的排放,故C错误;
雾霾、光化学烟雾、温室效应、PM2.5都是由汽车尾气的氮氧化物、碳氢化物及它们相互反应转化的物质有关,故D正确。
1
2
3
4
5
6
4.当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
1
2
3
4
5
6
下列关于该“消除”过程的叙述不正确的是
A.部分光能转变为化学能
B.消除总变化为NOx+O2
+H2O―→HNO3
C.消除反应能全天候发生
D.使用纳米TiO2的消除效率更高
√
题中示意图表明,在TiO2的催化作用下紫外线提供能量,发生反应:NOx+O2+H2O―→HNO3,故B项正确;
没有紫外线时上述反应不能发生,故C项错误;
纳米TiO2与紫外线接触面积更大,将产生更多的光生电子和光生空穴,从而消除更多的NOx,故D项正确。
1
2
3
4
5
6
解析 在TiO2的催化作用下紫外线提供能量,部分光能转变为化学能,故A项正确;
5.中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如右图所示。
(1)根据右图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的____(填字母)。
a.SO2
b.NOx
c.VOCs
d.NH3
1
2
3
4
5
6
解析 根据示意图可知SO2不是由机动车行驶造成的,故答案为a。
a
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式:
_________________。
1
2
3
4
5
6
解析 稀燃过程中NO发生的主要反应的方程为2NO+O2===2NO2。
2NO+O2===2NO2
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
1
2
3
4
5
6
请判断A的化学式并说明判断理由:_____________________________
_____________________________________________________________
________________________________________________________。
N为+4价,反应后HONO中N元素为+3价,化合价降低;则必有元素化合价升高,是S元素从+4价升高到+6价,以
形式存在
1
2
3
4
5
6
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为
___________________________________。
6.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
1
2
3
4
5
6
②反应器中NH3还原NO2的化学方程式为_________________________
________。
1
2
3
4
5
6
12H2O
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_________________
_____________________。
1
2
3
4
5
6
2SO2+O2+4NH3
+2H2O===2(NH4)2SO4
解析 SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式为2SO2+O2+4NH3+2H2O===2(NH4)2SO4;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60
g·mol-1)含量的方法如下:取a
g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1
mL
c1
mol·L-1
H2SO4溶液吸收完全,剩余H2SO4用V2
mL
c2
mol·L-1
NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是______________。
1
2
3
4
5
6
解析 吸收NH3的硫酸的物质的量为V1×10-3
L×c1
mol·L-1-V2×10-3
L
1
2
3
4
5
6
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
1
2
3
4
5
6
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______。
BaO
解析 由图示可知BaO和NOx作用生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质是BaO;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是_______。
1
2
3
4
5
6
解析 由图示可知,第一步反应为H2与Ba(NO3)2反应生成NH3,1
mol
Ba(NO3)2反应生成NH3共转移16
mol电子,根据得失电子守恒,参加反应的氢气的物质的量为16
mol÷2=8
mol,则消耗的H2与Ba(NO3)2的物质的量之比是8∶1。
8∶1
返回
本课结束
第2课时 氮氧化物的无害化处理
1.理解氮氧化物(NO、NO2)的来源和性质。
2.了解氮氧化物对环境的影响。
3.认识氮氧化物对人体健康、社会可持续发展可能带来的双重影响,
科学合理地选择和应用物质及其变化。
核心素养发展目标
一、空气中氮氧化物的来源及危害
随堂演练 知识落实
课时对点练
二、氮氧化物处理的原理及方法
内
容
索
引
1.氮氧化物(NOx)是大气污染物,主要包括
、_________
。
一、空气中氮氧化物的来源及危害
2.氮氧化物的来源
(1)化石燃料的燃烧
(2)硝酸生产等排放的废气
(3)机动车辆排放的尾气
一氧化氮(NO)
二氧化氮
(NO2)
3.氮氧化物的危害主要是形成
、
和雾霾。
(1)酸雨的危害
①使土壤酸化,危害土壤和植物;②使人类得呼吸道疾病,危害人体的健康;③腐蚀建筑物、机械和市政设施。
(2)光化学烟雾及危害
①氮氧化物(NOx)在日光照射下能使氧气经过复杂的反应生成
。
和一些碳氢化合物在
下发生作用后,产生了一种
的烟雾,人们称它为光化学烟雾。
②性质与危害:光化学烟雾具有
,
眼睛,对人体健康、植物生长等都有很大的危害。
酸雨
光化学烟雾
臭氧(O3)
臭氧与空气中的氮氧化物
紫外线的照射
有毒
特殊气味
刺激
(1)氮氧化物也可以形成酸雨(
)
(2)汽车尾气中的氮氧化物和碳氢化合物是造成光化学烟雾的元凶(
)
(3)“温室效应”加剧所带来的环境问题是形成光化学烟雾(
)
判断正误
√
√
×
1.简述硝酸型酸雨的形成过程。
深度思考
提示 2NO+O2===2NO2,NO2溶于降水,与水反应生成HNO3:3NO2+H2O===2HNO3+NO。
2.1943年,美国洛杉矶市发生严重的光化学烟雾事件,持续数十天之久,这种烟雾使人眼睛发红、咽喉疼痛、呼吸憋闷、头昏、头痛,不少老人因呼吸衰竭而死亡。它的形成过程可通过下图来表示
产生的臭氧(O3)、甲醛、乙醛、其他氧化剂等主要是刺激眼、喉、鼻。
(1)过程1包括三步反应,分别是___________________、______________
_______、
_____________。
2NO+O2===
2NO2
O2+O===O3
(2)总反应可表示为______________,NO2在其中起了______作用。
(3)过程2的反应中做氧化剂的是_____,产生的有刺激的物质的化学式为______________。
催化
O3
CH2O、C2H4O
返回
二、氮氧化物处理的原理及方法
1.应用化学反应将汽车尾气中的氮氧化物(NOx)转化为无污染的氮气
如,汽车排气管上安装催化转化装置,反应的化学方程式为___________
_________________。
2.根据氮氧化物可与碱反应的性质,用碱液吸收工厂排放废气中的NOx,反应原理如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
2NO+2CO
3.使用洁净能源减少尾气的排放,如为减少汽车有害气体的排放,可采用以下三种措施:
(1)以
、
代替汽油。
(2)安装汽车尾气净化装置,将NOx转化为中性的,无污染的氮气。
(3)使用以液化天然气(LNG)或高效燃料
作为动力的新型环保汽车。
甲醇
液化气
电池
(1)严格控制汽车尾气的排放,可有效减少氮氧化物对大气的污染(
)
(2)植物秸秆的焚烧产生的氮氧化物也参与了氮的循环(
)
(3)CO、NO等都是汽油和柴油的不完全燃烧产物(
)
判断正误
√
√
×
1.用氢氧化钠溶液可吸收废气中的氮氧化物,相同条件下,
(1)若废气中只含有NO2气体,被氢氧化钠溶液吸收时,生成两种盐,则该反应的离子方程式为_________________________________。
(2)若V(NO)∶V(NO2)=1的混合气体被烧碱溶液恰好吸收,只生成一种盐,写出该反应的离子方程式为_______________________________。
(3)废气中的氮氧化物(NOx)能被烧碱溶液完全吸收的条件是___________
_____________________。
(4)将336
mL
NO、112
mL
NO2和112
mL
N2O4的混合气体(体积均折算成标准状况的气体体积)缓缓通入盛有0.3
mol·L-1
NaOH溶液的烧杯中,气体恰好被完全吸收,则至少需要NaOH溶液的体积为_______。
理解应用
V(NO2)≥
V(NO)或n(NO2)≥n(NO)
100
mL
解析 根据反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O可知,生成物中氮元素和钠元素的物质的量之比为1∶1,所以氢氧化钠的物质的量等于氮氧化物中氮原子的物质的量。
2.(1)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨
气和二氧化氮在一定条件下反应的化学方程式:______________________
_____________。
(2)若某工厂排出废气中NO2含量为0.5%(体积分数),则处理1.0×103
m3(标准状况)这种废气,需要______千克氨气(计算结果保留2位小数)。
7N2+12H2O
5.06
解析 尾气中二氧化氮含量为1.0×106
L×0.5%=0.5×104
L,设需要氨气x
mol,
6NO2 + 8NH3 === 7N2+12H2O
6×22.4
L
8
mol
0.5×104
L
x
解得:x≈297.62
mol,则氨气的质量为297.62×17×10-3
kg≈5.06
kg。
返回
1.(2019·宁夏育才中学高一月考)下列现象的产生与人为排放大气污染物氮氧化物无关的是
A.温室效应
B.光化学烟雾
C.酸雨
D.水体的富营养化
1
2
3
5
随堂演练 知识落实
4
√
解析 温室效应主要来自于CO2的大量排放,和氮氧化物无关。氮氧化物是形成光化学烟雾和酸雨的一个重要原因。水体中过量的氮对水体会造成污染,使水体富营养化,导致藻类“疯长”。
2.下列说法符合绿色化学思想的是
A.对工业生产硝酸产生的废气、废水进行严格处理
B.开发利用仿生固氮技术以减少氮肥使用
C.验证硝酸的强氧化性时在通风橱内进行实验
D.建设“花园式工厂”
1
2
3
5
4
√
解析 A项,对废气、废水严格处理是补救措施,没有从源头上减少污染;
B项,利用仿生固氮技术能减少氮肥使用,从源头上减少了污染物的排放;
C项,在通风橱内进行实验并不能减轻对大气的污染;
D项,“花园式工厂”也只是对环境的美化,没有从源头上减少污染。
3.下列有关环境污染的说法不正确的是
A.燃煤时加入适量生石灰,可减少废气中SO2的量
B.pH在5.6~7之间的降水通常称为酸雨
C.光化学烟雾的形成主要与NOx和碳氢化合物有关
D.含磷洗涤剂会导致水体污染
√
1
2
3
5
4
4.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——CO2
B.臭氧层破坏——CO
C.酸雨——SO2
D.光化学污染——NOx
1
2
3
5
4
解析 A项,二氧化碳可以造成温室效应,不合题意;
B项,臭氧层破坏不是因为一氧化碳,选B;
C项,硫的氧化物和氮的氧化物形成酸雨,不合题意;
D项,氮的氧化物可以形成光化学污染,不合题意。
√
5.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
1
2
3
5
4
√
1
2
3
5
4
汽车尾气的主要污染成分为有毒的CO和NO,B项正确;
NO和O2在常温下就能反应生成NO2,C项错误;
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 常见的环境污染
1.(2020·太原高一调研)下列污染现象主要与NO2有关的是
A.臭氧空洞
B.水体富营养化
C.光化学烟雾
D.温室效应
√
A组 基础对点练
10
2.(2018·全国卷Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
1
2
3
4
5
6
7
8
9
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
√
10
解析 雾和霾的分散剂都是空气,A项正确;
雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;
NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;
过度施用氮肥会增加大气中氨的含量,D项正确。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
3.下列现象与污染源对应不正确的是
A.酸雨—硫的氧化物、氮的氧化物
B.光化学烟雾—碳氢化合物、氮的氧化物
C.臭氧空洞—氟氯烃(如氟利昂)
D.温室效应—SO2
√
解析 酸雨与人们排放的SO2、NOx等有关;光化学烟雾与碳氢化合物和氮的氧化物有关;臭氧空洞与氟氯烃(如氟利昂)有关;温室效应与大气中CO2浓度不断上升有关。
10
4.在碳、氮、硫的氧化物中,许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物的说法,不正确的是
A.开发太阳能、水能、风能、氢能等新能源将有利于减少这些氧化物的产生
B.这些氧化物使雨水的pH<7,我们把pH<7的雨水称之为酸雨
C.氮与硫的氧化物还能直接危害人的身体健康,引发呼吸道疾病
D.“温室效应”与二氧化碳的排放有着直接的关系
√
解析 正常雨水为二氧化碳的饱和溶液,其pH为5.6,pH小于5.6的雨水才为酸雨。
1
2
3
4
5
6
7
8
9
10
5.(2019·怀化高一检测)化学与环境密切相关,下列有关说法正确的是
A.CO2和NO2都会导致酸雨的形成
B.大气中的PM2.5会导致雾霾的形成
C.NO2和SO2都会导致光化学烟雾的形成
D.大气中SO2含量的增加会导致温室效应加剧
√
1
2
3
4
5
6
7
8
9
解析 CO2不会导致酸雨形成,会导致温室效应,A错误;
大气中的PM2.5会导致雾霾形成,B正确;
SO2不能导致光化学烟雾,C错误;
SO2会导致酸雨,不会导致温室效应,D错误。
10
1
2
3
4
5
6
7
8
9
6.(2020·福建师大附中高一期末)研究氮及其化合物的性质具有极为重要的意义。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:___________
________________。
3NO2+H2O
===2HNO3+NO
解析 NO2和水反应转化为HNO3的化学方程式:3NO2+H2O===2HNO3+NO。
10
1
2
3
4
5
6
7
8
9
(2)在含Cu+的酶的活化中,亚硝酸根离子(
)可转化为NO,写出Cu+和亚硝酸根离子在酸性溶液中反应的离子方程式:_________________
______________________。
===Cu2++NO↑+H2O
10
(3)将38.4
g铜与150
mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2
L,请回答:
①NO2的体积为______
L。
3.36
解析 将38.4
g铜与150
mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2
L。
1
2
3
4
5
6
7
8
9
10
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度约为______
mol·L-1。
11.3
1
2
3
4
5
6
7
8
9
10
题组二 汽车尾气的危害与防治
7.(2019·安徽蚌埠二中检测)汽车排放的尾气中含有NO2,NO2是城市大气的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2―→2NO+2O,②2NO+O2―→2NO2,③O+O2―→O3。下列对该反应过程及产物的叙述正确的是
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2性质相同
1
2
3
4
5
6
7
8
9
√
10
解析 由①式和②③式叠加,反应的总方程式为2O2===O3+O,因此NO2为催化剂,由反应知NO为中间产物不起催化作用,NO2在反应①中化合价既升高,又降低,故NO2在①的反应过程中既起氧化作用,又起还原作用,故A项正确,B、C项错误;
O2和O3的性质是不同的,D项错误。
1
2
3
4
5
6
7
8
9
10
8.下列对NO、NO2的描述,不正确的是
A.NO2是红棕色气体,易溶于水,不是酸性氧化物
B.NO可以用排水法收集,但不能由N2和O2直接化合而得到
C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大
气污染物
D.NO、NO2都有毒,且NO是汽车尾气的有害成分之一
1
2
3
4
5
6
7
8
9
√
10
解析 A项,NO2是红棕色气体,易溶于水,并与水发生反应:3NO2+H2O===2HNO3+NO,由于反应前后N元素的化合价发生了变化,因此NO2不是酸性氧化物,正确;
B项,NO难溶于水,可以用排水法收集,在放电时可由N2和O2直接化合而得到,错误;
C项,NO与氧气发生反应会产生NO2,NO2与水反应产生硝酸和NO,因此二者在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物,正确;
D项,NO、NO2都有毒,且在汽车发动时,在电火花作用下N2和O2化合产生NO,NO是汽车尾气的有害成分之一,正确。
1
2
3
4
5
6
7
8
9
10
9.诺贝尔化学奖曾授予德国化学家Gerhard
Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中的NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
1
2
3
4
5
6
7
8
9
解析 CO、NOx在铂表面发生的反应为CO+NOx―→CO2+N2(未配平),也可能是CO与O2反应,此过程中铂作催化剂;CO2不能与人体中的血红蛋白结合。
√
10
10.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5
(直径小于等于2.5
μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
1
2
3
4
5
6
7
8
9
解析 PM2.5的直径小于等于2.5×10-6
m,所以分散在空气中形成的分散系不属于胶体。
不属于
10
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为_____(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=______
mol·L-1。
酸
10-4
1
2
3
4
5
6
7
8
9
10
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
3
4
4OH-
3
4
2H2O
1
2
3
4
5
6
7
8
9
10
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:
________________________。
1
2
3
4
5
6
7
8
9
10
②洗涤含SO2的烟气。以下物质可作洗涤剂的是_____(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
1
2
3
4
5
6
7
8
9
ab
解析 二氧化硫是酸性氧化物,能够与碱反应:SO2+Ca(OH)2===CaSO3↓+H2O;也能够与碳酸钠反应:SO2+Na2CO3===Na2SO3+CO2,与氯化钙、亚硫酸氢钠均不反应,答案选ab。
10
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中
生成NO的化学方程式:__________________。
1
2
3
4
5
6
7
8
9
10
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转
化器可减少CO和NO的污染,其化学反应方程式为___________________
___________。
1
2
3
4
5
6
7
8
9
2CO2+N2
10
B组 综合强化练
1.中办、国办在第二轮中央生态环保督察启动之际印发了《中央生态环境保护督察工作规定》。可见国家对环境保护的重视程度。
1
2
3
4
5
6
下列环境问题与产生的主要原因不相符的是
①“光化学烟雾”主要是由汽车排放的
氮氧化物所引起的
②“酸雨”主要是由空气中CO2的浓度
增大引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“赤潮”主要是由于水体中N、P等元素含量过高而引起的
A.只有①②
B.只有②③
C.全部
D.只有②
√
解析 “酸雨”主要是由空气中SO2或NOx的浓度增大引起的。
1
2
3
4
5
6
2.如图表示汽车尾气净化器处理汽车尾气的过程。有关叙述不正确的是
1
2
3
4
5
6
A.CO氧化为CO2所需氧来源于NOx
B.汽车安装这种净化器后,能避免铅污染
C.Pt-?Rh催化剂化学反应前后质量不变
D.使用该净化器能减少酸雨的发生
√
解析 CO氧化为CO2所需氧来源于氮的氧化物(NOx),故A正确;
汽车安装这种净化器后,能避免CO、NOx造成的空气污染,不是铅污染,故B错误;
Pt-?Rh催化剂在反应前后质量和化学性质都不变,故C正确;
氮的氧化物会造成酸雨,因此使用该净化器能减少酸雨的发生,故D正确。
1
2
3
4
5
6
3.化学与生活、社会密切相关,下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.春节是我国传统的节日,应把“爆竹声声辞旧岁,总把新桃换旧符”
发扬光大
C.工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放
D.“雾霾天气”“温室效应”“光化学烟雾”“PM2.5”等都与汽车尾气
排放有关
1
2
3
4
5
6
√
解析 绿色化学的核心是从源头上减少对环境的污染,而不是先污染再治理,故A错误;
爆竹爆炸会产生大量的有害气体,粉尘和纸屑,污染环境,故B错误;
燃煤时加入少量石灰石,可以减少SO2的排放,不能减少CO2的排放,故C错误;
雾霾、光化学烟雾、温室效应、PM2.5都是由汽车尾气的氮氧化物、碳氢化物及它们相互反应转化的物质有关,故D正确。
1
2
3
4
5
6
4.当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
1
2
3
4
5
6
下列关于该“消除”过程的叙述不正确的是
A.部分光能转变为化学能
B.消除总变化为NOx+O2
+H2O―→HNO3
C.消除反应能全天候发生
D.使用纳米TiO2的消除效率更高
√
题中示意图表明,在TiO2的催化作用下紫外线提供能量,发生反应:NOx+O2+H2O―→HNO3,故B项正确;
没有紫外线时上述反应不能发生,故C项错误;
纳米TiO2与紫外线接触面积更大,将产生更多的光生电子和光生空穴,从而消除更多的NOx,故D项正确。
1
2
3
4
5
6
解析 在TiO2的催化作用下紫外线提供能量,部分光能转变为化学能,故A项正确;
5.中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如右图所示。
(1)根据右图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的____(填字母)。
a.SO2
b.NOx
c.VOCs
d.NH3
1
2
3
4
5
6
解析 根据示意图可知SO2不是由机动车行驶造成的,故答案为a。
a
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式:
_________________。
1
2
3
4
5
6
解析 稀燃过程中NO发生的主要反应的方程为2NO+O2===2NO2。
2NO+O2===2NO2
(3)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
1
2
3
4
5
6
请判断A的化学式并说明判断理由:_____________________________
_____________________________________________________________
________________________________________________________。
N为+4价,反应后HONO中N元素为+3价,化合价降低;则必有元素化合价升高,是S元素从+4价升高到+6价,以
形式存在
1
2
3
4
5
6
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为
___________________________________。
6.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
1
2
3
4
5
6
②反应器中NH3还原NO2的化学方程式为_________________________
________。
1
2
3
4
5
6
12H2O
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_________________
_____________________。
1
2
3
4
5
6
2SO2+O2+4NH3
+2H2O===2(NH4)2SO4
解析 SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式为2SO2+O2+4NH3+2H2O===2(NH4)2SO4;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60
g·mol-1)含量的方法如下:取a
g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1
mL
c1
mol·L-1
H2SO4溶液吸收完全,剩余H2SO4用V2
mL
c2
mol·L-1
NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是______________。
1
2
3
4
5
6
解析 吸收NH3的硫酸的物质的量为V1×10-3
L×c1
mol·L-1-V2×10-3
L
1
2
3
4
5
6
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
1
2
3
4
5
6
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______。
BaO
解析 由图示可知BaO和NOx作用生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质是BaO;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是_______。
1
2
3
4
5
6
解析 由图示可知,第一步反应为H2与Ba(NO3)2反应生成NH3,1
mol
Ba(NO3)2反应生成NH3共转移16
mol电子,根据得失电子守恒,参加反应的氢气的物质的量为16
mol÷2=8
mol,则消耗的H2与Ba(NO3)2的物质的量之比是8∶1。
8∶1
返回
本课结束
