第2节 金属的化学性质(金属与酸和盐反应图像专题)同步练习(含解析)
文档属性
| 名称 | 第2节 金属的化学性质(金属与酸和盐反应图像专题)同步练习(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 131.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-07 22:31:19 | ||
图片预览



文档简介
2021-2022学年浙教版科学金属与酸和盐反应图像专题
一.选择题(共12小题)
1.向等质量的相同的稀硫酸中分别加入足量的镁条、铁片、锌粒,有关量的关系图象如下,其中正确的是( )
A.
B.
C.
D.
2.等质量的A、B、C三种金属的粉末,与足量的等浓度稀硫酸反应(A、B、C三种金属元素在生成物中都显+2价)生成H2的质量与时间的关系如图所示,下列说法错误的是( )
A.三种金属的活动性为B>A>C
B.生成氢气的质量:A>B>C
C.相对原子质量:A>B>C
D.消耗硫酸的质量:A>B>C
3.等质量的甲、乙两种金属分别与足量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是( )
A.乙金属的活动性一定大于甲金属
B.乙金属的相对原子质量一定大于甲金属
C.甲、乙两种金属可能分别为镁、锌
D.把横坐标“反应时间”改为“稀硫酸的质量”时,坐标中的曲线不会发生变化
4.在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示。下列表述正确的是( )
A.反应结束后稀硫酸一定都没有剩余
B.反应结束后消耗两种金属的质量相等
C.A表示铁和稀硫酸的反应曲线
D.反应结束后两种金属一定都有剩余
5.将质量相等的A、B、C三种金属(颗粒大小相同),同时分别放入三份溶质质量分数
相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论错误的是( )(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是A>B>C
B.金属活动性顺序是B>A>C
C.反应速率最大的是B
D.相对原子质量是B>C>A
6.向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量,酸溶液的质量与生成盐的质量关系如图所示,请根据题干和图象信息判断,下列说法正确的是( )
A.镁粉消耗稀盐酸的质量多
B.参加反应的稀盐酸的质量相等
C.生成盐的质量相等
D.铁粉与稀盐酸反应更快
7.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图所示。下列说法错误的是( )
A.a点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
B.d点所得溶液中的溶质为硝酸亚铁和硝酸锌
C.b点所得固体为银
D.c点所得固体为银、铁
8.向硝酸铜、硝酸银和硝酸亚铁的混合溶液的烧杯中,缓慢连续加入质量为m克的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系,如图所示。
①c点对应溶液中含有的金属离子为Zn2+和Cu2+
②b点对应溶液呈蓝色
③bc段(不含两端点)对应溶液中析出的金属是Fe
④ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+
⑤若bc段和cd段对应溶液中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1<m2
⑥若将d点的混合物过滤,滤渣一定有Zn、Fe、Cu和Ag
其中说法正确的个数有( )
A.1个
B.2
个
C.3
个
D.4
个
9.将质量相等的A,B,C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是(已知:A,B,C在生成物中均为+2价)( )
A.放出H2的质量是B>A>C
B.三种金属反应完所需要的时间相同
C.相对原子质量是A>B>C
D.反应结束时,A金属消耗的稀盐酸溶液质量最多
10.在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,某发生反应的质量关系如图所示,根据图中信息,下面推理合理的是( )
A.反应生成氢气质量:Mg=Fe=Zn
B.曲线P、Q、M所表示的金属分别表示Mg、Zn、Fe
C.三种金属反应速率:Mg>Fe>Zn
D.反应后溶液质量:Mg=Fe=Zn
11.向盛有一定质量稀盐酸酸的烧杯中加入过量的铝粉,下列4个图象中,能正确反映对应变化关系的个数是( )
A.4
B.3
C.2
D.1
12.将铜粉和铁粉的混合物mg放入烧杯中,向烧杯中不断加入FeCl3溶液,测得烧杯中剩余固体的质量与加入FeCl3溶液体积的关系如图所示。已知:铁和铜都能与FeCl3溶液发生反应,有关化学方程式为:①Fe+2FeCl3═3FeCl2
②Cu+2FeCl3═CuCl2+2FeCl2.下列说法正确的是( )
A.FeCl3与Cu发生的反应属于置换反应
B.M点溶液中一定含有FeCl2和CuCl2
C.加入V1mL
FeCl3,溶液时,Fe恰好完全反应
D.混合物中铁粉与铜粉的质量比为m:n
二.填空题(共3小题)
13.根据所学知识回答下列与金属材料有关的问题。
将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有 种。如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示不正确的是 (填标号)。
14.铜、铁、铝是生活中常见的金属,请回答:
(1)黄铜是铜锌合金,其硬度比纯铜 (选填“大”或“小”)。
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的 。
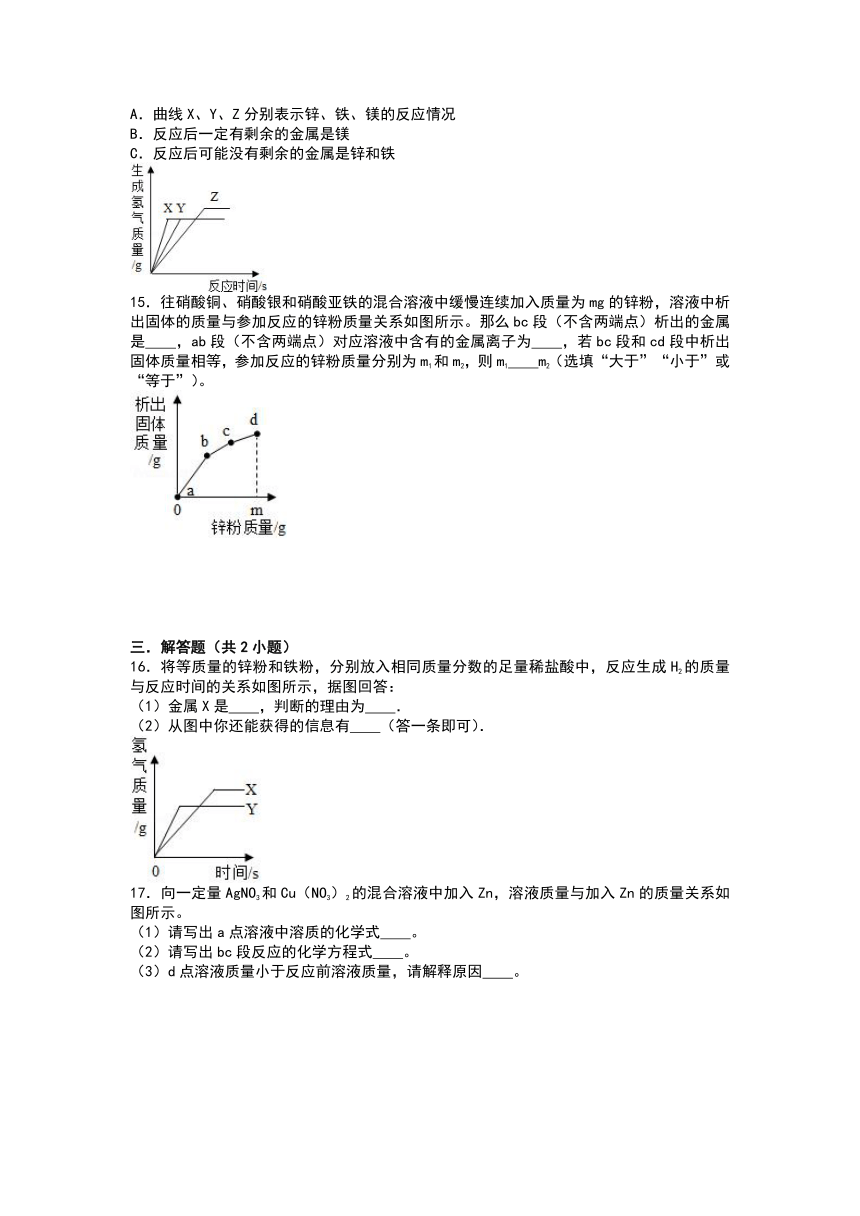
(3)用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 。(选填字母代号)
A.曲线X、Y、Z分别表示锌、铁、镁的反应情况
B.反应后一定有剩余的金属是镁
C.反应后可能没有剩余的金属是锌和铁
15.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为mg的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示。那么bc段(不含两端点)析出的金属是 ,ab段(不含两端点)对应溶液中含有的金属离子为 ,若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1 m2(选填“大于”“小于”或“等于”)。
三.解答题(共2小题)
16.将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:
(1)金属X是 ,判断的理由为 .
(2)从图中你还能获得的信息有 (答一条即可).
17.向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示。
(1)请写出a点溶液中溶质的化学式 。
(2)请写出bc段反应的化学方程式 。
(3)d点溶液质量小于反应前溶液质量,请解释原因 。
2021-2022学年浙教版科学金属与酸和盐反应图像专题
参考答案与试题解析
一.选择题(共12小题)
1.解:金属活动性顺序可知,三种金属镁最活泼,锌次之,铁最不活泼,所以镁与稀硫酸反应速率最快,锌次之,铁反应最慢,向等质量的相同的稀硫酸中分别加入足量的镁条、铁片、锌粒,金属是足量的,所以生成氢气的质量相等,通过分析可知,故选:B。
2.解:A、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内B放出氢气的质量大于A、大于C,可判断三种金属活动性顺序是B>A>C,故说法正确;
B、根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,故说法正确;
C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,因此可判断相对原子质量是C>B>A,故说法错误;
D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:A>B>C,故说法正确。
故选:C。
3.解:A、从图象中不难看出,金属乙的反应需要的时间短,说明金属乙的反应速率快,即金属乙的金属活动性强,金属乙比甲活泼,故A正确;
B、由于金属的化合价不确定,不能比较金属的相对原子质量,故B错误。
C、由于镁的活动定性大于铝,镁反应的时间短,故甲、乙两种金属不可能分别为镁、锌;故C错误。
D、由于金属与相同的酸反应时生成的氢气的质量相同,坐标中的曲线会发生变化;故D错误。
故选:A。
4.解:A、金属置换酸中的氢元素,由图象可知生成氢气的质量相等,硫酸均反应完,故A正确;
B、根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g铁生成2g氢气,根据化学方程式Zn+H2SO4═ZnSO4+H2↑,可知每65g锌反应生成2g氢气;由于生成氢气的质量相同,消耗金属的质量一定不相等,故B错误;
C、由于锌的活动性大于铁,生成相同质量的氢气,锌用的时间短,所以A表示锌和稀硫酸的反应曲线,故C错误;
D、由方程式分析可知:生成氢气的质量相等,反应消耗锌的质量较多,如果锌恰好反应,则铁有剩余;或者金属都有剩余,故错误。
故选:A。
5.解:A、根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,故A正确;
B、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内B放出氢气的质量大于A、大于C,可判断三种金属中B的活动性最强,其次是A,活动性最弱的是C,故B正确;
C、根据反应生成H2的质量与反应时间的关系图所示,等质量的三种金属B最先完全反应,因此反应速度最大的是B,故C正确;
D、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,所以可判断相对原子质量是C>B>A,故D错误。
故选:D。
6.解:A、镁与稀盐酸反应生成盐的质量多,则镁粉消耗稀盐酸的质量多,故选项说法正确。
B、镁与稀盐酸反应生成盐的质量多,则镁粉消耗稀盐酸的质量多,故选项说法错误。
C、由图示可知,镁与稀盐酸反应生成盐的质量多,故选项说法错误。
D、镁的金属活动性比铁强,与稀盐酸反应反应更快,故选项说法错误。
故选:A。
7.解:A、向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,锌先与硝酸银反应,把硝酸银反应完了,再与硝酸亚铁反应,a点是锌与一部分硝酸银反应,锌与硝酸银反应生成银和硝酸锌,所以液中的溶质为硝酸银、硝酸亚铁和硝酸锌,故A正确;
B、d点是加入的锌粉过量,硝酸银和硝酸亚铁完全发生了反应,溶质为硝酸锌,故B错误;
C、b点是锌与硝酸银刚好反应完,所得固体为银,故C正确;
D、c点是锌与硝酸亚铁刚好反应完,所得固体为银、铁,故D正确。
故选:B。
8.解:由于金属的活动性顺序是:锌>铁>铜>银,向硝酸铜、硝酸银和硝酸亚铁的混合溶液的烧杯中,缓慢连续加入质量为m克的锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,最后和硝酸亚铁反应生成硝酸锌和铁。
①c点时锌和硝酸铜恰好完全反应,对应溶液中含有的金属离子为Zn2+和Fe2+,该选项说法不正确;
②b点对应溶液中含有硝酸铜、硝酸亚铁,溶液颜色应是蓝色和浅绿色的混合色,该选项说法不正确;
③bc段(不含两端点)析出的金属是Cu,该选项说法不正确;
④ab段(不含两端点)对应溶液中含有的金属离子为Ag+、Zn2+、Cu2+、Fe2+,该选项说法正确;
⑤锌和硝酸铜、硝酸亚铁反应的化学方程式及其质量关系为:
Zn+Cu(NO3)2=Zn(NO3)2+Cu,
65
64
Zn+Fe(NO3)2=Zn(NO3)2+Fe,
65
56
由以上质量关系可知,若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1<m2,该选项说法正确;
⑥由于d点时锌恰好反应,若将d点的混合物过滤,滤渣一定有Fe、Cu和Ag,该选项说法不正确。
故选:B。
9.解:A、由图象可知,完全反应后生成氢气的质量A>B>C,故不正确;
B、由图象可知,三种金属反应完所需要的时间不相同,B时间最短,A时间最长,故不正确;
C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C;因此可判断相对原子质量是C>B>A,故不正确;
D、根据质量守恒定律可知,氢元素全部来自酸,生成氢气的质量A>B>C,所以反应结束时,A金属消耗的稀盐酸溶液质量最多,故正确。
故选:D。
10.解:A、相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,则最终生成的氢气的质量相等,正确;
B、与等质量的稀硫酸反应,开始消耗的锌的质量大,镁的质量小,故P是镁,Q是铁,M是锌,错误;
C、三种金属的活动性顺序为Mg>Zn>Fe,错误;
D、反应后溶液的质量为Zn>Fe>Mg,错误;
故选:A。
11.解:①稀盐酸为酸性溶液,开始时其pH小于7,故错误;
②烧杯中有稀盐酸,所以其溶质质量不能为零,故错误;
③加入铝粉之后,铝和稀盐酸马上开始反应生成氢气,直至将稀盐酸消耗完全,生成氢气的质量不再改变,起点应从零点开始,故错误;
④加入铝粉之后,铝和稀盐酸马上开始反应生成氯化铝,直至将稀盐酸消耗完全,生成氯化铝的质量不再改变,故正确。
故选:D。
12.解:在金属活动性顺序中,铁在铜的前面,铁能与铜盐溶液发生置换反应,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁优先与氯化铁发生反应生成氯化亚铁,然后铜与氯化铁反应生成氯化铜和氯化亚铁,所以:
A、FeCl3与Cu
发生的化学反应,由两种物质生成了一种物质,属于化合反应,不是置换反应,故A错误;
B、根据反应特点,铁金属活动性强于铜,所以是铁与氯化铁先反应,铁的相对分子质量小于铜的相对分子质量,因此铁与氯化铁质量减少幅度不如铜与氯化铁反应的大,故在M点时是铁正好与氯化铁反应完毕,此时溶液中不含有铜离子,故B错误;
C、当加入V1mL
FeCl3
溶液时,铁恰好完全反应,故C正确;
D、在M点时,铁全部反应,剩余固体全部为铜,所以铜质量ng,铜粉和铁粉的混合物mg,铁粉的质量为(m﹣n)g,铁粉与铜粉的质量比为(m﹣n):n,故D错误;
故选:C。
二.填空题(共3小题)
13.解:将过量的稀盐酸加入一定量的铁、铜混合物中,则铁与稀盐酸反应生成氯化亚铁,盐酸过量,则反应后溶液中溶质有氯化亚铁和氯化氢2种;
A、加入盐酸,则铁与盐酸反应产生氢气,当铁完全反应,氢气的质量不再增加,故A选项正确;
B、铜不与稀盐酸反应,故固体质量不会减小到0,故B选项错误;
C、铁与盐酸反应生成氯化亚铁溶解在溶液中,固体质量减小,铜不与盐酸反应,故还有剩余,故C选项正确;
故填:2;B。
14.解:(1)黄铜是铜锌合金,其硬度比纯铜大;
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的水和氧气;
(3)A、由于金属的活动性强弱是:镁>锌>铁,由图象可知,金属X是Mg,Y是锌,Z是铁,故A错误;
B、24份质量的镁会生成2份质量的氢气,56份质量的铁会生成2份质量的氢气,65份质量的锌会生成2份质量的氢气,结合图象可知,反应后可能已经反应完的金属是Zn、Fe,X、Y生成氢气的质量相同,则金属Mg一定有剩余,故B正确;
C、由上述分析可知,反应后可能没有剩余的金属是锌和铁,故C正确。
故答案为:(1)大。
(2)水和氧气。
(3)BC。
15.解:锌的金属活动性比银、铜、铁强,往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为mg的锌粉,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,锌再能与Cu(NO3)2反应生成硝酸锌和铜,Cu(NO3)2反应完,锌再能与Fe(NO3)2反应生成硝酸锌和铁。
bc段发生的是锌与硝酸铜溶液的反应,则bc段(不含两端点)析出的金属是铜。
ab段,发生的是锌与硝酸银溶液的反应,(不含两端点)对应溶液中含有的金属离子为银离子、铜离子、亚铁离子、锌离子。
bc段发生的是锌与硝酸银溶液的反应,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu,每65份质量的锌可置换出64份质量的铜。cd段发生的是锌与硝酸亚铁反应生成硝酸锌和铁,反应的化学方程式为Zn+Fe(NO3)2═Zn(NO3)2+Fe,每65份质量的锌可置换出56份质量的铜。若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1小于m2。
故答案为:
铜;银离子、铜离子、亚铁离子、锌离子;小于。
三.解答题(共2小题)
16.解:(1)由于锌和铁在与盐酸反应时得到的盐溶液中金属元素的化合价都是+2价,化合价相同时相对原子质量越小产生氢气质量越多,相对原子质量越大产生氢气质量越少,所以铁产生氢气比锌多,所以X是铁;
(2)金属活动性越强,反应速度越快,用的时间就越短,所以最先到达最高点的说明该金属活泼.
故答案为:(1)铁;等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多;(2)锌比铁活泼.
17.解:(1)锌的金属活动性比银、铜强,向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2反应生成硝酸锌和铜。a点溶液中,硝酸银有剩余,a点溶液中溶质是硝酸银、硝酸铜、硝酸锌,其化学式为AgNO3、Cu(NO3)2和Zn(NO3)2。
(2)bc段反应发生的是锌与硝酸铜反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu。
(3)Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少;锌与硝酸铜溶液反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu,每65份质量的锌可置换出64份质量的铜,溶液的质量会增大。最终减小的质量大于增大的质量,溶液质量减小,d点溶液质量小于反应前溶液质量。
故答案为:
(1)AgNO3、Cu(NO3)2和Zn(NO3)2;
(2
)Zn+Cu(NO3)2═Zn(NO3)2+Cu;
(3)Zn与AgNO3溶液反应,溶液质量减小,Zn与Cu(NO3)2溶液反应,溶液质量增大,最终减小的质量大于增大的质量,溶液质量减小。
一.选择题(共12小题)
1.向等质量的相同的稀硫酸中分别加入足量的镁条、铁片、锌粒,有关量的关系图象如下,其中正确的是( )
A.
B.
C.
D.
2.等质量的A、B、C三种金属的粉末,与足量的等浓度稀硫酸反应(A、B、C三种金属元素在生成物中都显+2价)生成H2的质量与时间的关系如图所示,下列说法错误的是( )
A.三种金属的活动性为B>A>C
B.生成氢气的质量:A>B>C
C.相对原子质量:A>B>C
D.消耗硫酸的质量:A>B>C
3.等质量的甲、乙两种金属分别与足量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是( )
A.乙金属的活动性一定大于甲金属
B.乙金属的相对原子质量一定大于甲金属
C.甲、乙两种金属可能分别为镁、锌
D.把横坐标“反应时间”改为“稀硫酸的质量”时,坐标中的曲线不会发生变化
4.在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示。下列表述正确的是( )
A.反应结束后稀硫酸一定都没有剩余
B.反应结束后消耗两种金属的质量相等
C.A表示铁和稀硫酸的反应曲线
D.反应结束后两种金属一定都有剩余
5.将质量相等的A、B、C三种金属(颗粒大小相同),同时分别放入三份溶质质量分数
相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论错误的是( )(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是A>B>C
B.金属活动性顺序是B>A>C
C.反应速率最大的是B
D.相对原子质量是B>C>A
6.向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量,酸溶液的质量与生成盐的质量关系如图所示,请根据题干和图象信息判断,下列说法正确的是( )
A.镁粉消耗稀盐酸的质量多
B.参加反应的稀盐酸的质量相等
C.生成盐的质量相等
D.铁粉与稀盐酸反应更快
7.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图所示。下列说法错误的是( )
A.a点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
B.d点所得溶液中的溶质为硝酸亚铁和硝酸锌
C.b点所得固体为银
D.c点所得固体为银、铁
8.向硝酸铜、硝酸银和硝酸亚铁的混合溶液的烧杯中,缓慢连续加入质量为m克的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系,如图所示。
①c点对应溶液中含有的金属离子为Zn2+和Cu2+
②b点对应溶液呈蓝色
③bc段(不含两端点)对应溶液中析出的金属是Fe
④ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+
⑤若bc段和cd段对应溶液中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1<m2
⑥若将d点的混合物过滤,滤渣一定有Zn、Fe、Cu和Ag
其中说法正确的个数有( )
A.1个
B.2
个
C.3
个
D.4
个
9.将质量相等的A,B,C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是(已知:A,B,C在生成物中均为+2价)( )
A.放出H2的质量是B>A>C
B.三种金属反应完所需要的时间相同
C.相对原子质量是A>B>C
D.反应结束时,A金属消耗的稀盐酸溶液质量最多
10.在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,某发生反应的质量关系如图所示,根据图中信息,下面推理合理的是( )
A.反应生成氢气质量:Mg=Fe=Zn
B.曲线P、Q、M所表示的金属分别表示Mg、Zn、Fe
C.三种金属反应速率:Mg>Fe>Zn
D.反应后溶液质量:Mg=Fe=Zn
11.向盛有一定质量稀盐酸酸的烧杯中加入过量的铝粉,下列4个图象中,能正确反映对应变化关系的个数是( )
A.4
B.3
C.2
D.1
12.将铜粉和铁粉的混合物mg放入烧杯中,向烧杯中不断加入FeCl3溶液,测得烧杯中剩余固体的质量与加入FeCl3溶液体积的关系如图所示。已知:铁和铜都能与FeCl3溶液发生反应,有关化学方程式为:①Fe+2FeCl3═3FeCl2
②Cu+2FeCl3═CuCl2+2FeCl2.下列说法正确的是( )
A.FeCl3与Cu发生的反应属于置换反应
B.M点溶液中一定含有FeCl2和CuCl2
C.加入V1mL
FeCl3,溶液时,Fe恰好完全反应
D.混合物中铁粉与铜粉的质量比为m:n
二.填空题(共3小题)
13.根据所学知识回答下列与金属材料有关的问题。
将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有 种。如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示不正确的是 (填标号)。
14.铜、铁、铝是生活中常见的金属,请回答:
(1)黄铜是铜锌合金,其硬度比纯铜 (选填“大”或“小”)。
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的 。
(3)用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 。(选填字母代号)
A.曲线X、Y、Z分别表示锌、铁、镁的反应情况
B.反应后一定有剩余的金属是镁
C.反应后可能没有剩余的金属是锌和铁
15.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为mg的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示。那么bc段(不含两端点)析出的金属是 ,ab段(不含两端点)对应溶液中含有的金属离子为 ,若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1 m2(选填“大于”“小于”或“等于”)。
三.解答题(共2小题)
16.将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:
(1)金属X是 ,判断的理由为 .
(2)从图中你还能获得的信息有 (答一条即可).
17.向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示。
(1)请写出a点溶液中溶质的化学式 。
(2)请写出bc段反应的化学方程式 。
(3)d点溶液质量小于反应前溶液质量,请解释原因 。
2021-2022学年浙教版科学金属与酸和盐反应图像专题
参考答案与试题解析
一.选择题(共12小题)
1.解:金属活动性顺序可知,三种金属镁最活泼,锌次之,铁最不活泼,所以镁与稀硫酸反应速率最快,锌次之,铁反应最慢,向等质量的相同的稀硫酸中分别加入足量的镁条、铁片、锌粒,金属是足量的,所以生成氢气的质量相等,通过分析可知,故选:B。
2.解:A、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内B放出氢气的质量大于A、大于C,可判断三种金属活动性顺序是B>A>C,故说法正确;
B、根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,故说法正确;
C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,因此可判断相对原子质量是C>B>A,故说法错误;
D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:A>B>C,故说法正确。
故选:C。
3.解:A、从图象中不难看出,金属乙的反应需要的时间短,说明金属乙的反应速率快,即金属乙的金属活动性强,金属乙比甲活泼,故A正确;
B、由于金属的化合价不确定,不能比较金属的相对原子质量,故B错误。
C、由于镁的活动定性大于铝,镁反应的时间短,故甲、乙两种金属不可能分别为镁、锌;故C错误。
D、由于金属与相同的酸反应时生成的氢气的质量相同,坐标中的曲线会发生变化;故D错误。
故选:A。
4.解:A、金属置换酸中的氢元素,由图象可知生成氢气的质量相等,硫酸均反应完,故A正确;
B、根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g铁生成2g氢气,根据化学方程式Zn+H2SO4═ZnSO4+H2↑,可知每65g锌反应生成2g氢气;由于生成氢气的质量相同,消耗金属的质量一定不相等,故B错误;
C、由于锌的活动性大于铁,生成相同质量的氢气,锌用的时间短,所以A表示锌和稀硫酸的反应曲线,故C错误;
D、由方程式分析可知:生成氢气的质量相等,反应消耗锌的质量较多,如果锌恰好反应,则铁有剩余;或者金属都有剩余,故错误。
故选:A。
5.解:A、根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,故A正确;
B、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内B放出氢气的质量大于A、大于C,可判断三种金属中B的活动性最强,其次是A,活动性最弱的是C,故B正确;
C、根据反应生成H2的质量与反应时间的关系图所示,等质量的三种金属B最先完全反应,因此反应速度最大的是B,故C正确;
D、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C,所以可判断相对原子质量是C>B>A,故D错误。
故选:D。
6.解:A、镁与稀盐酸反应生成盐的质量多,则镁粉消耗稀盐酸的质量多,故选项说法正确。
B、镁与稀盐酸反应生成盐的质量多,则镁粉消耗稀盐酸的质量多,故选项说法错误。
C、由图示可知,镁与稀盐酸反应生成盐的质量多,故选项说法错误。
D、镁的金属活动性比铁强,与稀盐酸反应反应更快,故选项说法错误。
故选:A。
7.解:A、向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,锌先与硝酸银反应,把硝酸银反应完了,再与硝酸亚铁反应,a点是锌与一部分硝酸银反应,锌与硝酸银反应生成银和硝酸锌,所以液中的溶质为硝酸银、硝酸亚铁和硝酸锌,故A正确;
B、d点是加入的锌粉过量,硝酸银和硝酸亚铁完全发生了反应,溶质为硝酸锌,故B错误;
C、b点是锌与硝酸银刚好反应完,所得固体为银,故C正确;
D、c点是锌与硝酸亚铁刚好反应完,所得固体为银、铁,故D正确。
故选:B。
8.解:由于金属的活动性顺序是:锌>铁>铜>银,向硝酸铜、硝酸银和硝酸亚铁的混合溶液的烧杯中,缓慢连续加入质量为m克的锌粉,锌先和硝酸银反应生成硝酸锌和银,再和硝酸铜反应生成硝酸锌和铜,最后和硝酸亚铁反应生成硝酸锌和铁。
①c点时锌和硝酸铜恰好完全反应,对应溶液中含有的金属离子为Zn2+和Fe2+,该选项说法不正确;
②b点对应溶液中含有硝酸铜、硝酸亚铁,溶液颜色应是蓝色和浅绿色的混合色,该选项说法不正确;
③bc段(不含两端点)析出的金属是Cu,该选项说法不正确;
④ab段(不含两端点)对应溶液中含有的金属离子为Ag+、Zn2+、Cu2+、Fe2+,该选项说法正确;
⑤锌和硝酸铜、硝酸亚铁反应的化学方程式及其质量关系为:
Zn+Cu(NO3)2=Zn(NO3)2+Cu,
65
64
Zn+Fe(NO3)2=Zn(NO3)2+Fe,
65
56
由以上质量关系可知,若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1<m2,该选项说法正确;
⑥由于d点时锌恰好反应,若将d点的混合物过滤,滤渣一定有Fe、Cu和Ag,该选项说法不正确。
故选:B。
9.解:A、由图象可知,完全反应后生成氢气的质量A>B>C,故不正确;
B、由图象可知,三种金属反应完所需要的时间不相同,B时间最短,A时间最长,故不正确;
C、三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是A>B>C;因此可判断相对原子质量是C>B>A,故不正确;
D、根据质量守恒定律可知,氢元素全部来自酸,生成氢气的质量A>B>C,所以反应结束时,A金属消耗的稀盐酸溶液质量最多,故正确。
故选:D。
10.解:A、相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,则最终生成的氢气的质量相等,正确;
B、与等质量的稀硫酸反应,开始消耗的锌的质量大,镁的质量小,故P是镁,Q是铁,M是锌,错误;
C、三种金属的活动性顺序为Mg>Zn>Fe,错误;
D、反应后溶液的质量为Zn>Fe>Mg,错误;
故选:A。
11.解:①稀盐酸为酸性溶液,开始时其pH小于7,故错误;
②烧杯中有稀盐酸,所以其溶质质量不能为零,故错误;
③加入铝粉之后,铝和稀盐酸马上开始反应生成氢气,直至将稀盐酸消耗完全,生成氢气的质量不再改变,起点应从零点开始,故错误;
④加入铝粉之后,铝和稀盐酸马上开始反应生成氯化铝,直至将稀盐酸消耗完全,生成氯化铝的质量不再改变,故正确。
故选:D。
12.解:在金属活动性顺序中,铁在铜的前面,铁能与铜盐溶液发生置换反应,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁优先与氯化铁发生反应生成氯化亚铁,然后铜与氯化铁反应生成氯化铜和氯化亚铁,所以:
A、FeCl3与Cu
发生的化学反应,由两种物质生成了一种物质,属于化合反应,不是置换反应,故A错误;
B、根据反应特点,铁金属活动性强于铜,所以是铁与氯化铁先反应,铁的相对分子质量小于铜的相对分子质量,因此铁与氯化铁质量减少幅度不如铜与氯化铁反应的大,故在M点时是铁正好与氯化铁反应完毕,此时溶液中不含有铜离子,故B错误;
C、当加入V1mL
FeCl3
溶液时,铁恰好完全反应,故C正确;
D、在M点时,铁全部反应,剩余固体全部为铜,所以铜质量ng,铜粉和铁粉的混合物mg,铁粉的质量为(m﹣n)g,铁粉与铜粉的质量比为(m﹣n):n,故D错误;
故选:C。
二.填空题(共3小题)
13.解:将过量的稀盐酸加入一定量的铁、铜混合物中,则铁与稀盐酸反应生成氯化亚铁,盐酸过量,则反应后溶液中溶质有氯化亚铁和氯化氢2种;
A、加入盐酸,则铁与盐酸反应产生氢气,当铁完全反应,氢气的质量不再增加,故A选项正确;
B、铜不与稀盐酸反应,故固体质量不会减小到0,故B选项错误;
C、铁与盐酸反应生成氯化亚铁溶解在溶液中,固体质量减小,铜不与盐酸反应,故还有剩余,故C选项正确;
故填:2;B。
14.解:(1)黄铜是铜锌合金,其硬度比纯铜大;
(2)“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的水和氧气;
(3)A、由于金属的活动性强弱是:镁>锌>铁,由图象可知,金属X是Mg,Y是锌,Z是铁,故A错误;
B、24份质量的镁会生成2份质量的氢气,56份质量的铁会生成2份质量的氢气,65份质量的锌会生成2份质量的氢气,结合图象可知,反应后可能已经反应完的金属是Zn、Fe,X、Y生成氢气的质量相同,则金属Mg一定有剩余,故B正确;
C、由上述分析可知,反应后可能没有剩余的金属是锌和铁,故C正确。
故答案为:(1)大。
(2)水和氧气。
(3)BC。
15.解:锌的金属活动性比银、铜、铁强,往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为mg的锌粉,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,锌再能与Cu(NO3)2反应生成硝酸锌和铜,Cu(NO3)2反应完,锌再能与Fe(NO3)2反应生成硝酸锌和铁。
bc段发生的是锌与硝酸铜溶液的反应,则bc段(不含两端点)析出的金属是铜。
ab段,发生的是锌与硝酸银溶液的反应,(不含两端点)对应溶液中含有的金属离子为银离子、铜离子、亚铁离子、锌离子。
bc段发生的是锌与硝酸银溶液的反应,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu,每65份质量的锌可置换出64份质量的铜。cd段发生的是锌与硝酸亚铁反应生成硝酸锌和铁,反应的化学方程式为Zn+Fe(NO3)2═Zn(NO3)2+Fe,每65份质量的锌可置换出56份质量的铜。若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1小于m2。
故答案为:
铜;银离子、铜离子、亚铁离子、锌离子;小于。
三.解答题(共2小题)
16.解:(1)由于锌和铁在与盐酸反应时得到的盐溶液中金属元素的化合价都是+2价,化合价相同时相对原子质量越小产生氢气质量越多,相对原子质量越大产生氢气质量越少,所以铁产生氢气比锌多,所以X是铁;
(2)金属活动性越强,反应速度越快,用的时间就越短,所以最先到达最高点的说明该金属活泼.
故答案为:(1)铁;等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多;(2)锌比铁活泼.
17.解:(1)锌的金属活动性比银、铜强,向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2反应生成硝酸锌和铜。a点溶液中,硝酸银有剩余,a点溶液中溶质是硝酸银、硝酸铜、硝酸锌,其化学式为AgNO3、Cu(NO3)2和Zn(NO3)2。
(2)bc段反应发生的是锌与硝酸铜反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu。
(3)Zn+2AgNO3═Zn(NO3)2+2Ag,由反应时的质量比可知,每65份质量的锌可置换出216份质量的银,溶液的质量会减少;锌与硝酸铜溶液反应生成硝酸锌和铜,反应的化学方程式为Zn+Cu(NO3)2═Zn(NO3)2+Cu,每65份质量的锌可置换出64份质量的铜,溶液的质量会增大。最终减小的质量大于增大的质量,溶液质量减小,d点溶液质量小于反应前溶液质量。
故答案为:
(1)AgNO3、Cu(NO3)2和Zn(NO3)2;
(2
)Zn+Cu(NO3)2═Zn(NO3)2+Cu;
(3)Zn与AgNO3溶液反应,溶液质量减小,Zn与Cu(NO3)2溶液反应,溶液质量增大,最终减小的质量大于增大的质量,溶液质量减小。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
