高中化学苏教版(2019)必修第二册 专题9 本专题知识体系构建与核心素养解读(33张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题9 本专题知识体系构建与核心素养解读(33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 794.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-26 17:11:29 | ||
图片预览






文档简介
(共33张PPT)
本专题知识体系构建与核心素养解读
知识体系构建
核心素养解读
内
容
索
引
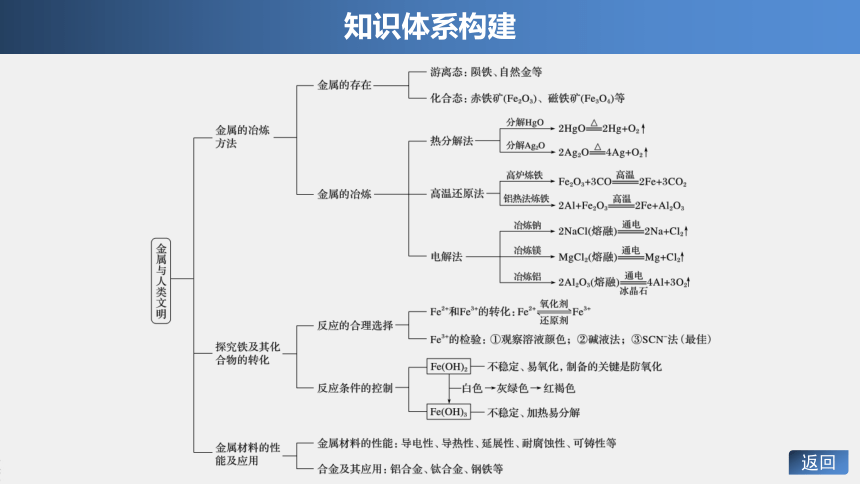
知识体系构建
返回
核心素养解读
通过本专题的学习,结合真实情境中的应用实例和通过实验探究,知道铁及其重要化合物的主要性质,了解它们在生产、生活中的应用。能从物质分类、化合价的角度归纳铁、铁盐、亚铁盐的相互转化关系。
能依据金属及其化合物的性质提出物质间的转化思路;能从多个方面对可能的转化路径进行优选;能运用变量控制方法设计转化的实验方案,根据实验现象进行推理。
能联系合金的组成解释合金性质,认识合金对人类社会的贡献,能用简单实验控制反应的条件,制备Fe(OH)2,能设计简单实验检验Fe2+、Fe3+。
例1 (2020·金山中学高一期末)为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是
选项
实验操作
实验现象
离子反应
实验结论
A
在氯化亚铁溶液中滴加新制氯水
浅绿色溶液变成棕黄色溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe2+具有氧化性
B
在氯化亚铁溶液中加入锌片
浅绿色溶液变成无色溶液
Fe2++Zn===Fe
+Zn2+
Fe2+具有氧化性
C
在氯化铁溶液中加入铁粉
棕黄色溶液变成浅绿色溶液
Fe3++Fe===2Fe2+
铁单质具有
还原性
D
在氯化铁溶液中加入铜粉
棕黄色溶液变成蓝色溶液
2Fe3++Cu===2Fe2++Cu2+
Fe3+具有还原性
√
解析 Fe2+具有还原性,在氯化亚铁溶液中滴加新制氯水,Fe2+被氯水氧化生成Fe3+,溶液由浅绿色变成棕黄色,故A错误;
Fe2+具有氧化性,Zn具有还原性,在氯化亚铁溶液中加入锌片,锌与Fe2+发生置换反应生成Fe和无色的Zn2+,溶液由浅绿色变成无色,故B正确;
氯化铁溶液与铁粉反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe===3Fe2+,故C错误;
氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,反应前氯化铁溶液为棕黄色,反应后氯化亚铁溶液为浅绿色,氯化铜溶液为淡蓝色,氯化亚铁和氯化铜的混合溶液为蓝绿色,说明Fe3+具有氧化性,故D错误。
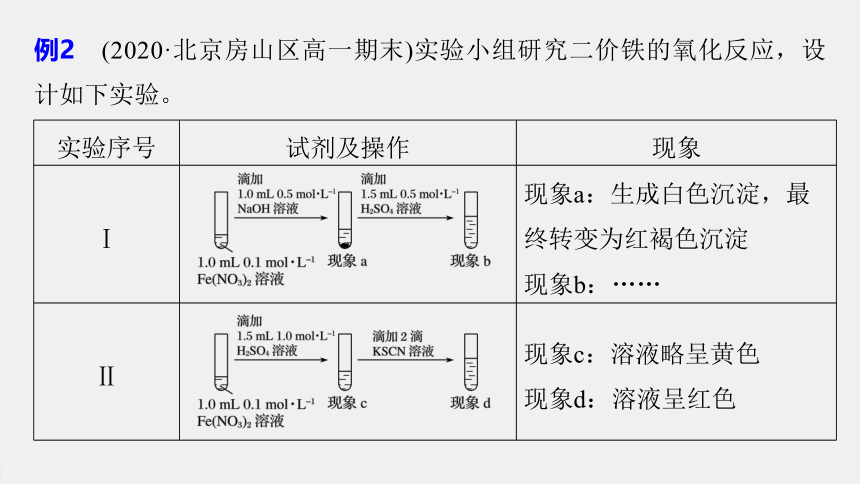
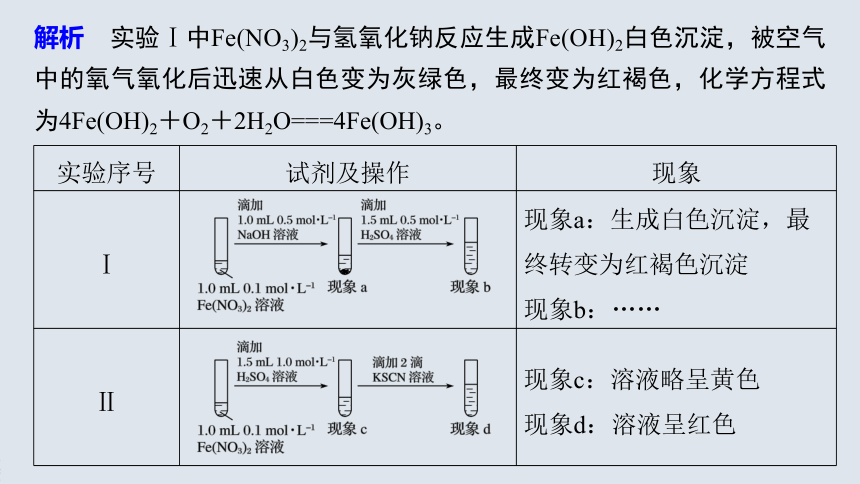
例2 (2020·北京房山区高一期末)实验小组研究二价铁的氧化反应,设计如下实验。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
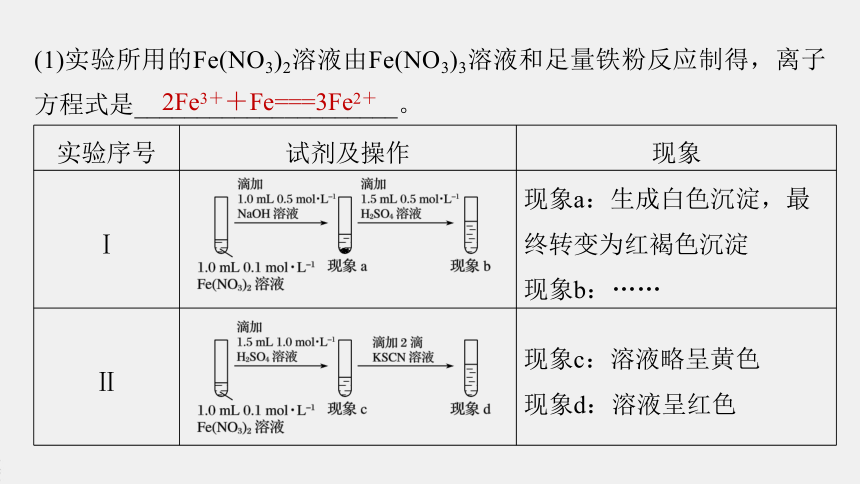
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是_____________________。
2Fe3++Fe===3Fe2+
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
解析 Fe3+与Fe发生氧化还原反应生成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
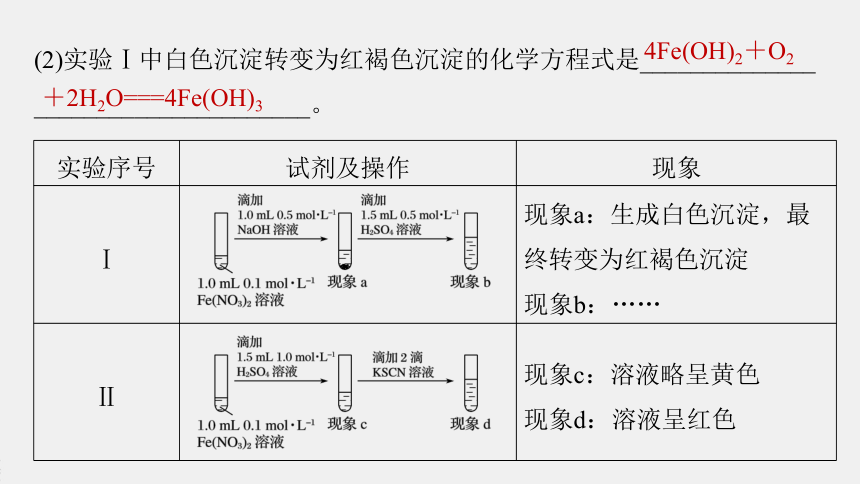
(2)实验Ⅰ中白色沉淀转变为红褐色沉淀的化学方程式是______________
______________________。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
4Fe(OH)2+O2
+2H2O===4Fe(OH)3
解析 实验Ⅰ中Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被空气中的氧气氧化后迅速从白色变为灰绿色,最终变为红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
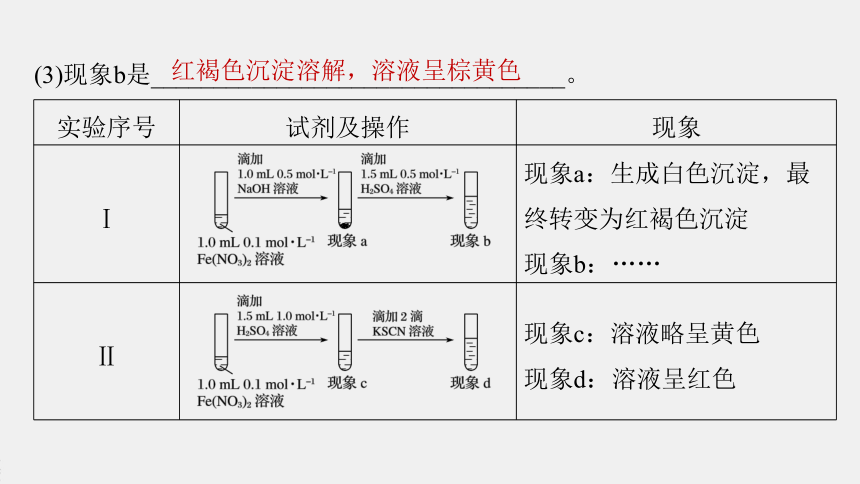
(3)现象b是_________________________________。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
红褐色沉淀溶解,溶液呈棕黄色
解析 Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被氧化变为红褐色沉淀Fe(OH)3,加入硫酸溶液后发生酸碱中和反应,红褐色沉淀溶解,溶液变为棕黄色。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(4)实验小组对实验Ⅱ中何种物质氧化Fe2+进行研究,提出两种假设:
ⅰ.酸性条件下,O2氧化了Fe2+;
ⅱ.酸性条件下,_________________。
①将假设ⅱ补充完整。
实验序号
试剂及操作
现象
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
②设计实验,证实了假设ⅰ不是实验Ⅱ中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0
mL____________________溶液中滴加1.5
mL
1.0
mol·L-1
H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到________________。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
实验序号
试剂及操作
现象
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
0.1
mol·L-1
FeSO4
溶液无明显变化
解析 根据控制变量法可知,要证明氧化剂为氧气,需要排除硝酸根离子的干扰,因此,可以改为向1.0
mL
0.1
mol·L-1
FeSO4溶液中滴加1.5
mL
1.0
mol·L-1H2SO4溶液。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(5)综合题述实验,说明二价铁的氧化反应与________________________
_______________________因素有关。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
溶液酸碱性强弱、氧化剂种
类及二价铁的存在形式等
解析 根据实验的过程和实验现象可知,二价铁的氧化反应与溶液的酸碱性、氧化剂种类及二价铁的存在形式等因素有关。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
例3 “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
①打开这种药片的密封膜,发现其外观为淡黄色;
②将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,溶液立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐;
③学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐,而是亚铁盐。
④为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是_____同学的结论,另一同学判断出错的原因是_____________________________。
乙
亚铁盐在空气中易被氧气氧化
(2)丙的实验①说明维生素C具有较强的______(填“氧化”或“还原”)性。
(3)写出与②中现象对应的离子方程式:____________________________。
(4)关于③中的实验现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了。请你设计一个实验方案以确认哪种假设更合理:________________________
___________________________________________________________________。
还原
2Fe2++Cl2===2Fe3++2Cl-
再加过量的KSCN溶液,如果溶液变红色,则第二种假设合理;如果溶液不变色,则第一种假设合理
例4 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁
__________________________________________________________________________________________________________________________________________________。
在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中滴加氯水,溶液变红,可以证明绿矾中的铁是二价铁而不是三价铁
解析 证明绿矾中的铁是二价铁而不是三价铁的方法是在试管中加入少量绿矾样品,加水溶解,然后滴加KSCN溶液,溶液颜色无明显变化,说明溶液中无Fe3+,然后再向试管中滴加氯水,溶液变红就证明滴加氯水后反应产生了Fe3+,从而可以证明绿矾中的铁是二价铁而不是三价铁。
(2)为测定绿矾中结晶水的含量,将石英玻璃管(两端带开关K1和K2,设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为m2
g。按如图连接好装置进行实验。
①仪器B的名称是________。
干燥管
解析 由仪器的图形可知B为干燥管;
②将下列实验操作步骤正确排序___________(填字母);重复上述操作步骤,直至A恒重,记为m3
g。
a.点燃酒精灯,加热
b.打开K1和K2,缓缓通入N2
c.关闭K1和K2
d.熄灭酒精灯
e.称量A
f.冷却到室温
badfce
解析 实验时,为避免样品被氧化,应先打开K1和K2,缓缓通入N2,排出装置中的空气,防止空气中水蒸气的干扰,然后点燃酒精灯,使绿矾发生分解反应,待物质完全分解后,熄灭酒精灯,冷却至室温,关闭K1和K2,再称量固体质量的变化,则正确的顺序为badfce;
③根据实验记录,计算绿矾化学式中结晶水数目x=___________(列式表示)。若实验时按a、b次序操作,则使x________(填“偏大”“偏小”或“无影响”)。
偏小
解析 直至A恒重,记为m3
g,应为FeSO4和装置的质量,
则m(FeSO4)=(m3-m1)g,m(H2O)=(m2-m3)g,
若实验时按a、b次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。已知:SO2可使品红溶液褪色。
①C中的溶液为BaCl2,其作用是________________。D溶液为_________,D中可观察到的现象为_____________。
检验生成的SO3
品红溶液
品红溶液褪色
解析 实验后反应管中残留固体为红色粉末,说明FeSO4分解生成Fe2O3,反应中Fe元素化合价升高,则S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡溶液,用于检验SO3,SO3溶于水生成H2SO4,H2SO4与BaCl2溶液反应产生BaSO4白色沉淀,D为品红溶液,可用于检验SO2,观察到品红溶液褪色;
②写出硫酸亚铁高温分解反应的化学方程式:________________________
_________。
+SO3↑
解析 硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,利用电子守恒、原子守恒,可得该反应的化学方程式为2FeSO4
Fe2O3+SO2↑+SO3↑;
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该实验装置的措施:
________________________________________。
加一个装有氢氧化钠溶液的尾气处理装置
解析 该反应分解产生的SO3、SO2都是大气污染物,因此该实验装置存在一定缺陷,完善该实验装置的措施是在装置D后面加一个装有氢氧化钠溶液的尾气处理装置,用来吸收SO3、SO2,避免污染环境。
返回
本课结束
本专题知识体系构建与核心素养解读
知识体系构建
核心素养解读
内
容
索
引
知识体系构建
返回
核心素养解读
通过本专题的学习,结合真实情境中的应用实例和通过实验探究,知道铁及其重要化合物的主要性质,了解它们在生产、生活中的应用。能从物质分类、化合价的角度归纳铁、铁盐、亚铁盐的相互转化关系。
能依据金属及其化合物的性质提出物质间的转化思路;能从多个方面对可能的转化路径进行优选;能运用变量控制方法设计转化的实验方案,根据实验现象进行推理。
能联系合金的组成解释合金性质,认识合金对人类社会的贡献,能用简单实验控制反应的条件,制备Fe(OH)2,能设计简单实验检验Fe2+、Fe3+。
例1 (2020·金山中学高一期末)为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是
选项
实验操作
实验现象
离子反应
实验结论
A
在氯化亚铁溶液中滴加新制氯水
浅绿色溶液变成棕黄色溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe2+具有氧化性
B
在氯化亚铁溶液中加入锌片
浅绿色溶液变成无色溶液
Fe2++Zn===Fe
+Zn2+
Fe2+具有氧化性
C
在氯化铁溶液中加入铁粉
棕黄色溶液变成浅绿色溶液
Fe3++Fe===2Fe2+
铁单质具有
还原性
D
在氯化铁溶液中加入铜粉
棕黄色溶液变成蓝色溶液
2Fe3++Cu===2Fe2++Cu2+
Fe3+具有还原性
√
解析 Fe2+具有还原性,在氯化亚铁溶液中滴加新制氯水,Fe2+被氯水氧化生成Fe3+,溶液由浅绿色变成棕黄色,故A错误;
Fe2+具有氧化性,Zn具有还原性,在氯化亚铁溶液中加入锌片,锌与Fe2+发生置换反应生成Fe和无色的Zn2+,溶液由浅绿色变成无色,故B正确;
氯化铁溶液与铁粉反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe===3Fe2+,故C错误;
氯化铁溶液与铜粉反应生成氯化亚铁和氯化铜,反应前氯化铁溶液为棕黄色,反应后氯化亚铁溶液为浅绿色,氯化铜溶液为淡蓝色,氯化亚铁和氯化铜的混合溶液为蓝绿色,说明Fe3+具有氧化性,故D错误。
例2 (2020·北京房山区高一期末)实验小组研究二价铁的氧化反应,设计如下实验。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(1)实验所用的Fe(NO3)2溶液由Fe(NO3)3溶液和足量铁粉反应制得,离子方程式是_____________________。
2Fe3++Fe===3Fe2+
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
解析 Fe3+与Fe发生氧化还原反应生成Fe2+,离子方程式为2Fe3++Fe===3Fe2+。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(2)实验Ⅰ中白色沉淀转变为红褐色沉淀的化学方程式是______________
______________________。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
4Fe(OH)2+O2
+2H2O===4Fe(OH)3
解析 实验Ⅰ中Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被空气中的氧气氧化后迅速从白色变为灰绿色,最终变为红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(3)现象b是_________________________________。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
红褐色沉淀溶解,溶液呈棕黄色
解析 Fe(NO3)2与氢氧化钠反应生成Fe(OH)2白色沉淀,被氧化变为红褐色沉淀Fe(OH)3,加入硫酸溶液后发生酸碱中和反应,红褐色沉淀溶解,溶液变为棕黄色。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(4)实验小组对实验Ⅱ中何种物质氧化Fe2+进行研究,提出两种假设:
ⅰ.酸性条件下,O2氧化了Fe2+;
ⅱ.酸性条件下,_________________。
①将假设ⅱ补充完整。
实验序号
试剂及操作
现象
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
②设计实验,证实了假设ⅰ不是实验Ⅱ中氧化Fe2+的主要原因。将实验方案和现象补充完整。
步骤1:向1.0
mL____________________溶液中滴加1.5
mL
1.0
mol·L-1
H2SO4溶液;
步骤2:向上述所得溶液中滴加KSCN溶液,观察到________________。
③向步骤2所得溶液中滴加NaOH溶液至pH约为5,检测到有Fe3+产生。
实验序号
试剂及操作
现象
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
0.1
mol·L-1
FeSO4
溶液无明显变化
解析 根据控制变量法可知,要证明氧化剂为氧气,需要排除硝酸根离子的干扰,因此,可以改为向1.0
mL
0.1
mol·L-1
FeSO4溶液中滴加1.5
mL
1.0
mol·L-1H2SO4溶液。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
(5)综合题述实验,说明二价铁的氧化反应与________________________
_______________________因素有关。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
溶液酸碱性强弱、氧化剂种
类及二价铁的存在形式等
解析 根据实验的过程和实验现象可知,二价铁的氧化反应与溶液的酸碱性、氧化剂种类及二价铁的存在形式等因素有关。
实验序号
试剂及操作
现象
Ⅰ
?
现象a:生成白色沉淀,最终转变为红褐色沉淀
现象b:……
Ⅱ
?
现象c:溶液略呈黄色
现象d:溶液呈红色
例3 “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
①打开这种药片的密封膜,发现其外观为淡黄色;
②将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,溶液立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐;
③学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐,而是亚铁盐。
④为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是_____同学的结论,另一同学判断出错的原因是_____________________________。
乙
亚铁盐在空气中易被氧气氧化
(2)丙的实验①说明维生素C具有较强的______(填“氧化”或“还原”)性。
(3)写出与②中现象对应的离子方程式:____________________________。
(4)关于③中的实验现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了。请你设计一个实验方案以确认哪种假设更合理:________________________
___________________________________________________________________。
还原
2Fe2++Cl2===2Fe3++2Cl-
再加过量的KSCN溶液,如果溶液变红色,则第二种假设合理;如果溶液不变色,则第一种假设合理
例4 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁
__________________________________________________________________________________________________________________________________________________。
在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中滴加氯水,溶液变红,可以证明绿矾中的铁是二价铁而不是三价铁
解析 证明绿矾中的铁是二价铁而不是三价铁的方法是在试管中加入少量绿矾样品,加水溶解,然后滴加KSCN溶液,溶液颜色无明显变化,说明溶液中无Fe3+,然后再向试管中滴加氯水,溶液变红就证明滴加氯水后反应产生了Fe3+,从而可以证明绿矾中的铁是二价铁而不是三价铁。
(2)为测定绿矾中结晶水的含量,将石英玻璃管(两端带开关K1和K2,设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为m2
g。按如图连接好装置进行实验。
①仪器B的名称是________。
干燥管
解析 由仪器的图形可知B为干燥管;
②将下列实验操作步骤正确排序___________(填字母);重复上述操作步骤,直至A恒重,记为m3
g。
a.点燃酒精灯,加热
b.打开K1和K2,缓缓通入N2
c.关闭K1和K2
d.熄灭酒精灯
e.称量A
f.冷却到室温
badfce
解析 实验时,为避免样品被氧化,应先打开K1和K2,缓缓通入N2,排出装置中的空气,防止空气中水蒸气的干扰,然后点燃酒精灯,使绿矾发生分解反应,待物质完全分解后,熄灭酒精灯,冷却至室温,关闭K1和K2,再称量固体质量的变化,则正确的顺序为badfce;
③根据实验记录,计算绿矾化学式中结晶水数目x=___________(列式表示)。若实验时按a、b次序操作,则使x________(填“偏大”“偏小”或“无影响”)。
偏小
解析 直至A恒重,记为m3
g,应为FeSO4和装置的质量,
则m(FeSO4)=(m3-m1)g,m(H2O)=(m2-m3)g,
若实验时按a、b次序操作,会导致硫酸亚铁被氧化,则导致固体质量偏大,测定结果偏小。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。已知:SO2可使品红溶液褪色。
①C中的溶液为BaCl2,其作用是________________。D溶液为_________,D中可观察到的现象为_____________。
检验生成的SO3
品红溶液
品红溶液褪色
解析 实验后反应管中残留固体为红色粉末,说明FeSO4分解生成Fe2O3,反应中Fe元素化合价升高,则S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡溶液,用于检验SO3,SO3溶于水生成H2SO4,H2SO4与BaCl2溶液反应产生BaSO4白色沉淀,D为品红溶液,可用于检验SO2,观察到品红溶液褪色;
②写出硫酸亚铁高温分解反应的化学方程式:________________________
_________。
+SO3↑
解析 硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,利用电子守恒、原子守恒,可得该反应的化学方程式为2FeSO4
Fe2O3+SO2↑+SO3↑;
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该实验装置的措施:
________________________________________。
加一个装有氢氧化钠溶液的尾气处理装置
解析 该反应分解产生的SO3、SO2都是大气污染物,因此该实验装置存在一定缺陷,完善该实验装置的措施是在装置D后面加一个装有氢氧化钠溶液的尾气处理装置,用来吸收SO3、SO2,避免污染环境。
返回
本课结束
