高中化学苏教版(2019)必修第二册 专题9 第二单元 第2课时 反应条件的控制(61张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题9 第二单元 第2课时 反应条件的控制(61张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 976.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-26 00:00:00 | ||
图片预览










文档简介
(共61张PPT)
第2课时 反应条件的控制
1.通过实验掌握Fe(OH)2的制备原理及化学性质。
2.在制备物质时,学会合理选择并控制好反应的条件。
核心素养发展目标
反应条件的控制
随堂演练 知识落实
课时对点练
内
容
索
引
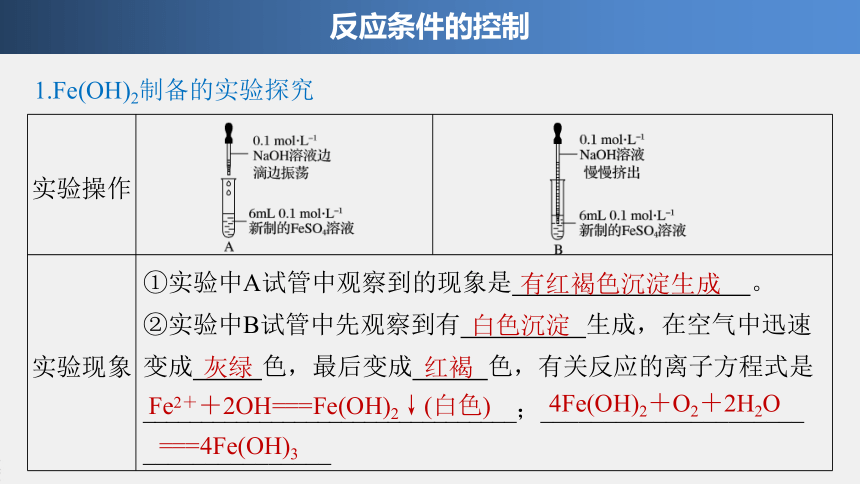
1.Fe(OH)2制备的实验探究
反应条件的控制
实验操作
?
?
实验现象
①实验中A试管中观察到的现象是
。
②实验中B试管中先观察到有
生成,在空气中迅速变成
色,最后变成
色,有关反应的离子方程式是
________________________________;_____________________
_______________
有红褐色沉淀生成
白色沉淀
灰绿
红褐
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O
===4Fe(OH)3
实验结论
在不同的反应条件下,FeSO4溶液与NaOH溶液反应的实验现象不同,得到的产物也不同
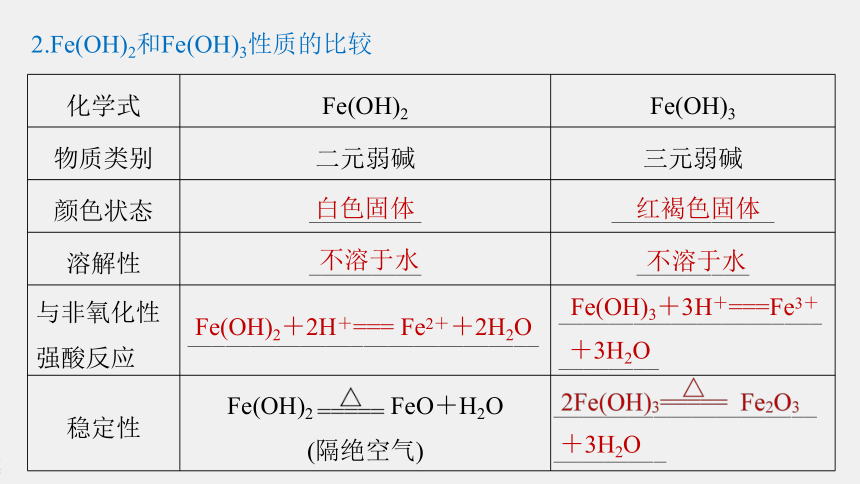
2.Fe(OH)2和Fe(OH)3性质的比较
化学式
Fe(OH)2
Fe(OH)3
物质类别
二元弱碱
三元弱碱
颜色状态
_________
_____________
溶解性
_________
_________
与非氧化性强酸反应
____________________________
_____________________________
稳定性
Fe(OH)2
FeO+H2O
(隔绝空气)
_____________________
_________
白色固体
红褐色固体
Fe(OH)2+2H+===
Fe2++2H2O
不溶于水
Fe(OH)3+3H+===Fe3+
+3H2O
+3H2O
不溶于水
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
(2)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(3)Fe(OH)3不能利用化合反应生成( )
(4)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
判断正误
×
×
×
√
1.Fe3O4中Fe有+2、+3两种价态,可表示成FeO·Fe2O3形式,请类比写出Fe4O5的表示形式。
提示 2FeO·Fe2O3
深度思考
2.氢氧化亚铁制备实验的改进
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过____________,目的是_________________。
加热煮沸
赶走溶解的氧气
(2)在FeSO4溶液表面覆盖一层苯,作用是___________________。
隔绝空气中的氧气
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是_______________。
稀H2SO4、铁屑
(4)在试管Ⅱ里加入的试剂是____________。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_______________________________________________
______________________。
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的
空气后,再关闭止水夹a
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________
______________________________。
试管Ⅰ中反应生成的H2充满了试管Ⅰ和
试管Ⅱ,且外界空气不容易进入
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
归纳总结
返回
1.下列物质反应后一定有+3价铁生成的是
A.过量的Fe与Cl2反应
B.Fe与过量稀硫酸反应
C.CuCl2溶液中加入过量Fe
D.足量Fe和Fe2O3的混合物溶于盐酸中
1
2
3
随堂演练 知识落实
4
√
解析 A项,Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原;
B项,Fe与稀硫酸反应只能生成Fe2+;
C项,在溶液中Fe被Cu2+氧化为Fe2+;
D项,首先Fe与盐酸反应生成FeCl2,Fe2O3与盐酸反应生成FeCl3,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
1
2
3
4
2.铁有+2价和+3价两种价态,下列反应中不涉及铁元素价态变化的是
A.用还原铁粉除去氯化亚铁溶液中的少许氯化铁杂质
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
1
2
3
4
√
解析 氢氧化铁受热分解得到氧化铁和水,是非氧化还原反应,铁元素价态不变。其他选项都涉及氧化还原反应,铁元素价态发生变化。
3.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,除加硫酸防止生成Fe(OH)2外,还需加入_______。
(2)除去蒸馏水中溶解的O2,常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下,再慢慢挤出NaOH溶液。这样操作的理由是_____________________________________________。
1
2
3
4
铁屑
煮沸
避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀
4.化合物A、B组成元素相同,且B为白色。C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的NaOH溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。回答下列问题:
(1)写出各物质的化学式:
A:________、B:________、C:________、D:________。
解析 解答本题的关键是抓住C与NaOH溶液反应的特征现象,确定A是Fe(OH)3,C是FeSO4,B是Fe(OH)2,D是Fe2O3。
Fe(OH)3
Fe(OH)2
FeSO4
Fe2O3
1
2
3
4
(2)写出B转化为A的化学方程式:
________________________________。
写出A受热分解的化学方程式:
___________________________。
1
2
3
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 反应条件对产物的影响
1.在一定条件下,铁与有关物质的反应所得产物错误的是
A组 基础对点练
√
解析 Cl2是强氧化剂,可将Fe氧化成FeCl3,故A正确;
S是弱氧化剂,可将Fe氧化成FeS,故B正确;
Fe与H2O(g)反应生成Fe3O4,而不是Fe(OH)3,故C错误;
Fe在O2中燃烧生成Fe3O4,故D正确。
1
2
3
4
5
6
7
8
9
2.下列叙述不正确的是
1
2
3
4
5
6
7
8
9
选项
被提纯物质
杂质
除杂试剂或方法
A
FeCl3溶液
FeCl2
通入适量Cl2
B
FeCl2溶液
FeCl3
加入过量铁粉并过滤
C
铜粉
铁粉
加入过量盐酸并过滤
D
Fe(OH)3
Fe(OH)2
在空气中灼烧
√
解析 FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;
Fe(OH)3、Fe(OH)2受热都易分解,D错误。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
3.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是
√
解析 B项中CCl4密度大,应在下层,不能长时间观察到白色沉淀;
D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
4.(2020·云南峨山一中月考)为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
1
2
3
4
5
6
7
8
9
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A________,B_______________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A:_____________________________;
A→B:____________________。
血红色
不变(浅绿色)
Fe2O3+6HCl===2FeCl3+3H2O
Fe+2FeCl3===3FeCl2
1
2
3
4
5
6
7
8
9
(3)B→C可看到的现象是__________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_________效应。
白色沉淀迅速变为灰绿色最终转变为红褐色
Fe(OH)3
丁达尔
5.(2020·天津市蓟州区联考)电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
1
2
3
4
5
6
7
8
9
(1)步骤Ⅰ的操作名称:______;所需玻璃仪器:______、________、________。
1
2
3
4
5
6
7
8
9
过滤
烧杯
漏斗
玻璃棒
解析 废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向FeCl2滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:________________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:_______________,实验现象:________________________。
1
2
3
4
5
6
7
8
9
2Fe3++Cu===2Fe2++Cu2+
硫氰化钾溶液
溶液由棕黄色变为血红色
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
_____________________________________________________________,
此转化的化学方程式为__________________________________________
__________________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:____________________________。
1
2
3
4
5
6
7
8
9
先产生白色絮状沉淀,然后迅速变为灰绿色,最终变为红褐色
FeCl2+2NaOH===Fe(OH)2↓+2NaCl、
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe、Cu
2Fe2++Cl2===2Fe3++2Cl-
1
2
3
4
5
6
7
8
9
题组二 铁及其化合物之间的相互转化
6.右图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
锌粉
KSCN
D
Na2O2
MgCl2
Fe
KSCN
√
1
2
3
4
5
6
7
8
9
解析 Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
7.下列物质之间有如右反应关系:
已知E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
1
2
3
4
5
6
7
8
9
(1)写出下列物质的化学式:
A:________,B:_________,D:____________,甲:____________,乙:________________,丙:_________。
(2)写出E→C反应的化学方程式:________________________________。
Fe2O3
FeCl3
FeCl2
Cl2
NaOH(或KOH等)
KSCN
4Fe(OH)2+O2+2H2O===4Fe(OH)3
1
2
3
4
5
6
7
8
9
解析 E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色,则E为Fe(OH)2,C为Fe(OH)3,A为红棕色粉末,则A为Fe2O3,B为FeCl3,D为FeCl2,乙为NaOH(或KOH等),由D→B的转化可知,甲为氯气或新制氯水等,由血红色溶液可知,丙为KSCN溶液。
题组三 食品中的铁元素
8.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
实验
现象
结论
试管Ⅰ
试管Ⅱ
a
褪色
不变红
?
b
不褪色
变红
?
c
褪色
变红
?
(1)请你填出该同学实验中出现以下现象时应得出的结论:
没有变质
完全变质
部分变质
(2)能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:_______________________________________________________
_____________________。
1
2
3
4
5
6
7
8
9
不能,KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
9.(2020·北京东城区高一期末)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100
g黑木耳含铁量高达185
mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
1
2
3
4
5
6
7
8
9
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
1
2
3
4
5
6
7
8
9
(1)步骤②得到滤液A的操作是_________。
解析 不溶性固体和液体的分离可采用过滤的方法,因此步骤②得到滤液A的操作是过滤。
过滤
1
2
3
4
5
6
7
8
9
(2)步骤④检验Fe3+所用试剂是________溶液。
解析 一般用KSCN溶液检验铁离子,实验现象是溶液显红色,则步骤④检验Fe3+所用试剂是KSCN溶液。
KSCN
1
2
3
4
5
6
7
8
9
(3)下列有关上述实验得出的结论是________(填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
解析 根据步骤③中产生蓝色沉淀可知滤液A中含有亚铁离子,则白色沉淀中含有Fe(OH)2;
根据步骤④可知滤液A中含有铁离子,由于在灼烧过程中亚铁离子可能被氧化为铁离子,所以黑木耳中不一定含有铁离子,所以a错误,b、c正确。
bc
1
2
3
4
5
6
7
8
9
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
d
(4)可选做试剂B的物质是________(填字母)。
a.Na
b.Zn
c.Fe
d.Cu
1
2
3
4
5
6
7
8
9
解析 滤液A中含有铁离子,需要利用还原剂将其转化为亚铁离子,且不能再引入铁元素,也不能干扰亚铁离子与高锰酸钾的反应。金属钠在溶液中反应生成NaOH,NaOH与铁离子反应生成沉淀,得不到亚铁离子,a错误;
金属锌与铁离子、亚铁离子和高锰酸钾均反应,b错误;
金属铁和铁离子反应生成亚铁离子,但引入了铁元素,c错误;
金属铜与铁离子反应生成亚铁离子和铜离子,且不会影响亚铁离子与高锰酸钾的反应,d正确。
1
2
3
4
5
6
7
8
9
(5)步骤⑦中观察到的实验现象是__________________________,反应的离子方程式是__________________________________________。
酸性高锰酸钾溶液紫色褪去
解析 酸性高锰酸钾溶液与亚铁离子反应生成铁离子、锰离子和水,则步骤⑦中观察到的实验现象是酸性高锰酸钾溶液紫红色褪去,反应的离子方程式是5Fe2++
+8H+===5Fe3++Mn2++4H2O。
1
2
3
4
5
6
7
8
9
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是______________________________________________________。
黑木耳中还含有其他还原性物质(或黑木耳中还含有维生素C)
解析 由于黑木耳中含有其他还原性物质,如维生素C,导致消耗高锰酸钾溶液的体积增加,所以测得含铁量远大于实际的含量。
B组 综合强化练
1.(2020·湛江调研)联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广。其主要原因是
A.价格便宜,不易生锈
B.铁锅含有碳元素
C.烹调的食物中留有人体需要的铁元素
D.传热慢,保温性能好
1
2
3
4
5
6
7
√
解析 价格是物质用途需考虑的因素之一,但不是有益于健康的理由,铁锅为铁合金,易发生电化学腐蚀生锈,A项错误;
铁锅为铁的合金,主要成分为铁,还含有碳等其他元素,使用铁锅主要是获得铁元素,不是为了获得碳元素,B项错误;
使用铁锅烹调的食物中留有人体需要的铁元素,铁是合成血红蛋白的主要元素,缺乏会患贫血,C项正确;
铁合金具有良好的导热性能,但保温性能差,D项错误。
1
2
3
4
5
6
7
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是
A.Fe(OH)3;Fe2O3
B.Fe(OH)2;Fe2O3
C.Fe(OH)2;Fe(OH)3、Fe3O4
D.Fe2O3;Fe(OH)3
√
1
2
3
4
5
6
7
解析 铁与稀硫酸反应生成硫酸亚铁,当加入氨水时生成白色的氢氧化亚铁;氢氧化亚铁易被空气中的氧气氧化为红褐色的氢氧化铁,加热时氢氧化铁分解为红棕色的氧化铁。
3.(2020·贵州独山期末)某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能
制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
1
2
3
4
5
6
7
√
解析 Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;
搅拌可加速物质的溶解,故B正确;
由于胶体聚沉的条件,加热、搅拌、加入电解质等,故严格控制好条件,才能制得Fe(OH)3胶体,故C正确,D错误。
1
2
3
4
5
6
7
4.有关铁的化合物的说法中,错误的是
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被
氧化转变为红褐色
B.由图示操作可制取Fe(OH)2
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
1
2
3
4
5
6
7
√
解析 Fe(OH)2是一种白色固体,A错误;
煤油能减少FeSO4溶液与氧气接触,可以避免试管中部分氧气对氢氧化亚铁的氧化,B正确;
铁在氧气中燃烧可生成Fe3O4,可通过化合反应:4Fe(OH)2+2H2O+O2
===4Fe(OH)3来制取Fe(OH)3,C正确;
Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应,D正确。
1
2
3
4
5
6
7
5.下列中学常见实验的现象或表述正确的是
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,
滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅
拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上
层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发
皿中充分加热煮沸,然后冷却过滤,得固体物质为Cu(OH)2
√
1
2
3
4
5
6
7
解析 过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁,铁能和三价铁反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;
向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀物质,故B错误;
氧化铁和盐酸反应生成氯化铁溶液和水,三价铁遇KSCN溶液,会变血红色,故C正确;
CuSO4溶液中滴入过量NaOH溶液充分反应后,生成蓝色沉淀氢氧化铜,但是氢氧化铜受热容易分解,放入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质多为氧化铜,故D错误。
1
2
3
4
5
6
7
6.(2020·辽宁滨海实验中学期末)铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
1
2
3
4
5
6
7
试回答下列问题:
(1)试剂1是___________,试剂2是______________,加入新制氯水后溶液中发生反应的离子方程式是_____________________________、____________________________。
稀盐酸
KSCN溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
解析 该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;
试剂2用于检验三价铁离子,可以选用KSCN溶液;
氯气氧化亚铁离子生成铁离子,离子方程式为2Fe2++Cl2===2Fe3++2Cl-;
铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为Fe3++3SCN-===Fe(SCN)3。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为______________________,写出+2价Fe在空气中转化为+3价Fe的化学方程式:
_________________________________。
少量的Fe2+转化为Fe3+
4FeCl2+O2+4HCl===4FeCl3+2H2O
解析 Fe3+遇KSCN溶液变血红色,溶液由淡黄色变为浅红色,说明少量Fe2+被氧化成Fe3+;
亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2===4FeCl3+2H2O。
1
2
3
4
5
6
7
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?___________。若你认为合理,请说明理由(若你认为不合理,该空不作答)_______;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)_________________________________________________________________________________________________________________________________________。
不合理
猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色(或在褪色后的溶液中加入KSCN溶液,变血红色)
解析 因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;
可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变血红色)。
1
2
3
4
5
6
7
7.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6
mol·L-1的硫酸,其他试剂任选。
填写下列空白:
1
2
3
4
5
6
7
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是___________________________。
铁屑
Fe+2H+===Fe2++H2↑
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是_____。
H2
打开
1
2
3
4
5
6
7
(3)简述生成Fe(OH)2的操作过程:_________________________________
____________。
(4)拔去装置B中的橡皮塞,使空气进入,
写出有关反应的化学方程式:
_________________________________。
关闭止水夹E,使FeSO4溶液压入B瓶
中进行反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3
返回
解析 实验开始时先打开E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的颜色。H2充满B后关闭E,A中的FeSO4溶液沿竖直长导管进入B瓶,与NaOH反应。
本课结束
第2课时 反应条件的控制
1.通过实验掌握Fe(OH)2的制备原理及化学性质。
2.在制备物质时,学会合理选择并控制好反应的条件。
核心素养发展目标
反应条件的控制
随堂演练 知识落实
课时对点练
内
容
索
引
1.Fe(OH)2制备的实验探究
反应条件的控制
实验操作
?
?
实验现象
①实验中A试管中观察到的现象是
。
②实验中B试管中先观察到有
生成,在空气中迅速变成
色,最后变成
色,有关反应的离子方程式是
________________________________;_____________________
_______________
有红褐色沉淀生成
白色沉淀
灰绿
红褐
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O
===4Fe(OH)3
实验结论
在不同的反应条件下,FeSO4溶液与NaOH溶液反应的实验现象不同,得到的产物也不同
2.Fe(OH)2和Fe(OH)3性质的比较
化学式
Fe(OH)2
Fe(OH)3
物质类别
二元弱碱
三元弱碱
颜色状态
_________
_____________
溶解性
_________
_________
与非氧化性强酸反应
____________________________
_____________________________
稳定性
Fe(OH)2
FeO+H2O
(隔绝空气)
_____________________
_________
白色固体
红褐色固体
Fe(OH)2+2H+===
Fe2++2H2O
不溶于水
Fe(OH)3+3H+===Fe3+
+3H2O
+3H2O
不溶于水
(1)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
(2)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(3)Fe(OH)3不能利用化合反应生成( )
(4)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
判断正误
×
×
×
√
1.Fe3O4中Fe有+2、+3两种价态,可表示成FeO·Fe2O3形式,请类比写出Fe4O5的表示形式。
提示 2FeO·Fe2O3
深度思考
2.氢氧化亚铁制备实验的改进
方案一:有机覆盖层法
(1)配制NaOH和FeSO4溶液的蒸馏水要经过____________,目的是_________________。
加热煮沸
赶走溶解的氧气
(2)在FeSO4溶液表面覆盖一层苯,作用是___________________。
隔绝空气中的氧气
方案二:还原性气体保护法
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
思考解答下列问题:
(3)在试管Ⅰ里加入的试剂是_______________。
稀H2SO4、铁屑
(4)在试管Ⅱ里加入的试剂是____________。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_______________________________________________
______________________。
NaOH溶液
打开止水夹a,待Ⅰ中反应生成的氢气排净装置中的
空气后,再关闭止水夹a
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________________________________
______________________________。
试管Ⅰ中反应生成的H2充满了试管Ⅰ和
试管Ⅱ,且外界空气不容易进入
制备Fe(OH)2的关键是隔绝空气(O2),可采取的措施有:
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。
归纳总结
返回
1.下列物质反应后一定有+3价铁生成的是
A.过量的Fe与Cl2反应
B.Fe与过量稀硫酸反应
C.CuCl2溶液中加入过量Fe
D.足量Fe和Fe2O3的混合物溶于盐酸中
1
2
3
随堂演练 知识落实
4
√
解析 A项,Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原;
B项,Fe与稀硫酸反应只能生成Fe2+;
C项,在溶液中Fe被Cu2+氧化为Fe2+;
D项,首先Fe与盐酸反应生成FeCl2,Fe2O3与盐酸反应生成FeCl3,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
1
2
3
4
2.铁有+2价和+3价两种价态,下列反应中不涉及铁元素价态变化的是
A.用还原铁粉除去氯化亚铁溶液中的少许氯化铁杂质
B.铁在氧气中燃烧,其产物溶于盐酸中可得到两种盐
C.氢氧化亚铁是白色固体,在空气中迅速变成灰绿色,最终变成红褐色
D.氢氧化铁受热分解
1
2
3
4
√
解析 氢氧化铁受热分解得到氧化铁和水,是非氧化还原反应,铁元素价态不变。其他选项都涉及氧化还原反应,铁元素价态发生变化。
3.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,除加硫酸防止生成Fe(OH)2外,还需加入_______。
(2)除去蒸馏水中溶解的O2,常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面以下,再慢慢挤出NaOH溶液。这样操作的理由是_____________________________________________。
1
2
3
4
铁屑
煮沸
避免生成的Fe(OH)2沉淀接触O2转化成Fe(OH)3沉淀
4.化合物A、B组成元素相同,且B为白色。C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的NaOH溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。回答下列问题:
(1)写出各物质的化学式:
A:________、B:________、C:________、D:________。
解析 解答本题的关键是抓住C与NaOH溶液反应的特征现象,确定A是Fe(OH)3,C是FeSO4,B是Fe(OH)2,D是Fe2O3。
Fe(OH)3
Fe(OH)2
FeSO4
Fe2O3
1
2
3
4
(2)写出B转化为A的化学方程式:
________________________________。
写出A受热分解的化学方程式:
___________________________。
1
2
3
4
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 反应条件对产物的影响
1.在一定条件下,铁与有关物质的反应所得产物错误的是
A组 基础对点练
√
解析 Cl2是强氧化剂,可将Fe氧化成FeCl3,故A正确;
S是弱氧化剂,可将Fe氧化成FeS,故B正确;
Fe与H2O(g)反应生成Fe3O4,而不是Fe(OH)3,故C错误;
Fe在O2中燃烧生成Fe3O4,故D正确。
1
2
3
4
5
6
7
8
9
2.下列叙述不正确的是
1
2
3
4
5
6
7
8
9
选项
被提纯物质
杂质
除杂试剂或方法
A
FeCl3溶液
FeCl2
通入适量Cl2
B
FeCl2溶液
FeCl3
加入过量铁粉并过滤
C
铜粉
铁粉
加入过量盐酸并过滤
D
Fe(OH)3
Fe(OH)2
在空气中灼烧
√
解析 FeCl2与Cl2反应生成FeCl3,FeCl3与Fe粉反应生成FeCl2,A、B都正确;
Fe(OH)3、Fe(OH)2受热都易分解,D错误。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
3.下列实验操作能够制取Fe(OH)2并能较长时间观察到白色沉淀的是
√
解析 B项中CCl4密度大,应在下层,不能长时间观察到白色沉淀;
D项中的操作可防止氧气氧化Fe(OH)2,能较长时间观察到白色沉淀。
4.(2020·云南峨山一中月考)为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
1
2
3
4
5
6
7
8
9
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色:A________,B_______________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A:_____________________________;
A→B:____________________。
血红色
不变(浅绿色)
Fe2O3+6HCl===2FeCl3+3H2O
Fe+2FeCl3===3FeCl2
1
2
3
4
5
6
7
8
9
(3)B→C可看到的现象是__________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_________效应。
白色沉淀迅速变为灰绿色最终转变为红褐色
Fe(OH)3
丁达尔
5.(2020·天津市蓟州区联考)电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
1
2
3
4
5
6
7
8
9
(1)步骤Ⅰ的操作名称:______;所需玻璃仪器:______、________、________。
1
2
3
4
5
6
7
8
9
过滤
烧杯
漏斗
玻璃棒
解析 废液中含有FeCl2、CuCl2、FeCl3,向废液中加入过量Fe,发生反应2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量盐酸,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向FeCl2滤液中通入过量Cl2,发生的反应为2Fe2++Cl2===2Fe3++2Cl-,从而得到FeCl3溶液,以此解答该题。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:________________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:_______________,实验现象:________________________。
1
2
3
4
5
6
7
8
9
2Fe3++Cu===2Fe2++Cu2+
硫氰化钾溶液
溶液由棕黄色变为血红色
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:
_____________________________________________________________,
此转化的化学方程式为__________________________________________
__________________________________。
(5)写出③中所含物质:________,⑥发生反应的离子方程式:____________________________。
1
2
3
4
5
6
7
8
9
先产生白色絮状沉淀,然后迅速变为灰绿色,最终变为红褐色
FeCl2+2NaOH===Fe(OH)2↓+2NaCl、
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe、Cu
2Fe2++Cl2===2Fe3++2Cl-
1
2
3
4
5
6
7
8
9
题组二 铁及其化合物之间的相互转化
6.右图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
锌粉
KSCN
D
Na2O2
MgCl2
Fe
KSCN
√
1
2
3
4
5
6
7
8
9
解析 Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
7.下列物质之间有如右反应关系:
已知E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
1
2
3
4
5
6
7
8
9
(1)写出下列物质的化学式:
A:________,B:_________,D:____________,甲:____________,乙:________________,丙:_________。
(2)写出E→C反应的化学方程式:________________________________。
Fe2O3
FeCl3
FeCl2
Cl2
NaOH(或KOH等)
KSCN
4Fe(OH)2+O2+2H2O===4Fe(OH)3
1
2
3
4
5
6
7
8
9
解析 E转化成C的现象是白色沉淀迅速变为灰绿色,最后变为红褐色,则E为Fe(OH)2,C为Fe(OH)3,A为红棕色粉末,则A为Fe2O3,B为FeCl3,D为FeCl2,乙为NaOH(或KOH等),由D→B的转化可知,甲为氯气或新制氯水等,由血红色溶液可知,丙为KSCN溶液。
题组三 食品中的铁元素
8.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
实验
现象
结论
试管Ⅰ
试管Ⅱ
a
褪色
不变红
?
b
不褪色
变红
?
c
褪色
变红
?
(1)请你填出该同学实验中出现以下现象时应得出的结论:
没有变质
完全变质
部分变质
(2)能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:_______________________________________________________
_____________________。
1
2
3
4
5
6
7
8
9
不能,KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
9.(2020·北京东城区高一期末)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100
g黑木耳含铁量高达185
mg。
ⅱ.紫红色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
1
2
3
4
5
6
7
8
9
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
1
2
3
4
5
6
7
8
9
(1)步骤②得到滤液A的操作是_________。
解析 不溶性固体和液体的分离可采用过滤的方法,因此步骤②得到滤液A的操作是过滤。
过滤
1
2
3
4
5
6
7
8
9
(2)步骤④检验Fe3+所用试剂是________溶液。
解析 一般用KSCN溶液检验铁离子,实验现象是溶液显红色,则步骤④检验Fe3+所用试剂是KSCN溶液。
KSCN
1
2
3
4
5
6
7
8
9
(3)下列有关上述实验得出的结论是________(填字母)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)2
解析 根据步骤③中产生蓝色沉淀可知滤液A中含有亚铁离子,则白色沉淀中含有Fe(OH)2;
根据步骤④可知滤液A中含有铁离子,由于在灼烧过程中亚铁离子可能被氧化为铁离子,所以黑木耳中不一定含有铁离子,所以a错误,b、c正确。
bc
1
2
3
4
5
6
7
8
9
Ⅱ.为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
d
(4)可选做试剂B的物质是________(填字母)。
a.Na
b.Zn
c.Fe
d.Cu
1
2
3
4
5
6
7
8
9
解析 滤液A中含有铁离子,需要利用还原剂将其转化为亚铁离子,且不能再引入铁元素,也不能干扰亚铁离子与高锰酸钾的反应。金属钠在溶液中反应生成NaOH,NaOH与铁离子反应生成沉淀,得不到亚铁离子,a错误;
金属锌与铁离子、亚铁离子和高锰酸钾均反应,b错误;
金属铁和铁离子反应生成亚铁离子,但引入了铁元素,c错误;
金属铜与铁离子反应生成亚铁离子和铜离子,且不会影响亚铁离子与高锰酸钾的反应,d正确。
1
2
3
4
5
6
7
8
9
(5)步骤⑦中观察到的实验现象是__________________________,反应的离子方程式是__________________________________________。
酸性高锰酸钾溶液紫色褪去
解析 酸性高锰酸钾溶液与亚铁离子反应生成铁离子、锰离子和水,则步骤⑦中观察到的实验现象是酸性高锰酸钾溶液紫红色褪去,反应的离子方程式是5Fe2++
+8H+===5Fe3++Mn2++4H2O。
1
2
3
4
5
6
7
8
9
(6)若乙同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是______________________________________________________。
黑木耳中还含有其他还原性物质(或黑木耳中还含有维生素C)
解析 由于黑木耳中含有其他还原性物质,如维生素C,导致消耗高锰酸钾溶液的体积增加,所以测得含铁量远大于实际的含量。
B组 综合强化练
1.(2020·湛江调研)联合国卫生组织经过考核和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广。其主要原因是
A.价格便宜,不易生锈
B.铁锅含有碳元素
C.烹调的食物中留有人体需要的铁元素
D.传热慢,保温性能好
1
2
3
4
5
6
7
√
解析 价格是物质用途需考虑的因素之一,但不是有益于健康的理由,铁锅为铁合金,易发生电化学腐蚀生锈,A项错误;
铁锅为铁的合金,主要成分为铁,还含有碳等其他元素,使用铁锅主要是获得铁元素,不是为了获得碳元素,B项错误;
使用铁锅烹调的食物中留有人体需要的铁元素,铁是合成血红蛋白的主要元素,缺乏会患贫血,C项正确;
铁合金具有良好的导热性能,但保温性能差,D项错误。
1
2
3
4
5
6
7
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是
A.Fe(OH)3;Fe2O3
B.Fe(OH)2;Fe2O3
C.Fe(OH)2;Fe(OH)3、Fe3O4
D.Fe2O3;Fe(OH)3
√
1
2
3
4
5
6
7
解析 铁与稀硫酸反应生成硫酸亚铁,当加入氨水时生成白色的氢氧化亚铁;氢氧化亚铁易被空气中的氧气氧化为红褐色的氢氧化铁,加热时氢氧化铁分解为红棕色的氧化铁。
3.(2020·贵州独山期末)某学生以铁丝和Cl2为原料进行下列三个实验。从反应条件的控制分析,下列说法不正确的是
A.实验①中不管Cl2是否足量,产物均为FeCl3
B.实验②中,搅拌可加速FeCl3的溶解
C.实验③中,必须严格控制好反应条件,才能
制得Fe(OH)3胶体
D.实验③中,没有不断搅拌,故得不到Fe(OH)3胶体
1
2
3
4
5
6
7
√
解析 Cl2具有强氧化性,和Fe反应,产物为FeCl3,故A正确;
搅拌可加速物质的溶解,故B正确;
由于胶体聚沉的条件,加热、搅拌、加入电解质等,故严格控制好条件,才能制得Fe(OH)3胶体,故C正确,D错误。
1
2
3
4
5
6
7
4.有关铁的化合物的说法中,错误的是
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被
氧化转变为红褐色
B.由图示操作可制取Fe(OH)2
C.Fe3O4、Fe(OH)3都可以由化合反应制得
D.Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
1
2
3
4
5
6
7
√
解析 Fe(OH)2是一种白色固体,A错误;
煤油能减少FeSO4溶液与氧气接触,可以避免试管中部分氧气对氢氧化亚铁的氧化,B正确;
铁在氧气中燃烧可生成Fe3O4,可通过化合反应:4Fe(OH)2+2H2O+O2
===4Fe(OH)3来制取Fe(OH)3,C正确;
Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应,D正确。
1
2
3
4
5
6
7
5.下列中学常见实验的现象或表述正确的是
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,
滴加KSCN溶液,溶液显血红色
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅
拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上
层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发
皿中充分加热煮沸,然后冷却过滤,得固体物质为Cu(OH)2
√
1
2
3
4
5
6
7
解析 过量的铁投入到一定量的稀硝酸中,铁先被硝酸氧化为三价铁,铁能和三价铁反应生成亚铁离子,铁元素最终被氧化为+2价,滴加KSCN溶液,溶液不会显血红色,故A错误;
向硫酸亚铁溶液中滴加氢氧化钠溶液发生复分解反应生成氢氧化亚铁白色沉淀,搅拌后,氢氧化亚铁很容易被空气中的氧气氧化为氢氧化铁,得不到白色沉淀物质,故B错误;
氧化铁和盐酸反应生成氯化铁溶液和水,三价铁遇KSCN溶液,会变血红色,故C正确;
CuSO4溶液中滴入过量NaOH溶液充分反应后,生成蓝色沉淀氢氧化铜,但是氢氧化铜受热容易分解,放入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质多为氧化铜,故D错误。
1
2
3
4
5
6
7
6.(2020·辽宁滨海实验中学期末)铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
1
2
3
4
5
6
7
试回答下列问题:
(1)试剂1是___________,试剂2是______________,加入新制氯水后溶液中发生反应的离子方程式是_____________________________、____________________________。
稀盐酸
KSCN溶液
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
解析 该药品不溶于水但能溶于人体中的胃酸,试剂1用于溶解样品,可以选用稀盐酸;
试剂2用于检验三价铁离子,可以选用KSCN溶液;
氯气氧化亚铁离子生成铁离子,离子方程式为2Fe2++Cl2===2Fe3++2Cl-;
铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为Fe3++3SCN-===Fe(SCN)3。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为______________________,写出+2价Fe在空气中转化为+3价Fe的化学方程式:
_________________________________。
少量的Fe2+转化为Fe3+
4FeCl2+O2+4HCl===4FeCl3+2H2O
解析 Fe3+遇KSCN溶液变血红色,溶液由淡黄色变为浅红色,说明少量Fe2+被氧化成Fe3+;
亚铁离子被空气中的氧气氧化为铁离子,化学方程式为4FeCl2+4HCl+O2===4FeCl3+2H2O。
1
2
3
4
5
6
7
(3)该同学猜想红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?___________。若你认为合理,请说明理由(若你认为不合理,该空不作答)_______;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不作答)_________________________________________________________________________________________________________________________________________。
不合理
猜想:Fe(SCN)3中的SCN-被过量的氯水氧化;设计的实验为在褪色后的溶液中加入FeCl3溶液,不变红色(或在褪色后的溶液中加入KSCN溶液,变血红色)
解析 因为氯水氧化性强,不会还原Fe3+,该同学的猜想不合理;
可能是SCN-被过量的氯水氧化,可取少量褪色后的溶液,加入FeCl3溶液,不变红色(或取少量褪色后的溶液,加入KSCN溶液,变血红色)。
1
2
3
4
5
6
7
7.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6
mol·L-1的硫酸,其他试剂任选。
填写下列空白:
1
2
3
4
5
6
7
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是___________________________。
铁屑
Fe+2H+===Fe2++H2↑
(2)实验开始时先将止水夹E________(填“打开”或“关闭”),C中收集到气体的主要成分是_____。
H2
打开
1
2
3
4
5
6
7
(3)简述生成Fe(OH)2的操作过程:_________________________________
____________。
(4)拔去装置B中的橡皮塞,使空气进入,
写出有关反应的化学方程式:
_________________________________。
关闭止水夹E,使FeSO4溶液压入B瓶
中进行反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3
返回
解析 实验开始时先打开E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的颜色。H2充满B后关闭E,A中的FeSO4溶液沿竖直长导管进入B瓶,与NaOH反应。
本课结束
