高中化学苏教版(2019)必修第二册 专题9 第三单元 金属材料的性能及应用(71张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题9 第三单元 金属材料的性能及应用(71张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 926.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-26 00:00:00 | ||
图片预览











文档简介
(共71张PPT)
第三单元 金属材料的性能及应用
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与
微观探析的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材
料,培养学生的科学态度和社会责任感。
核心素养发展目标
一、金属材料的性能
随堂演练 知识落实
课时对点练
二、合金及其应用
内
容
索
引
三、无机非金属材料
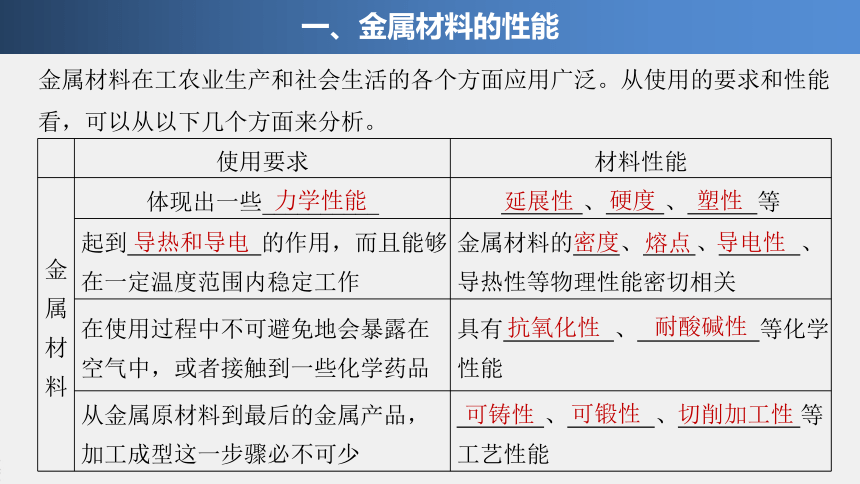
金属材料在工农业生产和社会生活的各个方面应用广泛。从使用的要求和性能看,可以从以下几个方面来分析。
一、金属材料的性能
?
使用要求
材料性能
金属材料
体现出一些__________
、
、
等
起到
的作用,而且能够在一定温度范围内稳定工作
金属材料的
、
、
、导热性等物理性能密切相关
在使用过程中不可避免地会暴露在空气中,或者接触到一些化学药品
具有
、
等化学性能
从金属原材料到最后的金属产品,加工成型这一步骤必不可少
、
、
等工艺性能
力学性能
延展性
硬度
塑性
导热和导电
密度
熔点
导电性
抗氧化性
耐酸碱性
可铸性
可锻性
切削加工性
(1)用铜制作导线,是因为铜具有良好的导电性和导热性( )
(2)铁制炊具可加热食物,是利用金属材料具有导热性( )
(3)金、银可制作各种各样的装饰品,是利用其具有良好的导电性、延展性等( )
(4)铁制品暴露在空气中,容易生锈( )
判断正误
×
×
√
√
青少年一定要爱护眼睛,在光线不足时看书、写字要用照明工具。如图是一种照明用台灯,请回答下列问题:
(1)图中表示的各部件中,用金属材料制成的是_________(填序号,任选一种)。
a(或b或e)
解析 金属单质及合金都属于金属材料,铁螺丝钉、铝箔反光片、铜质插头都属于金属材料。
理解应用
(2)金属及金属材料有很多优良的性能而被广泛应用。灯光后面的反光片为铝箔,铝块能制成铝箔是利用了铝的______性。
延展
解析 利用金属铝具有良好的延展性可把金属铝制成片。
(3)铝制品比铁制品耐用其原因是________
___________________________________________________________。
常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步被氧化
解析 铝制品常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步被氧化,故比铁制品耐腐蚀。
(4)比较铝和铁的金属活动性强弱______________________________(用一个化学方程式表示)。
解析 比较铝和铁的金属活动性,可以采用金属与盐溶液反应的方法,将铝片插入到硫酸亚铁溶液中,化学方程式为2Al+3FeSO4===3Fe+Al2(SO4)3。
2Al+3FeSO4===3Fe+Al2(SO4)3
返回
二、合金及其应用
1.合金
概念
将两种或两种以上的
(或
)共熔可制备出特殊的金属材料,这种材料叫作合金
性能
硬度
硬度一般
它的成分金属
熔点
熔点一般
它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能
举例
在焊接电子元件中使用的
是锡和铅的合金,生铁和钢都是铁和碳的合金
金属
金属与非金属
高于
低于
焊锡
2.常见的合金
(1)铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的
、
、
等,密度
,强度
,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
(2)武德合金
由锡(熔点232
℃)、铋(熔点271
℃)、镉(熔点321
℃)和铅(熔点327
℃)等金属按照一定的质量比制成的,熔点只有67
℃,它可以用来做电器、火灾报警等装置中的保险丝。
(3)镍铬铝铁、镍铬铝铜等合金具有很高的电阻率,可用于制备电路中的精密元件。
铜
镁
锰
小
大
(4)铁合金
不锈钢是一种重要的合金钢,主要的合金元素是
(占12%~32%),在大气中比较稳定,不易生锈,抗腐蚀能力强,常用于制造医疗器材、厨房用具和餐具,以及地铁列车的车体等。
(5)钛合金
①钛合金是一种新型的金属材料,其强度高,密度小,耐热性好,易于加工,抗腐蚀性强,远优于不锈钢,即使将它们放入海水中数年,取出后仍然光亮如新。
②应用
钛和钛合金被认为是21世纪的重要金属材料,被广泛应用于医疗、火箭、导弹、航天飞机、船舶、化工和通信设备等领域。
铬
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)合金中只含有金属元素( )
(4)合金是混合物,具有金属的特性( )
(5)我国最早使用的合金是生铁( )
判断正误
×
√
×
√
×
1.改进合金性能的常用措施有哪些?
深度思考
提示 合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
2.合金比成分金属的硬度大,原因是什么?
提示 纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
3.已知铜的熔点为1
083
℃,钠的沸点为883
℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
返回
1.传统非金属材料:
、
、
。
2.半导体材料:硅的
介于
之间,是一种重要的____
,被广泛用于电子工业的各个领域。工业上利用
可以制得高纯度的硅。
3.光导纤维
光导纤维的主要成分是
,可用来制造通讯光缆,用于光纤通信或传送高强度的激光等。光导纤维导光能力非常强,一条光缆由上万条光导纤维组成,因此可以利用其传输大量的信息。用光缆代替普通的金属通信电缆可以节约大量有色金属。
三、无机非金属材料
水泥
玻璃
陶瓷
导电性
导体和绝缘体
半导
体材料
二氧化硅
二氧化硅
4.新型陶瓷材料
新型陶瓷分为
和
两大类。结构陶瓷具有机械功能、热功能和部分化学功能,如
,高温结构陶瓷主要有高温氧化物(如氧化铝陶瓷)和高温非氧化物(如氮化硅陶瓷)两大类。功能陶瓷具有光、电、磁、化学和生物等方面的特殊功能,如
等,压电陶瓷主要成分是钛酸钡和钛酸铅。
结构陶瓷
功能陶瓷
高温结构陶瓷等
压电陶瓷
(1)光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便( )
(2)化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐( )
(3)三峡大坝的建设使用了大量水泥,水泥是硅酸盐材料( )
(4)氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料( )
(5)太阳能电池可采用硅材料制作,其应用有利于环保、节能( )
判断正误
×
×
√
√
√
氮化硅是一种新型陶瓷材料,它是一种超硬物质,还具有熔点高、耐磨损、抗腐蚀等性能,可用于制汽轮机叶片、制造轴承、做发动机受热面等。
(1)在氮化硅中,N为-3价、Si为+4价,写出氮化硅的化学式:_______。
深度思考
解析 根据化合价不难写出氮化硅的化学式为Si3N4。
Si3N4
(2)粉末状的氮化硅可以由SiCl4的蒸气和NH3的混合物反应制取,写出反应的化学方程式:______________________________。
3SiCl4+4NH3===Si3N4+12HCl
解析 根据元素守恒、原子守恒可写出SiCl4和NH3反应的化学方程式:3SiCl4+4NH3===Si3N4+12HCl。
(3)SiCl4和氮气在氢气气氛保护下加强热发生反应,可制得较高纯度的氮化硅,反应的化学方程式:__________________________________。
解析 SiCl4与N2反应生成Si3N4,N元素化合价降低而Si元素化合价未发生变化,根据氧化还原反应原理,H元素化合价应升高,因此另一种生成物是HCl。
(4)粉末状的氮化硅在空气和水中都不稳定。粉末状氮化硅与H2O作用生成两种化合物,其中一种是制玻璃的原料。写出该反应的化学方程式:____________________________。
解析 根据题意可知,Si3N4与H2O反应的生成物之一是SiO2,则根据元素守恒可判断另一种化合物是NH3。
Si3N4+6H2O===3SiO2+4NH3↑
(5)氮化硅陶瓷抗腐能力强,除氢氟酸外,它不与其他无机酸反应。该陶瓷与氢氟酸发生复分解反应生成两种气体,请写出反应的化学方程式:_______________________________。
解析 氮化硅与氢氟酸的反应类似于二氧化硅与氢氟酸的反应。
Si3N4+12HF===3SiF4↑+4NH3↑
归纳总结
无机材料
返回
1.合金具有许多优良的物理、化学或机械性能。下列物质不属于合金的是
A.青铜
B.金刚砂(SiC)
C.硬铝
D.生铁
1
2
3
5
随堂演练 知识落实
4
√
解析 本题考查了合金的特征。合金是指在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,合金具有以下特点:①一定是混合物;②合金中至少有一种金属。青铜是金属冶铸史上最早的合金,是在纯铜(红铜)中加入锡或铅的合金,故A错误。
金刚砂(SiC)是纯净物,故B正确。
硬铝是将铜、镁、锰等加到铝中,得到的强度比铝高得多的合金,故C错误。
生铁是铁与碳的合金,故D错误。
1
2
3
5
4
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门等。下列性质与这些用途无关的是
A.强度高
B.不易生锈
C.密度小
D.导电、导热性好
1
2
3
5
4
√
解析 铝镁合金用于制作门窗、防护栏等时主要是利用了铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点,与导电性是否良好无关。
3.下列关于合金的叙述中正确的是
①合金具有金属特性;②合金中的元素以单质形式存在;③合金中不一定含有金属;④合金中一定不含有非金属;⑤合金属于金属材料;⑥钢是含杂质较少的铁合金;⑦合金一定是混合物
A.①②③④⑤
B.①③④⑤
C.②③④⑤
D.①②⑤⑥⑦
√
1
2
3
5
4
解析 合金是一种金属与其他金属或非金属熔合而成具有金属特性的物质,属于金属材料,合金中至少有一种金属,③④错误。
4.合金是两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(1)下列物质不属于合金的是________(填字母,下同)。
A.明矾
B.硬铝
C.生铁
D.青铜
1
2
3
5
4
解析 A属于化合物;
硬铝中含铝、铜、镁等,生铁中主要含铁、碳,青铜中含有铜、锡等,它们都属于合金。
A
(2)根据右表中四种金属的熔、沸点:
1
2
3
5
4
解析 当一种金属的熔点超过另一种金属的沸点时,它们就不可能熔合在一起而形成合金。
金
属
Na
Cu
Al
Fe
熔点/℃
97.8
1
083
660
1
535
沸点/℃
883
2
567
2
467
2
750
其中不能形成合金的是________。
①Cu与Na ②Fe与Cu
③Fe与Na ④Al与Na
A.①②
B.①③
C.①④
D.②④
B
1
2
3
5
4
解析 Mg、Al都与盐酸反应,Mg(OH)2不溶于NaOH溶液,而Al(OH)3溶于NaOH溶液生成NaAlO2和H2O。
(3)镁、铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结果是________。
A.没有沉淀物生成
B.只有氢氧化铝沉淀生成
C.只有氢氧化镁沉淀生成
D.有氢氧化铝和氢氧化镁沉淀生成
C
5.金属及金属材料有很多优良的性能而被广泛应用。
(1)铁制炊具加热食物。说明铁具有的性质是_________。
1
2
3
5
4
解析 铁具有优良的导电、导热性,所以可用铁制炊具加热食物,说明铁具有的性质是导热性。
导热性
(2)钛合金因为优良的性能,被广泛应用于生物医学、航空航天等领域。钛合金的优点有______________(任写一条),构成金属钛的粒子是________(填“分子”“原子”或“离子”)。
1
2
3
5
4
抗腐蚀性强
原子
解析 钛合金的优点有:抗腐蚀性强,金属是由原子直接构成的,所以构成金属钛的粒子是原子。
(3)合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。
①熔炼制备Mg2Cu合金时,通入氩气的目的是____________________。
1
2
3
5
4
解析 熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化;
防止金属被氧化
②将11.2
g的Mg2Cu合金与过量盐酸反应,生成氢气的质量为______
g。
1
2
3
5
4
0.4
1
2
3
5
4
解析 11.2
g
Mg2Cu中只有镁与盐酸反应产生氢气,
设生成氢气的质量为x,
Mg+2HCl===MgCl2+H2↑
24
2
4.8
g
x
x=0.4
g,
所以生成氢气的质量为0.4
g。
返回
题组一 合金及其应用
1.下列物质中,不属于合金的是
A.硬铝
B.黄铜
C.钢铁
D.水银
课时对点练
1
2
3
4
5
6
7
8
9
√
A组 基础对点练
解析 硬铝是铝、铜、镁、锰等形成的合金;黄铜是铜锌合金;钢是铁碳合金;而水银是纯净的汞单质。
10
11
2.在日常生活中人们经常使用的金属材料大多数属于合金,以下关于合金的叙述正确的是
①青铜是中国历史上使用最早的合金 ②合金的熔点一般比各成分金属熔点高 ③合金往往比各成分金属的物理、化学或机械性能好 ④合金的性质是各成分金属性质之和
A.①③④
B.①③
C.①②
D.①②③④
√
解析 合金的熔点一般比各成分金属熔点低,合金的物理性质与各成分金属不同。
1
2
3
4
5
6
7
8
9
10
11
3.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切实际的是
A.用来作保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,制作钛合金装饰门
√
1
2
3
4
5
6
7
8
9
10
11
解析 由于其熔点高,不适合作保险丝,A错误;
由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;
由于钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排斥反应,因此可以用来制造人造骨,C正确;
由于其密度小、可塑性好、易于加工,因此可用于家庭装修,作钛合金装饰门,D正确。
1
2
3
4
5
6
7
8
9
10
11
4.铁和不锈钢(铁合金)都是生活中常见的材料,下列说法中不正确的是
A.铁和不锈钢都能与盐酸反应
B.铁是纯净物,不锈钢是混合物
C.铁和不锈钢都只含有金属元素
D.不锈钢比铁更耐腐蚀
解析 铁和不锈钢(铁合金)都能与盐酸反应;不锈钢含有碳、硅等非金属,属于混合物;不锈钢的抗腐蚀性能比铁好。
√
1
2
3
4
5
6
7
8
9
10
11
5.纯铁的熔点为1
535
℃,而高炉炼铁时生铁(含碳量较高的铁合金)在
1
200
℃左右就熔化了,这是因为
A.铁的纯度越高熔点越低
B.合金的熔点比其各成分金属的熔点高
C.生铁是铁碳合金,熔点比纯铁低
D.生铁在高炉中熔化时发生了化学反应
√
解析 合金的熔点一般低于其成分金属的熔点,生铁的熔点比纯铁低是因为生铁是铁碳合金,C项正确。
1
2
3
4
5
6
7
8
9
10
11
6.嫦娥三号是中国国家航天局嫦娥工程第二阶段的登月探测器,它携带中国第一艘月球车,实现了中国首次月面软着陆。嫦娥三号中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般地,合金的熔点比它的各成分金属的更低
C.合金的化学性质与成分金属的化学性质不同
D.改变原料的配比、改变生成合金的条件,可以得到具有不同性能的合金
√
解析 生铁是铁和碳的合金,合金的熔点比其成分金属的低。合金的化学性质和成分金属的化学性质相同。
1
2
3
4
5
6
7
8
9
10
11
7.根据你学过的有关金属的知识,回答下列问题:
(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是__________(填字母)。
A.铜的熔点不是太高,易于冶炼,易于铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早的掌握了湿法炼铜的技术
D.自然界有大量的游离态的铜
解析 铜钱作为货币,首先应易得,再者不容易被腐蚀。
ABC
1
2
3
4
5
6
7
8
9
10
11
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是________(填名称),铁的氧化物常见的还有________、________(填化学式)。
氧化铁
FeO
Fe3O4
解析 铁锈主要成分为Fe2O3,常见铁的氧化物还有FeO和Fe3O4。
1
2
3
4
5
6
7
8
9
10
11
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为________________________________。
Al2O3+2NaOH===2NaAlO2+H2O
解析 Al2O3+2NaOH===2NaAlO2+H2O。
1
2
3
4
5
6
7
8
9
10
11
(4)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是_____币,黑色物质是________(填名称),形成这种物质的化学方程式为_________________,绿色物质是______________(填化学式),这枚金属币的真面目为_____色。另外一枚是闪闪发光的黄色金属币,它肯定是_____币,表面一直未被氧化的原因是____________________________________。
铜
氧化铜
2Cu+O2===2CuO
Cu2(OH)2CO3
紫红
金
金的化学性质不活泼,不易被氧化
解析 铜与氧气反应生成黑色CuO,铜在空气中“生锈”的反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3(绿色);金的化学性质不活泼,空气中不与O2反应。
1
2
3
4
5
6
7
8
9
10
11
(5)不法分子有时用铜锌合金制成假金币行骗。下列方法中能有效鉴别其真假的是________(填字母)。
A.观察颜色
B.查看图案
C.用手掂量轻重
D.滴一滴硝酸在币的表面,观察现象
解析 有些假金币外形图案、颜色与金相近,密度与真金币相当,用手掂量不出来,假金币中的Zn、Cu均可与HNO3反应产生大量气泡,而Au不与HNO3反应。
D
1
2
3
4
5
6
7
8
9
10
11
题组二 无机非金属材料
8.2019年2月,某品牌发布了制造出首款5G折叠屏手机的消息。下列说法错误的是
A.制造手机芯片的关键材料是二氧化硅
B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池电极材料碳纳米管是新型无机非金属材料
√
1
2
3
4
5
6
7
8
9
10
11
解析 硅是制造手机芯片的材料,故A错误;
铜具有良好的导电性,常用于制作导线,所以用铜制作手机线路板利用了铜优良的导电性,故B正确;
合金的硬度比各成分的硬度大,所以镁铝合金制成的手机外壳具有轻便抗压的特点,故C正确;
用作手机电池电极材料的碳纳米管是新型无机非金属材料,故D正确。
1
2
3
4
5
6
7
8
9
10
11
9.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B.碳化硅(SiC)的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2
D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键个数之比为1∶2
解析 A项,在氮化硅中N元素为-3价,Si元素为+4价则化学式为Si3N4,正确;
D项,在SiO2晶体中,一个硅原子与周围4个氧原子形成4个硅氧单键,错误。
√
1
2
3
4
5
6
7
8
9
10
11
10.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是
A.陶瓷餐具
B.石英钟表
C.计算机芯片
D.光导纤维
解析 陶瓷餐具是硅酸盐产品,石英钟表和光导纤维用到SiO2,计算机芯片用到单质硅。
√
1
2
3
4
5
6
7
8
9
10
11
11.改革开放以来,我国取得了很多世界瞩目的科技成果,下列说法不正确的是
A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.国产C919用到的氮化硅陶瓷是新型无机非金属材料
D.中国天眼传输信息用的光纤材料是高纯硅
√
1
2
3
4
5
6
7
8
9
10
11
解析 A对,蛟龙号潜水器用到钛合金,22号钛元素位于第四周期,第ⅣB族,属于过渡元素。
B对,合金材料一般具有强度大、密度小、耐腐蚀等性能。
C对,氮化硅陶瓷是新型无机非金属材料。
D错,中国天眼传输信息用的光纤材料是二氧化硅。
1
2
3
4
5
6
7
8
9
10
11
B组 综合强化练
1.合金相对于纯金属制成的金属材料来说优点是
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它的各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤
B.②③④
C.①②④
D.①②④⑤
√
1
2
3
4
5
6
7
8
解析 合金具有许多优良的物理、化学或机械性能,在许多方面优于各成分金属。例如,合金的硬度一般比其各成分金属的硬度大,多数合金的熔点比其各成分金属的熔点低,但合金的导电性比纯金属弱。
1
2
3
4
5
6
7
8
2.下列说法正确的是
A.青铜是我国使用最早的合金,也是目前使用最广泛的合金
B.不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样
C.我们日常生活中用到的铜合金制品主要是黄铜制的
D.各种铜合金都有良好的导电、导热性
1
2
3
4
5
6
7
8
√
解析 青铜是我国使用最早的合金,但目前使用最广泛的合金是铁合金;铜合金与铜相比,因熔合了其他元素,其机械性能和硬度、熔点等性质发生变化;白铜的导电、导热性均比铜单质差。
3.易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是
A.加入盐酸产生无色气体,含铝、铁、镁三种元素
B.加入氢氧化钠溶液有无色气体产生,含有铝元素
C.加入盐酸后,所得溶液中再加入少量氢氧化钠溶液产生白色沉淀,含
有镁元素
D.加入盐酸后,所得溶液中再加入少量硫氰化钾溶液呈红色,含有铁元素
√
1
2
3
4
5
6
7
8
解析 铝、铁、镁都能与盐酸反应产生氢气,所得的溶液中加入少量氢氧化钠溶液,能产生白色沉淀的可能是氯化镁溶液,也可能是氯化铝溶液;
铝能与氢氧化钠溶液反应产生氢气;铁单质与酸反应产生Fe2+,不能使硫氰化钾溶液变红色。
1
2
3
4
5
6
7
8
4.下列说法正确的是
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
√
1
2
3
4
5
6
7
8
解析 不锈钢中含有非金属碳,A项不正确;
我国流通的硬币材质是合金,B项不正确;
铝的冶炼方法在十九世纪才被发现,明朝时不可能有大量铝制餐具,C项不正确;
合金的机械加工性能一般优于其成分金属,D项正确。
1
2
3
4
5
6
7
8
5.高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
1
2
3
4
5
6
7
8
下列说法正确的是
A.步骤①的化学方程式为SiO2+C
Si+CO2↑
B.步骤①②③中每生成或反应1
mol
Si,转移2
mol电子
C.SiHCl3(沸点33.0
℃)中含有少量的SiCl4(沸点67.6
℃),通过蒸馏(或分馏)
可提纯SiHCl3
D.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
√
1
2
3
4
5
6
7
8
解析 二氧化硅在高温下与C反应生成CO气体,即步骤①的化学方程式为SiO2+2C
Si+2CO↑,故A错误;
步骤①中Si的化合价降低4,每生成1
mol
Si转移电子数为4
mol,步骤②中生成SiHCl3,化合价升高2,步骤③中每生成1
mol
Si,转移2
mol电子,故B错误;
沸点相差30
℃以上的两种液体可以采用蒸馏的方法分离,故C正确;
硅能与氢氟酸反应生成氢气和SiF4,故D错误。
6.根据不同部位工作条件的不同,航天飞机使用了多种防热材料。例如,机身和机翼下表面使用高温陶瓷瓦。下列对新型陶瓷材料的有关叙述中,错误的是
A.高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料
B.氧化铝陶瓷属于新型无机非金属材料,它是结构陶瓷
C.氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面
D.新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比
较差
√
1
2
3
4
5
6
7
8
解析 高温结构陶瓷包括Si3N4陶瓷、SiC陶瓷等,属于新型无机非金属材料,可以作为高级耐火材料,A正确;
氧化铝陶瓷属于新型无机非金属材料,是结构陶瓷,B正确;
氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面,C正确;
新型无机非金属材料具有耐高温、耐冲击、电学特性、光学特性、生物功能等优点,克服了传统无机非金属材料的缺点,具有较高的强度和耐磨性,D错误。
1
2
3
4
5
6
7
8
7.我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
1
2
3
4
5
6
7
8
应用
“复兴号”高铁车轮
“鲲龙”水陆两栖飞机零部件
华为折叠手机屏幕
用到的材料
高速钢
钛合金、铝合金
聚酰亚胺塑料
(1)上述材料中属于有机合成材料的是_______________,属于金属材料的是__________________________(写一种即可)。
解析 聚酰亚胺塑料是一种有机合成材料,合金相对于成分金属往往硬度更大,更耐腐蚀。
聚酰亚胺塑料
高速钢(或钛合金或铝合金)
(2)飞机外壳用钛合金、铝合金的优点是_____________________。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为___________________________,反应基本类型是________________。
1
2
3
4
5
6
7
8
应用
“复兴号”高铁车轮
“鲲龙”水陆两栖飞机零部件
华为折叠手机屏幕
用到的材料
高速钢
钛合金、铝合金
聚酰亚胺塑料
耐腐蚀、硬度大等
置换反应
8.铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响,请完成(1)~(3)题。
(1)在化学反应中,铜元素可表现为0、+1、+2价。在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式:__________________________。
解析 实际上是用铁还原CuSO4得到单质铜。
1
2
3
4
5
6
7
8
CuSO4+Fe===FeSO4+Cu
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物反应的化学方程式:
_______________________________________________________________________________________________。
解析 因为铜绿(碱式碳酸铜)能与酸反应,生成可溶性盐和气体,故可用酸除之。
1
2
3
4
5
6
7
8
Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑[或Cu2(OH)2CO3+2H2SO4===2CuSO4+3H2O+CO2↑]
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析铜为什么常用于制造货币(铜的熔点是1
183.4
℃,铁的熔点是1
534.8
℃)______________________________________________________
__________________。
解析 铜在古代作为货币主要因为其熔点低,易于铸造,且不易被腐蚀。
返回
1
2
3
4
5
6
7
8
铜的化学性质比较稳定,不易被腐蚀;铜的熔点比较低,
容易冶炼铸造成型
本课结束
第三单元 金属材料的性能及应用
1.能从合金结构与组成的角度理解合金的特殊性能,培养宏观辨识与
微观探析的能力。
2.能列举常见合金的组成和性能,能科学、合理的选择和使用金属材
料,培养学生的科学态度和社会责任感。
核心素养发展目标
一、金属材料的性能
随堂演练 知识落实
课时对点练
二、合金及其应用
内
容
索
引
三、无机非金属材料
金属材料在工农业生产和社会生活的各个方面应用广泛。从使用的要求和性能看,可以从以下几个方面来分析。
一、金属材料的性能
?
使用要求
材料性能
金属材料
体现出一些__________
、
、
等
起到
的作用,而且能够在一定温度范围内稳定工作
金属材料的
、
、
、导热性等物理性能密切相关
在使用过程中不可避免地会暴露在空气中,或者接触到一些化学药品
具有
、
等化学性能
从金属原材料到最后的金属产品,加工成型这一步骤必不可少
、
、
等工艺性能
力学性能
延展性
硬度
塑性
导热和导电
密度
熔点
导电性
抗氧化性
耐酸碱性
可铸性
可锻性
切削加工性
(1)用铜制作导线,是因为铜具有良好的导电性和导热性( )
(2)铁制炊具可加热食物,是利用金属材料具有导热性( )
(3)金、银可制作各种各样的装饰品,是利用其具有良好的导电性、延展性等( )
(4)铁制品暴露在空气中,容易生锈( )
判断正误
×
×
√
√
青少年一定要爱护眼睛,在光线不足时看书、写字要用照明工具。如图是一种照明用台灯,请回答下列问题:
(1)图中表示的各部件中,用金属材料制成的是_________(填序号,任选一种)。
a(或b或e)
解析 金属单质及合金都属于金属材料,铁螺丝钉、铝箔反光片、铜质插头都属于金属材料。
理解应用
(2)金属及金属材料有很多优良的性能而被广泛应用。灯光后面的反光片为铝箔,铝块能制成铝箔是利用了铝的______性。
延展
解析 利用金属铝具有良好的延展性可把金属铝制成片。
(3)铝制品比铁制品耐用其原因是________
___________________________________________________________。
常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步被氧化
解析 铝制品常温下,与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步被氧化,故比铁制品耐腐蚀。
(4)比较铝和铁的金属活动性强弱______________________________(用一个化学方程式表示)。
解析 比较铝和铁的金属活动性,可以采用金属与盐溶液反应的方法,将铝片插入到硫酸亚铁溶液中,化学方程式为2Al+3FeSO4===3Fe+Al2(SO4)3。
2Al+3FeSO4===3Fe+Al2(SO4)3
返回
二、合金及其应用
1.合金
概念
将两种或两种以上的
(或
)共熔可制备出特殊的金属材料,这种材料叫作合金
性能
硬度
硬度一般
它的成分金属
熔点
熔点一般
它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能
举例
在焊接电子元件中使用的
是锡和铅的合金,生铁和钢都是铁和碳的合金
金属
金属与非金属
高于
低于
焊锡
2.常见的合金
(1)铝合金是目前用途广泛的合金之一,硬铝是在铝中添加了一定比例的
、
、
等,密度
,强度
,具有较强抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
(2)武德合金
由锡(熔点232
℃)、铋(熔点271
℃)、镉(熔点321
℃)和铅(熔点327
℃)等金属按照一定的质量比制成的,熔点只有67
℃,它可以用来做电器、火灾报警等装置中的保险丝。
(3)镍铬铝铁、镍铬铝铜等合金具有很高的电阻率,可用于制备电路中的精密元件。
铜
镁
锰
小
大
(4)铁合金
不锈钢是一种重要的合金钢,主要的合金元素是
(占12%~32%),在大气中比较稳定,不易生锈,抗腐蚀能力强,常用于制造医疗器材、厨房用具和餐具,以及地铁列车的车体等。
(5)钛合金
①钛合金是一种新型的金属材料,其强度高,密度小,耐热性好,易于加工,抗腐蚀性强,远优于不锈钢,即使将它们放入海水中数年,取出后仍然光亮如新。
②应用
钛和钛合金被认为是21世纪的重要金属材料,被广泛应用于医疗、火箭、导弹、航天飞机、船舶、化工和通信设备等领域。
铬
(1)合金一定是不同金属熔合而成的具有金属特性的化合物( )
(2)生铁的熔点比纯铁低,但机械强度和硬度比纯铁高( )
(3)合金中只含有金属元素( )
(4)合金是混合物,具有金属的特性( )
(5)我国最早使用的合金是生铁( )
判断正误
×
√
×
√
×
1.改进合金性能的常用措施有哪些?
深度思考
提示 合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
2.合金比成分金属的硬度大,原因是什么?
提示 纯金属所有原子的大小和形状相同,原子排列十分规整;加入或大或小的其他元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金硬度变大。
3.已知铜的熔点为1
083
℃,钠的沸点为883
℃,试问铜与钠能否形成合金?
提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
返回
1.传统非金属材料:
、
、
。
2.半导体材料:硅的
介于
之间,是一种重要的____
,被广泛用于电子工业的各个领域。工业上利用
可以制得高纯度的硅。
3.光导纤维
光导纤维的主要成分是
,可用来制造通讯光缆,用于光纤通信或传送高强度的激光等。光导纤维导光能力非常强,一条光缆由上万条光导纤维组成,因此可以利用其传输大量的信息。用光缆代替普通的金属通信电缆可以节约大量有色金属。
三、无机非金属材料
水泥
玻璃
陶瓷
导电性
导体和绝缘体
半导
体材料
二氧化硅
二氧化硅
4.新型陶瓷材料
新型陶瓷分为
和
两大类。结构陶瓷具有机械功能、热功能和部分化学功能,如
,高温结构陶瓷主要有高温氧化物(如氧化铝陶瓷)和高温非氧化物(如氮化硅陶瓷)两大类。功能陶瓷具有光、电、磁、化学和生物等方面的特殊功能,如
等,压电陶瓷主要成分是钛酸钡和钛酸铅。
结构陶瓷
功能陶瓷
高温结构陶瓷等
压电陶瓷
(1)光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便( )
(2)化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐( )
(3)三峡大坝的建设使用了大量水泥,水泥是硅酸盐材料( )
(4)氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料( )
(5)太阳能电池可采用硅材料制作,其应用有利于环保、节能( )
判断正误
×
×
√
√
√
氮化硅是一种新型陶瓷材料,它是一种超硬物质,还具有熔点高、耐磨损、抗腐蚀等性能,可用于制汽轮机叶片、制造轴承、做发动机受热面等。
(1)在氮化硅中,N为-3价、Si为+4价,写出氮化硅的化学式:_______。
深度思考
解析 根据化合价不难写出氮化硅的化学式为Si3N4。
Si3N4
(2)粉末状的氮化硅可以由SiCl4的蒸气和NH3的混合物反应制取,写出反应的化学方程式:______________________________。
3SiCl4+4NH3===Si3N4+12HCl
解析 根据元素守恒、原子守恒可写出SiCl4和NH3反应的化学方程式:3SiCl4+4NH3===Si3N4+12HCl。
(3)SiCl4和氮气在氢气气氛保护下加强热发生反应,可制得较高纯度的氮化硅,反应的化学方程式:__________________________________。
解析 SiCl4与N2反应生成Si3N4,N元素化合价降低而Si元素化合价未发生变化,根据氧化还原反应原理,H元素化合价应升高,因此另一种生成物是HCl。
(4)粉末状的氮化硅在空气和水中都不稳定。粉末状氮化硅与H2O作用生成两种化合物,其中一种是制玻璃的原料。写出该反应的化学方程式:____________________________。
解析 根据题意可知,Si3N4与H2O反应的生成物之一是SiO2,则根据元素守恒可判断另一种化合物是NH3。
Si3N4+6H2O===3SiO2+4NH3↑
(5)氮化硅陶瓷抗腐能力强,除氢氟酸外,它不与其他无机酸反应。该陶瓷与氢氟酸发生复分解反应生成两种气体,请写出反应的化学方程式:_______________________________。
解析 氮化硅与氢氟酸的反应类似于二氧化硅与氢氟酸的反应。
Si3N4+12HF===3SiF4↑+4NH3↑
归纳总结
无机材料
返回
1.合金具有许多优良的物理、化学或机械性能。下列物质不属于合金的是
A.青铜
B.金刚砂(SiC)
C.硬铝
D.生铁
1
2
3
5
随堂演练 知识落实
4
√
解析 本题考查了合金的特征。合金是指在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,合金具有以下特点:①一定是混合物;②合金中至少有一种金属。青铜是金属冶铸史上最早的合金,是在纯铜(红铜)中加入锡或铅的合金,故A错误。
金刚砂(SiC)是纯净物,故B正确。
硬铝是将铜、镁、锰等加到铝中,得到的强度比铝高得多的合金,故C错误。
生铁是铁与碳的合金,故D错误。
1
2
3
5
4
2.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门等。下列性质与这些用途无关的是
A.强度高
B.不易生锈
C.密度小
D.导电、导热性好
1
2
3
5
4
√
解析 铝镁合金用于制作门窗、防护栏等时主要是利用了铝镁合金具有耐腐蚀性、密度小、机械强度高等方面的特点,与导电性是否良好无关。
3.下列关于合金的叙述中正确的是
①合金具有金属特性;②合金中的元素以单质形式存在;③合金中不一定含有金属;④合金中一定不含有非金属;⑤合金属于金属材料;⑥钢是含杂质较少的铁合金;⑦合金一定是混合物
A.①②③④⑤
B.①③④⑤
C.②③④⑤
D.①②⑤⑥⑦
√
1
2
3
5
4
解析 合金是一种金属与其他金属或非金属熔合而成具有金属特性的物质,属于金属材料,合金中至少有一种金属,③④错误。
4.合金是两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
(1)下列物质不属于合金的是________(填字母,下同)。
A.明矾
B.硬铝
C.生铁
D.青铜
1
2
3
5
4
解析 A属于化合物;
硬铝中含铝、铜、镁等,生铁中主要含铁、碳,青铜中含有铜、锡等,它们都属于合金。
A
(2)根据右表中四种金属的熔、沸点:
1
2
3
5
4
解析 当一种金属的熔点超过另一种金属的沸点时,它们就不可能熔合在一起而形成合金。
金
属
Na
Cu
Al
Fe
熔点/℃
97.8
1
083
660
1
535
沸点/℃
883
2
567
2
467
2
750
其中不能形成合金的是________。
①Cu与Na ②Fe与Cu
③Fe与Na ④Al与Na
A.①②
B.①③
C.①④
D.②④
B
1
2
3
5
4
解析 Mg、Al都与盐酸反应,Mg(OH)2不溶于NaOH溶液,而Al(OH)3溶于NaOH溶液生成NaAlO2和H2O。
(3)镁、铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结果是________。
A.没有沉淀物生成
B.只有氢氧化铝沉淀生成
C.只有氢氧化镁沉淀生成
D.有氢氧化铝和氢氧化镁沉淀生成
C
5.金属及金属材料有很多优良的性能而被广泛应用。
(1)铁制炊具加热食物。说明铁具有的性质是_________。
1
2
3
5
4
解析 铁具有优良的导电、导热性,所以可用铁制炊具加热食物,说明铁具有的性质是导热性。
导热性
(2)钛合金因为优良的性能,被广泛应用于生物医学、航空航天等领域。钛合金的优点有______________(任写一条),构成金属钛的粒子是________(填“分子”“原子”或“离子”)。
1
2
3
5
4
抗腐蚀性强
原子
解析 钛合金的优点有:抗腐蚀性强,金属是由原子直接构成的,所以构成金属钛的粒子是原子。
(3)合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。
①熔炼制备Mg2Cu合金时,通入氩气的目的是____________________。
1
2
3
5
4
解析 熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化;
防止金属被氧化
②将11.2
g的Mg2Cu合金与过量盐酸反应,生成氢气的质量为______
g。
1
2
3
5
4
0.4
1
2
3
5
4
解析 11.2
g
Mg2Cu中只有镁与盐酸反应产生氢气,
设生成氢气的质量为x,
Mg+2HCl===MgCl2+H2↑
24
2
4.8
g
x
x=0.4
g,
所以生成氢气的质量为0.4
g。
返回
题组一 合金及其应用
1.下列物质中,不属于合金的是
A.硬铝
B.黄铜
C.钢铁
D.水银
课时对点练
1
2
3
4
5
6
7
8
9
√
A组 基础对点练
解析 硬铝是铝、铜、镁、锰等形成的合金;黄铜是铜锌合金;钢是铁碳合金;而水银是纯净的汞单质。
10
11
2.在日常生活中人们经常使用的金属材料大多数属于合金,以下关于合金的叙述正确的是
①青铜是中国历史上使用最早的合金 ②合金的熔点一般比各成分金属熔点高 ③合金往往比各成分金属的物理、化学或机械性能好 ④合金的性质是各成分金属性质之和
A.①③④
B.①③
C.①②
D.①②③④
√
解析 合金的熔点一般比各成分金属熔点低,合金的物理性质与各成分金属不同。
1
2
3
4
5
6
7
8
9
10
11
3.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切实际的是
A.用来作保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,制作钛合金装饰门
√
1
2
3
4
5
6
7
8
9
10
11
解析 由于其熔点高,不适合作保险丝,A错误;
由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;
由于钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排斥反应,因此可以用来制造人造骨,C正确;
由于其密度小、可塑性好、易于加工,因此可用于家庭装修,作钛合金装饰门,D正确。
1
2
3
4
5
6
7
8
9
10
11
4.铁和不锈钢(铁合金)都是生活中常见的材料,下列说法中不正确的是
A.铁和不锈钢都能与盐酸反应
B.铁是纯净物,不锈钢是混合物
C.铁和不锈钢都只含有金属元素
D.不锈钢比铁更耐腐蚀
解析 铁和不锈钢(铁合金)都能与盐酸反应;不锈钢含有碳、硅等非金属,属于混合物;不锈钢的抗腐蚀性能比铁好。
√
1
2
3
4
5
6
7
8
9
10
11
5.纯铁的熔点为1
535
℃,而高炉炼铁时生铁(含碳量较高的铁合金)在
1
200
℃左右就熔化了,这是因为
A.铁的纯度越高熔点越低
B.合金的熔点比其各成分金属的熔点高
C.生铁是铁碳合金,熔点比纯铁低
D.生铁在高炉中熔化时发生了化学反应
√
解析 合金的熔点一般低于其成分金属的熔点,生铁的熔点比纯铁低是因为生铁是铁碳合金,C项正确。
1
2
3
4
5
6
7
8
9
10
11
6.嫦娥三号是中国国家航天局嫦娥工程第二阶段的登月探测器,它携带中国第一艘月球车,实现了中国首次月面软着陆。嫦娥三号中使用了大量合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.一般地,合金的熔点比它的各成分金属的更低
C.合金的化学性质与成分金属的化学性质不同
D.改变原料的配比、改变生成合金的条件,可以得到具有不同性能的合金
√
解析 生铁是铁和碳的合金,合金的熔点比其成分金属的低。合金的化学性质和成分金属的化学性质相同。
1
2
3
4
5
6
7
8
9
10
11
7.根据你学过的有关金属的知识,回答下列问题:
(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是__________(填字母)。
A.铜的熔点不是太高,易于冶炼,易于铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早的掌握了湿法炼铜的技术
D.自然界有大量的游离态的铜
解析 铜钱作为货币,首先应易得,再者不容易被腐蚀。
ABC
1
2
3
4
5
6
7
8
9
10
11
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是________(填名称),铁的氧化物常见的还有________、________(填化学式)。
氧化铁
FeO
Fe3O4
解析 铁锈主要成分为Fe2O3,常见铁的氧化物还有FeO和Fe3O4。
1
2
3
4
5
6
7
8
9
10
11
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为________________________________。
Al2O3+2NaOH===2NaAlO2+H2O
解析 Al2O3+2NaOH===2NaAlO2+H2O。
1
2
3
4
5
6
7
8
9
10
11
(4)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是_____币,黑色物质是________(填名称),形成这种物质的化学方程式为_________________,绿色物质是______________(填化学式),这枚金属币的真面目为_____色。另外一枚是闪闪发光的黄色金属币,它肯定是_____币,表面一直未被氧化的原因是____________________________________。
铜
氧化铜
2Cu+O2===2CuO
Cu2(OH)2CO3
紫红
金
金的化学性质不活泼,不易被氧化
解析 铜与氧气反应生成黑色CuO,铜在空气中“生锈”的反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3(绿色);金的化学性质不活泼,空气中不与O2反应。
1
2
3
4
5
6
7
8
9
10
11
(5)不法分子有时用铜锌合金制成假金币行骗。下列方法中能有效鉴别其真假的是________(填字母)。
A.观察颜色
B.查看图案
C.用手掂量轻重
D.滴一滴硝酸在币的表面,观察现象
解析 有些假金币外形图案、颜色与金相近,密度与真金币相当,用手掂量不出来,假金币中的Zn、Cu均可与HNO3反应产生大量气泡,而Au不与HNO3反应。
D
1
2
3
4
5
6
7
8
9
10
11
题组二 无机非金属材料
8.2019年2月,某品牌发布了制造出首款5G折叠屏手机的消息。下列说法错误的是
A.制造手机芯片的关键材料是二氧化硅
B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池电极材料碳纳米管是新型无机非金属材料
√
1
2
3
4
5
6
7
8
9
10
11
解析 硅是制造手机芯片的材料,故A错误;
铜具有良好的导电性,常用于制作导线,所以用铜制作手机线路板利用了铜优良的导电性,故B正确;
合金的硬度比各成分的硬度大,所以镁铝合金制成的手机外壳具有轻便抗压的特点,故C正确;
用作手机电池电极材料的碳纳米管是新型无机非金属材料,故D正确。
1
2
3
4
5
6
7
8
9
10
11
9.硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B.碳化硅(SiC)的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2
D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键个数之比为1∶2
解析 A项,在氮化硅中N元素为-3价,Si元素为+4价则化学式为Si3N4,正确;
D项,在SiO2晶体中,一个硅原子与周围4个氧原子形成4个硅氧单键,错误。
√
1
2
3
4
5
6
7
8
9
10
11
10.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是
A.陶瓷餐具
B.石英钟表
C.计算机芯片
D.光导纤维
解析 陶瓷餐具是硅酸盐产品,石英钟表和光导纤维用到SiO2,计算机芯片用到单质硅。
√
1
2
3
4
5
6
7
8
9
10
11
11.改革开放以来,我国取得了很多世界瞩目的科技成果,下列说法不正确的是
A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.国产C919用到的氮化硅陶瓷是新型无机非金属材料
D.中国天眼传输信息用的光纤材料是高纯硅
√
1
2
3
4
5
6
7
8
9
10
11
解析 A对,蛟龙号潜水器用到钛合金,22号钛元素位于第四周期,第ⅣB族,属于过渡元素。
B对,合金材料一般具有强度大、密度小、耐腐蚀等性能。
C对,氮化硅陶瓷是新型无机非金属材料。
D错,中国天眼传输信息用的光纤材料是二氧化硅。
1
2
3
4
5
6
7
8
9
10
11
B组 综合强化练
1.合金相对于纯金属制成的金属材料来说优点是
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它的各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤
B.②③④
C.①②④
D.①②④⑤
√
1
2
3
4
5
6
7
8
解析 合金具有许多优良的物理、化学或机械性能,在许多方面优于各成分金属。例如,合金的硬度一般比其各成分金属的硬度大,多数合金的熔点比其各成分金属的熔点低,但合金的导电性比纯金属弱。
1
2
3
4
5
6
7
8
2.下列说法正确的是
A.青铜是我国使用最早的合金,也是目前使用最广泛的合金
B.不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样
C.我们日常生活中用到的铜合金制品主要是黄铜制的
D.各种铜合金都有良好的导电、导热性
1
2
3
4
5
6
7
8
√
解析 青铜是我国使用最早的合金,但目前使用最广泛的合金是铁合金;铜合金与铜相比,因熔合了其他元素,其机械性能和硬度、熔点等性质发生变化;白铜的导电、导热性均比铜单质差。
3.易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是
A.加入盐酸产生无色气体,含铝、铁、镁三种元素
B.加入氢氧化钠溶液有无色气体产生,含有铝元素
C.加入盐酸后,所得溶液中再加入少量氢氧化钠溶液产生白色沉淀,含
有镁元素
D.加入盐酸后,所得溶液中再加入少量硫氰化钾溶液呈红色,含有铁元素
√
1
2
3
4
5
6
7
8
解析 铝、铁、镁都能与盐酸反应产生氢气,所得的溶液中加入少量氢氧化钠溶液,能产生白色沉淀的可能是氯化镁溶液,也可能是氯化铝溶液;
铝能与氢氧化钠溶液反应产生氢气;铁单质与酸反应产生Fe2+,不能使硫氰化钾溶液变红色。
1
2
3
4
5
6
7
8
4.下列说法正确的是
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
√
1
2
3
4
5
6
7
8
解析 不锈钢中含有非金属碳,A项不正确;
我国流通的硬币材质是合金,B项不正确;
铝的冶炼方法在十九世纪才被发现,明朝时不可能有大量铝制餐具,C项不正确;
合金的机械加工性能一般优于其成分金属,D项正确。
1
2
3
4
5
6
7
8
5.高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
1
2
3
4
5
6
7
8
下列说法正确的是
A.步骤①的化学方程式为SiO2+C
Si+CO2↑
B.步骤①②③中每生成或反应1
mol
Si,转移2
mol电子
C.SiHCl3(沸点33.0
℃)中含有少量的SiCl4(沸点67.6
℃),通过蒸馏(或分馏)
可提纯SiHCl3
D.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
√
1
2
3
4
5
6
7
8
解析 二氧化硅在高温下与C反应生成CO气体,即步骤①的化学方程式为SiO2+2C
Si+2CO↑,故A错误;
步骤①中Si的化合价降低4,每生成1
mol
Si转移电子数为4
mol,步骤②中生成SiHCl3,化合价升高2,步骤③中每生成1
mol
Si,转移2
mol电子,故B错误;
沸点相差30
℃以上的两种液体可以采用蒸馏的方法分离,故C正确;
硅能与氢氟酸反应生成氢气和SiF4,故D错误。
6.根据不同部位工作条件的不同,航天飞机使用了多种防热材料。例如,机身和机翼下表面使用高温陶瓷瓦。下列对新型陶瓷材料的有关叙述中,错误的是
A.高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料
B.氧化铝陶瓷属于新型无机非金属材料,它是结构陶瓷
C.氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面
D.新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比
较差
√
1
2
3
4
5
6
7
8
解析 高温结构陶瓷包括Si3N4陶瓷、SiC陶瓷等,属于新型无机非金属材料,可以作为高级耐火材料,A正确;
氧化铝陶瓷属于新型无机非金属材料,是结构陶瓷,B正确;
氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面,C正确;
新型无机非金属材料具有耐高温、耐冲击、电学特性、光学特性、生物功能等优点,克服了传统无机非金属材料的缺点,具有较高的强度和耐磨性,D错误。
1
2
3
4
5
6
7
8
7.我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
1
2
3
4
5
6
7
8
应用
“复兴号”高铁车轮
“鲲龙”水陆两栖飞机零部件
华为折叠手机屏幕
用到的材料
高速钢
钛合金、铝合金
聚酰亚胺塑料
(1)上述材料中属于有机合成材料的是_______________,属于金属材料的是__________________________(写一种即可)。
解析 聚酰亚胺塑料是一种有机合成材料,合金相对于成分金属往往硬度更大,更耐腐蚀。
聚酰亚胺塑料
高速钢(或钛合金或铝合金)
(2)飞机外壳用钛合金、铝合金的优点是_____________________。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为___________________________,反应基本类型是________________。
1
2
3
4
5
6
7
8
应用
“复兴号”高铁车轮
“鲲龙”水陆两栖飞机零部件
华为折叠手机屏幕
用到的材料
高速钢
钛合金、铝合金
聚酰亚胺塑料
耐腐蚀、硬度大等
置换反应
8.铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响,请完成(1)~(3)题。
(1)在化学反应中,铜元素可表现为0、+1、+2价。在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(CuSO4)跟铁反应就生成铜]。试写出该反应的化学方程式:__________________________。
解析 实际上是用铁还原CuSO4得到单质铜。
1
2
3
4
5
6
7
8
CuSO4+Fe===FeSO4+Cu
(2)铜器表面有时会生成铜绿[Cu2(OH)2CO3],这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物反应的化学方程式:
_______________________________________________________________________________________________。
解析 因为铜绿(碱式碳酸铜)能与酸反应,生成可溶性盐和气体,故可用酸除之。
1
2
3
4
5
6
7
8
Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑[或Cu2(OH)2CO3+2H2SO4===2CuSO4+3H2O+CO2↑]
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析铜为什么常用于制造货币(铜的熔点是1
183.4
℃,铁的熔点是1
534.8
℃)______________________________________________________
__________________。
解析 铜在古代作为货币主要因为其熔点低,易于铸造,且不易被腐蚀。
返回
1
2
3
4
5
6
7
8
铜的化学性质比较稳定,不易被腐蚀;铜的熔点比较低,
容易冶炼铸造成型
本课结束
