高中化学苏教版(2019)必修第二册 专题9 第一单元 金属的冶炼方法(58张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)必修第二册 专题9 第一单元 金属的冶炼方法(58张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-26 17:23:46 | ||
图片预览











文档简介
(共58张PPT)
第一单元 金属的冶炼方法
1.熟知铁、铝的冶炼原理和方法。
2.知道金属在自然界中的存在形态和金属冶炼的一般方法,会写相关
的化学方程式。
3.认识我国古代文明与金属冶炼的关系;感受物质制备中丰富的化学
思想。
核心素养发展目标
一、金属的存在形式
随堂演练 知识落实
课时对点练
二、金属的冶炼
内
容
索
引
1.金属的存在形式
(1)_______:以_____形式存在,比如_______________等。
(2)_______:以_______形式存在,比如铁元素存在于赤铁矿中,铝元素存在于铝土矿中等。
(3)还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
一、金属的存在形式
游离态
单质
自然金和自然银
化合态
化合态
2.金属的存在形式与其活动性的关系
(1)活动性较___的金属,以各种各样的_______存在于自然界中。
(2)活动性较___的金属,有可能以_______形式存在。
3.铁、银元素的存在形式
(1)铁元素在自然界中存在形式既有_______也有_______,主要以______
的形式存在。铁元素有_____(主要存在于_____中)_______和_______等存在形式。
(2)银元素有_______、_______(Ag2S)、_______(Ag2Te)等存在形式。
化合态
强
弱
游离态
游离态
化合态
化合态
单质
陨石
氧化物
硫酸盐
自然银
辉银矿
碲银矿
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)金属元素主要存在于地壳的矿石中,海洋中几乎没有金属元素( )
(3)由于银活动性较弱,在自然界中只有游离态的自然银没有化合态的银矿石( )
(4)铝的活动性较强,所以铝被人类开发利用年限较早( )
(5)金属铜是人类使用和开发比较早的金属之一( )
×
判断正误
×
×
×
√
如图表示金属活动性顺序
表中铜、锡、铁和铝元素
被人类大规模开发利用的
大致年限。
(1)新石器中期,在我国的河北和甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
提示 铁的金属活动性较铜强,自然界中没有自然铁,自然铁主要存在于陨石中。
深度思考
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
提示 金属的活动性越弱,人类开发、利用它的时间越早;金属的活动性越强,人类开发、利用它的时间越迟。
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
返回
1.金属冶炼
(1)定义:利用_________使金属元素从_______变为_______的过程。
(2)金属的冶炼方法
①热分解法:适合冶炼________________的金属。
例如:____________________,
。
②高温还原法:用________________________________还原金属氧化物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
例如:__________________________。
二、金属的冶炼
化学反应
化合态
游离态
金属活动性较差
还原剂(CO、C、H2和活泼金属等)
③电解法:适合冶炼________________的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
例如:MgCl2(熔融)
__________,
2NaCl(熔融)
___________,
2Al2O3(熔融)
___________。
金属活动性较强
Mg+Cl2↑
2Na+Cl2↑
4Al+3O2↑
2.铁的冶炼
(1)高炉炼铁
①原料:_______、_____、_______等。
②设备:_________。
③原理:高温下用还原剂将_______________________。
铁矿石
焦炭
石灰石
炼铁高炉
铁从其化合物中还原出来
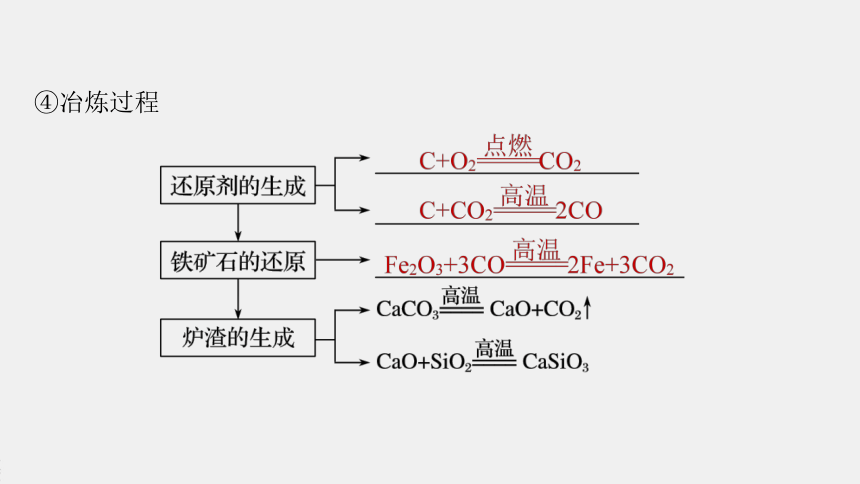
④冶炼过程
实验装置
?
(2)铝热法炼铁
铝热反应实验中的有关问题
为铝热反应提供高温条件
产生氧气,引发反应
氧化铁和铝粉的混合物
实验现象
①_____________________________________________,氧化铁与铝粉在较高温度下发生剧烈的反应;
②______________________________________
实验结论
高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式:__________________________
原理应用
①冶炼___________、活动性____于Al的金属,如钒、铬、锰、钨等。
②金属焊接,如__________等
镁带剧烈燃烧,放出大量的热,并发出耀眼的白光
纸漏斗的下部被烧穿,有熔融物落入沙中
熔点较高
弱
焊接钢轨
(1)赤铁矿的主要成分为Fe3O4( )
(2)MgO与Al粉的混合物也可称为铝热剂( )
(3)活泼的金属如Na、Mg、Al可采用电解法冶炼( )
(4)高炉炼铁中加入的石灰石只会产生炉渣,无其他作用( )
(5)高炉炼铁中其实还原氧化铁的还原剂是CO( )
判断正误
√
×
×
×
√
金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
?
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是____________________________________________。
理解应用
铜>铁>铝
能
铬排在氢前,而铜排在氢后,铬的活动性大于铜
解析 由图中标注的开发年代可知铜开发的最早,铝最晚;因为氢前金属可与酸反应生成氢气,所以铬在氢前,而铜在氢后,依据活动性强的金属可从活动性弱的金属的盐溶液中把金属置换出来可知铬的活动性大于铜。
(2)炼铁的原理是高温下,利用一氧化碳与氧化铁的反应,其反应的化学方程式为Fe2O3+3CO
2Fe+3X,则X的化学式是_____。
CO2
解析 依据化学反应前后原子的个数及种类不变可知X中应该含有1个碳原子和2个氧原子,则是二氧化碳,只有这样才能保证原子的个数反应前后不变。
(3)工业上,采用电解熔融氧化铝(Al2O3)的方法冶炼铝,电解熔融氧化铝
生成铝和氧气,写出反应的化学方程式:___________________________。
解析 叙述中反应物是氧化铝,生成物是铝与氧气,条件是通电,方程式为2Al2O3(熔融)
4Al+3O2↑。
(1)金属的冶炼方法与金属活动性的关系
归纳总结
返回
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼金属从它的盐溶液中置换出来。
例如:CuSO4+Fe===Cu+FeSO4。
1.高炉炼铁生产中下列说法正确的是
A.还原氧化铁的还原剂是焦炭
B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是为了除去过量碳
D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
1
2
3
5
随堂演练 知识落实
4
√
6
解析 A项中,焦炭发生的反应:
其中CO将铁矿石中的铁还原成铁单质,A项错误;
高炉炼铁得到的只是含碳量为2%~4.5%的生铁,不会得到纯铁,B项错误;
加入石灰石的目的是它在高温下分解成生石灰,继而再与SiO2反应生成CaSiO3炉渣,除去杂质SiO2,故C项错误。
1
2
3
5
4
6
解析 A项,关于金属冶炼的本质和方法的叙述是正确的;
B项,湿法炼铜是用铁置换出铜;
C项,炼铁中加入石灰石是为了除去二氧化硅杂质;
D项,工业上电解熔融的NaCl来制取Na。
2.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活
动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
1
2
3
5
4
√
6
解析 工业上电解熔融的氯化镁来制取金属Mg,A错误;
钙的工业制法与镁相似,电解熔融的氯化钙,B错误;
工业制取Mn用高温还原法,单质Al与二氧化锰发生置换反应,C正确;
汞单质的制取用热分解法,分解HgO得到Hg单质,D错误。
3.工业上制备下列金属,采用的化学反应原理正确的是
√
1
2
3
5
4
6
4.下列各种冶炼方法中,可制得相应金属的为
A.高温分解碳酸钙
B.电解熔融氯化镁
C.氧化铝和焦炭混合加热
D.电解饱和食盐水
√
1
2
3
5
4
6
5.目前电动车、手机等使用的新型电池——锂电池,是一种高效、环保电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是
A.电解法
B.高温还原法
C.热分解法
D.铝热还原法
1
2
3
5
4
√
6
解析 中等活泼的金属用高温还原法冶炼;活泼金属用电解法冶炼;不活泼金属用热分解法冶炼;高熔点金属用铝热法冶炼。
6.冶炼金属常用以下几种方法:
①以C、CO或H2作还原剂 ②利用铝热反应原理还原
③电解法 ④热分解法。下列金属各采用哪种方法还原最佳。
(1)Fe、Zn、Cu等中等活泼金属_____(填序号,下同)。
(2)Na、Mg、Al等活泼或较活泼金属______。
(3)Hg、Ag等不活泼金属_____。
(4)V、Cr、Mn、W等高熔点金属_____。
1
2
3
5
4
①
③
④
②
6
返回
题组一 金属冶炼与金属活动性的关系
1.从使用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。使用金属的先后顺序跟下列有关的是
①地壳中的金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易顺序 ⑤金属的延展性
A.①③
B.②④
C.③⑤
D.②⑤
课时对点练
1
2
3
4
5
6
7
8
9
10
√
A组 基础对点练
解析 由图可知,活泼性越弱的金属越早被人类开发利用,因此金属开发利用的大致年代与其活动性有关。
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示三种金属被人类开发利用的大致年代,之所以有先后,主要取决于
A.金属的导电性强弱
B.地壳中金属元素的含量多少
C.金属的化合价高低
D.金属的活动性强弱
1
2
3
4
5
6
7
8
9
10
√
3.已知一些金属单质的发现与其金属活动性存在着某种必然的联系,你认为下列事件发生在铁器时代之前的是
①金属铝的冶炼 ②青铜器时代 ③金银的使用 ④戴维发现金属钠 ⑤15世纪中国使用锌铸币
A.②③⑤
B.②③
C.①②③
D.①④⑤
√
1
2
3
4
5
6
7
8
9
10
题组二 金属的冶炼原理与方法
4.工业上冶炼金属一般用热分解法、高温还原法和电解法。选用不同方法冶炼不同金属的主要依据是
A.金属在自然界中的存在形式
B.金属元素在地壳中的含量
C.金属阳离子得电子的能力
D.金属熔点的高低
1
2
3
4
5
6
7
8
9
10
√
5.我国古代曾用火烧孔雀石和焦炭混合物的方法炼铜。孔雀石的主要成分是CuCO3·Cu(OH)2,这种冶炼铜的方法是
A.焦炭还原法
B.湿法炼铜
C.铝热还原法
D.电解法
1
2
3
4
5
6
7
8
9
10
√
解析 CuCO3·Cu(OH)2
2CuO+CO2↑+H2O,生成的CuO被焦炭与
CO2反应生成的CO还原生成Cu。
6.工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如图:
下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.Y是HCl,它与
反应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将试剂X与Y进行对换,最终可以达到相同结果
1
2
3
4
5
6
7
8
9
10
√
解析 B项,若Y是HCl,它与
反应生成Al3+,错误;
C项,图中所示转化只有2Al2O3(熔融)
4Al+3O2↑是氧化还原反应,
错误;
D项,试剂X为氢氧化钠溶液,沉淀C为氧化铁,溶液A为偏铝酸钠和氢氧化钠溶液,通入过量二氧化碳气体,发生反应:NaAlO2+CO2+2H2O
===Al(OH)3↓+NaHCO3,不能对换,错误。
1
2
3
4
5
6
7
8
9
10
7.铝热反应(2Al+Fe2O3
Al2O3+2Fe)的实验装置如图所示,有关该
反应的下列说法中正确的是
A.a为镁条
B.b为氧化铁与铝粉的混合物
C.2
mol氧化剂参与反应转移电子的数目为6NA
D.还原剂与氧化产物的物质的量之比为1∶2
1
2
3
4
5
6
7
8
9
10
√
解析 a为镁条,起引燃作用,A项正确;
b为氯酸钾,B项错误;
该反应中的氧化剂是氧化铁,2
mol氧化铁参与反
应转移电子的数目为12NA,C项错误;
该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,D项错误。
1
2
3
4
5
6
7
8
9
10
解析 此题考查了正在迅速发展的生物炼铜技术。生物炼铜是一项成本低、污染小、反应简单、前景广阔的新兴炼铜技术,其利用“吃岩石的细菌”将不溶性的硫化铜转化为可溶性硫酸铜,而使铜的冶炼变得简单。
题组三 金属冶炼在新情境下的应用
8.生物炼铜是利用某些具有特殊本领的微生物帮助我们从矿石中提取铜,这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化为可溶性的铜的化合物,这种可溶性的铜化合物是
A.碳酸铜
B.硝酸铜
C.硫酸铜
D.氢氧化铜
1
2
3
4
5
6
7
8
9
10
√
题组四 高炉炼铁及有关计算
9.在高温下用一氧化碳还原m
g四氧化三铁得到n
g铁。已知氧的相对原子质量为16,则铁的相对原子质量为
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 设铁的相对原子质量为x,则
解析 焦炭在炼铁的过程中既作为能源提供反应所需要的能量,同时生成CO作为还原剂,还原出铁矿石中的Fe。
10.钢铁工业对促进经济和社会的发展具有重要的意义,现代炼铁的主要方法是高炉炼铁。其设备如图所示。炼铁的炉料(铁矿石、焦炭、石灰石等)由高炉的顶部投入,原料在下降过程中与高炉气气流在炉身部分发生作用。请回答下列问题:
(1)焦炭在炼铁的过程中所起的作用是___________
________________。
1
2
3
4
5
6
7
8
9
10
既提供热量,
又产生还原剂CO
解析 采用炉料从上部加入,热空气从下部通入的工艺,主要是采用逆流操作,不仅利于矿石与还原性气体充分接触,还增加了接触时间,利于反应。
(2)采用炉料从上部加入,热空气从下部通入的工艺,其目的是________________________________
_____________________。
1
2
3
4
5
6
7
8
9
10
采用逆流接触操作,使矿石与还原
性气体充分接触、反应
解析 炼铁高炉中发生的主要反应就是还原剂的生成及生成铁的反应。
(3)写出以赤铁矿为原料的炼铁高炉中发生的主要化学反应:__________________________________
___________________________。
1
2
3
4
5
6
7
8
9
10
解析 高炉气的主要成分有CO、CO2等,其主要气态污染物是有毒的CO;回收利用CO,可用作燃料或还原剂等。
(4)高炉气中含有的主要气态污染物是______,若直接排放将污染空气,因此应回收利用,请写出该污染物的一种用途:__________________。
1
2
3
4
5
6
7
8
9
10
CO
用作燃料(或还原剂)
B组 综合强化练
1
2
3
4
5
6
7
1.下列关于金属的说法不正确的是
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应
B.工业上金属Mg、Cu都是用高温还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
√
解析 在工业上Mg用电解法冶炼,Cu用高温还原法冶炼,B项错误。
8
选项
冶炼原理
方法
A
热分解法
B
电解法
C
热分解法
D
高温还原法
2.下表中金属冶炼的原理与方法错误的是
√
1
2
3
4
5
6
7
8
解析 活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用高温还原法冶炼,不活泼金属Hg、Ag等用热分解法冶炼,故A、B、D三项正确,C项错误。
1
2
3
4
5
6
7
8
3.下列反应原理不符合工业冶炼金属实际情况的是
√
1
2
3
4
5
6
7
8
4.从化学原理和经济利益角度分析,下列从海水中提取镁单质的方法最可行的是
√
1
2
3
4
5
6
7
8
解析 高温下石灰石首先分解生成CaO和CO2,生成的生石灰(碱性氧化物)可与SiO2(酸性氧化物)反应实现高炉造渣;生成的CO2可与碳反应提供一部分还原剂CO。因无单质硅,所以没有B项所给的反应发生。
5.硅在自然界只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)的形式存在。炼铁时为了除去脉石,向炼铁高炉中加入石灰石。该过程不可能涉及到的化学反应是
√
1
2
3
4
5
6
7
8
6.用足量的CO还原32.0
g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60
g沉淀,则该氧化物是
A.FeO
B.Fe2O3
C.CuO
D.Cu2O
1
2
3
4
5
6
7
√
解析 n(CaCO3)=
=0.6
mol,由于1
mol
CO与氧化物反应后变成1
mol
CO2,夺取了氧化物中的1
mol
O,故可知32.0
g氧化物中含氧原子0.6
mol,氧元素的质量为9.6
g,则氧化物中金属元素的质量为22.4
g,
两元素的物质的量之比为
8
7.火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2===Cu2S+2FeS+SO2,下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2只是还原剂,硫元素被氧化
C.每生成1
mol
Cu2S,有4
mol硫被氧化
D.每转移1.2
mol电子,有0.2
mol硫被氧化
1
2
3
4
5
6
7
√
8
解析 由反应方程式知,CuFeS2中Cu化合价降低被还原为Cu2S,CuFeS2中
的S化合价升高,被氧化为SO2;O2在反应后化合价降低,被还原为SO2,因此可知SO2既是氧化产物又是还原产物,A项错误;
CuFeS2既是氧化剂又是还原剂,B项错误;
每生成1
mol
Cu2S,有1
mol硫被氧化,C项错误;
利用反应知转移6
mol
e-,有1
mol硫被氧化,D项正确。
1
2
3
4
5
6
7
8
解析 Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的实质是Al2O3+2OH-===
+H2O。
8.铝土矿(主要成分为Al2O3,还有少量杂质,杂质不溶于NaOH溶液)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
(1)请用离子方程式表示以上工艺流程中第①步反应:
________________
_____________。
1
2
3
4
5
6
7
Al2O3+2OH-===
8
解析 向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3。
(2)写出以上工艺流程中第③步反应的化学方程式:__________________
___________________________。
1
2
3
4
5
6
7
2H2O===Al(OH)3↓+NaHCO3
NaAlO2+CO2+
8
解析 上述分析可知步骤④是过滤得到氢氧化铝沉淀的操作。
(3)步骤④所需进行的实验操作是______。
1
2
3
4
5
6
7
过滤
8
解析 金属铝在高温下可以和氧化铁发生铝热反应,反应的化学方程式为2Al+Fe2O3
2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨。
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_________________________。请举一例该反应的用途_________。
1
2
3
4
5
6
7
焊接钢轨
8
解析 电解熔融氧化铝制取金属铝2Al2O3(熔融)
4Al+3O2↑,2
mol
Al2O3反应转移电子为12
mol,若有0.6
mol电子发生转移,则能得到金属
铝的质量是
(5)电解熔融氧化铝制取金属铝,若有0.6
mol电子发生转移。理论上能得到金属铝的质量是______。
1
2
3
4
5
6
7
5.4
g
返回
8
本课结束
第一单元 金属的冶炼方法
1.熟知铁、铝的冶炼原理和方法。
2.知道金属在自然界中的存在形态和金属冶炼的一般方法,会写相关
的化学方程式。
3.认识我国古代文明与金属冶炼的关系;感受物质制备中丰富的化学
思想。
核心素养发展目标
一、金属的存在形式
随堂演练 知识落实
课时对点练
二、金属的冶炼
内
容
索
引
1.金属的存在形式
(1)_______:以_____形式存在,比如_______________等。
(2)_______:以_______形式存在,比如铁元素存在于赤铁矿中,铝元素存在于铝土矿中等。
(3)还有一些金属以离子或矿石的形式分布于海洋中,如钠、镁、锰等。
一、金属的存在形式
游离态
单质
自然金和自然银
化合态
化合态
2.金属的存在形式与其活动性的关系
(1)活动性较___的金属,以各种各样的_______存在于自然界中。
(2)活动性较___的金属,有可能以_______形式存在。
3.铁、银元素的存在形式
(1)铁元素在自然界中存在形式既有_______也有_______,主要以______
的形式存在。铁元素有_____(主要存在于_____中)_______和_______等存在形式。
(2)银元素有_______、_______(Ag2S)、_______(Ag2Te)等存在形式。
化合态
强
弱
游离态
游离态
化合态
化合态
单质
陨石
氧化物
硫酸盐
自然银
辉银矿
碲银矿
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)金属元素主要存在于地壳的矿石中,海洋中几乎没有金属元素( )
(3)由于银活动性较弱,在自然界中只有游离态的自然银没有化合态的银矿石( )
(4)铝的活动性较强,所以铝被人类开发利用年限较早( )
(5)金属铜是人类使用和开发比较早的金属之一( )
×
判断正误
×
×
×
√
如图表示金属活动性顺序
表中铜、锡、铁和铝元素
被人类大规模开发利用的
大致年限。
(1)新石器中期,在我国的河北和甘肃等地就已用自然铜来打制铜器,俄罗斯和意大利都有自然铜的矿产地。但很少听闻关于自然铁(单质铁)矿产的报道。为什么?
提示 铁的金属活动性较铜强,自然界中没有自然铁,自然铁主要存在于陨石中。
深度思考
(2)根据以上金属的活动性和人类开发利用这些金属时间的数据,你发现了什么规律?
提示 金属的活动性越弱,人类开发、利用它的时间越早;金属的活动性越强,人类开发、利用它的时间越迟。
(3)找出你熟悉的2~3种金属单质,说明它们的制备方法,写出有关的化学方程式。
返回
1.金属冶炼
(1)定义:利用_________使金属元素从_______变为_______的过程。
(2)金属的冶炼方法
①热分解法:适合冶炼________________的金属。
例如:____________________,
。
②高温还原法:用________________________________还原金属氧化物,适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
例如:__________________________。
二、金属的冶炼
化学反应
化合态
游离态
金属活动性较差
还原剂(CO、C、H2和活泼金属等)
③电解法:适合冶炼________________的金属(一般为金属活动性顺序表中铝及铝前面的金属)。
例如:MgCl2(熔融)
__________,
2NaCl(熔融)
___________,
2Al2O3(熔融)
___________。
金属活动性较强
Mg+Cl2↑
2Na+Cl2↑
4Al+3O2↑
2.铁的冶炼
(1)高炉炼铁
①原料:_______、_____、_______等。
②设备:_________。
③原理:高温下用还原剂将_______________________。
铁矿石
焦炭
石灰石
炼铁高炉
铁从其化合物中还原出来
④冶炼过程
实验装置
?
(2)铝热法炼铁
铝热反应实验中的有关问题
为铝热反应提供高温条件
产生氧气,引发反应
氧化铁和铝粉的混合物
实验现象
①_____________________________________________,氧化铁与铝粉在较高温度下发生剧烈的反应;
②______________________________________
实验结论
高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式:__________________________
原理应用
①冶炼___________、活动性____于Al的金属,如钒、铬、锰、钨等。
②金属焊接,如__________等
镁带剧烈燃烧,放出大量的热,并发出耀眼的白光
纸漏斗的下部被烧穿,有熔融物落入沙中
熔点较高
弱
焊接钢轨
(1)赤铁矿的主要成分为Fe3O4( )
(2)MgO与Al粉的混合物也可称为铝热剂( )
(3)活泼的金属如Na、Mg、Al可采用电解法冶炼( )
(4)高炉炼铁中加入的石灰石只会产生炉渣,无其他作用( )
(5)高炉炼铁中其实还原氧化铁的还原剂是CO( )
判断正误
√
×
×
×
√
金属与人类生活和社会发展的关系非常密切。
(1)如图表示金属活动性顺序表中铜、铁和铝元素被人类大规模开发、利用的大致年限。
?
图中信息可以说明:铜、铁和铝的金属活动性强弱与人类开发、利用它们的时间先后的关系是____________。金属铬(Cr)能溶解在热的盐酸中,放出H2,同时生成CrCl2,预测:铬____(填“能”或“不能”)与硫酸铜溶液反应,理由是____________________________________________。
理解应用
铜>铁>铝
能
铬排在氢前,而铜排在氢后,铬的活动性大于铜
解析 由图中标注的开发年代可知铜开发的最早,铝最晚;因为氢前金属可与酸反应生成氢气,所以铬在氢前,而铜在氢后,依据活动性强的金属可从活动性弱的金属的盐溶液中把金属置换出来可知铬的活动性大于铜。
(2)炼铁的原理是高温下,利用一氧化碳与氧化铁的反应,其反应的化学方程式为Fe2O3+3CO
2Fe+3X,则X的化学式是_____。
CO2
解析 依据化学反应前后原子的个数及种类不变可知X中应该含有1个碳原子和2个氧原子,则是二氧化碳,只有这样才能保证原子的个数反应前后不变。
(3)工业上,采用电解熔融氧化铝(Al2O3)的方法冶炼铝,电解熔融氧化铝
生成铝和氧气,写出反应的化学方程式:___________________________。
解析 叙述中反应物是氧化铝,生成物是铝与氧气,条件是通电,方程式为2Al2O3(熔融)
4Al+3O2↑。
(1)金属的冶炼方法与金属活动性的关系
归纳总结
返回
(2)在工业上还有一种冶炼方法叫做湿法冶金,即利用活泼金属把不活泼金属从它的盐溶液中置换出来。
例如:CuSO4+Fe===Cu+FeSO4。
1.高炉炼铁生产中下列说法正确的是
A.还原氧化铁的还原剂是焦炭
B.采用富氧空气可以得到纯铁
C.加石灰石的目的主要是为了除去过量碳
D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿
1
2
3
5
随堂演练 知识落实
4
√
6
解析 A项中,焦炭发生的反应:
其中CO将铁矿石中的铁还原成铁单质,A项错误;
高炉炼铁得到的只是含碳量为2%~4.5%的生铁,不会得到纯铁,B项错误;
加入石灰石的目的是它在高温下分解成生石灰,继而再与SiO2反应生成CaSiO3炉渣,除去杂质SiO2,故C项错误。
1
2
3
5
4
6
解析 A项,关于金属冶炼的本质和方法的叙述是正确的;
B项,湿法炼铜是用铁置换出铜;
C项,炼铁中加入石灰石是为了除去二氧化硅杂质;
D项,工业上电解熔融的NaCl来制取Na。
2.下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活
动性决定
B.铜的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.铁通常采用高温还原法冶炼,加入石灰石的目的是除去过量的碳
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
1
2
3
5
4
√
6
解析 工业上电解熔融的氯化镁来制取金属Mg,A错误;
钙的工业制法与镁相似,电解熔融的氯化钙,B错误;
工业制取Mn用高温还原法,单质Al与二氧化锰发生置换反应,C正确;
汞单质的制取用热分解法,分解HgO得到Hg单质,D错误。
3.工业上制备下列金属,采用的化学反应原理正确的是
√
1
2
3
5
4
6
4.下列各种冶炼方法中,可制得相应金属的为
A.高温分解碳酸钙
B.电解熔融氯化镁
C.氧化铝和焦炭混合加热
D.电解饱和食盐水
√
1
2
3
5
4
6
5.目前电动车、手机等使用的新型电池——锂电池,是一种高效、环保电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是
A.电解法
B.高温还原法
C.热分解法
D.铝热还原法
1
2
3
5
4
√
6
解析 中等活泼的金属用高温还原法冶炼;活泼金属用电解法冶炼;不活泼金属用热分解法冶炼;高熔点金属用铝热法冶炼。
6.冶炼金属常用以下几种方法:
①以C、CO或H2作还原剂 ②利用铝热反应原理还原
③电解法 ④热分解法。下列金属各采用哪种方法还原最佳。
(1)Fe、Zn、Cu等中等活泼金属_____(填序号,下同)。
(2)Na、Mg、Al等活泼或较活泼金属______。
(3)Hg、Ag等不活泼金属_____。
(4)V、Cr、Mn、W等高熔点金属_____。
1
2
3
5
4
①
③
④
②
6
返回
题组一 金属冶炼与金属活动性的关系
1.从使用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。使用金属的先后顺序跟下列有关的是
①地壳中的金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易顺序 ⑤金属的延展性
A.①③
B.②④
C.③⑤
D.②⑤
课时对点练
1
2
3
4
5
6
7
8
9
10
√
A组 基础对点练
解析 由图可知,活泼性越弱的金属越早被人类开发利用,因此金属开发利用的大致年代与其活动性有关。
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示三种金属被人类开发利用的大致年代,之所以有先后,主要取决于
A.金属的导电性强弱
B.地壳中金属元素的含量多少
C.金属的化合价高低
D.金属的活动性强弱
1
2
3
4
5
6
7
8
9
10
√
3.已知一些金属单质的发现与其金属活动性存在着某种必然的联系,你认为下列事件发生在铁器时代之前的是
①金属铝的冶炼 ②青铜器时代 ③金银的使用 ④戴维发现金属钠 ⑤15世纪中国使用锌铸币
A.②③⑤
B.②③
C.①②③
D.①④⑤
√
1
2
3
4
5
6
7
8
9
10
题组二 金属的冶炼原理与方法
4.工业上冶炼金属一般用热分解法、高温还原法和电解法。选用不同方法冶炼不同金属的主要依据是
A.金属在自然界中的存在形式
B.金属元素在地壳中的含量
C.金属阳离子得电子的能力
D.金属熔点的高低
1
2
3
4
5
6
7
8
9
10
√
5.我国古代曾用火烧孔雀石和焦炭混合物的方法炼铜。孔雀石的主要成分是CuCO3·Cu(OH)2,这种冶炼铜的方法是
A.焦炭还原法
B.湿法炼铜
C.铝热还原法
D.电解法
1
2
3
4
5
6
7
8
9
10
√
解析 CuCO3·Cu(OH)2
2CuO+CO2↑+H2O,生成的CuO被焦炭与
CO2反应生成的CO还原生成Cu。
6.工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如图:
下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.Y是HCl,它与
反应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将试剂X与Y进行对换,最终可以达到相同结果
1
2
3
4
5
6
7
8
9
10
√
解析 B项,若Y是HCl,它与
反应生成Al3+,错误;
C项,图中所示转化只有2Al2O3(熔融)
4Al+3O2↑是氧化还原反应,
错误;
D项,试剂X为氢氧化钠溶液,沉淀C为氧化铁,溶液A为偏铝酸钠和氢氧化钠溶液,通入过量二氧化碳气体,发生反应:NaAlO2+CO2+2H2O
===Al(OH)3↓+NaHCO3,不能对换,错误。
1
2
3
4
5
6
7
8
9
10
7.铝热反应(2Al+Fe2O3
Al2O3+2Fe)的实验装置如图所示,有关该
反应的下列说法中正确的是
A.a为镁条
B.b为氧化铁与铝粉的混合物
C.2
mol氧化剂参与反应转移电子的数目为6NA
D.还原剂与氧化产物的物质的量之比为1∶2
1
2
3
4
5
6
7
8
9
10
√
解析 a为镁条,起引燃作用,A项正确;
b为氯酸钾,B项错误;
该反应中的氧化剂是氧化铁,2
mol氧化铁参与反
应转移电子的数目为12NA,C项错误;
该反应中还原剂是铝,氧化产物是氧化铝,还原剂和氧化产物的物质的量之比为2∶1,D项错误。
1
2
3
4
5
6
7
8
9
10
解析 此题考查了正在迅速发展的生物炼铜技术。生物炼铜是一项成本低、污染小、反应简单、前景广阔的新兴炼铜技术,其利用“吃岩石的细菌”将不溶性的硫化铜转化为可溶性硫酸铜,而使铜的冶炼变得简单。
题组三 金属冶炼在新情境下的应用
8.生物炼铜是利用某些具有特殊本领的微生物帮助我们从矿石中提取铜,这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化为可溶性的铜的化合物,这种可溶性的铜化合物是
A.碳酸铜
B.硝酸铜
C.硫酸铜
D.氢氧化铜
1
2
3
4
5
6
7
8
9
10
√
题组四 高炉炼铁及有关计算
9.在高温下用一氧化碳还原m
g四氧化三铁得到n
g铁。已知氧的相对原子质量为16,则铁的相对原子质量为
1
2
3
4
5
6
7
8
9
10
√
1
2
3
4
5
6
7
8
9
10
解析 设铁的相对原子质量为x,则
解析 焦炭在炼铁的过程中既作为能源提供反应所需要的能量,同时生成CO作为还原剂,还原出铁矿石中的Fe。
10.钢铁工业对促进经济和社会的发展具有重要的意义,现代炼铁的主要方法是高炉炼铁。其设备如图所示。炼铁的炉料(铁矿石、焦炭、石灰石等)由高炉的顶部投入,原料在下降过程中与高炉气气流在炉身部分发生作用。请回答下列问题:
(1)焦炭在炼铁的过程中所起的作用是___________
________________。
1
2
3
4
5
6
7
8
9
10
既提供热量,
又产生还原剂CO
解析 采用炉料从上部加入,热空气从下部通入的工艺,主要是采用逆流操作,不仅利于矿石与还原性气体充分接触,还增加了接触时间,利于反应。
(2)采用炉料从上部加入,热空气从下部通入的工艺,其目的是________________________________
_____________________。
1
2
3
4
5
6
7
8
9
10
采用逆流接触操作,使矿石与还原
性气体充分接触、反应
解析 炼铁高炉中发生的主要反应就是还原剂的生成及生成铁的反应。
(3)写出以赤铁矿为原料的炼铁高炉中发生的主要化学反应:__________________________________
___________________________。
1
2
3
4
5
6
7
8
9
10
解析 高炉气的主要成分有CO、CO2等,其主要气态污染物是有毒的CO;回收利用CO,可用作燃料或还原剂等。
(4)高炉气中含有的主要气态污染物是______,若直接排放将污染空气,因此应回收利用,请写出该污染物的一种用途:__________________。
1
2
3
4
5
6
7
8
9
10
CO
用作燃料(或还原剂)
B组 综合强化练
1
2
3
4
5
6
7
1.下列关于金属的说法不正确的是
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应
B.工业上金属Mg、Cu都是用高温还原法制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
√
解析 在工业上Mg用电解法冶炼,Cu用高温还原法冶炼,B项错误。
8
选项
冶炼原理
方法
A
热分解法
B
电解法
C
热分解法
D
高温还原法
2.下表中金属冶炼的原理与方法错误的是
√
1
2
3
4
5
6
7
8
解析 活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用高温还原法冶炼,不活泼金属Hg、Ag等用热分解法冶炼,故A、B、D三项正确,C项错误。
1
2
3
4
5
6
7
8
3.下列反应原理不符合工业冶炼金属实际情况的是
√
1
2
3
4
5
6
7
8
4.从化学原理和经济利益角度分析,下列从海水中提取镁单质的方法最可行的是
√
1
2
3
4
5
6
7
8
解析 高温下石灰石首先分解生成CaO和CO2,生成的生石灰(碱性氧化物)可与SiO2(酸性氧化物)反应实现高炉造渣;生成的CO2可与碳反应提供一部分还原剂CO。因无单质硅,所以没有B项所给的反应发生。
5.硅在自然界只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)的形式存在。炼铁时为了除去脉石,向炼铁高炉中加入石灰石。该过程不可能涉及到的化学反应是
√
1
2
3
4
5
6
7
8
6.用足量的CO还原32.0
g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60
g沉淀,则该氧化物是
A.FeO
B.Fe2O3
C.CuO
D.Cu2O
1
2
3
4
5
6
7
√
解析 n(CaCO3)=
=0.6
mol,由于1
mol
CO与氧化物反应后变成1
mol
CO2,夺取了氧化物中的1
mol
O,故可知32.0
g氧化物中含氧原子0.6
mol,氧元素的质量为9.6
g,则氧化物中金属元素的质量为22.4
g,
两元素的物质的量之比为
8
7.火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2===Cu2S+2FeS+SO2,下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2只是还原剂,硫元素被氧化
C.每生成1
mol
Cu2S,有4
mol硫被氧化
D.每转移1.2
mol电子,有0.2
mol硫被氧化
1
2
3
4
5
6
7
√
8
解析 由反应方程式知,CuFeS2中Cu化合价降低被还原为Cu2S,CuFeS2中
的S化合价升高,被氧化为SO2;O2在反应后化合价降低,被还原为SO2,因此可知SO2既是氧化产物又是还原产物,A项错误;
CuFeS2既是氧化剂又是还原剂,B项错误;
每生成1
mol
Cu2S,有1
mol硫被氧化,C项错误;
利用反应知转移6
mol
e-,有1
mol硫被氧化,D项正确。
1
2
3
4
5
6
7
8
解析 Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的实质是Al2O3+2OH-===
+H2O。
8.铝土矿(主要成分为Al2O3,还有少量杂质,杂质不溶于NaOH溶液)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
(1)请用离子方程式表示以上工艺流程中第①步反应:
________________
_____________。
1
2
3
4
5
6
7
Al2O3+2OH-===
8
解析 向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3。
(2)写出以上工艺流程中第③步反应的化学方程式:__________________
___________________________。
1
2
3
4
5
6
7
2H2O===Al(OH)3↓+NaHCO3
NaAlO2+CO2+
8
解析 上述分析可知步骤④是过滤得到氢氧化铝沉淀的操作。
(3)步骤④所需进行的实验操作是______。
1
2
3
4
5
6
7
过滤
8
解析 金属铝在高温下可以和氧化铁发生铝热反应,反应的化学方程式为2Al+Fe2O3
2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨。
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_________________________。请举一例该反应的用途_________。
1
2
3
4
5
6
7
焊接钢轨
8
解析 电解熔融氧化铝制取金属铝2Al2O3(熔融)
4Al+3O2↑,2
mol
Al2O3反应转移电子为12
mol,若有0.6
mol电子发生转移,则能得到金属
铝的质量是
(5)电解熔融氧化铝制取金属铝,若有0.6
mol电子发生转移。理论上能得到金属铝的质量是______。
1
2
3
4
5
6
7
5.4
g
返回
8
本课结束
