高中化学选择性必修2人教版(2019)3.1 晶胞 课件 (26张ppt)
文档属性
| 名称 | 高中化学选择性必修2人教版(2019)3.1 晶胞 课件 (26张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-27 00:00:00 | ||
图片预览





文档简介
(共26张PPT)
第三章
晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第2课时
晶胞
三、晶胞
1.定义
描述晶体结构的基本单元叫做晶胞。
2.晶体和晶胞的关系
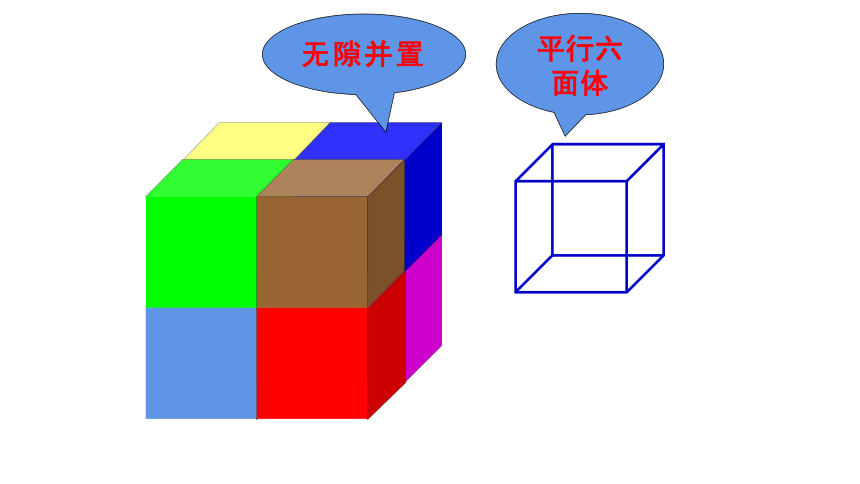
一般来说,常规的晶胞都是平行六面体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是相邻晶胞之间没有任何间隙。
(2)“并置”是所有晶胞都是平行排列的,取向相同。
(3)所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
晶胞是晶体中最小的结构重复单元。
平行六面体
无隙并置
(1)晶胞是否全是平行六面体?(2)由晶胞构成的晶体,其化学式是否表示一个分子中原子的数目?
思考与讨论
【提示】 (1)不一定,如有的晶胞呈六棱柱形。(2)不表示,只表示每个晶胞中各类原子的最简整数比。
(1)晶胞一般是平行六面体,其三条边的长度不一定相等,也不一定互相垂直。晶胞的形状和大小由具体晶体的结构所决定。(2)整个晶体就是晶胞按其周期性在三维空间重复排列而成。每个晶胞上下左右前后无隙并置地排列着与其一样的无数晶胞,决定了晶胞的8个顶角、平行的面以及平行的棱完全相同。
3.晶胞的特点及晶胞中粒子个数的计算
①晶胞的特点
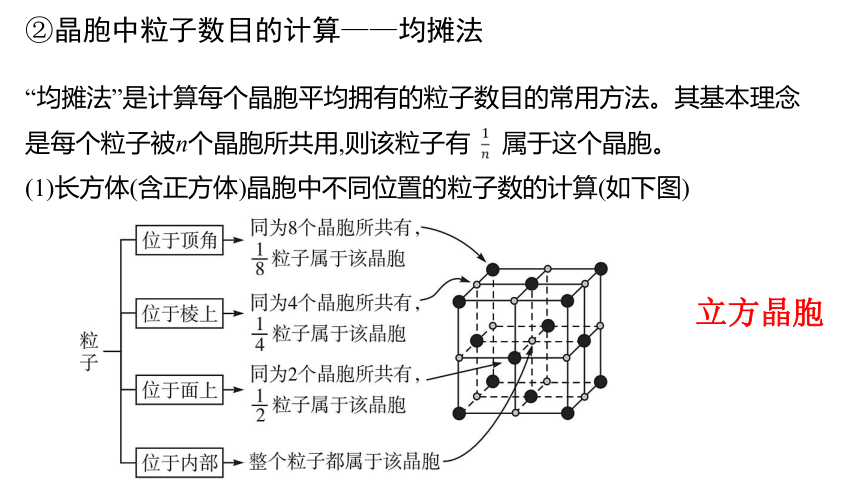
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有
属于这个晶胞。
②晶胞中粒子数目的计算——均摊法
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)
立方晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
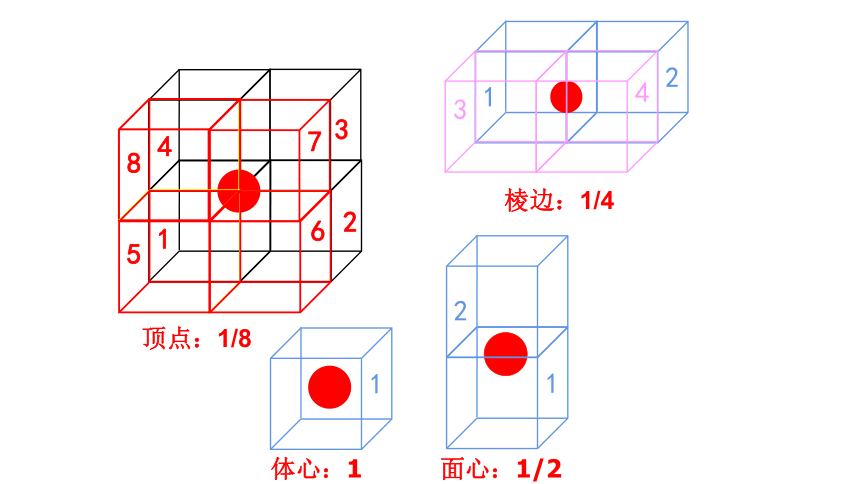
体心:1
面心:1/2
顶点:1/8
棱边:1/4
体心:1
面心:1/2
顶点:1/8
棱边:1/4
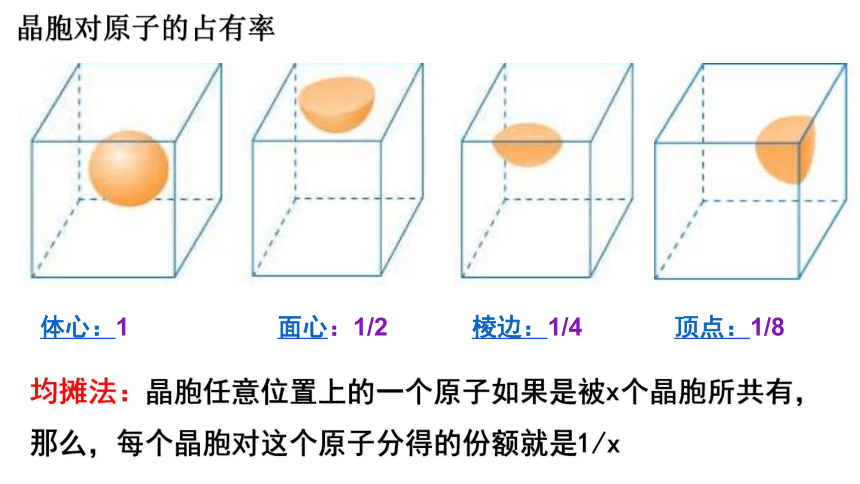
均摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x
晶胞对原子的占有率
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
氯化钠晶胞中所含的Na+、Cl-数
氯化钠晶胞如图所示,其中体积较小的为Na+离子(填“Na+”或“Cl-”,下同),体积较大的为Cl-离子,则晶胞中含4个Na+(提示:晶胞中心还有一个Na+)和4个Cl-。
金属铜的一个晶胞中,位于晶胞顶点的铜原子有
个,位于面心的铜原子有
个,金属铜晶胞中所含的铜原子数平均为
。
8
6
练习:金属铜晶胞中原子个数的计算
思考与讨论
(1)晶胞有几套平行棱?有几套平行面?
晶胞有3套平行棱,有3套平行面?
(2)下图依次是金属钠(Na)、锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
金属钠(C)
金属锌(Zn)
碘(I2)
金刚石(C)
③常见的晶胞
简单立方
体心立方
面心立方
类型
简单立方
体心立方
面心立方
结构特点
在平面六面体的8个顶角上有粒子
除8个顶角上有粒子外,平行六面体的体心上还有1个粒子
除8个顶角上有粒子外,平行六面体的6个面的面心上均有1个粒子
一个晶胞的原子数
1
2
4
晶胞类型
顶角贡献
棱上贡献
面上贡献
内部贡献
六方体
1/6
1/3
1/2
1
正三棱柱
1/12
水平1/4;竖直1/6
1/2
1
(2)非长方体晶胞中的粒子视具体情况而定
非长方体(正方体)晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶角(1个碳原子)被三个六边形共有,每个六边形占该粒子的1/3。
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
现有甲、乙、丙(如图所示)三种晶体的晶胞(甲中X和乙中A均处于晶胞的体心)。
思考与讨论
(1)甲晶胞中X与Y的个数比是多少?
(2)乙晶胞中A与B的个数比是多少?
提示:乙晶胞中,体心的A为1,顶角的B为8×
=1,所以N(A)∶N(B)=1∶1。
(3)丙晶体中每个晶胞包含的C离子、D离子各为多少?
例如:在较高温度时,钾、氧两种元素形成的一种晶体结构,则该化合物的化学式是
。
每个晶胞中属于该晶胞的K+的个数=
;
O2-的个数=
;
故其比值为1:1
四、晶体结构的测定
测定晶体结构最常用的仪器是X射线衍射仪。
通过晶体的X射线衍射实验获得行射图后,经过计算可以从衍射图形获得晶体结构的有关信息,包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
2.X射线衍射实验获得晶胞信息
晶体的X射线衍射实验图经过计算,可以获得包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
3.X射线衍射实验获得分子信息
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
(1)晶胞是晶体的最小重复单元。
(
)(2)晶胞中的任何一个粒子都只属于该晶胞。
(
)
()位于顶角上的粒子一定为8个晶胞所共有。( )
(4)X射线通过晶体,导致晶体发生化学变化,形成特征的衍射图。
( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
2.下图是某晶体的晶胞示意图,其中X粒子位于此晶胞的中心,Y粒子位于8个顶点,该晶体中粒子X和Y的个数比是( )
A.1∶1
B.1∶2
C.1∶4
D.1∶8
解析:X粒子属于晶胞独立拥有,而每个Y粒子则为8个晶胞共用,每个晶胞均摊Y粒子的个数为
×8=1,故A项正确。
A
3.话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
解析:仔细观察钛酸钡晶胞的结构示意图可知:Ba在立方体的体心,完全属于该晶胞;Ti处于立方体的8个顶点,O处于立方体的12条棱的中点,故晶胞中Ba、Ti、O三种原子的个数比为
D
4.如图为甲、乙两种晶体的晶胞示意图:
试写出:
(1)甲晶体的化学式(X为阳离子)为 。?
(2)乙晶体中A、B、C三种粒子的个数比是 。?
X3Y
1∶3∶1
规律总结
晶体化学式的确定流程:观察确认粒子种类→确定各粒子在晶胞中的位置→用均摊法求晶胞均摊各粒子的数目→求各粒子数目的最简比→确定化学式。
5.如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
(1)在该物质的晶体中,每个钛离子周围与它最接近的
且等距离的钛离子共有 个。?
(2)该晶体中,元素氧、钛、钙的粒子个数比是 。?
6
3∶1∶1
解析:回答第(1)小题要注意发挥空间想象力,在晶胞的上、下、左、右、前、后都有完全等同的晶胞,依据一个晶胞我们能观察到3个与钛离子最接近且等距离的钛离子,在与这3个钛离子相反的位置还有3个钛离子,所以共有6个钛离子。对于第(2)小题我们可以使用均摊法求得
第三章
晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第2课时
晶胞
三、晶胞
1.定义
描述晶体结构的基本单元叫做晶胞。
2.晶体和晶胞的关系
一般来说,常规的晶胞都是平行六面体,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是相邻晶胞之间没有任何间隙。
(2)“并置”是所有晶胞都是平行排列的,取向相同。
(3)所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。
晶胞是晶体中最小的结构重复单元。
平行六面体
无隙并置
(1)晶胞是否全是平行六面体?(2)由晶胞构成的晶体,其化学式是否表示一个分子中原子的数目?
思考与讨论
【提示】 (1)不一定,如有的晶胞呈六棱柱形。(2)不表示,只表示每个晶胞中各类原子的最简整数比。
(1)晶胞一般是平行六面体,其三条边的长度不一定相等,也不一定互相垂直。晶胞的形状和大小由具体晶体的结构所决定。(2)整个晶体就是晶胞按其周期性在三维空间重复排列而成。每个晶胞上下左右前后无隙并置地排列着与其一样的无数晶胞,决定了晶胞的8个顶角、平行的面以及平行的棱完全相同。
3.晶胞的特点及晶胞中粒子个数的计算
①晶胞的特点
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有
属于这个晶胞。
②晶胞中粒子数目的计算——均摊法
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)
立方晶胞
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
体心:1
面心:1/2
顶点:1/8
棱边:1/4
均摊法:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x
晶胞对原子的占有率
1
2
4
3
7
6
8
5
1
2
2
1
3
4
1
体心:1
面心:1/2
顶点:1/8
棱边:1/4
氯化钠晶胞中所含的Na+、Cl-数
氯化钠晶胞如图所示,其中体积较小的为Na+离子(填“Na+”或“Cl-”,下同),体积较大的为Cl-离子,则晶胞中含4个Na+(提示:晶胞中心还有一个Na+)和4个Cl-。
金属铜的一个晶胞中,位于晶胞顶点的铜原子有
个,位于面心的铜原子有
个,金属铜晶胞中所含的铜原子数平均为
。
8
6
练习:金属铜晶胞中原子个数的计算
思考与讨论
(1)晶胞有几套平行棱?有几套平行面?
晶胞有3套平行棱,有3套平行面?
(2)下图依次是金属钠(Na)、锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
金属钠(C)
金属锌(Zn)
碘(I2)
金刚石(C)
③常见的晶胞
简单立方
体心立方
面心立方
类型
简单立方
体心立方
面心立方
结构特点
在平面六面体的8个顶角上有粒子
除8个顶角上有粒子外,平行六面体的体心上还有1个粒子
除8个顶角上有粒子外,平行六面体的6个面的面心上均有1个粒子
一个晶胞的原子数
1
2
4
晶胞类型
顶角贡献
棱上贡献
面上贡献
内部贡献
六方体
1/6
1/3
1/2
1
正三棱柱
1/12
水平1/4;竖直1/6
1/2
1
(2)非长方体晶胞中的粒子视具体情况而定
非长方体(正方体)晶胞中粒子视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶角(1个碳原子)被三个六边形共有,每个六边形占该粒子的1/3。
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部:1
现有甲、乙、丙(如图所示)三种晶体的晶胞(甲中X和乙中A均处于晶胞的体心)。
思考与讨论
(1)甲晶胞中X与Y的个数比是多少?
(2)乙晶胞中A与B的个数比是多少?
提示:乙晶胞中,体心的A为1,顶角的B为8×
=1,所以N(A)∶N(B)=1∶1。
(3)丙晶体中每个晶胞包含的C离子、D离子各为多少?
例如:在较高温度时,钾、氧两种元素形成的一种晶体结构,则该化合物的化学式是
。
每个晶胞中属于该晶胞的K+的个数=
;
O2-的个数=
;
故其比值为1:1
四、晶体结构的测定
测定晶体结构最常用的仪器是X射线衍射仪。
通过晶体的X射线衍射实验获得行射图后,经过计算可以从衍射图形获得晶体结构的有关信息,包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
2.X射线衍射实验获得晶胞信息
晶体的X射线衍射实验图经过计算,可以获得包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,以及结合晶体化学组成的信息推出原子之间的相互关系。
3.X射线衍射实验获得分子信息
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
(1)晶胞是晶体的最小重复单元。
(
)(2)晶胞中的任何一个粒子都只属于该晶胞。
(
)
()位于顶角上的粒子一定为8个晶胞所共有。( )
(4)X射线通过晶体,导致晶体发生化学变化,形成特征的衍射图。
( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
2.下图是某晶体的晶胞示意图,其中X粒子位于此晶胞的中心,Y粒子位于8个顶点,该晶体中粒子X和Y的个数比是( )
A.1∶1
B.1∶2
C.1∶4
D.1∶8
解析:X粒子属于晶胞独立拥有,而每个Y粒子则为8个晶胞共用,每个晶胞均摊Y粒子的个数为
×8=1,故A项正确。
A
3.话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
解析:仔细观察钛酸钡晶胞的结构示意图可知:Ba在立方体的体心,完全属于该晶胞;Ti处于立方体的8个顶点,O处于立方体的12条棱的中点,故晶胞中Ba、Ti、O三种原子的个数比为
D
4.如图为甲、乙两种晶体的晶胞示意图:
试写出:
(1)甲晶体的化学式(X为阳离子)为 。?
(2)乙晶体中A、B、C三种粒子的个数比是 。?
X3Y
1∶3∶1
规律总结
晶体化学式的确定流程:观察确认粒子种类→确定各粒子在晶胞中的位置→用均摊法求晶胞均摊各粒子的数目→求各粒子数目的最简比→确定化学式。
5.如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
(1)在该物质的晶体中,每个钛离子周围与它最接近的
且等距离的钛离子共有 个。?
(2)该晶体中,元素氧、钛、钙的粒子个数比是 。?
6
3∶1∶1
解析:回答第(1)小题要注意发挥空间想象力,在晶胞的上、下、左、右、前、后都有完全等同的晶胞,依据一个晶胞我们能观察到3个与钛离子最接近且等距离的钛离子,在与这3个钛离子相反的位置还有3个钛离子,所以共有6个钛离子。对于第(2)小题我们可以使用均摊法求得
