微粒之间的相互作用力
图片预览





文档简介
(共13张PPT)
微粒之间的相互作用力
------离子键
你曾否想过
为什么一百多种元素可形成一千多万种物质?
原子是怎样结合的?
为什么两个氢原子能自动结合成氢分子,而两
个氦原子不能结合在一起?
为什么原子间按一定比例结合?
原子结合成分子后,性质为什么差别很大?
要使氢分子分解成氢原子,需要加热到
2000℃,而且分解率还不够1%。
这说明氢分子里两个氢原子间存在着强烈
的相互作用
在水分子中
氧原子与氢原子直接相邻
氢原子与氢原子非直接相邻
相互作用比较强烈
相互作用比较弱
(H-O-H)
直接相邻的原子或离子之间强烈的相互作用,叫做化学键。
化学键
离子键
共价键
注意:⑴ 指相邻的原子或离子
⑵ 强烈的相互作用
金属键
离子化合物:由阴阳离子通过静电作用形成的化合物
(3)化学键只存在于原子或离子间而不存在于分子间
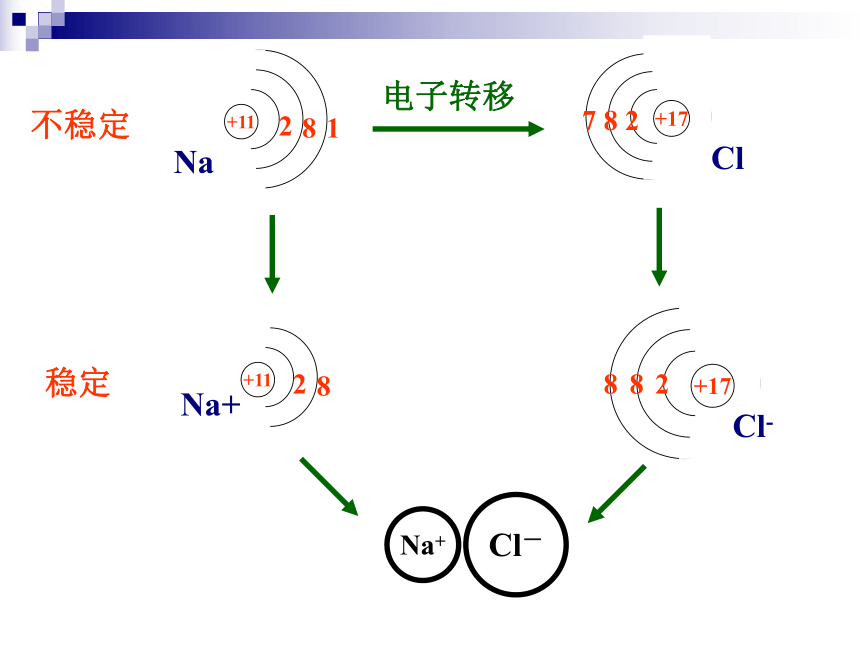
+11
2
8
1
+11
2
8
+17
7
8
2
+17
8
8
2
Cl
Na
Na+
Na+
Cl-
电子转移
不稳定
稳定
Cl-
动脑筋想想
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
阴阳离子间电子与电子、原子核与原子核间的
相互排斥作用
离 子 键
定义: 阴阳离子间通过静电作用所形成的
化学键叫做离子键。
成键微粒:阴阳离子
注
意
相互作用:静电作用(静电引力和斥力)
成键过程:阴阳离子接近到某一定距离时,
吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物一定是离子化合物
思考
哪些物质能形成离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子形成的盐
铵离子和酸根离子(或活泼非金属元素)形成的盐。
在元素符号周围用“ · ”或“×”来表示
原子、离子最外层电子的式子,叫电子式。
(1)原子的电子式:
电子式的概念
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
(2)离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
简单阳离子:金属阳离子的电子式就是其离子符号
阴离子的电子式:元素符号周围标出最外层电子的情况,再标 [ ] 及“ 电荷数 ”
(3)离子化合物的电子式:将阳离子 和阴离子的电子式组合在一起。
Na+
[ Cl ]-
··
··
:
:
(4)离子化合物的形成过程:
注
意
反应物要用原子的电子式表示,而不是用分子式或分子式的电子式表示;生成物中“同类项”,只能分写,不能合并。
用箭头表示电子转移情况。
离子化合物连接反应物和生成物一般用“ ”,而不用“ ”。
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
写出MgF2、Na2O、KCl的电子式
写出MgCl2、 Na2O的形成过程的电子式
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
微粒之间的相互作用力
------离子键
你曾否想过
为什么一百多种元素可形成一千多万种物质?
原子是怎样结合的?
为什么两个氢原子能自动结合成氢分子,而两
个氦原子不能结合在一起?
为什么原子间按一定比例结合?
原子结合成分子后,性质为什么差别很大?
要使氢分子分解成氢原子,需要加热到
2000℃,而且分解率还不够1%。
这说明氢分子里两个氢原子间存在着强烈
的相互作用
在水分子中
氧原子与氢原子直接相邻
氢原子与氢原子非直接相邻
相互作用比较强烈
相互作用比较弱
(H-O-H)
直接相邻的原子或离子之间强烈的相互作用,叫做化学键。
化学键
离子键
共价键
注意:⑴ 指相邻的原子或离子
⑵ 强烈的相互作用
金属键
离子化合物:由阴阳离子通过静电作用形成的化合物
(3)化学键只存在于原子或离子间而不存在于分子间
+11
2
8
1
+11
2
8
+17
7
8
2
+17
8
8
2
Cl
Na
Na+
Na+
Cl-
电子转移
不稳定
稳定
Cl-
动脑筋想想
在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
阴阳离子间电子与电子、原子核与原子核间的
相互排斥作用
离 子 键
定义: 阴阳离子间通过静电作用所形成的
化学键叫做离子键。
成键微粒:阴阳离子
注
意
相互作用:静电作用(静电引力和斥力)
成键过程:阴阳离子接近到某一定距离时,
吸引和排斥达到平衡,就形成了离子键。
含有离子键的化合物一定是离子化合物
思考
哪些物质能形成离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子形成的盐
铵离子和酸根离子(或活泼非金属元素)形成的盐。
在元素符号周围用“ · ”或“×”来表示
原子、离子最外层电子的式子,叫电子式。
(1)原子的电子式:
电子式的概念
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
(2)离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
简单阳离子:金属阳离子的电子式就是其离子符号
阴离子的电子式:元素符号周围标出最外层电子的情况,再标 [ ] 及“ 电荷数 ”
(3)离子化合物的电子式:将阳离子 和阴离子的电子式组合在一起。
Na+
[ Cl ]-
··
··
:
:
(4)离子化合物的形成过程:
注
意
反应物要用原子的电子式表示,而不是用分子式或分子式的电子式表示;生成物中“同类项”,只能分写,不能合并。
用箭头表示电子转移情况。
离子化合物连接反应物和生成物一般用“ ”,而不用“ ”。
[ 练习] 写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
写出MgF2、Na2O、KCl的电子式
写出MgCl2、 Na2O的形成过程的电子式
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
