第一章 水和水的溶液(1.5-1.6 )同步练习(含解析)
文档属性
| 名称 | 第一章 水和水的溶液(1.5-1.6 )同步练习(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 238.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-07 22:21:08 | ||
图片预览

文档简介
浙教版科学八上第一章1.5-1.6
物质的溶解及物质的分离同步练习
一、单选题
1.如图是恒温下模拟海水晒盐过程的示意图,从甲到丙可以肯定是饱和溶液的是(
???)
A.?甲??????????????????????????????????????B.?乙??????????????????????????????????????C.?丙??????????????????????????????D.?无法判断
2.下列各种措施中会影响硝酸钾在水里溶解度大小的是(??
)
A.?加水??????????????????????????????????B.?搅拌??????????????????????????C.?加硝酸钾????????????????????????D.?升温
3.如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是(?
)
A.?升温?????????????????????????????????????B.?降温????????????????????C.?加糖?????????????????????????????????????D.?搅拌
4.衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如表所示,由表可知,能最快洗净衣服上溶质的碘污渍且对人体无害的是(???
)
溶质
碘
溶剂
水
酒精
汽油
苯(有毒)
溶解性
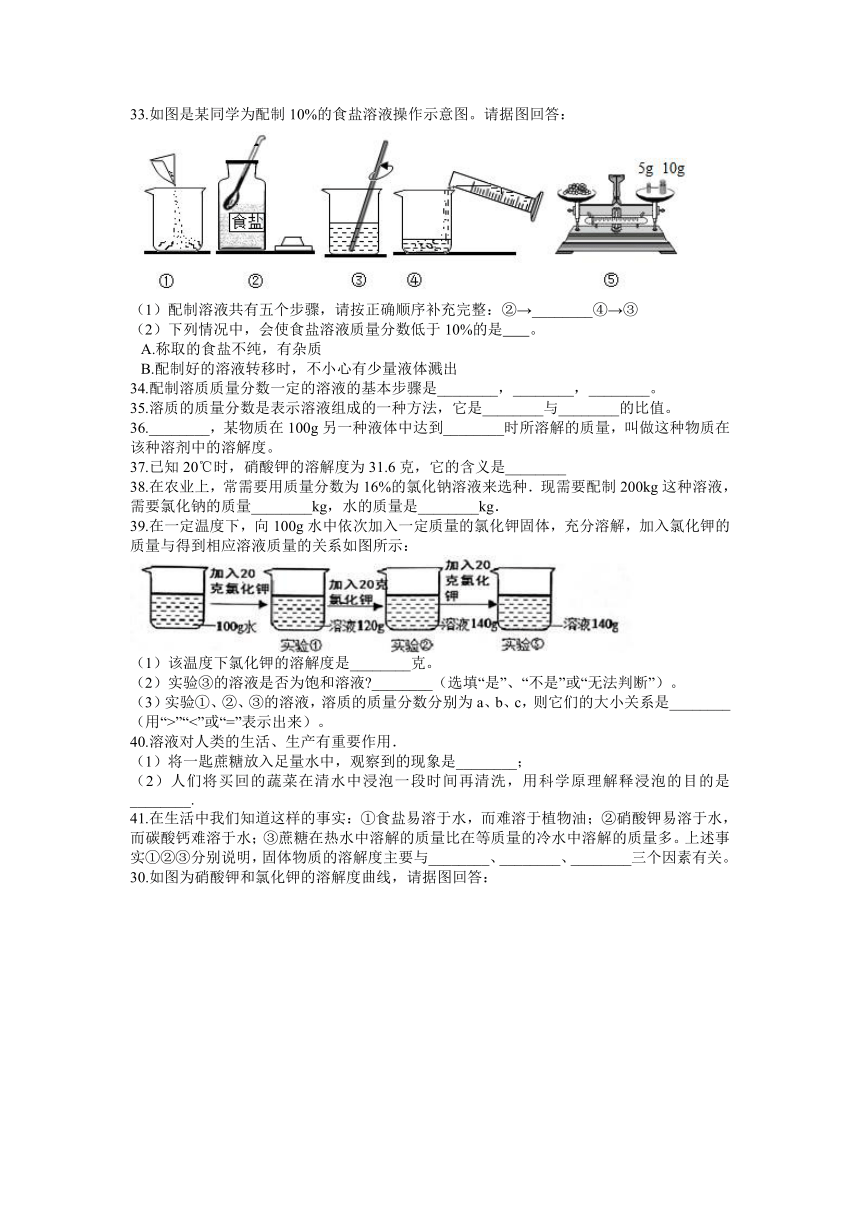
微溶
可溶
易溶
易溶
A.?水???????????????????????????????????????B.?酒精????????????????????????C.?汽油???????????????????????????????????????D.?苯
5.下列物质放入水中,能使水温明显上升的是(???
)
A.?硝酸铵?????????????????????????????????B.?氢氧化钠?????????????????C.?蔗糖?????????????????????????????????D.?食盐
6.配制溶质质量分数一定的氯化钠溶液涉及的操作有:①称量
②溶解
③计算,其正确的操作顺序为(??
)
A.?②①③????????????????????????????????B.?②③①????????????????????????????????C.?③①②????????????????????????????????D.?③②①
7.把室温下的不饱和食
盐水变成饱和溶液,最好的方法是(??
)
A.?蒸发水???????????????????????????B.?加食盐?????????????????C.?给溶液降温??????????D.?给溶液升温
8.下列几种物质?
①硝酸钾?
②熟石灰?
③氧气?
④二氧化碳,溶解度随温度的升高而增大的是(??
)
A.?①②??????????????????????????????????B.?③④??????????????????????????????C.?①③④?????????????????????????????D.?只有①
9.某温度下,将5g氯化钠放入10g水中,得到13.6g氯化钠溶液,该溶液一定是(??
)
A.?饱和溶液???????????????????????????B.?不饱和溶液???????????????????????C.?稀溶液?????????????????????D.?无法判断
10.20℃时氯化钠的溶解度是36g,则氯化钠属于(??
)
A.??
易溶物质???????????????????????????B.?可溶物质???????????????????????????C.?微溶物质?????????????D.?难溶物质
11.某温度下,将3gA物质放入7g水中,得到10g溶液,该溶液是(??
)
A.?饱和溶液???????????????????????????B.?不饱和溶液???????????????????????????C.?浓溶液???????????????D.?无法确定
12.如图所示是一个一次性降温杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度明显下降。制造此降温杯可选用的固体碎块是
(
???)
?
A.?硝酸铵?????????????????????????????????B.?氢氧化钠
C.?蔗糖?????????????????????????????????D.?食盐
13.下列配制氯化钠溶液操作顺序正确的是(??
)?
?
A.?abcde????????????????????????????????B.?bdcea????????????????????????????????C.?ebdca????????????????????????????????D.?bcdea
14.某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是?
( ?
)
A.?蔗糖????????????????????????????????B.?硝酸铵?????????????????????????????C.?氯化钠????????????????????????D.?氢氧化钠
15.20%的氯化钠溶液中,溶质、溶剂、溶液之间的质量关系不正确的是(???
?)
A.?m质:m液=1:5????????B.?m质:m液=1:6????????
C.?m质:m剂=1:4????????D.?m剂:m液=4:5
16.炎热的夏天,小红打开雪碧瓶盖时,发现雪碧会自动喷出,喝了雪碧后又常常会打嗝。热爱科学的小红由此得出下列有关气体溶解性的观点,其中不正确的是(
)
A.?气体溶解度与压强和温度有关???????????B.?压强减小,气体溶解度减小
C.?温度升高,气体溶解度减小????????????????D.?气体溶解度除了与压强和温度有关外,还与溶剂的量有关
17.下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都一定发生变化的是(
)
A.?将一定量硝酸钾不饱和溶液升温
10℃?????????????????B.?将一定量饱和石灰水升温
10℃
C.?取一定量蔗糖不饱和溶液向其中加入少量蔗糖????D.?取一定量氯化钠饱和溶液向其中加入少量水
18.如表说明
A、B、C、D
四种液体的性质,小龙取其中一种液体与蒸馏水加入试管中,在室温下,充分搅拌后静置一段时间,试管内的情况如图所示。则小龙所取的液体为哪种(
)
液体
密度(g/cm3)
熔点(℃)
沸点(℃)
与蒸馏水作用
A
0.78
-9.7
65
可互相溶解
B
1.15
-5.2
218
不可互相溶解
C
0.8
6.4
81
不可互相溶解
D
1.3
12.5
290
可互相溶解
A.?A???????????????????????????????????????????B.?B??????????????????????????????????????C.?C?????????????????????????????????????D.?D
19.某粗心的同学在做“配制一定溶质质量分数的溶液”时,部分操作如下,其中操作明显有误的一项是(??
)
A.??????????????B.??????????C.????????????D.?
20.溶质的质量分数为10%的氢氧化钠溶液,对其意义理解不正确的是(??
)
A.?100克水中溶解有10克氢氧化钠
B.?10克溶液中含有1克氢氧化钠
C.?溶液中溶质质量与溶剂质量的比为1∶9
D.?把5克氢氧化钠固体溶解在45克水中,可制成10%的氢氧化钠溶液
21.如图是简易净水器示意图,净水器中的石子、细沙、纱布、棉花的主要作用是(??
)
A.?过滤?????????????????????????????????????B.?沉淀?????????????????????????????????????C.?吸附?????????????????????????????????????D.?消毒
22.下图中各图所表示的实验操作,哪一项可以将食盐水中的食盐结晶出来(
???)
A.???????????????B.???????????????C.???????????????D.?
23.2016年4月25日14时11分,尼泊尔(北纬28.2度,东经84.7度)发生8.1级地震,当地生产生活受到很大影响,尤其是饮用水的污染和短缺。下列几个步骤将河水转化为饮用水:①化学沉降(用明矾)②消毒杀菌(用漂白粉)③自然沉降④加热煮沸。以上处理过程最合理的顺序是
(
?????)
A.??
③②①④???????????????????????????B.?③①②④???????????????????????????C.?③①④②???????????????????????????D.?①③②④
24.下列关于粗盐提纯实验操作要领,其中错误的是(
)
A.?溶解、过滤和蒸发时都要用到玻璃棒??????????????????B.?引流的玻璃棒应该靠在三层滤纸的一边
C.?漏斗中的滤纸的边缘要低于漏斗的边缘???????????????D.?蒸发结晶食盐时,一直要加热到水分完全蒸干
25.在粗盐提纯的实验中,下列操作不规范的是(
)
A.?称量
?????????????????????????????????B.?溶解
C.?过滤
??????????????????????????????????????????D.?蒸发
26..粗盐提纯的正确顺序是(
)
A.?过滤
蒸发
结晶
溶解???????????????????????????????????????????B.?溶解
蒸发
过滤
结晶
C.?溶解
过滤
蒸发
结晶???????????????????????????????????????????D.?溶解
蒸发
结晶
过滤
27.野外生存训练课上,某同学设计了几种获得饮用水的方法,其中最不合理的是(
)
A.?融化积雪,煮沸后使用???????????????????????????????????????B.?收集雨水,煮沸后使用
C.?过滤泥水,煮沸后使用???????????????????????????????????????D.?用沙子和木炭处理海水,煮沸后使用
28.下列混合物的分离方法不正确的是(
)
A.?酒精和水——(蒸馏)???????????????????????????????????????B.?泥沙和食盐——(溶解和过滤)
C.?食盐和碘——(加热)???????????????????????????????????????D.?汽油和水——(过滤)
29.海水晒盐是利用下列哪种方法结出晶体的(
)
A.?冷却热饱和溶液????????????B.?升温使其溶解度下降????????????C.?蒸发溶剂????????????D.?降温使其溶解度下降
30.净化水的方法有:①过滤②加明矾吸附沉降③蒸馏④消毒杀菌,要将混有泥沙的天然水净化成生活用的自来水,应选用的方法和顺序为(
???)
??
A.?①②③④??????????????????????????????B.?②④①③??????????????????????????????C.?①③④??????????????????????????????D.?②①④
31.水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类纯净水的下列说法正确的是(??
)
A.?它是纯天然饮品,不含任何化学物质?????????????????B.?它清洁、纯净,长期饮用对健康有益而无害
C.?它含有人体所需的矿物质和多种微量元素??????????D.?它可以通过自来水加热产生的水蒸气冷却而获得
32.下列关于结晶的说法不正确的是(??
)
A.?结晶是指有规则几何形状的晶体从溶液中析出的过程?????????B.?不同物质的晶体从溶液中析出后,其几何形状可能不相同
C.?结晶必须在蒸发溶液的时候才能进行?????????????????D.?把硝酸钾晶体从其溶液中结晶出来最好采用冷却热饱和溶液法
二、填空题
33.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是?????
。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
34.配制溶质质量分数一定的溶液的基本步骤是________,________,________。
35.溶质的质量分数是表示溶液组成的一种方法,它是________与________的比值。
36.________,某物质在100g另一种液体中达到________时所溶解的质量,叫做这种物质在该种溶剂中的溶解度。
37.已知20℃时,硝酸钾的溶解度为31.6克,它的含义是________
38.在农业上,常需要用质量分数为16%的氯化钠溶液来选种.现需要配制200kg这种溶液,需要氯化钠的质量________kg,水的质量是________kg.
39.在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,加入氯化钾的质量与得到相应溶液质量的关系如图所示:
(1)该温度下氯化钾的溶解度是________克。
(2)实验③的溶液是否为饱和溶液?________(选填“是”、“不是”或“无法判断”)。
(3)实验①、②、③的溶液,溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“>”“<”或“=”表示出来)。
40.溶液对人类的生活、生产有重要作用.
(1)将一匙蔗糖放入足量水中,观察到的现象是________;
(2)人们将买回的蔬菜在清水中浸泡一段时间再清洗,用科学原理解释浸泡的目的是________.
41.在生活中我们知道这样的事实:①食盐易溶于水,而难溶于植物油;②硝酸钾易溶于水,而碳酸钙难溶于水;③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多。上述事实①②③分别说明,固体物质的溶解度主要与________、________、________三个因素有关。
30.如图为硝酸钾和氯化钾的溶解度曲线,请据图回答:
(1)60℃时,等质量的硝酸钾饱和溶液和氯化钾饱和溶液中,含溶剂质量较多的是________饱和溶液。
(2)把
t℃的硝酸钾和氯化钾饱和溶液同时升温到
60℃(不计水份蒸发),两者的溶质质量分数关系为:硝酸钾溶液________氯化钾溶液(选填“大于”、“等于”、“小于”)。
三、解答题
42.已知20℃时,硝酸钾的溶解度是31.6g,在100g饱和的硝酸钾溶液中有多少克硝酸钾?
43.实验室准备配制
50g
溶质质量分数为
10%的氯化钠溶液,问:
(1)需要固体氯化钠多少克?
(2)如改用
20%的氯化钠溶液进行配置,则需要
20%的氯化钠溶液多少克?
44.医院的生理盐水注射液瓶子上商标如图所示,请回答:
该瓶生理盐水含氯化钠多少克?含水多少克?
答案解析部分
一、单选题
1.
C
解析:如果溶液中有未溶的固体出现,那么溶液饱和;如果没有未溶的固体出现,那么无法判断溶液是否饱和,据此分析判断。
根据图片可知,溶液丙中出现了未溶的固体,那么丙肯定是饱和溶液,故C正确,而A、B、D错误。
故选C。
2.
D
解析:根据溶解度的影响因素分析判断。
同种物质的溶解度大小与溶液温度有关,而硝酸钾的溶解度随温度的升高而增大,故D正确,而A、B、C错误。
故选D。
3.
A
解析:增大溶质质量分数的方法:①增加溶质;②减小溶剂,据此分析即可。
A.溶液升温后,蔗糖的溶解度会增大,杯中未溶的蔗糖会继续溶解,而溶剂的质量不变,因此溶质的质量分数会变大,故A正确;
B.降温时,蔗糖溶液的溶解度会减小,会有更多的蔗糖析出,溶质质量减小,而溶剂的质量不变,因此溶质的质量分数会变小,故B错误;
C.现在蔗糖溶液已经饱和,再加入蔗糖也不会溶解,因此溶质质量分数保持不变,故C错误;
D.搅拌不能使饱和溶液的溶质质量增大,因此溶质质量分数不变,故D错误。
故选A。
4.
C
解析:碘在不同溶剂中溶解性是不同的,人们并不用苯来清洗衣物上的碘,因为苯挥发有毒。
A、碘并不能溶于水,不能用水清洗来清除碘,A不符合题意。
?
B、碘能溶解于酒精,能用于清洗碘,但是速度不是最快,B不符合题意。
?
C、碘易溶于汽油,可用汽油快速除去碘污,C符合题意。
?
D、碘可溶于苯,但是苯挥发有毒,D不符合题意。
?
故答案为:C
5.
B
解析:根据氢氧化钠溶解放热、硝酸铵溶解吸热、蔗糖、食盐溶解温度不变分析。
硝酸铵溶解于水吸热,溶液温度降低,蔗糖、食盐溶于水温度不变,氢氧化钠溶解于水温度升高;
故答案为:B。
6.
C
解析:根据配制一定质量分数的溶液的步骤分析。
配制一定质量分数的溶液的步骤为计算、称量、溶解;
故答案为:C。
7.
B
解析:根据饱和溶液变不饱和溶液的方法有加溶质、蒸发溶剂或改变温度。
因食盐的溶解度受温度影响不大,所以不饱和溶液变饱和溶液,最好的方法是加溶质;
故答案为:B。
8.
D
解析:根据固体氢氧化钙与气体的溶解度随温度升高而减小分析,大多数固体溶解度随温度的升高而增大分析。
①硝酸钾的溶解度随温度的升高而增大,②熟石灰、
③氧气、
④二氧化碳的溶解度随温度的升高而减小;
故答案为:D。
9.
A
解析:根据饱和溶液定义分析。
5g氯化钠放入10g水中,得到13.6g氯化钠溶液,
说明固体没有全部溶解,所得溶液为饱和溶液;
故答案为:A。
10.
A
解析:根据溶解度与溶解性的关系分析,20℃时溶解度大于10g为易溶物质,大于1g小于10g为可溶物质,小于1g大于0.01g为微溶物质,小于0.01g为难溶性物质。
20℃时氯化钠的溶解度是36g
,大于10g,属于易溶物质;
故答案为:A。
11.
D
解析:根据饱和溶液不饱和溶液定义分析。
将3gA物质放入7g水中,得到10g溶液,
溶质全部溶解,所得溶液可能是刚好达到饱和也可能是不饱和溶液;
故答案为:D。
12.
A
解析:根据常见物质溶解时的放热和吸热现象分析。
A、硝酸铵溶解时吸热能使溶液温度降低,符合题意;
B、氢氧化钠溶解时放热,能使溶液温度升高,不符合题意;
C、蔗糖溶解时温度没有明显变化,不符合题意;
D、食盐溶解时温度没有明显变化,不符合题意;
故答案为:A。
13.
B
解析:根据配制一定质量分数的氯化钠溶液的方法步骤分析。
配制氯化钠溶液应先计算,再取用固体称量所需氯化钠,将称量好的氯化钠倒放烧杯中,再量取所需体积的水,倒入烧杯中,最后搅拌溶解;
故答案为:B。
14.
D
解析:该题主要考查学生对常见物质溶解过程中吸热、放热情况的掌握。
A
C.蔗糖和氯化钠溶于水时不放热,也不吸热;故A
C错误;
B.硝酸铵溶于水吸热,周围温度降低,石蜡不会融化;故B错误;
D.氢氧化钠溶于水会放出大量热量,导致烧杯的温度升高,石蜡会熔化,故D正确;
故答案为:D。
15.
B
解析:根据溶质质量分数定义分析。
20%的氯化钠溶液中,溶质、溶剂、溶液质量比为20:80:100=1:4:5;
故B关系不正确。
16.
D
解析:根据气体溶解度的影响因素分析。
气体溶解度除了与压强和温度有关外,还与溶剂的种类有关,但与溶剂的量无关,D不正确;
故答案为:D。
17.
B
解析:有些物质的溶解度随温度的升高而增大,有的物质的溶解度随温度的升高而减小;根据溶液的变化以及溶质质量分数的计算方法进行分析解答即可。
A、将一定量硝酸钾不饱和溶液升温10℃,硝酸钾的溶解度变大,溶质质量分数不变,故A不符合题意;
B、由于氢氧化钙的溶解度随温度的升高而减小,一定量饱和石灰水升温10℃,溶解度会变小,会析出部分氢氧化钙,溶质质量分数会变小,溶液中溶质的溶解度和溶质质量分数都发生变化,故B符合题意;
C、取一定量蔗糖不饱和溶液向其中加入少量蔗糖,溶解度不变,溶质的质量分数会变大,故C不符合题意;
D、取一定量氯化钠饱和溶液向其中加入少量水,溶质的溶解度不变,溶质质量分数变小,故D不符合题意;
故答案为:B。
18.
C
解析:根据试管中的现象可以看出,液体的密度小于水且不与水互溶,据此分析解答。
根据试管中的现象可以看出,液体浮在水的上面,说明液体的密度小于水且不与水互溶,
A、从所给数据可以看出,该物质与水互溶,故A不符合题意;
B、从所给数据可以看出,该物质与水不互溶,但密度比水大,故B不符合题意;
C、从所给数据可以看出,该物质与水不互溶,且密度比水小,故C符合题意;
D、从所给数据可以看出,该物质密度比水大,与水互溶,故D不符合题意;
故答案为:C。
19.
B
解析:根据天平的正确使用方法分析;根据取用固体药品的注意事项分析;根据量筒的正确使用分析;根据配制溶液要用玻璃棒搅拌分析。
天平使用应左物右砝,B中将氯化钠放在了右盘错误;
故答案为:B。
20.
A
解析:根据溶质质量分数定义分析。
溶质的质量分数为10%的氢氧化钠溶液即为100g溶液中含有10g溶质,而溶剂质量为90g,A理解不正确;
故答案为:A。
21.【答案】
A
【解析】【分析】过滤操作用于分离液体和不溶于液体的固态物质,据此分析判断。
【解答】净水器中的石子、细沙、纱布、棉花,这些材料间的空隙逐渐减小,可以将水中的杂质按照从大到小的顺序依次过滤掉,从而达到净水的目的,故A正确,而B、C、D错误。
故选A。
22.【答案】
C
【解析】【分析】根据结晶的方法分析判断。
【解答】食盐的溶解度受温度的影响非常小,因此可以使用蒸发溶剂的方式使其结晶出来,故C正确,而A、B、D错误。
故选C。
23.【答案】
B
【解析】【分析】自然界的水因含有许多物质和细菌,所以是混合物不宜直接饮用,针对水质的不同,需要对水进行净化处理。
【解答】水的净化过程是先物理净化再化学净化最后消毒后煮沸即可饮用,所以要先自然沉降,之后再化学沉降,然后消毒即可,饮用时要煮沸;故B符合;
故答案为:B。
24.【答案】
D
【解析】【分析】根据过滤、蒸发的操作步骤及注意事项分析。
【解答】蒸发结晶时,蒸发皿中出现较多量固体时停止加热,D操作错误;
故答案为:D。
25.【答案】
B
【解析】【分析】粗盐的提纯包括溶解、过滤和蒸发三个步骤,根据各步中的注意事项进行分析解答。
【解答】A、用托盘天平称量物体时遵循“左物右码”的原则,故A正确,但不符合题意;
B、不能在量筒里溶解粗盐,故B错误,但符合题意;
C、在过滤操作时,一定要做到“一贴、二低、三靠”,故C正确,但不符合题意;
D、蒸发时,要用玻璃棒不断的搅拌,防止局部过热,造成液体飞溅,故D正确,但不符合题意;
故答案为:B。
26.【答案】
C
【解析】【分析】粗食盐中含有不溶性(如泥沙)和可溶性的杂质(如K+、Mg2+、SO42+、Ca2+离子等)。不溶性的杂质可用溶解、过滤的方法除去;可溶性的杂质则是向粗食盐的溶液中加入能与杂质离子作用的盐类,使之生成沉淀后过滤除去。对K+
,
利用KCl溶解度大于NaCl,且含量少,蒸发浓缩后,NaCl呈晶体析出,分离可得NaCl晶体。
【解答】A
B
D对于粗盐应先溶解,不溶性杂质通过过滤除去,可溶性杂质先使之沉淀然后过滤除去,对于KCl与NaCl的水溶液,利用他们溶解度的不同,通过蒸发结晶的方法除去少量的KCl;故A
B
D错误,C正确;
故答案为C。
27.【答案】
D
【解析】【分析】根据水的净化处理的方法进行分析解答。
【解答】A、融化积雪,煮沸后使用,可以得到较纯净的软水,故A正确,但不符合题意;
B、收集雨水,煮沸后使用,可以得到较纯净的软水,故B正确,但不符合题意;
C、过滤泥水,煮沸后使用,可以得到较纯净的软水,故C正确,但不符合题意;
D、用沙子和木炭处理海水,不能除去海水中的盐,煮沸后不能使用,故D错误,但符合题意;
故答案为:D。
28.【答案】
D
【解析】【分析】蒸馏原理:利用液体混合物中各组分挥发度的差别,使液体混合物部分汽化并随之使蒸气部分冷凝,从而实现其所含组分的分离。过滤原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。
【解答】A、酒精和水沸点不同,可以用蒸馏的方法分离;故A正确;
B、泥沙不溶于水,食盐溶于水,将其混合物溶于水可以用过滤的方法分离;故B正确;
C、氯化钠不易升华,碘在高温条件下易升华,因此,可用加热的方法将两者分离;故C正确;
D、汽油和水是两种互不相溶的液态物质,不能采用过滤的方法分离;故D错误;
故答案为:D。
29.【答案】
C
【解析】【分析】结晶方法一般为两种,一种是蒸发结晶,一种是降温结晶。蒸发结晶一般是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出的方法。降温结晶一般是指先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出的方法。观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。当陡升型溶液中混有缓升型时,若要分离出陡升型的溶质,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法。
【解答】根据盐的溶解度曲线可知其为缓升型曲线。因此,分离盐易用蒸发结晶的方法,即蒸发溶剂的方法;故C正确;AD都有提到降温结晶,故AD错误;氯化钠的溶解度随温度变化较小,故B错误。
故答案为:C。
30.【答案】
D
【解析】【分析】根据净水的知识进行分析,除杂时可以采用先除去易除的杂质,再除去难除的杂质的顺序.水中含有的不溶性国体大颗粒杂质可以通过沉降除去;不溶性小颗粒固体杂质可以通过过滤除去;投药消毒杀菌可以除去细菌微生物。
【解答】将混有泥沙的天然水净化成生活用的自来水,加明矾吸附沉降是把水中小颗粒泥尘聚集大的,以利于沉降;不溶性小颗粒固体杂质可以通过过滤除去;投药消毒杀菌可以除去细菌微生物;故混有泥沙的天然水净化成生活用的自来水,将所选用的方法按净化过程排序是②加明矾吸附沉降→①过滤→④消毒杀菌,净水过程中无需进行蒸馏;
故答案为:D。
31.【答案】
D
【解析】【分析】根据蒸馏水为纯净的水,不含有其他杂质分析;根据蒸馏水的形成分析。
【解答】A.水本身就是一种化学物质,不符合题意;
B.蒸馏水是纯净的水,缺少人体所需矿物质,不能长期饮用,不符合题意;
C.蒸馏水不含其他杂质,不符合题意;
D.蒸馏水可以通过自来水加热产生的水蒸气冷却而获得,符合题意;
故答案为:D。
32.【答案】
C
【解析】【分析】根据结晶的定义及方法分析。
【解答】A.结晶是指有规则几何形状的晶体从溶液中析出的过程,说正确;
B.不同物质的晶体从溶液中析出后,其几何形状可能不相同,说法正确;
C.结晶可以在蒸发溶液的时候进行,也可以在改变温度的时候进行,说法错误;
D.硝酸钾的溶解度受温度变化影响很大,所以把硝酸钾晶体从其溶液中结晶出来最好采用冷却热饱和溶液法,说法正确;
故答案为:C。
二、填空题
33.
(1)⑤→①
(2)A
解析:(1)根据配制一定溶质质量分数的溶液的实验过程解答;
(2)根据溶质质量分数=可知,食盐溶液的溶质质量分数偏小,要么是因为溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
(1)配制溶液的步骤:
②从试剂瓶中取出食盐;
⑤用天平称量规定质量的食盐;
①将食盐倒入烧杯中;
④用量筒量取合适体积的水,然后倒入烧杯中;
③用玻璃棒搅拌,直至食盐完全溶解即可。
即②→⑤→①→④→③。
(2)A.称取的食盐不纯,那么食盐的质量偏小,从而导致溶质质量分析偏小,故①正确;
B.配制好的溶液是均一稳定的,即使有少量液体溅出,也不会影响溶质质量分数,故②错误。
故选A。
34.
计算溶质和溶剂的量;称量(或量取)所需的溶质与溶剂;溶解溶质配成溶液
解析:根据配制一定溶质质量分数溶液的实验过程解答。
配制溶质质量分数一定的溶液的基本步骤是:计算溶质和溶剂的量,称量(或量取)所需的溶质与溶剂,溶解溶质配成溶液。
35.
溶质质量;溶液质量
解析:根据溶质质量分数的定义解答。
溶质的质量分数是表示溶液组成的一种方法,它是溶质质量与溶液质量的比值。
36.
在一定温度下;饱和状态
解析:根据溶解度的定义解答。
在一定温度下,某物质在100g另一种液体中达到饱和状态时所溶解的质量,叫做这种物质在该种溶剂中的溶解度。
37.
20℃时,100g水中最多可溶解硝酸钾31.6g
解析:根据溶解度的意义解答。
20℃时,硝酸钾的溶解度为31.6克,它的含义是:20℃时,100g水中最多可溶解硝酸钾31.6g。
38.
32;168
解析:根据溶质质量=溶液质量×质量分数分析;根据溶液质量=溶质质量+溶剂质量分析。
配制200kg
质量分数为16%的氯化钠溶液
,需要氯化钠的质量为200kg×16%=32kg,水的质量是200kg-32kg=168kg;
故答案为:32;168.
39.
(1)40
(2)是
(3)b=c>a
解析:在一定温度下,在一定量溶剂里的溶质的溶解量是有一定限度的。化学上用溶解度表示这种溶解的限度;溶液中溶质的质量分数是溶质质量与溶液质量之比。
(1)在一定温度下,在一定量溶剂里的溶质的溶解量是有一定限度的。化学上用溶解度表示这种溶解的限度。
在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,
实验②溶液为140g,但是到实验③溶液依然为140g,说明到实验③溶液已经饱和了,所以
该温度下氯化钾的溶解度也就是溶解的最大限度为40克。
(2)实验②溶液为140g,但是到实验③溶液依然为140g,说明到实验③溶液已经饱和了,所以已经不能溶解了,实验③的溶液确实为饱和溶液。
(3)溶液中溶质的质量分数是溶质质量与溶液质量之比。实验①的溶质的质量分数为33.3%,实验②的溶质的质量分数为42.9%,实验③?由于已经饱和了,它的溶质的质量分数是42.9%。
?
故答案为:(1)
40?;(2)
是?;(3)
b=c>a
40.
(1)蔗糖逐渐溶解完全,溶液无色透明
(2)使蔬菜上残留的农药溶于水,方便除去
解析:溶解是指一种(或多种)物质进入液体物质,会发生一种(或多种)物质扩散进入液体物质,两者融为一体的过程。
(1)蔗糖是可溶于水的一种物质,所以蔗糖加入足量的水中,可以看到蔗糖会完全溶解,且溶液为无色;故答案为:蔗糖逐渐溶解完全,溶液无色透明;
(2)物质的溶解需要一段时间,所以为了更好的去除蔬菜上残留的农药,要浸泡一段时间再清洗;故答案为:使蔬菜上残留的农药溶于水,方便除去;
故答案为:(1)蔗糖逐渐溶解完全,溶液无色透明;(2)使蔬菜上残留的农药溶于水,方便除去。
41.
溶剂的性质;溶质的性质;温度
解析:影响固体溶解度的因素有:溶质的性质、溶剂的性质和温度,据此分析解答。
影响固体溶解度大小的因素有内因和外因两个方面,内因指:溶剂的性质,溶质的性质,外因指:温度;
①食盐易溶于水,而难溶于植物油,溶质相同溶剂不同,说明溶剂的性质的影响;
②硝酸钾易溶于水,而碳酸钙难溶于水,溶剂相同溶质不同,说明溶质的性质的影响;
③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多,溶质相同溶剂相同,温度不同,说明温度的影响;
故答案为:溶剂的性质;溶质的性质;温度。
42.
(1)氯化钾
(2)等于
解析:溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。物质的溶解度属于物理性质。
(1)由溶解度曲线可知,60摄氏度时氯化钾的溶解度大于硝酸钾的溶解度,饱和溶液中溶解度越大,溶解的溶质越多;故答案为:氯化钾;
(2)由图可知,t摄氏度时氯化钾和硝酸钾的溶解度相同,说明饱和溶液中氯化钾和硝酸钾的溶质质量相同,而升高温度会改变物质的溶解度,但没有继续溶解溶质进去,所以两者的溶质质量分数是不变的;故答案为:等于;
故答案为:(1)氯化钾;(2)等于。
三、解答题
43.
设100g饱和的硝酸钾溶液中有x克硝酸钾,
;
解得:x=24g。
答:含有硝酸钾24g
解析:在同一温度下,饱和溶液的溶质质量分数保持不变,根据溶质质量分数=列方程计算即可。
44.
(1)需要氯化钠的质量为:50g×10%=5g;
(2)需要20%的氯化钠溶液质量:。
解析:(1)根据溶质质量=溶液质量×溶质质量分数计算;
(2)稀释前后,溶质的质量保持不变,根据溶液质量=计算即可。
33.
500g生理盐水中含氯化钠的质量为:500g×0.9%=4.5g;
其中含水的质量为:500g-4.5g=495.5g。
解析:根据溶液质量×溶质质量分数计算出氯化钠的质量,根据溶质量-溶质质量计算出溶剂水的质量。
2
物质的溶解及物质的分离同步练习
一、单选题
1.如图是恒温下模拟海水晒盐过程的示意图,从甲到丙可以肯定是饱和溶液的是(
???)
A.?甲??????????????????????????????????????B.?乙??????????????????????????????????????C.?丙??????????????????????????????D.?无法判断
2.下列各种措施中会影响硝酸钾在水里溶解度大小的是(??
)
A.?加水??????????????????????????????????B.?搅拌??????????????????????????C.?加硝酸钾????????????????????????D.?升温
3.如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是(?
)
A.?升温?????????????????????????????????????B.?降温????????????????????C.?加糖?????????????????????????????????????D.?搅拌
4.衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如表所示,由表可知,能最快洗净衣服上溶质的碘污渍且对人体无害的是(???
)
溶质
碘
溶剂
水
酒精
汽油
苯(有毒)
溶解性
微溶
可溶
易溶
易溶
A.?水???????????????????????????????????????B.?酒精????????????????????????C.?汽油???????????????????????????????????????D.?苯
5.下列物质放入水中,能使水温明显上升的是(???
)
A.?硝酸铵?????????????????????????????????B.?氢氧化钠?????????????????C.?蔗糖?????????????????????????????????D.?食盐
6.配制溶质质量分数一定的氯化钠溶液涉及的操作有:①称量
②溶解
③计算,其正确的操作顺序为(??
)
A.?②①③????????????????????????????????B.?②③①????????????????????????????????C.?③①②????????????????????????????????D.?③②①
7.把室温下的不饱和食
盐水变成饱和溶液,最好的方法是(??
)
A.?蒸发水???????????????????????????B.?加食盐?????????????????C.?给溶液降温??????????D.?给溶液升温
8.下列几种物质?
①硝酸钾?
②熟石灰?
③氧气?
④二氧化碳,溶解度随温度的升高而增大的是(??
)
A.?①②??????????????????????????????????B.?③④??????????????????????????????C.?①③④?????????????????????????????D.?只有①
9.某温度下,将5g氯化钠放入10g水中,得到13.6g氯化钠溶液,该溶液一定是(??
)
A.?饱和溶液???????????????????????????B.?不饱和溶液???????????????????????C.?稀溶液?????????????????????D.?无法判断
10.20℃时氯化钠的溶解度是36g,则氯化钠属于(??
)
A.??
易溶物质???????????????????????????B.?可溶物质???????????????????????????C.?微溶物质?????????????D.?难溶物质
11.某温度下,将3gA物质放入7g水中,得到10g溶液,该溶液是(??
)
A.?饱和溶液???????????????????????????B.?不饱和溶液???????????????????????????C.?浓溶液???????????????D.?无法确定
12.如图所示是一个一次性降温杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度明显下降。制造此降温杯可选用的固体碎块是
(
???)
?
A.?硝酸铵?????????????????????????????????B.?氢氧化钠
C.?蔗糖?????????????????????????????????D.?食盐
13.下列配制氯化钠溶液操作顺序正确的是(??
)?
?
A.?abcde????????????????????????????????B.?bdcea????????????????????????????????C.?ebdca????????????????????????????????D.?bcdea
14.某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是?
( ?
)
A.?蔗糖????????????????????????????????B.?硝酸铵?????????????????????????????C.?氯化钠????????????????????????D.?氢氧化钠
15.20%的氯化钠溶液中,溶质、溶剂、溶液之间的质量关系不正确的是(???
?)
A.?m质:m液=1:5????????B.?m质:m液=1:6????????
C.?m质:m剂=1:4????????D.?m剂:m液=4:5
16.炎热的夏天,小红打开雪碧瓶盖时,发现雪碧会自动喷出,喝了雪碧后又常常会打嗝。热爱科学的小红由此得出下列有关气体溶解性的观点,其中不正确的是(
)
A.?气体溶解度与压强和温度有关???????????B.?压强减小,气体溶解度减小
C.?温度升高,气体溶解度减小????????????????D.?气体溶解度除了与压强和温度有关外,还与溶剂的量有关
17.下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都一定发生变化的是(
)
A.?将一定量硝酸钾不饱和溶液升温
10℃?????????????????B.?将一定量饱和石灰水升温
10℃
C.?取一定量蔗糖不饱和溶液向其中加入少量蔗糖????D.?取一定量氯化钠饱和溶液向其中加入少量水
18.如表说明
A、B、C、D
四种液体的性质,小龙取其中一种液体与蒸馏水加入试管中,在室温下,充分搅拌后静置一段时间,试管内的情况如图所示。则小龙所取的液体为哪种(
)
液体
密度(g/cm3)
熔点(℃)
沸点(℃)
与蒸馏水作用
A
0.78
-9.7
65
可互相溶解
B
1.15
-5.2
218
不可互相溶解
C
0.8
6.4
81
不可互相溶解
D
1.3
12.5
290
可互相溶解
A.?A???????????????????????????????????????????B.?B??????????????????????????????????????C.?C?????????????????????????????????????D.?D
19.某粗心的同学在做“配制一定溶质质量分数的溶液”时,部分操作如下,其中操作明显有误的一项是(??
)
A.??????????????B.??????????C.????????????D.?
20.溶质的质量分数为10%的氢氧化钠溶液,对其意义理解不正确的是(??
)
A.?100克水中溶解有10克氢氧化钠
B.?10克溶液中含有1克氢氧化钠
C.?溶液中溶质质量与溶剂质量的比为1∶9
D.?把5克氢氧化钠固体溶解在45克水中,可制成10%的氢氧化钠溶液
21.如图是简易净水器示意图,净水器中的石子、细沙、纱布、棉花的主要作用是(??
)
A.?过滤?????????????????????????????????????B.?沉淀?????????????????????????????????????C.?吸附?????????????????????????????????????D.?消毒
22.下图中各图所表示的实验操作,哪一项可以将食盐水中的食盐结晶出来(
???)
A.???????????????B.???????????????C.???????????????D.?
23.2016年4月25日14时11分,尼泊尔(北纬28.2度,东经84.7度)发生8.1级地震,当地生产生活受到很大影响,尤其是饮用水的污染和短缺。下列几个步骤将河水转化为饮用水:①化学沉降(用明矾)②消毒杀菌(用漂白粉)③自然沉降④加热煮沸。以上处理过程最合理的顺序是
(
?????)
A.??
③②①④???????????????????????????B.?③①②④???????????????????????????C.?③①④②???????????????????????????D.?①③②④
24.下列关于粗盐提纯实验操作要领,其中错误的是(
)
A.?溶解、过滤和蒸发时都要用到玻璃棒??????????????????B.?引流的玻璃棒应该靠在三层滤纸的一边
C.?漏斗中的滤纸的边缘要低于漏斗的边缘???????????????D.?蒸发结晶食盐时,一直要加热到水分完全蒸干
25.在粗盐提纯的实验中,下列操作不规范的是(
)
A.?称量
?????????????????????????????????B.?溶解
C.?过滤
??????????????????????????????????????????D.?蒸发
26..粗盐提纯的正确顺序是(
)
A.?过滤
蒸发
结晶
溶解???????????????????????????????????????????B.?溶解
蒸发
过滤
结晶
C.?溶解
过滤
蒸发
结晶???????????????????????????????????????????D.?溶解
蒸发
结晶
过滤
27.野外生存训练课上,某同学设计了几种获得饮用水的方法,其中最不合理的是(
)
A.?融化积雪,煮沸后使用???????????????????????????????????????B.?收集雨水,煮沸后使用
C.?过滤泥水,煮沸后使用???????????????????????????????????????D.?用沙子和木炭处理海水,煮沸后使用
28.下列混合物的分离方法不正确的是(
)
A.?酒精和水——(蒸馏)???????????????????????????????????????B.?泥沙和食盐——(溶解和过滤)
C.?食盐和碘——(加热)???????????????????????????????????????D.?汽油和水——(过滤)
29.海水晒盐是利用下列哪种方法结出晶体的(
)
A.?冷却热饱和溶液????????????B.?升温使其溶解度下降????????????C.?蒸发溶剂????????????D.?降温使其溶解度下降
30.净化水的方法有:①过滤②加明矾吸附沉降③蒸馏④消毒杀菌,要将混有泥沙的天然水净化成生活用的自来水,应选用的方法和顺序为(
???)
??
A.?①②③④??????????????????????????????B.?②④①③??????????????????????????????C.?①③④??????????????????????????????D.?②①④
31.水是人类生活不可缺少的物质。日常生活中不少人喜欢喝纯净水,市售的纯净水有些就是蒸馏水。有关这类纯净水的下列说法正确的是(??
)
A.?它是纯天然饮品,不含任何化学物质?????????????????B.?它清洁、纯净,长期饮用对健康有益而无害
C.?它含有人体所需的矿物质和多种微量元素??????????D.?它可以通过自来水加热产生的水蒸气冷却而获得
32.下列关于结晶的说法不正确的是(??
)
A.?结晶是指有规则几何形状的晶体从溶液中析出的过程?????????B.?不同物质的晶体从溶液中析出后,其几何形状可能不相同
C.?结晶必须在蒸发溶液的时候才能进行?????????????????D.?把硝酸钾晶体从其溶液中结晶出来最好采用冷却热饱和溶液法
二、填空题
33.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)配制溶液共有五个步骤,请按正确顺序补充完整:②→________④→③
(2)下列情况中,会使食盐溶液质量分数低于10%的是?????
。
A.称取的食盐不纯,有杂质
B.配制好的溶液转移时,不小心有少量液体溅出
34.配制溶质质量分数一定的溶液的基本步骤是________,________,________。
35.溶质的质量分数是表示溶液组成的一种方法,它是________与________的比值。
36.________,某物质在100g另一种液体中达到________时所溶解的质量,叫做这种物质在该种溶剂中的溶解度。
37.已知20℃时,硝酸钾的溶解度为31.6克,它的含义是________
38.在农业上,常需要用质量分数为16%的氯化钠溶液来选种.现需要配制200kg这种溶液,需要氯化钠的质量________kg,水的质量是________kg.
39.在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,加入氯化钾的质量与得到相应溶液质量的关系如图所示:
(1)该温度下氯化钾的溶解度是________克。
(2)实验③的溶液是否为饱和溶液?________(选填“是”、“不是”或“无法判断”)。
(3)实验①、②、③的溶液,溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“>”“<”或“=”表示出来)。
40.溶液对人类的生活、生产有重要作用.
(1)将一匙蔗糖放入足量水中,观察到的现象是________;
(2)人们将买回的蔬菜在清水中浸泡一段时间再清洗,用科学原理解释浸泡的目的是________.
41.在生活中我们知道这样的事实:①食盐易溶于水,而难溶于植物油;②硝酸钾易溶于水,而碳酸钙难溶于水;③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多。上述事实①②③分别说明,固体物质的溶解度主要与________、________、________三个因素有关。
30.如图为硝酸钾和氯化钾的溶解度曲线,请据图回答:
(1)60℃时,等质量的硝酸钾饱和溶液和氯化钾饱和溶液中,含溶剂质量较多的是________饱和溶液。
(2)把
t℃的硝酸钾和氯化钾饱和溶液同时升温到
60℃(不计水份蒸发),两者的溶质质量分数关系为:硝酸钾溶液________氯化钾溶液(选填“大于”、“等于”、“小于”)。
三、解答题
42.已知20℃时,硝酸钾的溶解度是31.6g,在100g饱和的硝酸钾溶液中有多少克硝酸钾?
43.实验室准备配制
50g
溶质质量分数为
10%的氯化钠溶液,问:
(1)需要固体氯化钠多少克?
(2)如改用
20%的氯化钠溶液进行配置,则需要
20%的氯化钠溶液多少克?
44.医院的生理盐水注射液瓶子上商标如图所示,请回答:
该瓶生理盐水含氯化钠多少克?含水多少克?
答案解析部分
一、单选题
1.
C
解析:如果溶液中有未溶的固体出现,那么溶液饱和;如果没有未溶的固体出现,那么无法判断溶液是否饱和,据此分析判断。
根据图片可知,溶液丙中出现了未溶的固体,那么丙肯定是饱和溶液,故C正确,而A、B、D错误。
故选C。
2.
D
解析:根据溶解度的影响因素分析判断。
同种物质的溶解度大小与溶液温度有关,而硝酸钾的溶解度随温度的升高而增大,故D正确,而A、B、C错误。
故选D。
3.
A
解析:增大溶质质量分数的方法:①增加溶质;②减小溶剂,据此分析即可。
A.溶液升温后,蔗糖的溶解度会增大,杯中未溶的蔗糖会继续溶解,而溶剂的质量不变,因此溶质的质量分数会变大,故A正确;
B.降温时,蔗糖溶液的溶解度会减小,会有更多的蔗糖析出,溶质质量减小,而溶剂的质量不变,因此溶质的质量分数会变小,故B错误;
C.现在蔗糖溶液已经饱和,再加入蔗糖也不会溶解,因此溶质质量分数保持不变,故C错误;
D.搅拌不能使饱和溶液的溶质质量增大,因此溶质质量分数不变,故D错误。
故选A。
4.
C
解析:碘在不同溶剂中溶解性是不同的,人们并不用苯来清洗衣物上的碘,因为苯挥发有毒。
A、碘并不能溶于水,不能用水清洗来清除碘,A不符合题意。
?
B、碘能溶解于酒精,能用于清洗碘,但是速度不是最快,B不符合题意。
?
C、碘易溶于汽油,可用汽油快速除去碘污,C符合题意。
?
D、碘可溶于苯,但是苯挥发有毒,D不符合题意。
?
故答案为:C
5.
B
解析:根据氢氧化钠溶解放热、硝酸铵溶解吸热、蔗糖、食盐溶解温度不变分析。
硝酸铵溶解于水吸热,溶液温度降低,蔗糖、食盐溶于水温度不变,氢氧化钠溶解于水温度升高;
故答案为:B。
6.
C
解析:根据配制一定质量分数的溶液的步骤分析。
配制一定质量分数的溶液的步骤为计算、称量、溶解;
故答案为:C。
7.
B
解析:根据饱和溶液变不饱和溶液的方法有加溶质、蒸发溶剂或改变温度。
因食盐的溶解度受温度影响不大,所以不饱和溶液变饱和溶液,最好的方法是加溶质;
故答案为:B。
8.
D
解析:根据固体氢氧化钙与气体的溶解度随温度升高而减小分析,大多数固体溶解度随温度的升高而增大分析。
①硝酸钾的溶解度随温度的升高而增大,②熟石灰、
③氧气、
④二氧化碳的溶解度随温度的升高而减小;
故答案为:D。
9.
A
解析:根据饱和溶液定义分析。
5g氯化钠放入10g水中,得到13.6g氯化钠溶液,
说明固体没有全部溶解,所得溶液为饱和溶液;
故答案为:A。
10.
A
解析:根据溶解度与溶解性的关系分析,20℃时溶解度大于10g为易溶物质,大于1g小于10g为可溶物质,小于1g大于0.01g为微溶物质,小于0.01g为难溶性物质。
20℃时氯化钠的溶解度是36g
,大于10g,属于易溶物质;
故答案为:A。
11.
D
解析:根据饱和溶液不饱和溶液定义分析。
将3gA物质放入7g水中,得到10g溶液,
溶质全部溶解,所得溶液可能是刚好达到饱和也可能是不饱和溶液;
故答案为:D。
12.
A
解析:根据常见物质溶解时的放热和吸热现象分析。
A、硝酸铵溶解时吸热能使溶液温度降低,符合题意;
B、氢氧化钠溶解时放热,能使溶液温度升高,不符合题意;
C、蔗糖溶解时温度没有明显变化,不符合题意;
D、食盐溶解时温度没有明显变化,不符合题意;
故答案为:A。
13.
B
解析:根据配制一定质量分数的氯化钠溶液的方法步骤分析。
配制氯化钠溶液应先计算,再取用固体称量所需氯化钠,将称量好的氯化钠倒放烧杯中,再量取所需体积的水,倒入烧杯中,最后搅拌溶解;
故答案为:B。
14.
D
解析:该题主要考查学生对常见物质溶解过程中吸热、放热情况的掌握。
A
C.蔗糖和氯化钠溶于水时不放热,也不吸热;故A
C错误;
B.硝酸铵溶于水吸热,周围温度降低,石蜡不会融化;故B错误;
D.氢氧化钠溶于水会放出大量热量,导致烧杯的温度升高,石蜡会熔化,故D正确;
故答案为:D。
15.
B
解析:根据溶质质量分数定义分析。
20%的氯化钠溶液中,溶质、溶剂、溶液质量比为20:80:100=1:4:5;
故B关系不正确。
16.
D
解析:根据气体溶解度的影响因素分析。
气体溶解度除了与压强和温度有关外,还与溶剂的种类有关,但与溶剂的量无关,D不正确;
故答案为:D。
17.
B
解析:有些物质的溶解度随温度的升高而增大,有的物质的溶解度随温度的升高而减小;根据溶液的变化以及溶质质量分数的计算方法进行分析解答即可。
A、将一定量硝酸钾不饱和溶液升温10℃,硝酸钾的溶解度变大,溶质质量分数不变,故A不符合题意;
B、由于氢氧化钙的溶解度随温度的升高而减小,一定量饱和石灰水升温10℃,溶解度会变小,会析出部分氢氧化钙,溶质质量分数会变小,溶液中溶质的溶解度和溶质质量分数都发生变化,故B符合题意;
C、取一定量蔗糖不饱和溶液向其中加入少量蔗糖,溶解度不变,溶质的质量分数会变大,故C不符合题意;
D、取一定量氯化钠饱和溶液向其中加入少量水,溶质的溶解度不变,溶质质量分数变小,故D不符合题意;
故答案为:B。
18.
C
解析:根据试管中的现象可以看出,液体的密度小于水且不与水互溶,据此分析解答。
根据试管中的现象可以看出,液体浮在水的上面,说明液体的密度小于水且不与水互溶,
A、从所给数据可以看出,该物质与水互溶,故A不符合题意;
B、从所给数据可以看出,该物质与水不互溶,但密度比水大,故B不符合题意;
C、从所给数据可以看出,该物质与水不互溶,且密度比水小,故C符合题意;
D、从所给数据可以看出,该物质密度比水大,与水互溶,故D不符合题意;
故答案为:C。
19.
B
解析:根据天平的正确使用方法分析;根据取用固体药品的注意事项分析;根据量筒的正确使用分析;根据配制溶液要用玻璃棒搅拌分析。
天平使用应左物右砝,B中将氯化钠放在了右盘错误;
故答案为:B。
20.
A
解析:根据溶质质量分数定义分析。
溶质的质量分数为10%的氢氧化钠溶液即为100g溶液中含有10g溶质,而溶剂质量为90g,A理解不正确;
故答案为:A。
21.【答案】
A
【解析】【分析】过滤操作用于分离液体和不溶于液体的固态物质,据此分析判断。
【解答】净水器中的石子、细沙、纱布、棉花,这些材料间的空隙逐渐减小,可以将水中的杂质按照从大到小的顺序依次过滤掉,从而达到净水的目的,故A正确,而B、C、D错误。
故选A。
22.【答案】
C
【解析】【分析】根据结晶的方法分析判断。
【解答】食盐的溶解度受温度的影响非常小,因此可以使用蒸发溶剂的方式使其结晶出来,故C正确,而A、B、D错误。
故选C。
23.【答案】
B
【解析】【分析】自然界的水因含有许多物质和细菌,所以是混合物不宜直接饮用,针对水质的不同,需要对水进行净化处理。
【解答】水的净化过程是先物理净化再化学净化最后消毒后煮沸即可饮用,所以要先自然沉降,之后再化学沉降,然后消毒即可,饮用时要煮沸;故B符合;
故答案为:B。
24.【答案】
D
【解析】【分析】根据过滤、蒸发的操作步骤及注意事项分析。
【解答】蒸发结晶时,蒸发皿中出现较多量固体时停止加热,D操作错误;
故答案为:D。
25.【答案】
B
【解析】【分析】粗盐的提纯包括溶解、过滤和蒸发三个步骤,根据各步中的注意事项进行分析解答。
【解答】A、用托盘天平称量物体时遵循“左物右码”的原则,故A正确,但不符合题意;
B、不能在量筒里溶解粗盐,故B错误,但符合题意;
C、在过滤操作时,一定要做到“一贴、二低、三靠”,故C正确,但不符合题意;
D、蒸发时,要用玻璃棒不断的搅拌,防止局部过热,造成液体飞溅,故D正确,但不符合题意;
故答案为:B。
26.【答案】
C
【解析】【分析】粗食盐中含有不溶性(如泥沙)和可溶性的杂质(如K+、Mg2+、SO42+、Ca2+离子等)。不溶性的杂质可用溶解、过滤的方法除去;可溶性的杂质则是向粗食盐的溶液中加入能与杂质离子作用的盐类,使之生成沉淀后过滤除去。对K+
,
利用KCl溶解度大于NaCl,且含量少,蒸发浓缩后,NaCl呈晶体析出,分离可得NaCl晶体。
【解答】A
B
D对于粗盐应先溶解,不溶性杂质通过过滤除去,可溶性杂质先使之沉淀然后过滤除去,对于KCl与NaCl的水溶液,利用他们溶解度的不同,通过蒸发结晶的方法除去少量的KCl;故A
B
D错误,C正确;
故答案为C。
27.【答案】
D
【解析】【分析】根据水的净化处理的方法进行分析解答。
【解答】A、融化积雪,煮沸后使用,可以得到较纯净的软水,故A正确,但不符合题意;
B、收集雨水,煮沸后使用,可以得到较纯净的软水,故B正确,但不符合题意;
C、过滤泥水,煮沸后使用,可以得到较纯净的软水,故C正确,但不符合题意;
D、用沙子和木炭处理海水,不能除去海水中的盐,煮沸后不能使用,故D错误,但符合题意;
故答案为:D。
28.【答案】
D
【解析】【分析】蒸馏原理:利用液体混合物中各组分挥发度的差别,使液体混合物部分汽化并随之使蒸气部分冷凝,从而实现其所含组分的分离。过滤原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。
【解答】A、酒精和水沸点不同,可以用蒸馏的方法分离;故A正确;
B、泥沙不溶于水,食盐溶于水,将其混合物溶于水可以用过滤的方法分离;故B正确;
C、氯化钠不易升华,碘在高温条件下易升华,因此,可用加热的方法将两者分离;故C正确;
D、汽油和水是两种互不相溶的液态物质,不能采用过滤的方法分离;故D错误;
故答案为:D。
29.【答案】
C
【解析】【分析】结晶方法一般为两种,一种是蒸发结晶,一种是降温结晶。蒸发结晶一般是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出的方法。降温结晶一般是指先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出的方法。观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。当陡升型溶液中混有缓升型时,若要分离出陡升型的溶质,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法。
【解答】根据盐的溶解度曲线可知其为缓升型曲线。因此,分离盐易用蒸发结晶的方法,即蒸发溶剂的方法;故C正确;AD都有提到降温结晶,故AD错误;氯化钠的溶解度随温度变化较小,故B错误。
故答案为:C。
30.【答案】
D
【解析】【分析】根据净水的知识进行分析,除杂时可以采用先除去易除的杂质,再除去难除的杂质的顺序.水中含有的不溶性国体大颗粒杂质可以通过沉降除去;不溶性小颗粒固体杂质可以通过过滤除去;投药消毒杀菌可以除去细菌微生物。
【解答】将混有泥沙的天然水净化成生活用的自来水,加明矾吸附沉降是把水中小颗粒泥尘聚集大的,以利于沉降;不溶性小颗粒固体杂质可以通过过滤除去;投药消毒杀菌可以除去细菌微生物;故混有泥沙的天然水净化成生活用的自来水,将所选用的方法按净化过程排序是②加明矾吸附沉降→①过滤→④消毒杀菌,净水过程中无需进行蒸馏;
故答案为:D。
31.【答案】
D
【解析】【分析】根据蒸馏水为纯净的水,不含有其他杂质分析;根据蒸馏水的形成分析。
【解答】A.水本身就是一种化学物质,不符合题意;
B.蒸馏水是纯净的水,缺少人体所需矿物质,不能长期饮用,不符合题意;
C.蒸馏水不含其他杂质,不符合题意;
D.蒸馏水可以通过自来水加热产生的水蒸气冷却而获得,符合题意;
故答案为:D。
32.【答案】
C
【解析】【分析】根据结晶的定义及方法分析。
【解答】A.结晶是指有规则几何形状的晶体从溶液中析出的过程,说正确;
B.不同物质的晶体从溶液中析出后,其几何形状可能不相同,说法正确;
C.结晶可以在蒸发溶液的时候进行,也可以在改变温度的时候进行,说法错误;
D.硝酸钾的溶解度受温度变化影响很大,所以把硝酸钾晶体从其溶液中结晶出来最好采用冷却热饱和溶液法,说法正确;
故答案为:C。
二、填空题
33.
(1)⑤→①
(2)A
解析:(1)根据配制一定溶质质量分数的溶液的实验过程解答;
(2)根据溶质质量分数=可知,食盐溶液的溶质质量分数偏小,要么是因为溶质质量偏小,要么是溶剂质量偏大,据此分析判断。
(1)配制溶液的步骤:
②从试剂瓶中取出食盐;
⑤用天平称量规定质量的食盐;
①将食盐倒入烧杯中;
④用量筒量取合适体积的水,然后倒入烧杯中;
③用玻璃棒搅拌,直至食盐完全溶解即可。
即②→⑤→①→④→③。
(2)A.称取的食盐不纯,那么食盐的质量偏小,从而导致溶质质量分析偏小,故①正确;
B.配制好的溶液是均一稳定的,即使有少量液体溅出,也不会影响溶质质量分数,故②错误。
故选A。
34.
计算溶质和溶剂的量;称量(或量取)所需的溶质与溶剂;溶解溶质配成溶液
解析:根据配制一定溶质质量分数溶液的实验过程解答。
配制溶质质量分数一定的溶液的基本步骤是:计算溶质和溶剂的量,称量(或量取)所需的溶质与溶剂,溶解溶质配成溶液。
35.
溶质质量;溶液质量
解析:根据溶质质量分数的定义解答。
溶质的质量分数是表示溶液组成的一种方法,它是溶质质量与溶液质量的比值。
36.
在一定温度下;饱和状态
解析:根据溶解度的定义解答。
在一定温度下,某物质在100g另一种液体中达到饱和状态时所溶解的质量,叫做这种物质在该种溶剂中的溶解度。
37.
20℃时,100g水中最多可溶解硝酸钾31.6g
解析:根据溶解度的意义解答。
20℃时,硝酸钾的溶解度为31.6克,它的含义是:20℃时,100g水中最多可溶解硝酸钾31.6g。
38.
32;168
解析:根据溶质质量=溶液质量×质量分数分析;根据溶液质量=溶质质量+溶剂质量分析。
配制200kg
质量分数为16%的氯化钠溶液
,需要氯化钠的质量为200kg×16%=32kg,水的质量是200kg-32kg=168kg;
故答案为:32;168.
39.
(1)40
(2)是
(3)b=c>a
解析:在一定温度下,在一定量溶剂里的溶质的溶解量是有一定限度的。化学上用溶解度表示这种溶解的限度;溶液中溶质的质量分数是溶质质量与溶液质量之比。
(1)在一定温度下,在一定量溶剂里的溶质的溶解量是有一定限度的。化学上用溶解度表示这种溶解的限度。
在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,
实验②溶液为140g,但是到实验③溶液依然为140g,说明到实验③溶液已经饱和了,所以
该温度下氯化钾的溶解度也就是溶解的最大限度为40克。
(2)实验②溶液为140g,但是到实验③溶液依然为140g,说明到实验③溶液已经饱和了,所以已经不能溶解了,实验③的溶液确实为饱和溶液。
(3)溶液中溶质的质量分数是溶质质量与溶液质量之比。实验①的溶质的质量分数为33.3%,实验②的溶质的质量分数为42.9%,实验③?由于已经饱和了,它的溶质的质量分数是42.9%。
?
故答案为:(1)
40?;(2)
是?;(3)
b=c>a
40.
(1)蔗糖逐渐溶解完全,溶液无色透明
(2)使蔬菜上残留的农药溶于水,方便除去
解析:溶解是指一种(或多种)物质进入液体物质,会发生一种(或多种)物质扩散进入液体物质,两者融为一体的过程。
(1)蔗糖是可溶于水的一种物质,所以蔗糖加入足量的水中,可以看到蔗糖会完全溶解,且溶液为无色;故答案为:蔗糖逐渐溶解完全,溶液无色透明;
(2)物质的溶解需要一段时间,所以为了更好的去除蔬菜上残留的农药,要浸泡一段时间再清洗;故答案为:使蔬菜上残留的农药溶于水,方便除去;
故答案为:(1)蔗糖逐渐溶解完全,溶液无色透明;(2)使蔬菜上残留的农药溶于水,方便除去。
41.
溶剂的性质;溶质的性质;温度
解析:影响固体溶解度的因素有:溶质的性质、溶剂的性质和温度,据此分析解答。
影响固体溶解度大小的因素有内因和外因两个方面,内因指:溶剂的性质,溶质的性质,外因指:温度;
①食盐易溶于水,而难溶于植物油,溶质相同溶剂不同,说明溶剂的性质的影响;
②硝酸钾易溶于水,而碳酸钙难溶于水,溶剂相同溶质不同,说明溶质的性质的影响;
③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多,溶质相同溶剂相同,温度不同,说明温度的影响;
故答案为:溶剂的性质;溶质的性质;温度。
42.
(1)氯化钾
(2)等于
解析:溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。物质的溶解度属于物理性质。
(1)由溶解度曲线可知,60摄氏度时氯化钾的溶解度大于硝酸钾的溶解度,饱和溶液中溶解度越大,溶解的溶质越多;故答案为:氯化钾;
(2)由图可知,t摄氏度时氯化钾和硝酸钾的溶解度相同,说明饱和溶液中氯化钾和硝酸钾的溶质质量相同,而升高温度会改变物质的溶解度,但没有继续溶解溶质进去,所以两者的溶质质量分数是不变的;故答案为:等于;
故答案为:(1)氯化钾;(2)等于。
三、解答题
43.
设100g饱和的硝酸钾溶液中有x克硝酸钾,
;
解得:x=24g。
答:含有硝酸钾24g
解析:在同一温度下,饱和溶液的溶质质量分数保持不变,根据溶质质量分数=列方程计算即可。
44.
(1)需要氯化钠的质量为:50g×10%=5g;
(2)需要20%的氯化钠溶液质量:。
解析:(1)根据溶质质量=溶液质量×溶质质量分数计算;
(2)稀释前后,溶质的质量保持不变,根据溶液质量=计算即可。
33.
500g生理盐水中含氯化钠的质量为:500g×0.9%=4.5g;
其中含水的质量为:500g-4.5g=495.5g。
解析:根据溶液质量×溶质质量分数计算出氯化钠的质量,根据溶质量-溶质质量计算出溶剂水的质量。
2
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
