江苏省华东师范大学盐城实验中学2021-2022学年上学期高二第一次月考化学试题 Word版含答案9-27
文档属性
| 名称 | 江苏省华东师范大学盐城实验中学2021-2022学年上学期高二第一次月考化学试题 Word版含答案9-27 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-28 10:10:35 | ||
图片预览

文档简介
9.27-28
2021—2022学年秋学期高二年级第一次质量检测
化
学
试
题
时长:150分钟
分值:150
命题人:
做题人:
审核人:
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Na
23
Al
27
S
32
C
35.5
K
39
Ca
40
Cr
52
Fe
56
Cu
64
I
127
单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.
1.从古至今化学均与生活、生产密切相关,化学工业在各国的国民经济中占有重要地位,是许多国家的基础产业和支柱产业。下列有关说法错误的是(
)
A.战国曾侯乙编钟属于青铜制品,青铜是一种合金
B.敦煌莫高窟壁画中绿色颜料铜绿的主要成分是碳酸铜
C.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
D.大兴机场的隔震支座由橡胶和钢板相互叠加黏结而成,不属于新型无机材料
2.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高经济效益
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶、月饼等包装中加入还原性铁粉,能显著延长茶叶、月饼等的储存时间
3.向体积均为2
L的A、B、C三个密闭容器中分别充入1
mol
X气体和3
mol
Y气体,发生反应:
X(g)+3Y(g)2Z(g)。2
min后反应达到最大限度,测得A中剩余0.4
mol
X,B中Y的浓度为
0.5
mol·L-1,C中用Z表示的反应速率为v(Z)=0.3
mol·L-1·min-1。则0~2
min
内三个容器中反
应速率的大小关系为( )
A.B>A=C
B.A>B=C
C.B>A>C
D.A>B>C
4.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
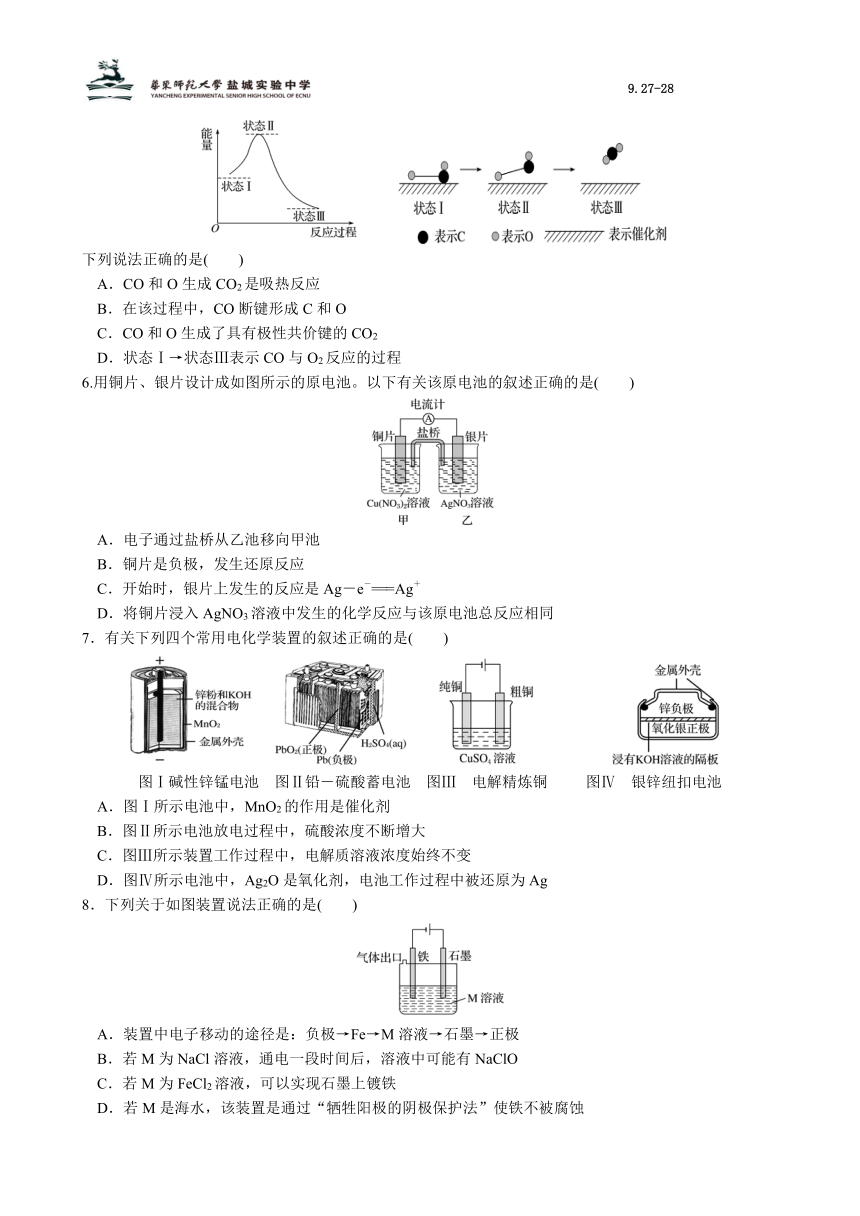
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
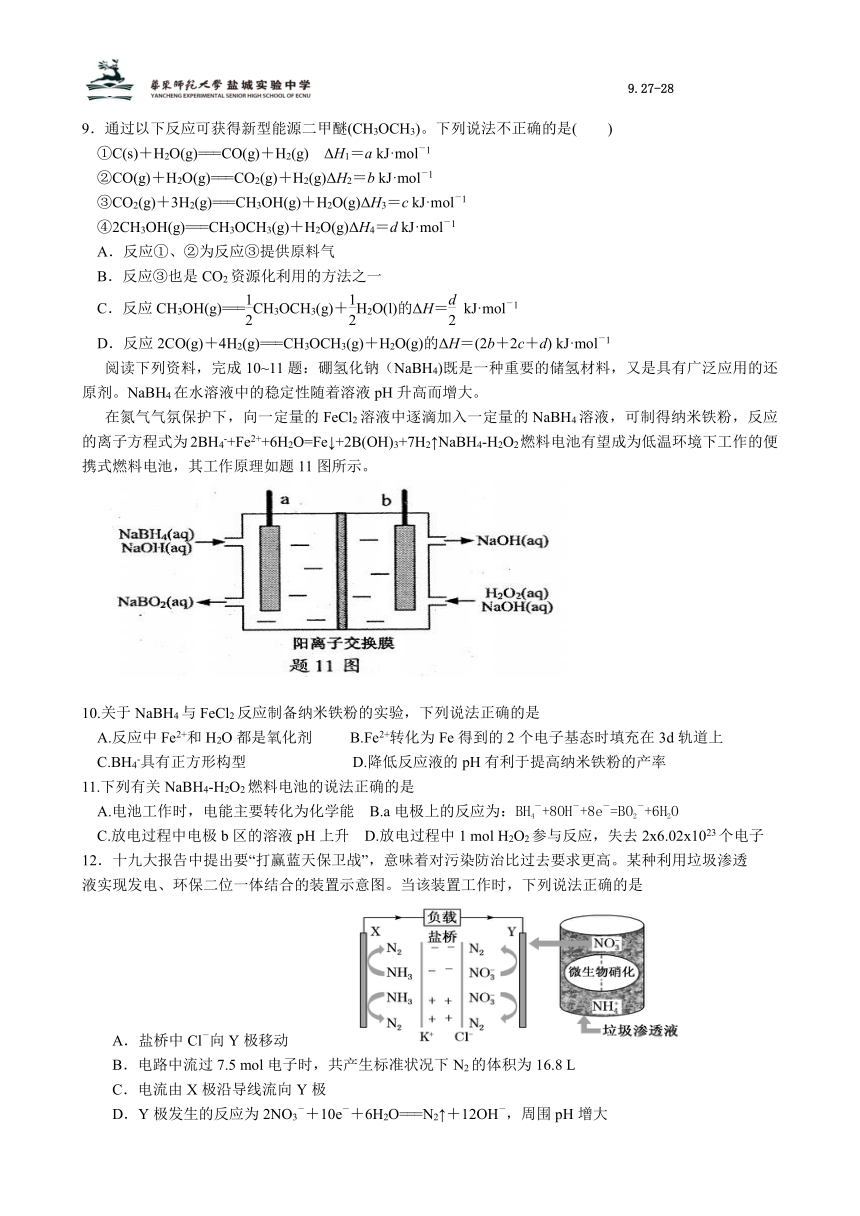
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.铜片是负极,发生还原反应
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
7.有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ碱性锌锰电池 图Ⅱ铅-硫酸蓄电池
图Ⅲ 电解精炼铜
图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
9.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a
kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)ΔH2=b
kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH3=c
kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)ΔH4=d
kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH=
kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)
kJ·mol-1
阅读下列资料,完成10~11题:硼氢化钠(NaBH4)既是一种重要的储氢材料,又是具有广泛应用的还原剂。NaBH4在水溶液中的稳定性随着溶液pH升高而增大。
在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉,反应的离子方程式为2BH4-+Fe2++6H2O=Fe↓+2B(OH)3+7H2↑NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如题11图所示。
10.关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是
A.反应中Fe2+和H2O都是氧化剂
B.Fe2+转化为Fe得到的2个电子基态时填充在3d轨道上
C.BH4-具有正方形构型
D.降低反应液的pH有利于提高纳米铁粉的产率
11.下列有关NaBH4-H2O2燃料电池的说法正确的是
A.电池工作时,电能主要转化为化学能
B.a电极上的反应为:BH4-+8OH-+8e-=BO2-+6H2O
C.放电过程中电极b区的溶液pH上升
D.放电过程中1
mol
H2O2参与反应,失去2x6.02x1023个电子
12.十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透
液实现发电、环保二位一体结合的装置示意图。当该装置工作时,下列说法正确的是
A.盐桥中Cl-向Y极移动
B.电路中流过7.5
mol电子时,共产生标准状况下N2的体积为16.8
L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH-,周围pH增大
13.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是( )
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能E正=186.19
kJ·mol-1
D.相同条件下,由中间产物Z转化为产物的速率:v(P1)二、非选择题(本题包括4小题,共61分)
14.(9分)在容积为2
L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4
mol,B为6
mol;5
min时测得C为3
mol,用D表示的化学反应速率v(D)为0.2
mol·L-1·min-1。
试回答下列问题:
(1)5
min时B的物质的量浓度为________。
(2)5
min内用A表示的化学反应速率v(A)为________。
(3)化学方程式中n为________。
(4)此反应在四种不同情况下的反应速率如下:
①v(A)=5
mol·L-1·min-1②v(B)=0.5
mol·L-1·s-1③v(C)=4.5
mol·L-1·min-1④v(D)=0.8
mol·L-1·s-1
其中反应速率最快的是________(填序号)。
15.(14分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;
装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为_______________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI?淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
16.(18分)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号
实验温度/K
有关物质
溶液颜色褪至无色所需时间/s
酸性KMnO4溶液
H2C2O4溶液
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
293
2
0.02
4
0.1
0
t1
B
T1
2
0.02
3
0.1
V1
8
C
313
2
0.02
V2
0.1
1
t2
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中
V1=______________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是____________________________________________;
忽略溶液体积的变化,利用实验B中数据计算,0~8
s内,用KMnO4的浓度变化表示的反应速率
v(KMnO4)=________。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中
n(Mn2+)随时间的变化情况如图所示,并认为造成这种变
化的原因是反应体系中的某种粒子对KMnO4与草酸之间
的反应有某种特殊作用,则该作用是__________,相应的
粒子最可能是________(填粒子符号)。
17.(20分)(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
①该电池放电时正极反应式为__________________________________________________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______________(填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________________________________________________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)一定温度下,反应H2+Cl2===2HCl中的某一基元反应为H2+Cl===HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
该基元反应的活化能为____________
kJ·mol-1,ΔH为________kJ·mol-1。
(4)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(5)已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
参考答案
1-5
B
D
A
D
C
6-10
D
D
B
C
A
11-13
C
D
C
14.(9分)
(1)2
mol·L-1 (2)0.1
mol·L-1·min-1 (3)2 (4)
(3分)④
(14分)
(1)②③ 2Cl-+2H2O2OH-+Cl2↑+H2↑
(2)CnH2nOn-4ne-+nH2O===nCO2+4nH+
(3)BH-8e-+8OH-===BO+6H2O 红
O2+2H2O+4e-===4OH- B
(18分)
(1)浓度 1 293 B、C 3
(2)其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4
mol·L-1·s-1
(3)催化作用 Mn2+
17.(20分)
(1)①FeO+4H2O+3e-===Fe(OH)3+5OH-②右 ③使用时间长、工作电压稳定
(2)①负 ②2HSO+2H++2e-===S2O+2H2O ③2NO+2S2O+2H2O===N2+4HSO
(3)21.5 7.5
(4)470
(5)226.8
kJ·mol-1
2021—2022学年秋学期高二年级第一次质量检测
化
学
试
题
时长:150分钟
分值:150
命题人:
做题人:
审核人:
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Na
23
Al
27
S
32
C
35.5
K
39
Ca
40
Cr
52
Fe
56
Cu
64
I
127
单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.
1.从古至今化学均与生活、生产密切相关,化学工业在各国的国民经济中占有重要地位,是许多国家的基础产业和支柱产业。下列有关说法错误的是(
)
A.战国曾侯乙编钟属于青铜制品,青铜是一种合金
B.敦煌莫高窟壁画中绿色颜料铜绿的主要成分是碳酸铜
C.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
D.大兴机场的隔震支座由橡胶和钢板相互叠加黏结而成,不属于新型无机材料
2.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高经济效益
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶、月饼等包装中加入还原性铁粉,能显著延长茶叶、月饼等的储存时间
3.向体积均为2
L的A、B、C三个密闭容器中分别充入1
mol
X气体和3
mol
Y气体,发生反应:
X(g)+3Y(g)2Z(g)。2
min后反应达到最大限度,测得A中剩余0.4
mol
X,B中Y的浓度为
0.5
mol·L-1,C中用Z表示的反应速率为v(Z)=0.3
mol·L-1·min-1。则0~2
min
内三个容器中反
应速率的大小关系为( )
A.B>A=C
B.A>B=C
C.B>A>C
D.A>B>C
4.某同学设计如图所示实验,探究反应中的能量变化。
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响
D.若用NaOH固体代替NaOH溶液与盐酸反应测定中和反应的反应热,则测定数值偏高
5.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
6.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.铜片是负极,发生还原反应
C.开始时,银片上发生的反应是Ag-e-===Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
7.有关下列四个常用电化学装置的叙述正确的是( )
图Ⅰ碱性锌锰电池 图Ⅱ铅-硫酸蓄电池
图Ⅲ 电解精炼铜
图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
8.下列关于如图装置说法正确的是( )
A.装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C.若M为FeCl2溶液,可以实现石墨上镀铁
D.若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
9.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a
kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)ΔH2=b
kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH3=c
kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)ΔH4=d
kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH=
kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)
kJ·mol-1
阅读下列资料,完成10~11题:硼氢化钠(NaBH4)既是一种重要的储氢材料,又是具有广泛应用的还原剂。NaBH4在水溶液中的稳定性随着溶液pH升高而增大。
在氮气气氛保护下,向一定量的FeCl2溶液中逐滴加入一定量的NaBH4溶液,可制得纳米铁粉,反应的离子方程式为2BH4-+Fe2++6H2O=Fe↓+2B(OH)3+7H2↑NaBH4-H2O2燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如题11图所示。
10.关于NaBH4与FeCl2反应制备纳米铁粉的实验,下列说法正确的是
A.反应中Fe2+和H2O都是氧化剂
B.Fe2+转化为Fe得到的2个电子基态时填充在3d轨道上
C.BH4-具有正方形构型
D.降低反应液的pH有利于提高纳米铁粉的产率
11.下列有关NaBH4-H2O2燃料电池的说法正确的是
A.电池工作时,电能主要转化为化学能
B.a电极上的反应为:BH4-+8OH-+8e-=BO2-+6H2O
C.放电过程中电极b区的溶液pH上升
D.放电过程中1
mol
H2O2参与反应,失去2x6.02x1023个电子
12.十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透
液实现发电、环保二位一体结合的装置示意图。当该装置工作时,下列说法正确的是
A.盐桥中Cl-向Y极移动
B.电路中流过7.5
mol电子时,共产生标准状况下N2的体积为16.8
L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH-,周围pH增大
13.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是( )
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能E正=186.19
kJ·mol-1
D.相同条件下,由中间产物Z转化为产物的速率:v(P1)
14.(9分)在容积为2
L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4
mol,B为6
mol;5
min时测得C为3
mol,用D表示的化学反应速率v(D)为0.2
mol·L-1·min-1。
试回答下列问题:
(1)5
min时B的物质的量浓度为________。
(2)5
min内用A表示的化学反应速率v(A)为________。
(3)化学方程式中n为________。
(4)此反应在四种不同情况下的反应速率如下:
①v(A)=5
mol·L-1·min-1②v(B)=0.5
mol·L-1·s-1③v(C)=4.5
mol·L-1·min-1④v(D)=0.8
mol·L-1·s-1
其中反应速率最快的是________(填序号)。
15.(14分)铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
为防止金属Fe被腐蚀,可以采用上述________(填装置序号)装置原理进行防护;
装置③中总反应的离子方程式为__________________________________________________________。
(2)用甲烷或其他有机物、氧气为原料可设计成原电池,以CnH2nOn、O2为原料,硫酸溶液为电解质设计成燃料电池,则负极的电极反应式为__________________________________。
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池。
图2电池负极区的电极反应为_______________________________________;
若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现________色,c位置的电极反应式为______________________________________________________,
若用KI?淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是________(填“A”或“B”)电极。
16.(18分)某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号
实验温度/K
有关物质
溶液颜色褪至无色所需时间/s
酸性KMnO4溶液
H2C2O4溶液
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
293
2
0.02
4
0.1
0
t1
B
T1
2
0.02
3
0.1
V1
8
C
313
2
0.02
V2
0.1
1
t2
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中
V1=______________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是____________________________________________;
忽略溶液体积的变化,利用实验B中数据计算,0~8
s内,用KMnO4的浓度变化表示的反应速率
v(KMnO4)=________。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中
n(Mn2+)随时间的变化情况如图所示,并认为造成这种变
化的原因是反应体系中的某种粒子对KMnO4与草酸之间
的反应有某种特殊作用,则该作用是__________,相应的
粒子最可能是________(填粒子符号)。
17.(20分)(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
①该电池放电时正极反应式为__________________________________________________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______________(填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________________________________________________________________________。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
①a是直流电源的________极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为________________________________________________________________________。
③用离子方程式表示吸收NO的原理__________________________________________
________________________________________________________________________。
(3)一定温度下,反应H2+Cl2===2HCl中的某一基元反应为H2+Cl===HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
该基元反应的活化能为____________
kJ·mol-1,ΔH为________kJ·mol-1。
(4)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(5)已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
参考答案
1-5
B
D
A
D
C
6-10
D
D
B
C
A
11-13
C
D
C
14.(9分)
(1)2
mol·L-1 (2)0.1
mol·L-1·min-1 (3)2 (4)
(3分)④
(14分)
(1)②③ 2Cl-+2H2O2OH-+Cl2↑+H2↑
(2)CnH2nOn-4ne-+nH2O===nCO2+4nH+
(3)BH-8e-+8OH-===BO+6H2O 红
O2+2H2O+4e-===4OH- B
(18分)
(1)浓度 1 293 B、C 3
(2)其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4
mol·L-1·s-1
(3)催化作用 Mn2+
17.(20分)
(1)①FeO+4H2O+3e-===Fe(OH)3+5OH-②右 ③使用时间长、工作电压稳定
(2)①负 ②2HSO+2H++2e-===S2O+2H2O ③2NO+2S2O+2H2O===N2+4HSO
(3)21.5 7.5
(4)470
(5)226.8
kJ·mol-1
同课章节目录
