福建省泉州现代重点高中2020-2021学年高一下学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 福建省泉州现代重点高中2020-2021学年高一下学期期中考试化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-29 00:00:00 | ||
图片预览




文档简介
泉州现代中学2020—2021学年下学期期中考高一年段化学试卷
一、选择题(21题,1-14题,每题2分,15-21题每题3分,共49分)。
1.
下列措施不符合节能减排的是
A.
大力发展火力发电,解决电力紧张问题
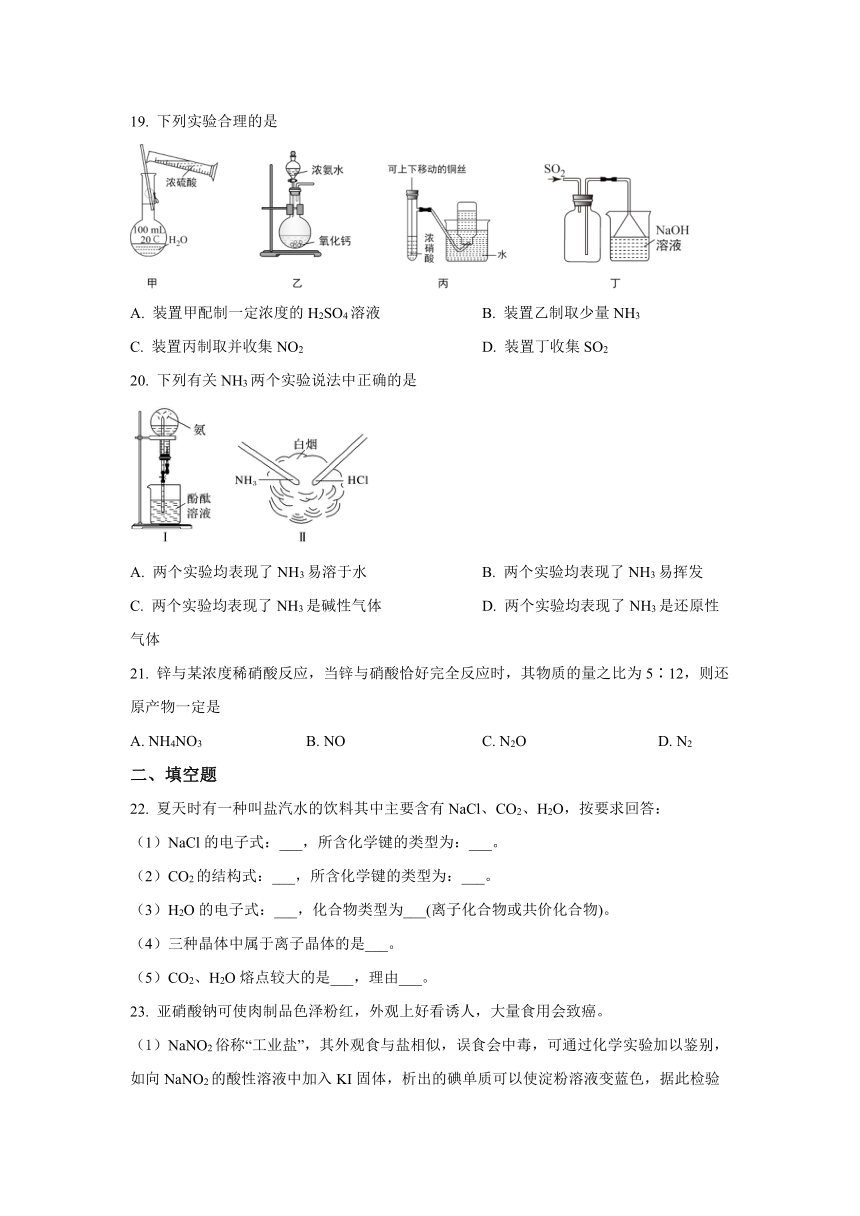
B.
在屋顶安装太阳能热水器为居民提供生活用热水
C.
用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.
用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
2.
下列说法正确的是
A.
浓硫酸沾在皮肤上,可以不做任何处理
B.
不慎洒出的酒精在桌上着火时,应立即用大量水扑灭
C.
大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.
金属钠着火时,可用水浇灭
3.
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2的说法正确的是( )
A.
SO2属于非法添加剂,不该添加到葡萄酒中
B.
SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.
SO2具有还原性,不能用浓硫酸干燥
D.
SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
4.
下列关于N、S的化合物的性质解释错误的是
A.
HNO3需避光保存,因为HNO3见光易分解
B.
SO2能使品红溶液褪色,是因为SO2有漂白性
C.
NH4HCO3化肥需密封储存,是因为NH4HCO3分解
D.
浓硫酸可用作气体干燥剂,是因为浓硫酸具有脱水性
5.
常温下,下列金属制成的容器能盛放浓硝酸的是
A.
铝
B.
镁
C.
铜
D.
银
6.
与Na+具有相同的质子数和电子数的微粒是
A.
F-
B.
Cl-
C.
OH-
D.
NH
7.
下列有关原子核外电子的说法错误的是
A.
每个电子层作为最外层时,最多可容纳8个电子
B.
电子在核外是分层排布的
C.
电子不停地做高速运动
D.
离原子核近的电子能量低,离原子核远的电子能量高
8.
下列化学用语的表述不正确的是
A.
CO2的结构式:O—C—O
B.
氯化铵的电子式:
C.
OH-:
D.
O2-离子的结构示意图为
9.
下列各组微粒中,互为同素异形体的是
A.
C和C
B.
红磷和白磷
C.
H2O和H2O2
D.
正丁烷和异丁烷
10.
下列化合物全部以共用电子对成键的是
A.
H2O
B.
MgCl2
C.
NaOH
D.
NH4Cl
11.
下列化合物中既含有离子键又含有共价键的化合物是
A.
CaBr2
B.
HCl
C.
NaOH
D.
H2O2
12.
根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.
电解水
B.
干冰受热直接变成气体
C.
HCl溶解于水
D.
打雷放电时,O2变成O3
13.
铋(Bi)在医药方面有重要应用,下列关于Bi和Bi的说法正确的是
A.
Bi和Bi都含有83个中子
B.
Bi和Bi互为同位素
C.
Bi和Bi的核外电子数不同
D.
Bi和Bi分别含有126和127个质子
14.
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.
CO2和H2O
B.
NaCl和HCl
C.
SiO2和CO2
D.
NaOH和CH4
15.
已知短周期元素的离子aA+、bB2+、cC2-、dD-具有相同的电子层结构;则下列叙述正确的是
A.
质子数:a>b>d>c
B.
金属性:A>B>D>C
C
离子半径:C2->D->B2+>A+
D.
原子半径:A>B>C>D
16.
已知溴的原子结构示意图如图,则下列对溴的结构及性质的说法不正确的是
A.
溴元素的原子序数是35
B.
溴元素在周期表的位置是第4周期,第ⅦA族
C.
溴的最高价为+7价
D.
溴的气态氢化物比HCl稳定
17.
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4,W与Y同主族。下列说法正确的是
A.
原子半径的大小顺序:W
>
Z
>
Y
>
X
B.
Y分别与Z、W形成的化合物中化学键类型相同
C.
单质Z能在X的最高价氧化物中燃烧
D.
Y、W的简单气态氢化物的热稳定性:Y
<
W
18.
几种短周期元素的原子半径及主要化合价见下表:
元素代号
A
L
M
Q
R
T
原子半径/nm
0.183
0.160
0.143
0.102
0.111
0.074
主要化合价
+1
+2
+3
+6、-2
+2
-2
下列叙述正确是( )
A.
A、L、M三元素的金属性逐渐增强
B.
在RCl2分子中,各原子均满足8电子的稳定结构
C.
Q元素的最高价氧化物为电解质,其水溶液能够导电
D.
A在T单质中燃烧所形成的化合物中含有共价键和离子键
19.
下列实验合理的是
A.
装置甲配制一定浓度的H2SO4溶液
B.
装置乙制取少量NH3
C.
装置丙制取并收集NO2
D.
装置丁收集SO2
20.
下列有关NH3两个实验说法中正确的是
A.
两个实验均表现了NH3易溶于水
B.
两个实验均表现了NH3易挥发
C.
两个实验均表现了NH3是碱性气体
D.
两个实验均表现了NH3是还原性气体
21.
锌与某浓度稀硝酸反应,当锌与硝酸恰好完全反应时,其物质的量之比为5∶12,则还原产物一定是
A.
NH4NO3
B.
NO
C.
N2O
D.
N2
二、填空题
22.
夏天时有一种叫盐汽水的饮料其中主要含有NaCl、CO2、H2O,按要求回答:
(1)NaCl的电子式:___,所含化学键的类型为:___。
(2)CO2的结构式:___,所含化学键的类型为:___。
(3)H2O的电子式:___,化合物类型为___(离子化合物或共价化合物)。
(4)三种晶体中属于离子晶体的是___。
(5)CO2、H2O熔点较大的是___,理由___。
23.
亚硝酸钠可使肉制品色泽粉红,外观上好看诱人,大量食用会致癌。
(1)NaNO2俗称“工业盐”,其外观食与盐相似,误食会中毒,可通过化学实验加以鉴别,如向NaNO2的酸性溶液中加入KI固体,析出的碘单质可以使淀粉溶液变蓝色,据此检验NaNO2。
①完成下列反应的化学方程式并配平:____。
_____NaNO2+_____KI+_____H2SO4=____Na2SO4+____K2SO4+____I2+___NO↑+_____
②该反应中被氧化的元素是___。
③标准状况下,该反应中每转移1mole-,生成气体的体积是___。
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,氧化剂与还原剂的物质的量之比为___。
24.
现有A、B、C、D、E五种短周期元素,原子序数逐渐增大,它们的性质或原子结构如表:
元素
性质或原子结构
A
原子核内只有一个质子
B
原子最外层电子数是次外层电子数的3倍
C
短周期元素中原子半径最大的元素
D
地壳中含量最多的金属元素
E
最高正化合价与最低负化合价的代数和为6
(1)写出下列各元素的符号:A___,B___,D___。
(2)元素D在周期表中的位置___。
(3)画出E元素原子的结构示意图___。
(4)写出单质A在单质E中燃烧的化学方程式___。
(5)元素C与元素D的最高价氧化物对应水化物的碱性较强的是___(填化学式),它们之间发生反应的离子方程式是___。
三、填空题。
25.
某化学兴趣小组为制取SO2并探究其性质按下列装置进行实验。【制取SO2的反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
【实验探究】
(1)装置(I)中仪器a的名称是___。
(2)实验进行一段时间后:
①装置(Ⅱ)中观察到紫色石蕊溶液颜色变为___,原因是SO2与H2O反应生成___(写化学式)。
②装置(Ⅲ)中观察到氯水颜色褪去,是因为SO2与氯水发生反应。补充完整该反应的化学方程式;SO2+Cl2+2H2O=H2SO4+2___。其中SO2表现___(填“氧化性”或“还原性”)。
(3)装置(Ⅳ)应从图中选用合适的尾气吸收装置是___(填“A”或“B”),烧杯中应盛放的溶液是___。
(4)用3.2gCu与足量浓硫酸反应,理论上可生成标准状况下SO2的体积为___L。(Cu的摩尔质量为64g·mol-1)
【实验拓展】
(5)该兴趣小组为进一步探究SO2漂白性,依次进行如下实验。
实验步骤
实验现象
实验结论
①
品红溶液颜色___
SO2具有漂白性
②
溶液恢复到原来颜色
SO2的漂白具有___性
【知识应用】
(6)硫酸是重要的化工产品。目前工业上主要采用接触法制硫酸,写出其中SO2与O2在一定条件下反应生成SO3的化学方程式:___。
26.
某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
【实验探究】
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
【知识应用】
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O24NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
泉州现代中学2020—2021学年下学期期中考高一年段化学试卷
答案版
一、选择题(21题,1-14题,每题2分,15-21题每题3分,共49分)。
1.
下列措施不符合节能减排的是
A.
大力发展火力发电,解决电力紧张问题
B.
在屋顶安装太阳能热水器为居民提供生活用热水
C.
用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.
用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
答案:A
2.
下列说法正确的是
A.
浓硫酸沾在皮肤上,可以不做任何处理
B.
不慎洒出的酒精在桌上着火时,应立即用大量水扑灭
C.
大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.
金属钠着火时,可用水浇灭
答案:C
3.
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2的说法正确的是( )
A.
SO2属于非法添加剂,不该添加到葡萄酒中
B.
SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.
SO2具有还原性,不能用浓硫酸干燥
D.
SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
答案:B
4.
下列关于N、S的化合物的性质解释错误的是
A.
HNO3需避光保存,因为HNO3见光易分解
B.
SO2能使品红溶液褪色,是因为SO2有漂白性
C.
NH4HCO3化肥需密封储存,是因为NH4HCO3分解
D.
浓硫酸可用作气体干燥剂,是因为浓硫酸具有脱水性
答案:D
5.
常温下,下列金属制成的容器能盛放浓硝酸的是
A.
铝
B.
镁
C.
铜
D.
银
答案:A
6.
与Na+具有相同的质子数和电子数的微粒是
A.
F-
B.
Cl-
C.
OH-
D.
NH
答案:D
7.
下列有关原子核外电子的说法错误的是
A.
每个电子层作为最外层时,最多可容纳8个电子
B.
电子在核外是分层排布的
C.
电子不停地做高速运动
D.
离原子核近的电子能量低,离原子核远的电子能量高
答案:A
8.
下列化学用语的表述不正确的是
A.
CO2的结构式:O—C—O
B.
氯化铵的电子式:
C.
OH-:
D.
O2-离子的结构示意图为
答案:A
9.
下列各组微粒中,互为同素异形体的是
A.
C和C
B.
红磷和白磷
C.
H2O和H2O2
D.
正丁烷和异丁烷
答案:B
10.
下列化合物全部以共用电子对成键的是
A.
H2O
B.
MgCl2
C.
NaOH
D.
NH4Cl
答案:A
11.
下列化合物中既含有离子键又含有共价键的化合物是
A.
CaBr2
B.
HCl
C.
NaOH
D.
H2O2
答案:C
12.
根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.
电解水
B.
干冰受热直接变成气体
C.
HCl溶解于水
D.
打雷放电时,O2变成O3
答案:B
13.
铋(Bi)在医药方面有重要应用,下列关于Bi和Bi的说法正确的是
A.
Bi和Bi都含有83个中子
B.
Bi和Bi互为同位素
C.
Bi和Bi的核外电子数不同
D.
Bi和Bi分别含有126和127个质子
答案:B
14.
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.
CO2和H2O
B.
NaCl和HCl
C.
SiO2和CO2
D.
NaOH和CH4
答案:A
15.
已知短周期元素的离子aA+、bB2+、cC2-、dD-具有相同的电子层结构;则下列叙述正确的是
A.
质子数:a>b>d>c
B.
金属性:A>B>D>C
C
离子半径:C2->D->B2+>A+
D.
原子半径:A>B>C>D
答案:D
16.
已知溴的原子结构示意图如图,则下列对溴的结构及性质的说法不正确的是
A.
溴元素的原子序数是35
B.
溴元素在周期表的位置是第4周期,第ⅦA族
C.
溴的最高价为+7价
D.
溴的气态氢化物比HCl稳定
答案:D
17.
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4,W与Y同主族。下列说法正确的是
A.
原子半径的大小顺序:W
>
Z
>
Y
>
X
B.
Y分别与Z、W形成的化合物中化学键类型相同
C.
单质Z能在X的最高价氧化物中燃烧
D.
Y、W的简单气态氢化物的热稳定性:Y
<
W
答案:C
18.
几种短周期元素的原子半径及主要化合价见下表:
元素代号
A
L
M
Q
R
T
原子半径/nm
0.183
0.160
0.143
0.102
0.111
0.074
主要化合价
+1
+2
+3
+6、-2
+2
-2
下列叙述正确是( )
A.
A、L、M三元素的金属性逐渐增强
B.
在RCl2分子中,各原子均满足8电子的稳定结构
C.
Q元素的最高价氧化物为电解质,其水溶液能够导电
D.
A在T单质中燃烧所形成的化合物中含有共价键和离子键
答案:D
19.
下列实验合理的是
A.
装置甲配制一定浓度的H2SO4溶液
B.
装置乙制取少量NH3
C.
装置丙制取并收集NO2
D.
装置丁收集SO2
答案:B
20.
下列有关NH3两个实验说法中正确的是
A.
两个实验均表现了NH3易溶于水
B.
两个实验均表现了NH3易挥发
C.
两个实验均表现了NH3是碱性气体
D.
两个实验均表现了NH3是还原性气体
答案:C
21.
锌与某浓度稀硝酸反应,当锌与硝酸恰好完全反应时,其物质的量之比为5∶12,则还原产物一定是
A.
NH4NO3
B.
NO
C.
N2O
D.
N2
答案:D
二、填空题
22.
夏天时有一种叫盐汽水的饮料其中主要含有NaCl、CO2、H2O,按要求回答:
(1)NaCl的电子式:___,所含化学键的类型为:___。
(2)CO2的结构式:___,所含化学键的类型为:___。
(3)H2O的电子式:___,化合物类型为___(离子化合物或共价化合物)。
(4)三种晶体中属于离子晶体的是___。
(5)CO2、H2O熔点较大的是___,理由___。
答案:(1)
①.
②.
离子键
(2)
①.
O=C=O
②.
(极性)共价键
(3)
①.
②.
共价化合物
(4)NaCl
(5)
①.
H2O
②.
H2O中存在分子间氢键
23.
亚硝酸钠可使肉制品色泽粉红,外观上好看诱人,大量食用会致癌。
(1)NaNO2俗称“工业盐”,其外观食与盐相似,误食会中毒,可通过化学实验加以鉴别,如向NaNO2的酸性溶液中加入KI固体,析出的碘单质可以使淀粉溶液变蓝色,据此检验NaNO2。
①完成下列反应的化学方程式并配平:____。
_____NaNO2+_____KI+_____H2SO4=____Na2SO4+____K2SO4+____I2+___NO↑+_____
②该反应中被氧化的元素是___。
③标准状况下,该反应中每转移1mole-,生成气体的体积是___。
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,氧化剂与还原剂的物质的量之比为___。
答案:(1)
①.
2NaNO2+2KI+2H2SO4═Na2SO4+K2SO4+I2+2NO↑+2H2O
②.
I
③.
22.4L
(2)1∶1
24.
现有A、B、C、D、E五种短周期元素,原子序数逐渐增大,它们的性质或原子结构如表:
元素
性质或原子结构
A
原子核内只有一个质子
B
原子最外层电子数是次外层电子数的3倍
C
短周期元素中原子半径最大的元素
D
地壳中含量最多的金属元素
E
最高正化合价与最低负化合价的代数和为6
(1)写出下列各元素的符号:A___,B___,D___。
(2)元素D在周期表中的位置___。
(3)画出E元素原子的结构示意图___。
(4)写出单质A在单质E中燃烧的化学方程式___。
(5)元素C与元素D的最高价氧化物对应水化物的碱性较强的是___(填化学式),它们之间发生反应的离子方程式是___。
答案:(1)
①.
H
②.
O
③.
Al
(2)第三周期ⅢA族
(3)
(4)
(5)
①.
NaOH
②.
三、填空题。
25.
某化学兴趣小组为制取SO2并探究其性质按下列装置进行实验。【制取SO2的反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
【实验探究】
(1)装置(I)中仪器a的名称是___。
(2)实验进行一段时间后:
①装置(Ⅱ)中观察到紫色石蕊溶液颜色变为___,原因是SO2与H2O反应生成___(写化学式)。
②装置(Ⅲ)中观察到氯水颜色褪去,是因为SO2与氯水发生反应。补充完整该反应的化学方程式;SO2+Cl2+2H2O=H2SO4+2___。其中SO2表现___(填“氧化性”或“还原性”)。
(3)装置(Ⅳ)应从图中选用合适的尾气吸收装置是___(填“A”或“B”),烧杯中应盛放的溶液是___。
(4)用3.2gCu与足量浓硫酸反应,理论上可生成标准状况下SO2的体积为___L。(Cu的摩尔质量为64g·mol-1)
【实验拓展】
(5)该兴趣小组为进一步探究SO2漂白性,依次进行如下实验。
实验步骤
实验现象
实验结论
①
品红溶液颜色___
SO2具有漂白性
②
溶液恢复到原来颜色
SO2的漂白具有___性
【知识应用】
(6)硫酸是重要的化工产品。目前工业上主要采用接触法制硫酸,写出其中SO2与O2在一定条件下反应生成SO3的化学方程式:___。
答案:
①.
圆底烧瓶
②.
红色
③.
H2SO3
④.
HCl
⑤.
还原性
⑥.
A
⑦.
氢氧化钠溶液
⑧.
1.12
⑨.
褪色
⑩.
不稳定(暂时)
?.
2SO2+O22SO3
26.
某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
【实验探究】
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
【知识应用】
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O24NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
答案:
①.
CaO
②.
分液漏斗
③.
碱石灰
④.
c
⑤.
白烟
⑥.
NH3+HCl=NH4Cl
⑦.
防止溶液倒吸
⑧.
红色
⑨.
氨水显碱性(或NH3·H2ONH4++OH-等)
⑩.
吸收
?.
升高
?.
还原性
一、选择题(21题,1-14题,每题2分,15-21题每题3分,共49分)。
1.
下列措施不符合节能减排的是
A.
大力发展火力发电,解决电力紧张问题
B.
在屋顶安装太阳能热水器为居民提供生活用热水
C.
用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.
用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
2.
下列说法正确的是
A.
浓硫酸沾在皮肤上,可以不做任何处理
B.
不慎洒出的酒精在桌上着火时,应立即用大量水扑灭
C.
大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.
金属钠着火时,可用水浇灭
3.
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2的说法正确的是( )
A.
SO2属于非法添加剂,不该添加到葡萄酒中
B.
SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.
SO2具有还原性,不能用浓硫酸干燥
D.
SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
4.
下列关于N、S的化合物的性质解释错误的是
A.
HNO3需避光保存,因为HNO3见光易分解
B.
SO2能使品红溶液褪色,是因为SO2有漂白性
C.
NH4HCO3化肥需密封储存,是因为NH4HCO3分解
D.
浓硫酸可用作气体干燥剂,是因为浓硫酸具有脱水性
5.
常温下,下列金属制成的容器能盛放浓硝酸的是
A.
铝
B.
镁
C.
铜
D.
银
6.
与Na+具有相同的质子数和电子数的微粒是
A.
F-
B.
Cl-
C.
OH-
D.
NH
7.
下列有关原子核外电子的说法错误的是
A.
每个电子层作为最外层时,最多可容纳8个电子
B.
电子在核外是分层排布的
C.
电子不停地做高速运动
D.
离原子核近的电子能量低,离原子核远的电子能量高
8.
下列化学用语的表述不正确的是
A.
CO2的结构式:O—C—O
B.
氯化铵的电子式:
C.
OH-:
D.
O2-离子的结构示意图为
9.
下列各组微粒中,互为同素异形体的是
A.
C和C
B.
红磷和白磷
C.
H2O和H2O2
D.
正丁烷和异丁烷
10.
下列化合物全部以共用电子对成键的是
A.
H2O
B.
MgCl2
C.
NaOH
D.
NH4Cl
11.
下列化合物中既含有离子键又含有共价键的化合物是
A.
CaBr2
B.
HCl
C.
NaOH
D.
H2O2
12.
根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.
电解水
B.
干冰受热直接变成气体
C.
HCl溶解于水
D.
打雷放电时,O2变成O3
13.
铋(Bi)在医药方面有重要应用,下列关于Bi和Bi的说法正确的是
A.
Bi和Bi都含有83个中子
B.
Bi和Bi互为同位素
C.
Bi和Bi的核外电子数不同
D.
Bi和Bi分别含有126和127个质子
14.
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.
CO2和H2O
B.
NaCl和HCl
C.
SiO2和CO2
D.
NaOH和CH4
15.
已知短周期元素的离子aA+、bB2+、cC2-、dD-具有相同的电子层结构;则下列叙述正确的是
A.
质子数:a>b>d>c
B.
金属性:A>B>D>C
C
离子半径:C2->D->B2+>A+
D.
原子半径:A>B>C>D
16.
已知溴的原子结构示意图如图,则下列对溴的结构及性质的说法不正确的是
A.
溴元素的原子序数是35
B.
溴元素在周期表的位置是第4周期,第ⅦA族
C.
溴的最高价为+7价
D.
溴的气态氢化物比HCl稳定
17.
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4,W与Y同主族。下列说法正确的是
A.
原子半径的大小顺序:W
>
Z
>
Y
>
X
B.
Y分别与Z、W形成的化合物中化学键类型相同
C.
单质Z能在X的最高价氧化物中燃烧
D.
Y、W的简单气态氢化物的热稳定性:Y
<
W
18.
几种短周期元素的原子半径及主要化合价见下表:
元素代号
A
L
M
Q
R
T
原子半径/nm
0.183
0.160
0.143
0.102
0.111
0.074
主要化合价
+1
+2
+3
+6、-2
+2
-2
下列叙述正确是( )
A.
A、L、M三元素的金属性逐渐增强
B.
在RCl2分子中,各原子均满足8电子的稳定结构
C.
Q元素的最高价氧化物为电解质,其水溶液能够导电
D.
A在T单质中燃烧所形成的化合物中含有共价键和离子键
19.
下列实验合理的是
A.
装置甲配制一定浓度的H2SO4溶液
B.
装置乙制取少量NH3
C.
装置丙制取并收集NO2
D.
装置丁收集SO2
20.
下列有关NH3两个实验说法中正确的是
A.
两个实验均表现了NH3易溶于水
B.
两个实验均表现了NH3易挥发
C.
两个实验均表现了NH3是碱性气体
D.
两个实验均表现了NH3是还原性气体
21.
锌与某浓度稀硝酸反应,当锌与硝酸恰好完全反应时,其物质的量之比为5∶12,则还原产物一定是
A.
NH4NO3
B.
NO
C.
N2O
D.
N2
二、填空题
22.
夏天时有一种叫盐汽水的饮料其中主要含有NaCl、CO2、H2O,按要求回答:
(1)NaCl的电子式:___,所含化学键的类型为:___。
(2)CO2的结构式:___,所含化学键的类型为:___。
(3)H2O的电子式:___,化合物类型为___(离子化合物或共价化合物)。
(4)三种晶体中属于离子晶体的是___。
(5)CO2、H2O熔点较大的是___,理由___。
23.
亚硝酸钠可使肉制品色泽粉红,外观上好看诱人,大量食用会致癌。
(1)NaNO2俗称“工业盐”,其外观食与盐相似,误食会中毒,可通过化学实验加以鉴别,如向NaNO2的酸性溶液中加入KI固体,析出的碘单质可以使淀粉溶液变蓝色,据此检验NaNO2。
①完成下列反应的化学方程式并配平:____。
_____NaNO2+_____KI+_____H2SO4=____Na2SO4+____K2SO4+____I2+___NO↑+_____
②该反应中被氧化的元素是___。
③标准状况下,该反应中每转移1mole-,生成气体的体积是___。
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,氧化剂与还原剂的物质的量之比为___。
24.
现有A、B、C、D、E五种短周期元素,原子序数逐渐增大,它们的性质或原子结构如表:
元素
性质或原子结构
A
原子核内只有一个质子
B
原子最外层电子数是次外层电子数的3倍
C
短周期元素中原子半径最大的元素
D
地壳中含量最多的金属元素
E
最高正化合价与最低负化合价的代数和为6
(1)写出下列各元素的符号:A___,B___,D___。
(2)元素D在周期表中的位置___。
(3)画出E元素原子的结构示意图___。
(4)写出单质A在单质E中燃烧的化学方程式___。
(5)元素C与元素D的最高价氧化物对应水化物的碱性较强的是___(填化学式),它们之间发生反应的离子方程式是___。
三、填空题。
25.
某化学兴趣小组为制取SO2并探究其性质按下列装置进行实验。【制取SO2的反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
【实验探究】
(1)装置(I)中仪器a的名称是___。
(2)实验进行一段时间后:
①装置(Ⅱ)中观察到紫色石蕊溶液颜色变为___,原因是SO2与H2O反应生成___(写化学式)。
②装置(Ⅲ)中观察到氯水颜色褪去,是因为SO2与氯水发生反应。补充完整该反应的化学方程式;SO2+Cl2+2H2O=H2SO4+2___。其中SO2表现___(填“氧化性”或“还原性”)。
(3)装置(Ⅳ)应从图中选用合适的尾气吸收装置是___(填“A”或“B”),烧杯中应盛放的溶液是___。
(4)用3.2gCu与足量浓硫酸反应,理论上可生成标准状况下SO2的体积为___L。(Cu的摩尔质量为64g·mol-1)
【实验拓展】
(5)该兴趣小组为进一步探究SO2漂白性,依次进行如下实验。
实验步骤
实验现象
实验结论
①
品红溶液颜色___
SO2具有漂白性
②
溶液恢复到原来颜色
SO2的漂白具有___性
【知识应用】
(6)硫酸是重要的化工产品。目前工业上主要采用接触法制硫酸,写出其中SO2与O2在一定条件下反应生成SO3的化学方程式:___。
26.
某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
【实验探究】
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
【知识应用】
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O24NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
泉州现代中学2020—2021学年下学期期中考高一年段化学试卷
答案版
一、选择题(21题,1-14题,每题2分,15-21题每题3分,共49分)。
1.
下列措施不符合节能减排的是
A.
大力发展火力发电,解决电力紧张问题
B.
在屋顶安装太阳能热水器为居民提供生活用热水
C.
用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.
用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
答案:A
2.
下列说法正确的是
A.
浓硫酸沾在皮肤上,可以不做任何处理
B.
不慎洒出的酒精在桌上着火时,应立即用大量水扑灭
C.
大量氯气泄漏时,用肥皂水浸湿毛巾捂住嘴和鼻子,并迅速离开现场
D.
金属钠着火时,可用水浇灭
答案:C
3.
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2的说法正确的是( )
A.
SO2属于非法添加剂,不该添加到葡萄酒中
B.
SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.
SO2具有还原性,不能用浓硫酸干燥
D.
SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
答案:B
4.
下列关于N、S的化合物的性质解释错误的是
A.
HNO3需避光保存,因为HNO3见光易分解
B.
SO2能使品红溶液褪色,是因为SO2有漂白性
C.
NH4HCO3化肥需密封储存,是因为NH4HCO3分解
D.
浓硫酸可用作气体干燥剂,是因为浓硫酸具有脱水性
答案:D
5.
常温下,下列金属制成的容器能盛放浓硝酸的是
A.
铝
B.
镁
C.
铜
D.
银
答案:A
6.
与Na+具有相同的质子数和电子数的微粒是
A.
F-
B.
Cl-
C.
OH-
D.
NH
答案:D
7.
下列有关原子核外电子的说法错误的是
A.
每个电子层作为最外层时,最多可容纳8个电子
B.
电子在核外是分层排布的
C.
电子不停地做高速运动
D.
离原子核近的电子能量低,离原子核远的电子能量高
答案:A
8.
下列化学用语的表述不正确的是
A.
CO2的结构式:O—C—O
B.
氯化铵的电子式:
C.
OH-:
D.
O2-离子的结构示意图为
答案:A
9.
下列各组微粒中,互为同素异形体的是
A.
C和C
B.
红磷和白磷
C.
H2O和H2O2
D.
正丁烷和异丁烷
答案:B
10.
下列化合物全部以共用电子对成键的是
A.
H2O
B.
MgCl2
C.
NaOH
D.
NH4Cl
答案:A
11.
下列化合物中既含有离子键又含有共价键的化合物是
A.
CaBr2
B.
HCl
C.
NaOH
D.
H2O2
答案:C
12.
根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是
A.
电解水
B.
干冰受热直接变成气体
C.
HCl溶解于水
D.
打雷放电时,O2变成O3
答案:B
13.
铋(Bi)在医药方面有重要应用,下列关于Bi和Bi的说法正确的是
A.
Bi和Bi都含有83个中子
B.
Bi和Bi互为同位素
C.
Bi和Bi的核外电子数不同
D.
Bi和Bi分别含有126和127个质子
答案:B
14.
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.
CO2和H2O
B.
NaCl和HCl
C.
SiO2和CO2
D.
NaOH和CH4
答案:A
15.
已知短周期元素的离子aA+、bB2+、cC2-、dD-具有相同的电子层结构;则下列叙述正确的是
A.
质子数:a>b>d>c
B.
金属性:A>B>D>C
C
离子半径:C2->D->B2+>A+
D.
原子半径:A>B>C>D
答案:D
16.
已知溴的原子结构示意图如图,则下列对溴的结构及性质的说法不正确的是
A.
溴元素的原子序数是35
B.
溴元素在周期表的位置是第4周期,第ⅦA族
C.
溴的最高价为+7价
D.
溴的气态氢化物比HCl稳定
答案:D
17.
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多4,W与Y同主族。下列说法正确的是
A.
原子半径的大小顺序:W
>
Z
>
Y
>
X
B.
Y分别与Z、W形成的化合物中化学键类型相同
C.
单质Z能在X的最高价氧化物中燃烧
D.
Y、W的简单气态氢化物的热稳定性:Y
<
W
答案:C
18.
几种短周期元素的原子半径及主要化合价见下表:
元素代号
A
L
M
Q
R
T
原子半径/nm
0.183
0.160
0.143
0.102
0.111
0.074
主要化合价
+1
+2
+3
+6、-2
+2
-2
下列叙述正确是( )
A.
A、L、M三元素的金属性逐渐增强
B.
在RCl2分子中,各原子均满足8电子的稳定结构
C.
Q元素的最高价氧化物为电解质,其水溶液能够导电
D.
A在T单质中燃烧所形成的化合物中含有共价键和离子键
答案:D
19.
下列实验合理的是
A.
装置甲配制一定浓度的H2SO4溶液
B.
装置乙制取少量NH3
C.
装置丙制取并收集NO2
D.
装置丁收集SO2
答案:B
20.
下列有关NH3两个实验说法中正确的是
A.
两个实验均表现了NH3易溶于水
B.
两个实验均表现了NH3易挥发
C.
两个实验均表现了NH3是碱性气体
D.
两个实验均表现了NH3是还原性气体
答案:C
21.
锌与某浓度稀硝酸反应,当锌与硝酸恰好完全反应时,其物质的量之比为5∶12,则还原产物一定是
A.
NH4NO3
B.
NO
C.
N2O
D.
N2
答案:D
二、填空题
22.
夏天时有一种叫盐汽水的饮料其中主要含有NaCl、CO2、H2O,按要求回答:
(1)NaCl的电子式:___,所含化学键的类型为:___。
(2)CO2的结构式:___,所含化学键的类型为:___。
(3)H2O的电子式:___,化合物类型为___(离子化合物或共价化合物)。
(4)三种晶体中属于离子晶体的是___。
(5)CO2、H2O熔点较大的是___,理由___。
答案:(1)
①.
②.
离子键
(2)
①.
O=C=O
②.
(极性)共价键
(3)
①.
②.
共价化合物
(4)NaCl
(5)
①.
H2O
②.
H2O中存在分子间氢键
23.
亚硝酸钠可使肉制品色泽粉红,外观上好看诱人,大量食用会致癌。
(1)NaNO2俗称“工业盐”,其外观食与盐相似,误食会中毒,可通过化学实验加以鉴别,如向NaNO2的酸性溶液中加入KI固体,析出的碘单质可以使淀粉溶液变蓝色,据此检验NaNO2。
①完成下列反应的化学方程式并配平:____。
_____NaNO2+_____KI+_____H2SO4=____Na2SO4+____K2SO4+____I2+___NO↑+_____
②该反应中被氧化的元素是___。
③标准状况下,该反应中每转移1mole-,生成气体的体积是___。
(2)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2↑,氧化剂与还原剂的物质的量之比为___。
答案:(1)
①.
2NaNO2+2KI+2H2SO4═Na2SO4+K2SO4+I2+2NO↑+2H2O
②.
I
③.
22.4L
(2)1∶1
24.
现有A、B、C、D、E五种短周期元素,原子序数逐渐增大,它们的性质或原子结构如表:
元素
性质或原子结构
A
原子核内只有一个质子
B
原子最外层电子数是次外层电子数的3倍
C
短周期元素中原子半径最大的元素
D
地壳中含量最多的金属元素
E
最高正化合价与最低负化合价的代数和为6
(1)写出下列各元素的符号:A___,B___,D___。
(2)元素D在周期表中的位置___。
(3)画出E元素原子的结构示意图___。
(4)写出单质A在单质E中燃烧的化学方程式___。
(5)元素C与元素D的最高价氧化物对应水化物的碱性较强的是___(填化学式),它们之间发生反应的离子方程式是___。
答案:(1)
①.
H
②.
O
③.
Al
(2)第三周期ⅢA族
(3)
(4)
(5)
①.
NaOH
②.
三、填空题。
25.
某化学兴趣小组为制取SO2并探究其性质按下列装置进行实验。【制取SO2的反应原理:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,部分夹持仪器已略去】
【实验探究】
(1)装置(I)中仪器a的名称是___。
(2)实验进行一段时间后:
①装置(Ⅱ)中观察到紫色石蕊溶液颜色变为___,原因是SO2与H2O反应生成___(写化学式)。
②装置(Ⅲ)中观察到氯水颜色褪去,是因为SO2与氯水发生反应。补充完整该反应的化学方程式;SO2+Cl2+2H2O=H2SO4+2___。其中SO2表现___(填“氧化性”或“还原性”)。
(3)装置(Ⅳ)应从图中选用合适的尾气吸收装置是___(填“A”或“B”),烧杯中应盛放的溶液是___。
(4)用3.2gCu与足量浓硫酸反应,理论上可生成标准状况下SO2的体积为___L。(Cu的摩尔质量为64g·mol-1)
【实验拓展】
(5)该兴趣小组为进一步探究SO2漂白性,依次进行如下实验。
实验步骤
实验现象
实验结论
①
品红溶液颜色___
SO2具有漂白性
②
溶液恢复到原来颜色
SO2的漂白具有___性
【知识应用】
(6)硫酸是重要的化工产品。目前工业上主要采用接触法制硫酸,写出其中SO2与O2在一定条件下反应生成SO3的化学方程式:___。
答案:
①.
圆底烧瓶
②.
红色
③.
H2SO3
④.
HCl
⑤.
还原性
⑥.
A
⑦.
氢氧化钠溶液
⑧.
1.12
⑨.
褪色
⑩.
不稳定(暂时)
?.
2SO2+O22SO3
26.
某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
【实验探究】
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
【知识应用】
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O24NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
答案:
①.
CaO
②.
分液漏斗
③.
碱石灰
④.
c
⑤.
白烟
⑥.
NH3+HCl=NH4Cl
⑦.
防止溶液倒吸
⑧.
红色
⑨.
氨水显碱性(或NH3·H2ONH4++OH-等)
⑩.
吸收
?.
升高
?.
还原性
同课章节目录
