第三单元物质构成的奥秘复习与检测练习A-2021-2022学年九年级化学人教版上册(word版 含详细解答)
文档属性
| 名称 | 第三单元物质构成的奥秘复习与检测练习A-2021-2022学年九年级化学人教版上册(word版 含详细解答) |  | |
| 格式 | docx | ||
| 文件大小 | 140.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-29 06:31:05 | ||
图片预览



文档简介
第三单元物质构成的奥秘复习与检测练习A九年级化学上学期(人教版)
练习
一、单选题,共12小题
1.海南岛存在大面积富硒土壤。富硒土壤中的“硒”指的是( )
A.元素
B.分子
C.原子
D.单质
2.原子不显电性的原因是( )
A.原子中不含带电荷的粒子
B.原子太小了
C.原子核和核外电子带等量的异种电荷
D.原因至今不明
3.地壳中的元素分布如图,其中区域②代表的元素是
A.氧
B.硅
C.铝
D.铁
4.一定条件下,6000L氧气可压入40L的钢瓶中。对此现象的微观解释正确的是
A.氧分子间的间隔变小
B.氧分子的质量变小
C.氧分子的体积变小
D.氧分子的数目减少
5.2020年6月23日长征三号乙运载火箭成功发射北斗三号卫星,在火箭的制造中使用了钛和钛合金。钛元素在元素周期表中的相关信息如下图所示。下列说法错误的是
A.钛原子的中子数为22
B.钛元素属于金属元素
C.钛的元素符号是Ti
D.钛元素的相对原子质量是47.87
6.如图为氧原子的结构示意图,从图中可获得的信息是
A.氧原子核内质子数为8、中子数为0,核外电子数为8
B.氧原子核外第一层上有6个电子
C.氧原子的原子核在整个原子中所占体积极小
D.氧原子在化学反应中容易得到2个电子
7.下列有关粒子的说法中正确的是
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
8.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时问,铷元素在元素周期表中的相关信息与铷原子的原子结构示意图如图所示。下列说法不正确的是
A.铷单质具有导电性
B.m的值是37,n的值是1
C.铷的相对原子质量为85.47
D.氯化铷的化学式为RbCl2
9.“农夫山泉”矿泉水里含有的下列成分中,指“元素”的是
A.偏硅酸
B.天然矿物盐
C.溶解性总固体
D.钾、钠、钙、镁
10.氮化镓是新一代半导体材料。氮、镓的原子结构示意图和它们在元素周期表中的信息如下图所示,下列说法正确的是
A.氮化镓的化学式为GaN
B.镓元素的相对原子质量是31
C.氮元素和镓元素位于同一周期
D.1个N2分子中含有7个电子
11.下列物质由分子构成的是(
)
A.铜
B.氧气
C.氯化钠
D.氢氧化钙
12.如下图是五种微粒的结构示意图,下列说法正确的是
A.①④属于金属元素
B.②的微粒符号是Al3+
C.②③⑤属于阳离子
D.②④位于元素周期表的同一周期
二、非选择题,共6小题
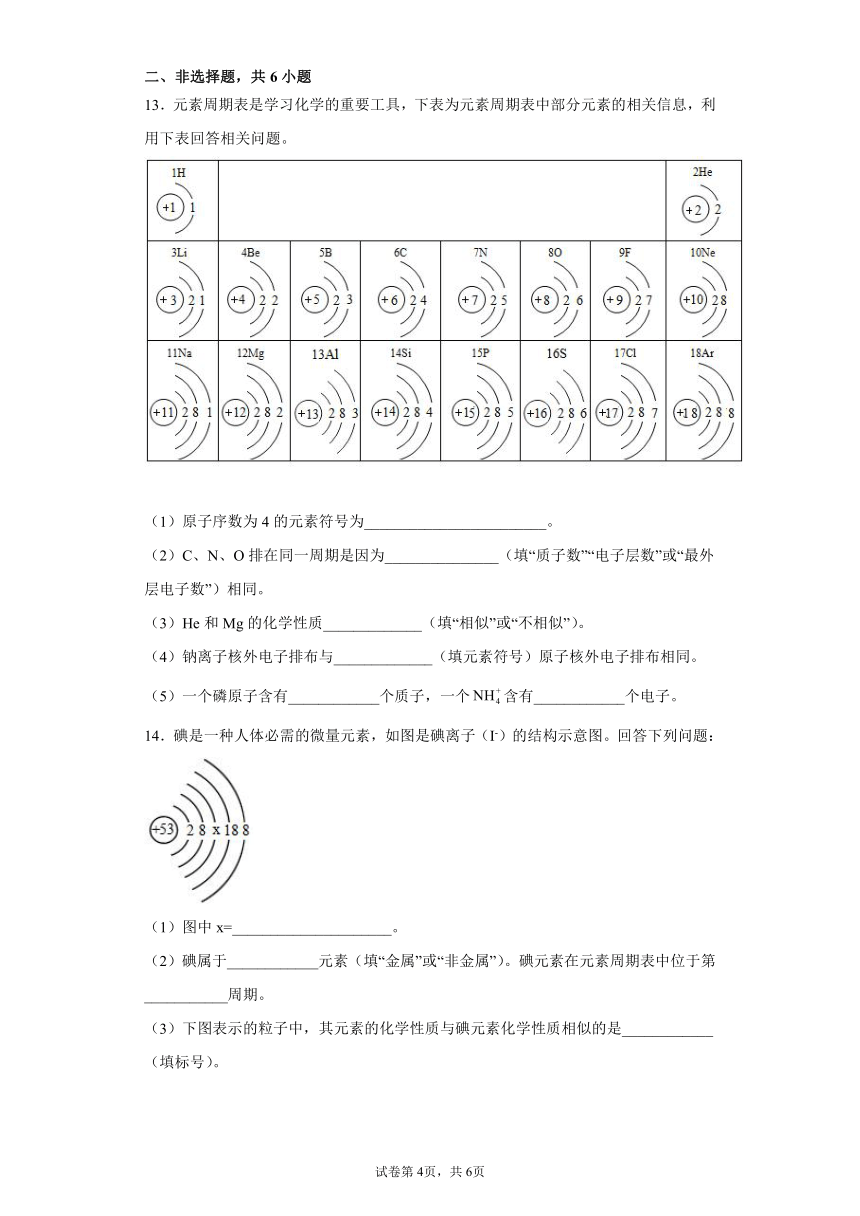
13.元素周期表是学习化学的重要工具,下表为元素周期表中部分元素的相关信息,利用下表回答相关问题。
(1)原子序数为4的元素符号为________________________。
(2)C、N、O排在同一周期是因为_______________(填“质子数”“电子层数”或“最外层电子数”)相同。
(3)He和Mg的化学性质_____________(填“相似”或“不相似”)。
(4)钠离子核外电子排布与_____________(填元素符号)原子核外电子排布相同。
(5)一个磷原子含有____________个质子,一个含有____________个电子。
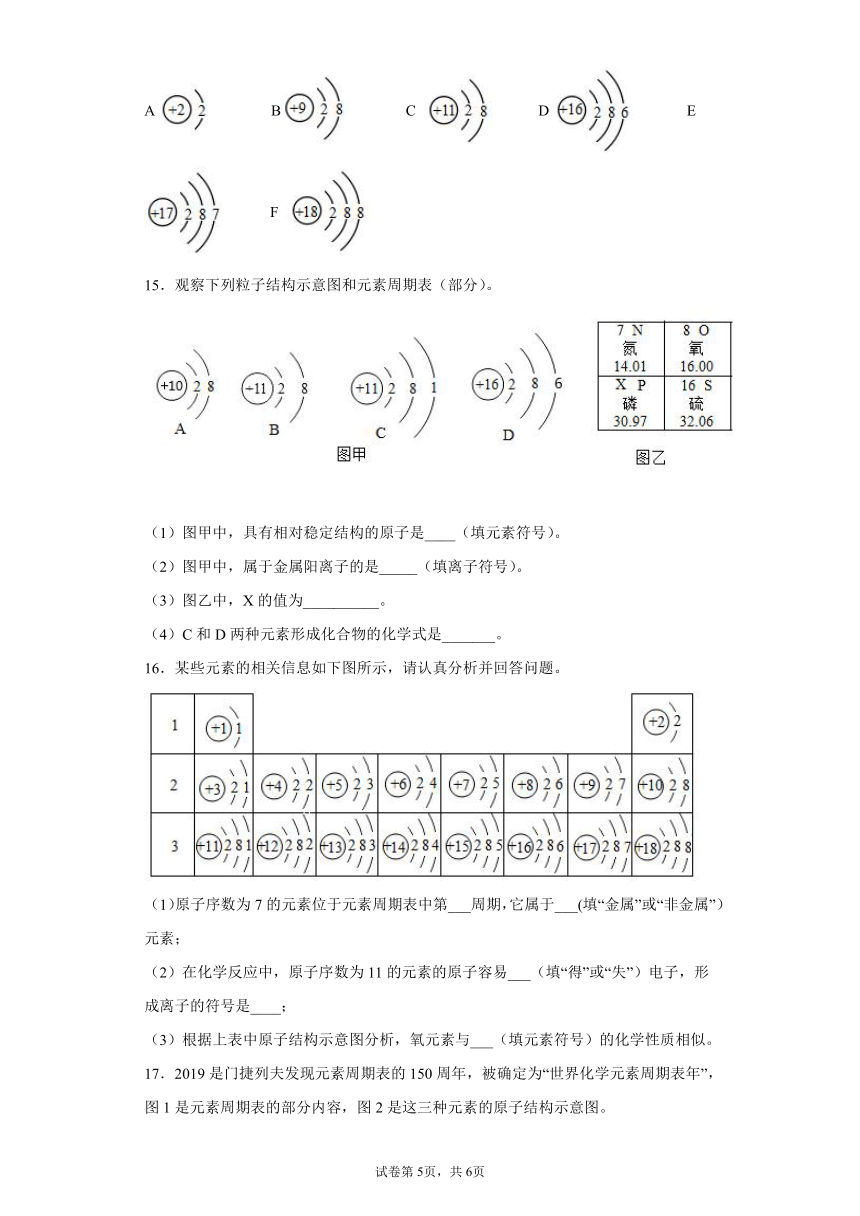
14.碘是一种人体必需的微量元素,如图是碘离子(I-)的结构示意图。回答下列问题:
(1)图中x=_____________________。
(2)碘属于____________元素(填“金属”或“非金属”)。碘元素在元素周期表中位于第___________周期。
(3)下图表示的粒子中,其元素的化学性质与碘元素化学性质相似的是____________(填标号)。
A
B
C
D
E
F
15.观察下列粒子结构示意图和元素周期表(部分)。
(1)图甲中,具有相对稳定结构的原子是____(填元素符号)。
(2)图甲中,属于金属阳离子的是_____(填离子符号)。
(3)图乙中,X的值为__________。
(4)C和D两种元素形成化合物的化学式是_______。
16.某些元素的相关信息如下图所示,请认真分析并回答问题。
(1)原子序数为7的元素位于元素周期表中第___周期,它属于___(填“金属”或“非金属”)元素;
(2)在化学反应中,原子序数为11的元素的原子容易___(填“得”或“失”)电子,形成离子的符号是____;
(3)根据上表中原子结构示意图分析,氧元素与___(填元素符号)的化学性质相似。
17.2019是门捷列夫发现元素周期表的150周年,被确定为“世界化学元素周期表年”,图1是元素周期表的部分内容,图2是这三种元素的原子结构示意图。
(1)SeO2的相对分子质量为__________________。
(2)图2中硫原子的结构示意图是_____________。
(3)氧、硫、硒三种元素化学性质相似的原因是_____________________________。
(4)画出O2-离子的结构示意图是_____________。
18.定义:具有相同_____(即核内_____)的一类原子的总称
[温馨提示]①一种元素与另一种元素的本质区别:_____
②同种元素组成的纯净物一定是单质,但同种元素组成的物质_____是单质(如O2与O3的混合物),不可能是_____
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.A
【详解】
富硒土壤中的“硒”不是以单质、分子、原子等形式存在,这里所指的“硒”是强调存在的元素,与具体形态无关。故选A。
2.C
【详解】
A、原子核内的质子带正电荷,原子核外的电子带负电荷,不符合题意;
B、原子的体积大小与是否不显电性无关,电子比原子小得多,但带负电荷,不符合题意;
C、原子核带正电荷,原子核外的电子带负电荷,且电量相等,电性相反,所以整个原子不显电性,符合题意;
D、因为原子内所带的正负电荷数相等造成不显电性,不符合题意。
故选C。
3.B
【详解】
区域②地壳中元素含量占比27.7%,即含量排第二位,表示硅元素。
故选:B。
4.A
【详解】
由于分子间有间隔,在受压时间隔变小,所以,容积40L的钢瓶中可压入6000L氧气。故选A。
5.A
【详解】
A、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=22,不是中子数,选项A错误;
B、由“钛”的偏旁“钅”可知,钛元素属于金属元素,选项B正确;
C、在元素周期表信息示意图中,元素名称右上角的符号表示元素符号,故钛的元素符号是Ti,选项C正确;
D、在元素周期表信息示意图中,元素名称下方的数字表示相对原子质量,故钛元素的相对原子质量是47.87,选项D正确。故选A。
6.D
【详解】
A、氧原子核内质子数为8、中子数为,质子数=核外电子数,核外电子数为8,故A不正确;
B、氧原子核外第一层上有2个电子,故B不正确;
C、原子是由原子核和核外电子构成的,原子核在原子中所占体积极小,则氧原子的原子核在整个原子中所占体积极小,但是原子结构示意图不能得到该信息,故C错误;
D、氧原子的最外层电子数为6,大于4,在化学反应中容易得到2个电子,故D正确。故选D。
故选D。
7.C
【详解】
A、在化学反应中,分子可分,原子不可分。但是实际上原子可分为原子核和核外电子,不符合题意;
B、原子得到电子后带负电荷,不符合题意;
C、分子、原子、离子都可以直接构成物质,如二氧化碳由二氧化碳分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,符合题意;
D、氢原子的原子核只有一个质子,没有中子,不符合题意。
故选C。
8.D
【详解】
A.铷属于金属单质,金属单质普遍具有导电性,选项正确;
B.铷的质子数为37,m表示质子数(核电荷数),则m的值是37,n=37-2-8-18-8=1,选项正确;
C.元素周期表汉字下面的数字表示相对原子质量,铷的相对原子质量为85.47,选项正确;
D.铷的最外层电子数为1,在化学反应中容易失去一个电子显+1价,氯元素在化合物中一般显-1价,则氯化铷的化学式为:RbCl,选项不正确。
故选:D。
【点睛】
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
9.D
【详解】
元素是具有相同的质子数(即核电荷数)的同一类原子的总称。“偏硅酸、天然矿物盐、溶解性总固体”,这些成分都是是指物质。“钾、钠、钙、镁”指的是元素。故选D。
【点睛】
10.A
【详解】
A、由氮、镓的原子结构示意图可知,氮原子的最外层电子数为5,在化学反应中,可得到3个电子,从而带上3个单位的负电荷;镓原子的最外层电子数为3,在化学反应中,容易失去3个电子,从而带上3个单位的正电荷,故氮化镓的化学式为GaN,选项A正确;
B、在元素周期表中,元素名称下方的数字表示相对原子质量,故镓元素的相对原子质量是69.72,选项B不正确;
C、由氮、镓的原子结构示意图可知,氮原子核外有2个电子层,位于第二周期,镓原子的核外有4个电子层,位于第四周期,选项C不正确;
D、由氮原子的结构示意图可知,氮原子的核外有7个电子,故1个N2分子中含有14个电子,选项D不正确。故选A。
11.B
【详解】
A、铜由铜原子构成,故不符合题意;
B、氧气由氧分子构成,故符合题意;
C、氯化钠由钠离子和氯离子构成,故不符合题意;
D、氢氧化钙由钙离子和氢氧根离子构成,故不符合题意。
故选B。
12.B
【详解】
图①~⑤分别表示氟原子(F)、铝离子(Al3+)、镁离子(Mg2+)、铝原子(Al)、氖原子(Ne);
A、①表示氟原子,属于非金属元素,A选项错误;
B、②表示铝离子,符号为Al3+,B选项正确;
C、⑤表示铝原子,不是离子,C选项错误;
D、②和④表示的是同一种元素,因此其位置相同,D选项错误;
故选B。
13.Be
电子层数
不相似
Ne
15
10
【详解】
(1)由图中信息可知,原子序数为4的元素符号为Be;
(2)根据元素周期律:电子层数等于周期数,C、N、O排在同一周期是因为电子层数相同;
(3)氦原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;镁的最外层电子数为2,在化学反应中易失去2个电子而形成阳离子;尽管最外层电子数相同,但它们化学性质不相似;
(4)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,钠元素是11号元素,钠原子的核外电子数是11,钠原子失去一个电子后,形成的离子的符号为:Na+;它的核外电子数为10,核外电子排布与氖元素的原子核外电子排布相同;
(5)根据磷元素在元素周期表中的相关信息,磷元素的原子序数为15,则一个磷原子中有15个质子;每个氮原子中含有7个电子,每个氢原子中含有1个电子,所以NH4中共有11个电子,而铵根离子(NH4+)是由NH4失去一个电子形成的,所以一个铵根离子(NH4+)含有电子的数目为:11-1=10。
14.18
非金属
5
E
【详解】
(1)碘离子(I-)最外层8个电子,故碘原子最外层7个电子,原子中核电荷数=核外电子数,故53=2+8+x+18+7,故x=18,故填:18。
(2)碘带“石”字旁,属于非金属元素,核外有五个电子层,电子层数等于周期数,故位于第五周期,故填:非金属;5。
(3)最外层电子数相同,化学性质相似,E最外层7个电子和碘原子最外层电子数相同,化学性质相似,故选:E。
15.Ne
Na+
15
Na2S
【详解】
(1)相对稳定结构的原子,其最外层电子为8电子稳定结构,观察图甲是图A,通过观察原子核内质子数为10,可知该原子是Ne,因此此处填:Ne。
(2)金属阳离子最外层应该为8电子稳定结构,且原子核内质子数比核外电子数要多,因此观察图甲中,属于金属阳离子的是B,B的原子核内质子数为11,可知该原子为Na,对应的阳离子为Na+。
(3)图乙中,X为硫的原子序数,而硫原子序数为15,故X=15。
(4)C的核内电子数为11对应的元素为Na,D的核内电子数为16对应的元素为S,因此C和D两种元素形成化合物的化学式是Na2S。
16.二
非金属
失
S
【详解】
(1)如图所示原子序数为7的元素位于元素周期表中第二横行,即位于第二周期,该元素是“氮元素”,由元素名称可知为“气”字头,它属于非金属元素;
(2)原子序数为11的元素为Na,如图所示其原子结构示意图中最外层电子数为1,通常情况下,最外层电子数小于4的原子在化学变化中容易失去电子,因此在化学反应中,钠原子容易失电子,形成带1个单位正电荷的钠离子,表示离子所带的电荷数时写在元素或原子团的右上角,数字在前,正负号在后,“1”通常省略不写,则钠离子的符号是;
(3)根据原子结构示意图可知元素原子的最外层电子数相同,元素的化学性质相似,由上表中原子结构示意图可知,氧原子的最外层电子数为6,硫原子的最外层电子数为6,氧元素与S的化学性质相似。
17.111
B
最外层电子数相同
【详解】
(1)SeO2的相对分子质量=79+162=111;
(2)硫原子的质子数为16,所以硫原子的结构示意图是B;
(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,氧、硫、硒三种元素化学性质相似的原因是它们的原子的最外层电子数相同;
(4)氧离子的核内质子数为8,带有2个单位的负电荷,核外有2个电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图为:。
18.核电荷数
质子数
质子数不相同
不一定
化合物
【详解】
元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
[温馨提示]①根据元素的概念可知,一种元素与另一种元素的本质区别是质子数不相同。
②同种元素组成的纯净物一定是单质,但同种元素组成的物质不一定是单质(如O2与O3的混合物),不可能是化合物,因为化合物是不同种元素组成的纯净物,所以化合物中至少含有两种元素。答案第1页,共2页
答案第1页,共2页
练习
一、单选题,共12小题
1.海南岛存在大面积富硒土壤。富硒土壤中的“硒”指的是( )
A.元素
B.分子
C.原子
D.单质
2.原子不显电性的原因是( )
A.原子中不含带电荷的粒子
B.原子太小了
C.原子核和核外电子带等量的异种电荷
D.原因至今不明
3.地壳中的元素分布如图,其中区域②代表的元素是
A.氧
B.硅
C.铝
D.铁
4.一定条件下,6000L氧气可压入40L的钢瓶中。对此现象的微观解释正确的是
A.氧分子间的间隔变小
B.氧分子的质量变小
C.氧分子的体积变小
D.氧分子的数目减少
5.2020年6月23日长征三号乙运载火箭成功发射北斗三号卫星,在火箭的制造中使用了钛和钛合金。钛元素在元素周期表中的相关信息如下图所示。下列说法错误的是
A.钛原子的中子数为22
B.钛元素属于金属元素
C.钛的元素符号是Ti
D.钛元素的相对原子质量是47.87
6.如图为氧原子的结构示意图,从图中可获得的信息是
A.氧原子核内质子数为8、中子数为0,核外电子数为8
B.氧原子核外第一层上有6个电子
C.氧原子的原子核在整个原子中所占体积极小
D.氧原子在化学反应中容易得到2个电子
7.下列有关粒子的说法中正确的是
A.分子可分,原子不可分
B.原子得到电子后带正电荷
C.分子、原子和离子都可以直接构成物质
D.原子的原子核都是由质子和中子构成的
8.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时问,铷元素在元素周期表中的相关信息与铷原子的原子结构示意图如图所示。下列说法不正确的是
A.铷单质具有导电性
B.m的值是37,n的值是1
C.铷的相对原子质量为85.47
D.氯化铷的化学式为RbCl2
9.“农夫山泉”矿泉水里含有的下列成分中,指“元素”的是
A.偏硅酸
B.天然矿物盐
C.溶解性总固体
D.钾、钠、钙、镁
10.氮化镓是新一代半导体材料。氮、镓的原子结构示意图和它们在元素周期表中的信息如下图所示,下列说法正确的是
A.氮化镓的化学式为GaN
B.镓元素的相对原子质量是31
C.氮元素和镓元素位于同一周期
D.1个N2分子中含有7个电子
11.下列物质由分子构成的是(
)
A.铜
B.氧气
C.氯化钠
D.氢氧化钙
12.如下图是五种微粒的结构示意图,下列说法正确的是
A.①④属于金属元素
B.②的微粒符号是Al3+
C.②③⑤属于阳离子
D.②④位于元素周期表的同一周期
二、非选择题,共6小题
13.元素周期表是学习化学的重要工具,下表为元素周期表中部分元素的相关信息,利用下表回答相关问题。
(1)原子序数为4的元素符号为________________________。
(2)C、N、O排在同一周期是因为_______________(填“质子数”“电子层数”或“最外层电子数”)相同。
(3)He和Mg的化学性质_____________(填“相似”或“不相似”)。
(4)钠离子核外电子排布与_____________(填元素符号)原子核外电子排布相同。
(5)一个磷原子含有____________个质子,一个含有____________个电子。
14.碘是一种人体必需的微量元素,如图是碘离子(I-)的结构示意图。回答下列问题:
(1)图中x=_____________________。
(2)碘属于____________元素(填“金属”或“非金属”)。碘元素在元素周期表中位于第___________周期。
(3)下图表示的粒子中,其元素的化学性质与碘元素化学性质相似的是____________(填标号)。
A
B
C
D
E
F
15.观察下列粒子结构示意图和元素周期表(部分)。
(1)图甲中,具有相对稳定结构的原子是____(填元素符号)。
(2)图甲中,属于金属阳离子的是_____(填离子符号)。
(3)图乙中,X的值为__________。
(4)C和D两种元素形成化合物的化学式是_______。
16.某些元素的相关信息如下图所示,请认真分析并回答问题。
(1)原子序数为7的元素位于元素周期表中第___周期,它属于___(填“金属”或“非金属”)元素;
(2)在化学反应中,原子序数为11的元素的原子容易___(填“得”或“失”)电子,形成离子的符号是____;
(3)根据上表中原子结构示意图分析,氧元素与___(填元素符号)的化学性质相似。
17.2019是门捷列夫发现元素周期表的150周年,被确定为“世界化学元素周期表年”,图1是元素周期表的部分内容,图2是这三种元素的原子结构示意图。
(1)SeO2的相对分子质量为__________________。
(2)图2中硫原子的结构示意图是_____________。
(3)氧、硫、硒三种元素化学性质相似的原因是_____________________________。
(4)画出O2-离子的结构示意图是_____________。
18.定义:具有相同_____(即核内_____)的一类原子的总称
[温馨提示]①一种元素与另一种元素的本质区别:_____
②同种元素组成的纯净物一定是单质,但同种元素组成的物质_____是单质(如O2与O3的混合物),不可能是_____
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.A
【详解】
富硒土壤中的“硒”不是以单质、分子、原子等形式存在,这里所指的“硒”是强调存在的元素,与具体形态无关。故选A。
2.C
【详解】
A、原子核内的质子带正电荷,原子核外的电子带负电荷,不符合题意;
B、原子的体积大小与是否不显电性无关,电子比原子小得多,但带负电荷,不符合题意;
C、原子核带正电荷,原子核外的电子带负电荷,且电量相等,电性相反,所以整个原子不显电性,符合题意;
D、因为原子内所带的正负电荷数相等造成不显电性,不符合题意。
故选C。
3.B
【详解】
区域②地壳中元素含量占比27.7%,即含量排第二位,表示硅元素。
故选:B。
4.A
【详解】
由于分子间有间隔,在受压时间隔变小,所以,容积40L的钢瓶中可压入6000L氧气。故选A。
5.A
【详解】
A、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=22,不是中子数,选项A错误;
B、由“钛”的偏旁“钅”可知,钛元素属于金属元素,选项B正确;
C、在元素周期表信息示意图中,元素名称右上角的符号表示元素符号,故钛的元素符号是Ti,选项C正确;
D、在元素周期表信息示意图中,元素名称下方的数字表示相对原子质量,故钛元素的相对原子质量是47.87,选项D正确。故选A。
6.D
【详解】
A、氧原子核内质子数为8、中子数为,质子数=核外电子数,核外电子数为8,故A不正确;
B、氧原子核外第一层上有2个电子,故B不正确;
C、原子是由原子核和核外电子构成的,原子核在原子中所占体积极小,则氧原子的原子核在整个原子中所占体积极小,但是原子结构示意图不能得到该信息,故C错误;
D、氧原子的最外层电子数为6,大于4,在化学反应中容易得到2个电子,故D正确。故选D。
故选D。
7.C
【详解】
A、在化学反应中,分子可分,原子不可分。但是实际上原子可分为原子核和核外电子,不符合题意;
B、原子得到电子后带负电荷,不符合题意;
C、分子、原子、离子都可以直接构成物质,如二氧化碳由二氧化碳分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成,符合题意;
D、氢原子的原子核只有一个质子,没有中子,不符合题意。
故选C。
8.D
【详解】
A.铷属于金属单质,金属单质普遍具有导电性,选项正确;
B.铷的质子数为37,m表示质子数(核电荷数),则m的值是37,n=37-2-8-18-8=1,选项正确;
C.元素周期表汉字下面的数字表示相对原子质量,铷的相对原子质量为85.47,选项正确;
D.铷的最外层电子数为1,在化学反应中容易失去一个电子显+1价,氯元素在化合物中一般显-1价,则氯化铷的化学式为:RbCl,选项不正确。
故选:D。
【点睛】
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
9.D
【详解】
元素是具有相同的质子数(即核电荷数)的同一类原子的总称。“偏硅酸、天然矿物盐、溶解性总固体”,这些成分都是是指物质。“钾、钠、钙、镁”指的是元素。故选D。
【点睛】
10.A
【详解】
A、由氮、镓的原子结构示意图可知,氮原子的最外层电子数为5,在化学反应中,可得到3个电子,从而带上3个单位的负电荷;镓原子的最外层电子数为3,在化学反应中,容易失去3个电子,从而带上3个单位的正电荷,故氮化镓的化学式为GaN,选项A正确;
B、在元素周期表中,元素名称下方的数字表示相对原子质量,故镓元素的相对原子质量是69.72,选项B不正确;
C、由氮、镓的原子结构示意图可知,氮原子核外有2个电子层,位于第二周期,镓原子的核外有4个电子层,位于第四周期,选项C不正确;
D、由氮原子的结构示意图可知,氮原子的核外有7个电子,故1个N2分子中含有14个电子,选项D不正确。故选A。
11.B
【详解】
A、铜由铜原子构成,故不符合题意;
B、氧气由氧分子构成,故符合题意;
C、氯化钠由钠离子和氯离子构成,故不符合题意;
D、氢氧化钙由钙离子和氢氧根离子构成,故不符合题意。
故选B。
12.B
【详解】
图①~⑤分别表示氟原子(F)、铝离子(Al3+)、镁离子(Mg2+)、铝原子(Al)、氖原子(Ne);
A、①表示氟原子,属于非金属元素,A选项错误;
B、②表示铝离子,符号为Al3+,B选项正确;
C、⑤表示铝原子,不是离子,C选项错误;
D、②和④表示的是同一种元素,因此其位置相同,D选项错误;
故选B。
13.Be
电子层数
不相似
Ne
15
10
【详解】
(1)由图中信息可知,原子序数为4的元素符号为Be;
(2)根据元素周期律:电子层数等于周期数,C、N、O排在同一周期是因为电子层数相同;
(3)氦原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;镁的最外层电子数为2,在化学反应中易失去2个电子而形成阳离子;尽管最外层电子数相同,但它们化学性质不相似;
(4)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,钠元素是11号元素,钠原子的核外电子数是11,钠原子失去一个电子后,形成的离子的符号为:Na+;它的核外电子数为10,核外电子排布与氖元素的原子核外电子排布相同;
(5)根据磷元素在元素周期表中的相关信息,磷元素的原子序数为15,则一个磷原子中有15个质子;每个氮原子中含有7个电子,每个氢原子中含有1个电子,所以NH4中共有11个电子,而铵根离子(NH4+)是由NH4失去一个电子形成的,所以一个铵根离子(NH4+)含有电子的数目为:11-1=10。
14.18
非金属
5
E
【详解】
(1)碘离子(I-)最外层8个电子,故碘原子最外层7个电子,原子中核电荷数=核外电子数,故53=2+8+x+18+7,故x=18,故填:18。
(2)碘带“石”字旁,属于非金属元素,核外有五个电子层,电子层数等于周期数,故位于第五周期,故填:非金属;5。
(3)最外层电子数相同,化学性质相似,E最外层7个电子和碘原子最外层电子数相同,化学性质相似,故选:E。
15.Ne
Na+
15
Na2S
【详解】
(1)相对稳定结构的原子,其最外层电子为8电子稳定结构,观察图甲是图A,通过观察原子核内质子数为10,可知该原子是Ne,因此此处填:Ne。
(2)金属阳离子最外层应该为8电子稳定结构,且原子核内质子数比核外电子数要多,因此观察图甲中,属于金属阳离子的是B,B的原子核内质子数为11,可知该原子为Na,对应的阳离子为Na+。
(3)图乙中,X为硫的原子序数,而硫原子序数为15,故X=15。
(4)C的核内电子数为11对应的元素为Na,D的核内电子数为16对应的元素为S,因此C和D两种元素形成化合物的化学式是Na2S。
16.二
非金属
失
S
【详解】
(1)如图所示原子序数为7的元素位于元素周期表中第二横行,即位于第二周期,该元素是“氮元素”,由元素名称可知为“气”字头,它属于非金属元素;
(2)原子序数为11的元素为Na,如图所示其原子结构示意图中最外层电子数为1,通常情况下,最外层电子数小于4的原子在化学变化中容易失去电子,因此在化学反应中,钠原子容易失电子,形成带1个单位正电荷的钠离子,表示离子所带的电荷数时写在元素或原子团的右上角,数字在前,正负号在后,“1”通常省略不写,则钠离子的符号是;
(3)根据原子结构示意图可知元素原子的最外层电子数相同,元素的化学性质相似,由上表中原子结构示意图可知,氧原子的最外层电子数为6,硫原子的最外层电子数为6,氧元素与S的化学性质相似。
17.111
B
最外层电子数相同
【详解】
(1)SeO2的相对分子质量=79+162=111;
(2)硫原子的质子数为16,所以硫原子的结构示意图是B;
(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,氧、硫、硒三种元素化学性质相似的原因是它们的原子的最外层电子数相同;
(4)氧离子的核内质子数为8,带有2个单位的负电荷,核外有2个电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图为:。
18.核电荷数
质子数
质子数不相同
不一定
化合物
【详解】
元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
[温馨提示]①根据元素的概念可知,一种元素与另一种元素的本质区别是质子数不相同。
②同种元素组成的纯净物一定是单质,但同种元素组成的物质不一定是单质(如O2与O3的混合物),不可能是化合物,因为化合物是不同种元素组成的纯净物,所以化合物中至少含有两种元素。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
