5.1.2质量守恒定律(课件21页)
图片预览








文档简介
(共21张PPT)
课题1 质量守恒定律(2)
第五单元 化学方程式
1.认识化学方程式,掌握化学方程式所包含的信息。
2.学会应用质量守恒定律
学习目标
反应
符号表达式
实验现象
1.镁在空气中燃烧
发出
,
生成___________
写出下列反应的化学符号表达式和实验现象。
白色固体
耀眼白光
化学用语天天练
新知导入
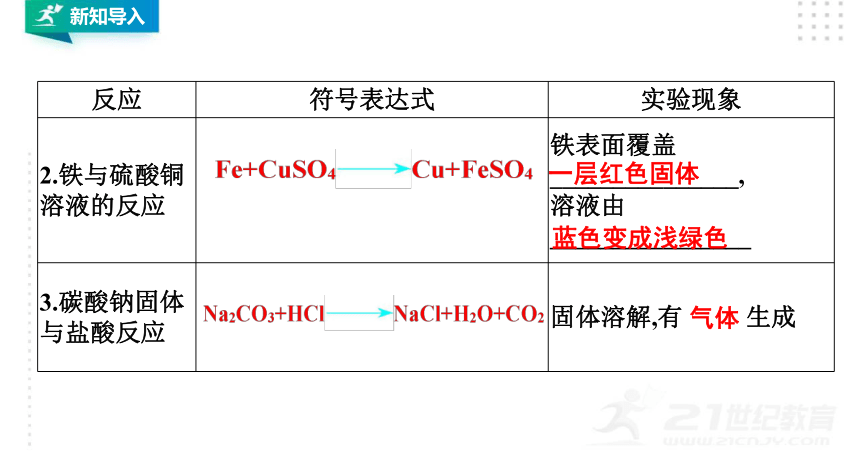
反应
符号表达式
实验现象
2.铁与硫酸铜溶液的反应
铁表面覆盖
_______________,
溶液由
________________
3.碳酸钠固体与盐酸反应
固体溶解,有
生成
气体
蓝色变成浅绿色
一层红色固体
新知导入
知识点一 化学方程式
【小组讨论】阅读教材P96,认识化学方程式。
1.化学方程式的定义:用
来表示化学反应的式子。化学方程式不仅表明了
、
、
,也可以通过相对分子质量表示各物质之间的质量关系,即
各物质间的质量比
反应条件
生成物
反应物
化学式
新知讲解
化学方程式
反应条件
质的
意义
反应物
生成物
氢气和氧气
水
通电
二氧化碳
碳和氧气
点燃
新知讲解
化学式
O2
H2O
CO2
2H2
2H2O
2NH3
相对分子
质量
34
36
4
44
18
32
知识点二 计算相对分子质量或相对分子质量的和
【小组讨论】计算下列物质的相对分子质量。
(相对原子质量:H-1;C-12;N-14;O-16)
新知讲解
量的
意义
宏观
相对质量:____
______
____
每
份质量的碳和______
份质量的氧气恰好完全反应,生成
份质量的二氧化碳
相对质量:____
__
___
每
份质量的水通电分解,生成_____份质量的氢气和
份质量的氧气
微观
每
个碳原子和
个氧分子恰好完全反应,生成
个二氧化碳分子
每
个水分子通电分解,生成
个氢分子和
个氧分子
1
2
2
32
4
36
36 4
32
1
1
1
44
32
12
12
32
44
新知讲解
【课堂练习1】1.
根据化学方程式不能获取的信息是(
)
A.生成物
B.化学反应的快慢
C.反应条件
D.各反应物和生成物之间的个数之比
B
课堂练习
A.在反应前后,元素的种类没有变化
B.常温下氢气与氧气混合就可以发生反应
C.4
g氢气与32
g氧气完全反应,可以生成36
g水
D.在反应前后,氢原子和氧原子的数目没有改变
B
课堂练习
3.计算下列化学方程式中各物质的质量比。(相对原子质量:
H-1 O-16 S-32 Fe-56 Cu-64)
1:1:2
1:40:32:9
7:20:19:8
课堂练习
B
课堂练习
A
课堂练习
B
课堂练习
B
课堂练习
C
课堂练习
2.(2020秋广州黄埔区期末)NH4ClO4
可用作火箭推进剂,当它发生分解反应时,不能生成的物质是(
)
A.CO2
B.Cl2
C.HCl
D.ClO2
A
课堂练习
A.该反应中共有三种元素
B.图中反应物都是化合物
C.该反应的本质是原子的重新组合
D.该反应前后分子的种类发生改变
3.某反应的微观示意图如图(一种小球代表一种元素的原子),下列说法错误的是(
)
B
课堂练习
4.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表:
下列说法中,不正确的是(
)
A.反应后物质甲的质量为13
g
B.乙是反应物
C.参与反应的乙、丁的质量比为5:4
D.物质丙可能是该反应的催化剂
物质
甲
乙
丙
丁
反应前的质量/g
18
1
2
32
反应后的质量/g
x
26
2
12
B
课堂练习
课题1 质量守恒定律(2)
第五单元 化学方程式
1.认识化学方程式,掌握化学方程式所包含的信息。
2.学会应用质量守恒定律
学习目标
反应
符号表达式
实验现象
1.镁在空气中燃烧
发出
,
生成___________
写出下列反应的化学符号表达式和实验现象。
白色固体
耀眼白光
化学用语天天练
新知导入
反应
符号表达式
实验现象
2.铁与硫酸铜溶液的反应
铁表面覆盖
_______________,
溶液由
________________
3.碳酸钠固体与盐酸反应
固体溶解,有
生成
气体
蓝色变成浅绿色
一层红色固体
新知导入
知识点一 化学方程式
【小组讨论】阅读教材P96,认识化学方程式。
1.化学方程式的定义:用
来表示化学反应的式子。化学方程式不仅表明了
、
、
,也可以通过相对分子质量表示各物质之间的质量关系,即
各物质间的质量比
反应条件
生成物
反应物
化学式
新知讲解
化学方程式
反应条件
质的
意义
反应物
生成物
氢气和氧气
水
通电
二氧化碳
碳和氧气
点燃
新知讲解
化学式
O2
H2O
CO2
2H2
2H2O
2NH3
相对分子
质量
34
36
4
44
18
32
知识点二 计算相对分子质量或相对分子质量的和
【小组讨论】计算下列物质的相对分子质量。
(相对原子质量:H-1;C-12;N-14;O-16)
新知讲解
量的
意义
宏观
相对质量:____
______
____
每
份质量的碳和______
份质量的氧气恰好完全反应,生成
份质量的二氧化碳
相对质量:____
__
___
每
份质量的水通电分解,生成_____份质量的氢气和
份质量的氧气
微观
每
个碳原子和
个氧分子恰好完全反应,生成
个二氧化碳分子
每
个水分子通电分解,生成
个氢分子和
个氧分子
1
2
2
32
4
36
36 4
32
1
1
1
44
32
12
12
32
44
新知讲解
【课堂练习1】1.
根据化学方程式不能获取的信息是(
)
A.生成物
B.化学反应的快慢
C.反应条件
D.各反应物和生成物之间的个数之比
B
课堂练习
A.在反应前后,元素的种类没有变化
B.常温下氢气与氧气混合就可以发生反应
C.4
g氢气与32
g氧气完全反应,可以生成36
g水
D.在反应前后,氢原子和氧原子的数目没有改变
B
课堂练习
3.计算下列化学方程式中各物质的质量比。(相对原子质量:
H-1 O-16 S-32 Fe-56 Cu-64)
1:1:2
1:40:32:9
7:20:19:8
课堂练习
B
课堂练习
A
课堂练习
B
课堂练习
B
课堂练习
C
课堂练习
2.(2020秋广州黄埔区期末)NH4ClO4
可用作火箭推进剂,当它发生分解反应时,不能生成的物质是(
)
A.CO2
B.Cl2
C.HCl
D.ClO2
A
课堂练习
A.该反应中共有三种元素
B.图中反应物都是化合物
C.该反应的本质是原子的重新组合
D.该反应前后分子的种类发生改变
3.某反应的微观示意图如图(一种小球代表一种元素的原子),下列说法错误的是(
)
B
课堂练习
4.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表:
下列说法中,不正确的是(
)
A.反应后物质甲的质量为13
g
B.乙是反应物
C.参与反应的乙、丁的质量比为5:4
D.物质丙可能是该反应的催化剂
物质
甲
乙
丙
丁
反应前的质量/g
18
1
2
32
反应后的质量/g
x
26
2
12
B
课堂练习
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
