山东省聊城市高唐县第一重点高中2022届高三上学期9月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 山东省聊城市高唐县第一重点高中2022届高三上学期9月开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 476.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-29 22:12:21 | ||
图片预览




文档简介
高唐县第一中学2022届高三上学期开学考试
化
学
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124
g
P4中所含P-P键数目为4NA
B.100
mL
1
mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2
L甲烷和乙烯混合物中含氢原子数目为2NA
D.密闭容器中,2
mol
SO2和1
mol
O2催化反应后分子总数为2NA
2.对于下列实验,能正确描述其反应的离子方程式是( )
A.用Na2SO3溶液吸收少量Cl2:3S+Cl2+H2O===2HS+2Cl-+S
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2===CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2===O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:N+OH-===NH3·H2O
3.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水
④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.③④⑤⑥
C.②④⑤⑥
D.①③④⑥
4.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
5.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
6.列有关金属及其化合物的应用不合理的是( )
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
7.某同学通过如下流程制备氧化亚铜:
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+===Cu2++Cu+H2O
下列说法不正确的是( )
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OH-Cu2O+2Cl-+H2O
D.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
8.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-===2As+3SnCl+6M。关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1
mol
As,反应中转移电子的物质的量为3
mol
④M为OH-
⑤SnCl是氧化产物
A.①②④⑤
B.①③⑤
C.①②③④
D.只有①③
9.一定条件下,下列物质可通过化合反应制得的共有( )
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁
⑤氢氧化铜 ⑥氢氧化铁
A.3种 B.4种
C.5种
D.6种
10.向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。下列说法不正确的是( )
A.Fe3+对该反应有催化作用
B.该过程中的Fe3+可由Fe(NO3)3提供
C.可用K3[Fe(CN)6]溶液区分Fe2+与Fe3+
D.制备CuCl2的总反应为2Cu+O2+4HCl===2CuCl2+2H2O
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.某试液中只可能含有K+、NH、Fe2+、Al3+、Cl-、SO、CO、AlO中的若干种离子,离子浓度均为0.1
mol·L-1,某同学进行了如下实验,下列说法正确的是( )
A.原溶液中存在NH、Fe2+、Cl-、SO
B.滤液X中大量存在的阳离子有NH、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.无法确定原试液中是否含有Al3+、Cl-
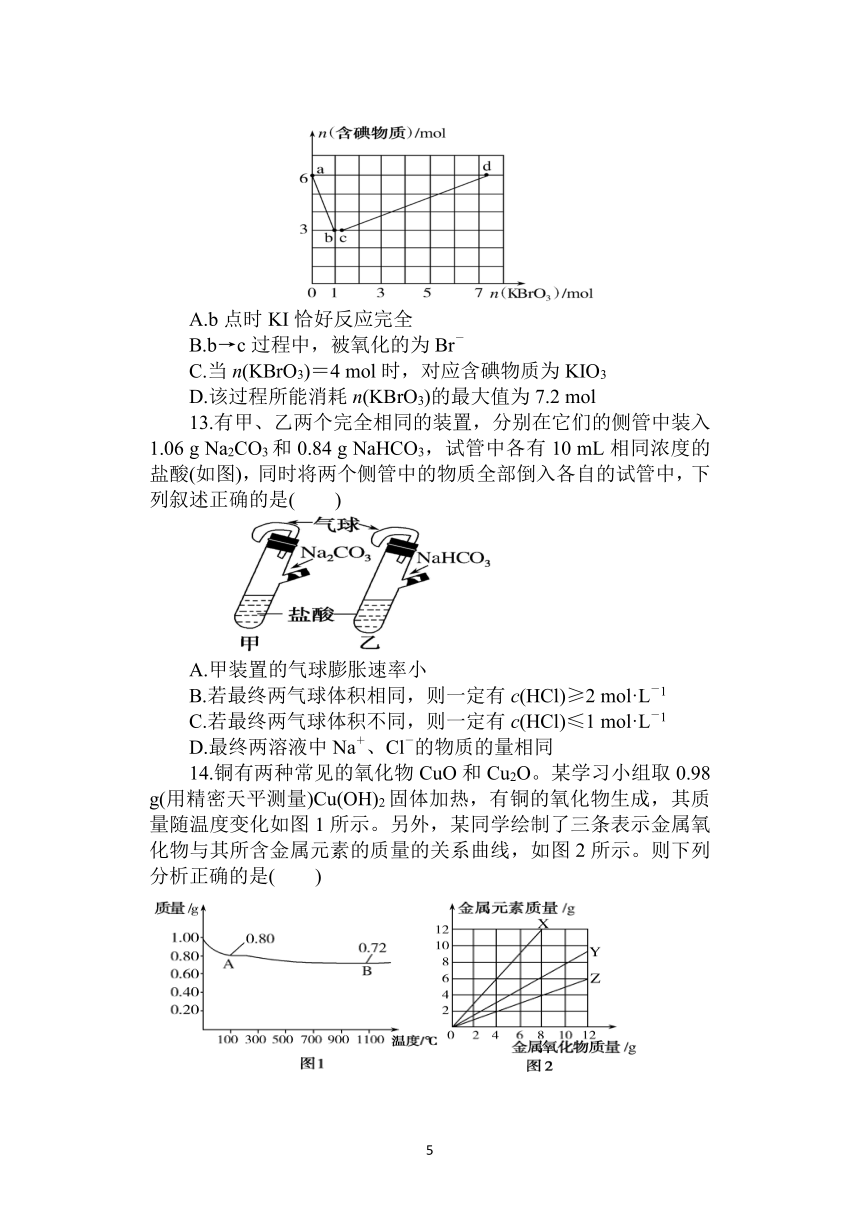
12.已知氧化性:BrO>IO>Br2>I2。向含6
mol
KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。下列有关说法错误的是( )
A.b点时KI恰好反应完全
B.b→c过程中,被氧化的为Br-
C.当n(KBrO3)=4
mol时,对应含碘物质为KIO3
D.该过程所能消耗n(KBrO3)的最大值为7.2
mol
13.有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06
g
Na2CO3和0.84
g
NaHCO3,试管中各有10
mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )
A.甲装置的气球膨胀速率小
B.若最终两气球体积相同,则一定有c(HCl)≥2
mol·L-1
C.若最终两气球体积不同,则一定有c(HCl)≤1
mol·L-1
D.最终两溶液中Na+、Cl-的物质的量相同
14.铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98
g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示。另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )
A.图1中,A到B的过程中有0.01
mol电子转移
B.图1整个过程中共生成0.26
g水
C.图2三条曲线中,表示CuO和其中所含Cu质量关系的曲线是Y
D.图1中A和B的化学式分别为Cu2O和CuO
15.某同学利用下列实验探究金属铝与铜盐溶液的反应:
下列说法正确的是( )。
A.由实验1可以得出结论:金属铝的活泼性弱于金属铜
B.实验2中生成红色物质的离子方程式为Al+Cu2+Al3++Cu
C.溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D.由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2
mol·L-1的盐酸和硫酸溶液反应,后者更剧烈
三、非选择题:本题共5小题,共60分。
16.(10分)Ⅰ.
今有12种物质:①Al ②稀硝酸 ③HNO3 ④液氨
⑤CO2 ⑥空气 ⑦NaCl ⑧CaCO3 ⑨NaHCO3 ⑩酒精 Al2O3 石墨
按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
序号
符合的条件
物质的序号
(1)
混合物
(2)
电解质,但熔融状态下并不导电
(3)
电解质,熔融状态能导电
(4)
电解质,但难溶于水
(5)
非电解质
(6)
既不是电解质,也不是非电解质,但本身能导电
Ⅱ.写出下列离子方程式
(1).向MnF2溶液中加入NH4HCO3生成MnCO3的离子方程式_______________
(2).Ag2SO3溶于氨水的离子方程式_____________________________________
17.(8分)钠的化合物在自然界广泛存在,并有重要用途。
(1)过氧化钠是钠的氧化物,写出过氧化钠中阴离子的电子式: 。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后,排出气体,固体残留物中一定含有的物质是 (写化学式)。
(3)工业上可采取金属钠氧化法制取过氧化钠,其流程如下:
Na
Na2O
Na2O2
如果把一定质量的过氧化钠按下列流程处理:
78
g
Na2O2
222
g
A(固体)
写出A物质的化学式: 。
(4)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1
mol
FeSO4参加反应转移4
mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式: 。
18.(共14分)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1
mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为 。
(2)滤渣1的主要成分除SiO2外还有 ;氧化除杂工序中ZnO的作用是 ,若不通入氧气,其后果是 。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为 。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为 ;沉积锌后的电解液可返回 工序继续使用。
19.(12分)无水AlCl3常用于有机合成的催化剂。现以铝酸钙(主要成份为CaO·Al2O3,含少量SiO2等杂质)和稀盐酸为原料制备无水氯化铝的方案如下:
已知:AlCl3易升华,沸点181℃,SOCl2熔点﹣105℃、沸点76℃,遇水剧烈水解生成两种酸性气体。相关物质的溶解度数据如表:
物质
0℃
80℃
AlCl3
31.03g
33.23g
CaCl2
37.3g
59.5g
按要求回答下列问题
(1)步骤①中稀盐酸应适当过量的原因是______________。
(2)操作a是_______________。
(3)操作b是_______________。
(4)某兴趣小组设计如图装置获取无水AlCl3。锥形瓶中得到的物质X的化学式为_________。碱石灰的作用是防止外界水蒸气进入和____________。
(5)写出一个化合反应(用化学方程式或离子方程式表示)________。要求同时满足:①其中一种反应物是AlCl3;②反应原理与“HCl+NH3=NH4Cl”相同。
20.(16分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料,某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
【实验一】测定硫元素的含量
Ⅰ.将m1
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。写出石英管中发生反应的化学方程式:____________________________________________________________________。
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)Ⅰ中,甲中所盛试剂是________,乙中发生反应的离子方程式为____________________________________________________________________。
(2)Ⅱ中,所加H2O2溶液需足量的目的是___________________________。
(3)该黄铁矿石中硫元素的质量分数为________。
【实验二】设计以下实验方案测定铁元素的含量
问题讨论:
(4)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(5)④中,若将稀释液久置后再用酸性KMnO4滴定,则所测得的铁元素的含量________(填“偏大”“偏小”或“无影响”)。
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
实验次数
第一次
第二次
第三次
消耗KMnO4溶液体积/mL
26.42
25.05
24.95
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________mol/L。
(提示:5Fe2++MnO+8H+===Mn2++5Fe3++4H2O)
9.1号开学第一考化学测试题答案
1.C
2A
3D
4.C
5.B
6.C
7.D
8.B
9.B
10.B
11.A
12.C
13.CD
14.AC
15.C
16.(10分)
Ⅰ.
(1)②⑥ (2)③ (3)⑦⑧⑨ (4)⑧
(5)④⑤⑩ (6)①
Ⅱ.(1)Mn2++2HC===MnCO3↓+CO2↑+H2O
(2)Ag2SO3+4NH3·H2O===2[Ag(NH3)2]++S+4H2O
17
(8分)(1)]2- (2)Na2CO3 (3)Na2O2·8H2O
(4)FeSO4+4Na2O2Na2FeO4+2Na2O+Na2SO4+O2↑
18.(14分)(1)2ZnS+3O22ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Zn+Cd2+===Zn2++Cd
(4)Zn2++2e-===Zn
溶浸
19.(12分)
(1)确保铝元素尽可能完全溶出,并抑制氯化铝水解
蒸发浓缩、趁热过滤
在干燥的HCl气流中加热脱水
SOCl2
除去SO2和HCl等有害气体
(
5
)
.AlCl3+Cl-=AlCl或AlCl3+NH3=AlCl3NH3
20.
(16分)Ⅰ.4FeS2+11O22Fe2O3+8SO2
Ⅱ.(1)碱石灰(或CaO、NaOH固体) SO2+2OH-===SO+H2O
(2)使SO完全氧化为SO
(3)×100%
(4)250
mL容量瓶
(5)偏小
(6)0.5
化
学
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124
g
P4中所含P-P键数目为4NA
B.100
mL
1
mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2
L甲烷和乙烯混合物中含氢原子数目为2NA
D.密闭容器中,2
mol
SO2和1
mol
O2催化反应后分子总数为2NA
2.对于下列实验,能正确描述其反应的离子方程式是( )
A.用Na2SO3溶液吸收少量Cl2:3S+Cl2+H2O===2HS+2Cl-+S
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2===CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2===O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:N+OH-===NH3·H2O
3.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水
④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.③④⑤⑥
C.②④⑤⑥
D.①③④⑥
4.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
5.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )
A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
6.列有关金属及其化合物的应用不合理的是( )
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
7.某同学通过如下流程制备氧化亚铜:
已知:CuCl难溶于水和稀硫酸;Cu2O+2H+===Cu2++Cu+H2O
下列说法不正确的是( )
A.步骤②中的SO2可用Na2SO3替换
B.步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C.步骤④发生反应的离子方程式为2CuCl+2OH-Cu2O+2Cl-+H2O
D.如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
8.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-===2As+3SnCl+6M。关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3
②还原性:Cl->As
③每生成1
mol
As,反应中转移电子的物质的量为3
mol
④M为OH-
⑤SnCl是氧化产物
A.①②④⑤
B.①③⑤
C.①②③④
D.只有①③
9.一定条件下,下列物质可通过化合反应制得的共有( )
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁
⑤氢氧化铜 ⑥氢氧化铁
A.3种 B.4种
C.5种
D.6种
10.向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。下列说法不正确的是( )
A.Fe3+对该反应有催化作用
B.该过程中的Fe3+可由Fe(NO3)3提供
C.可用K3[Fe(CN)6]溶液区分Fe2+与Fe3+
D.制备CuCl2的总反应为2Cu+O2+4HCl===2CuCl2+2H2O
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.某试液中只可能含有K+、NH、Fe2+、Al3+、Cl-、SO、CO、AlO中的若干种离子,离子浓度均为0.1
mol·L-1,某同学进行了如下实验,下列说法正确的是( )
A.原溶液中存在NH、Fe2+、Cl-、SO
B.滤液X中大量存在的阳离子有NH、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.无法确定原试液中是否含有Al3+、Cl-
12.已知氧化性:BrO>IO>Br2>I2。向含6
mol
KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。下列有关说法错误的是( )
A.b点时KI恰好反应完全
B.b→c过程中,被氧化的为Br-
C.当n(KBrO3)=4
mol时,对应含碘物质为KIO3
D.该过程所能消耗n(KBrO3)的最大值为7.2
mol
13.有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06
g
Na2CO3和0.84
g
NaHCO3,试管中各有10
mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )
A.甲装置的气球膨胀速率小
B.若最终两气球体积相同,则一定有c(HCl)≥2
mol·L-1
C.若最终两气球体积不同,则一定有c(HCl)≤1
mol·L-1
D.最终两溶液中Na+、Cl-的物质的量相同
14.铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98
g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示。另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )
A.图1中,A到B的过程中有0.01
mol电子转移
B.图1整个过程中共生成0.26
g水
C.图2三条曲线中,表示CuO和其中所含Cu质量关系的曲线是Y
D.图1中A和B的化学式分别为Cu2O和CuO
15.某同学利用下列实验探究金属铝与铜盐溶液的反应:
下列说法正确的是( )。
A.由实验1可以得出结论:金属铝的活泼性弱于金属铜
B.实验2中生成红色物质的离子方程式为Al+Cu2+Al3++Cu
C.溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D.由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2
mol·L-1的盐酸和硫酸溶液反应,后者更剧烈
三、非选择题:本题共5小题,共60分。
16.(10分)Ⅰ.
今有12种物质:①Al ②稀硝酸 ③HNO3 ④液氨
⑤CO2 ⑥空气 ⑦NaCl ⑧CaCO3 ⑨NaHCO3 ⑩酒精 Al2O3 石墨
按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
序号
符合的条件
物质的序号
(1)
混合物
(2)
电解质,但熔融状态下并不导电
(3)
电解质,熔融状态能导电
(4)
电解质,但难溶于水
(5)
非电解质
(6)
既不是电解质,也不是非电解质,但本身能导电
Ⅱ.写出下列离子方程式
(1).向MnF2溶液中加入NH4HCO3生成MnCO3的离子方程式_______________
(2).Ag2SO3溶于氨水的离子方程式_____________________________________
17.(8分)钠的化合物在自然界广泛存在,并有重要用途。
(1)过氧化钠是钠的氧化物,写出过氧化钠中阴离子的电子式: 。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后,排出气体,固体残留物中一定含有的物质是 (写化学式)。
(3)工业上可采取金属钠氧化法制取过氧化钠,其流程如下:
Na
Na2O
Na2O2
如果把一定质量的过氧化钠按下列流程处理:
78
g
Na2O2
222
g
A(固体)
写出A物质的化学式: 。
(4)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1
mol
FeSO4参加反应转移4
mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式: 。
18.(共14分)我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1
mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为 。
(2)滤渣1的主要成分除SiO2外还有 ;氧化除杂工序中ZnO的作用是 ,若不通入氧气,其后果是 。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为 。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为 ;沉积锌后的电解液可返回 工序继续使用。
19.(12分)无水AlCl3常用于有机合成的催化剂。现以铝酸钙(主要成份为CaO·Al2O3,含少量SiO2等杂质)和稀盐酸为原料制备无水氯化铝的方案如下:
已知:AlCl3易升华,沸点181℃,SOCl2熔点﹣105℃、沸点76℃,遇水剧烈水解生成两种酸性气体。相关物质的溶解度数据如表:
物质
0℃
80℃
AlCl3
31.03g
33.23g
CaCl2
37.3g
59.5g
按要求回答下列问题
(1)步骤①中稀盐酸应适当过量的原因是______________。
(2)操作a是_______________。
(3)操作b是_______________。
(4)某兴趣小组设计如图装置获取无水AlCl3。锥形瓶中得到的物质X的化学式为_________。碱石灰的作用是防止外界水蒸气进入和____________。
(5)写出一个化合反应(用化学方程式或离子方程式表示)________。要求同时满足:①其中一种反应物是AlCl3;②反应原理与“HCl+NH3=NH4Cl”相同。
20.(16分)黄铁矿是我国大多数硫酸厂制取硫酸的主要原料,某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
【实验一】测定硫元素的含量
Ⅰ.将m1
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。写出石英管中发生反应的化学方程式:____________________________________________________________________。
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)Ⅰ中,甲中所盛试剂是________,乙中发生反应的离子方程式为____________________________________________________________________。
(2)Ⅱ中,所加H2O2溶液需足量的目的是___________________________。
(3)该黄铁矿石中硫元素的质量分数为________。
【实验二】设计以下实验方案测定铁元素的含量
问题讨论:
(4)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(5)④中,若将稀释液久置后再用酸性KMnO4滴定,则所测得的铁元素的含量________(填“偏大”“偏小”或“无影响”)。
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
实验次数
第一次
第二次
第三次
消耗KMnO4溶液体积/mL
26.42
25.05
24.95
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________mol/L。
(提示:5Fe2++MnO+8H+===Mn2++5Fe3++4H2O)
9.1号开学第一考化学测试题答案
1.C
2A
3D
4.C
5.B
6.C
7.D
8.B
9.B
10.B
11.A
12.C
13.CD
14.AC
15.C
16.(10分)
Ⅰ.
(1)②⑥ (2)③ (3)⑦⑧⑨ (4)⑧
(5)④⑤⑩ (6)①
Ⅱ.(1)Mn2++2HC===MnCO3↓+CO2↑+H2O
(2)Ag2SO3+4NH3·H2O===2[Ag(NH3)2]++S+4H2O
17
(8分)(1)]2- (2)Na2CO3 (3)Na2O2·8H2O
(4)FeSO4+4Na2O2Na2FeO4+2Na2O+Na2SO4+O2↑
18.(14分)(1)2ZnS+3O22ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Zn+Cd2+===Zn2++Cd
(4)Zn2++2e-===Zn
溶浸
19.(12分)
(1)确保铝元素尽可能完全溶出,并抑制氯化铝水解
蒸发浓缩、趁热过滤
在干燥的HCl气流中加热脱水
SOCl2
除去SO2和HCl等有害气体
(
5
)
.AlCl3+Cl-=AlCl或AlCl3+NH3=AlCl3NH3
20.
(16分)Ⅰ.4FeS2+11O22Fe2O3+8SO2
Ⅱ.(1)碱石灰(或CaO、NaOH固体) SO2+2OH-===SO+H2O
(2)使SO完全氧化为SO
(3)×100%
(4)250
mL容量瓶
(5)偏小
(6)0.5
同课章节目录
